La enfermedad renal crónica (ERC) constituye un importante problema de salud que contribuye al desarrollo de alteraciones cardiovasculares como la insuficiencia cardíaca y la enfermedad cardiovascular arteriosclerótica (ECVA). Los objetivos de este estudio fueron determinar la prevalencia de ERC y evaluar su asociación con factores de riesgo cardiometabólicos y la ECVA.
MétodosEstudio observacional transversal realizado en el ámbito de atención primaria. Muestra aleatoria de base poblacional: 6.588 personas entre 18 y 102 años (tasa de respuesta: 66%). Se determinaron las tasas de prevalencia brutas y ajustadas por sexo y edad de ERC según KDIGO valorando albuminuria y filtrado glomerular estimado según CKD-EPI, y sus asociaciones con factores cardiometabólicos y ECVA.
ResultadosLa prevalencia cruda de ERC fue 11,48% (IC95%: 10,72–12,27%), sin diferencia significativa entre hombres (11,64% [IC95%: 10,49–12,86%]) y mujeres (11,35% [IC95%: 10,34–12,41%]). La tasa de prevalencia ajustada por edad y sexo de ERC fue 9,16% (hombres: 8,61%; mujeres: 9,69%). La prevalencia del filtrado glomerular estimado reducido (<60mL/min/1,73m2) y de albuminuria (≥30mg/g) fueron 7,95% (IC95%: 7,30–8,61) y 5,98% (IC95%: 5,41–6,55), respectivamente. Hipertensión, diabetes, prediabetes, índice cintura-talla aumentado, insuficiencia cardíaca, fibrilación auricular y ECVA se asociaban independientemente con ERC (p<0,001). El 77,51% (IC95%: 74,54–80,49) de la población con ERC tenía un riesgo cardiovascular muy alto según SCORE.
ConclusionesLa prevalencia ajustada de ERC era del 9,2% (filtrado glomerular estimado reducido: 8%; albuminuria: 6%). La mayoría de los pacientes con ERC tenía riesgo cardiovascular muy alto. Hipertensión, diabetes, prediabetes, índice cintura-talla aumentado y ECVA se asociaban independientemente con la ERC.
Chronic kidney disease (CKD) is a major health problem that contributes to the development of cardiovascular disorders such as heart failure and arteriosclerotic cardiovascular disease (ACVD). The aims of this study were to determine the prevalence of CKD and to assess its association with ACVD and cardiometabolic risk factors.
MethodsCross-sectional observational study conducted in primary care setting. Population-based random sample: 6,588 people between 18 and 102 years old (response rate: 66%). Crude and sex- and age-adjusted prevalence rates of CKD according to KDIGO were determined by assessing albuminuria and estimated glomerular filtration rate according to CKD-EPI, and their associations with cardiometabolic factors and ACVD were determined.
ResultsThe crude prevalence of CKD was 11.48% (95%CI: 10.72–12.27%), without significant difference between men (11.64% [95%CI: 10.49–12.86%]) and women (11.35% [95%CI: 10.34–12.41%]). The age- and sex-adjusted prevalence rate of CKD was 9.16% (men: 8.61%; women: 9.69%). The prevalence of low estimated glomerular filtration rate (<60mL/min/1.73m2) and albuminuria (≥30mg/g) were 7.95% (95%CI: 7.30–8.61) and 5.98% (95%CI: 5.41–6.55), respectively. Hypertension, diabetes, prediabetes, increased waist-to-height ratio, heart failure, atrial fibrillation, and ACVD were independently associated with CKD (P<.001). Very high cardiovascular risk according to SCORE was found in 77.51% (95%CI: 74.54–80.49) of the population with CKD.
ConclusionsThe adjusted prevalence of CKD was 9.2% (low estimated glomerular filtration rate: 8.0%; albuminuria: 6.0%). Most of the patients with CKD had very high cardiovascular risk. Hypertension, diabetes, prediabetes, increased waist-to-height ratio and ACVD were independently associated with CKD.
La insuficiencia o enfermedad renal crónica (ERC) se caracteriza por un deterioro gradual de la función de filtrado, eliminación de toxinas y control del volumen del organismo, que puede favorecer el desarrollo de problemas cardiovasculares como la insuficiencia cardíaca y la enfermedad cardiovascular arteriosclerótica (ECVA)1.
La ERC es un importante problema de salud pública, cuya carga de enfermedad está aumentando a escala mundial y está vinculada a graves resultados de salud, mala calidad de vida y elevados costes de la atención, sobre todo, los derivados del tratamiento renal sustitutivo que precisan los pacientes con enfermedad renal en etapa terminal (ERT), por lo que es necesario reorientar la estrategia hacia una detección precoz y tratamiento temprano con el objeto de mejorar los resultados de salud y disminuir la necesidad de tratamiento renal sustitutivo1–3.
La ERC constituye por sí misma un factor de riesgo cardiovascular (FRCV)4. Los pacientes con ERC asociada o no a otros FRCV tienen mayor probabilidad de mortalidad cardiovascular y por todas las causas1. La mortalidad aumenta exponencialmente a medida que empeora la función renal, principalmente debida a causa cardiovascular1. Existe una marcada asociación entre el pronóstico clínico, albuminuria y el filtrado glomerular estimado (FGe) reducido (<60mL/min/1,73 m2)2,5. Los metaanálisis realizados por el Chronic Kidney Disease (CKD) Prognosis Consortium6,7 demostraron la asociación del FGe reducido y la presencia de albuminuria con un mayor riesgo de mortalidad global, mortalidad cardiovascular, fallo renal, insuficiencia renal aguda y progresión de la ERC tanto en la población general como en poblaciones con riesgo cardiovascular (RCV) alto, independientemente de otros FRCV. Las personas con ERC tienen de 5 a 10 veces más probabilidades de morir prematuramente que de progresar a ERT.
Entre el 8 y el 16% de la población mundial padece ERC, aunque los datos difieren significativamente entre países y regiones del mundo3,8–10. Durante las últimas décadas, la prevalencia de ERC se ha incrementado por el aumento de la prevalencia de la hipertensión arterial (HTA), obesidad y diabetes (DM), y por la mayor longevidad de la población9,10. La DM y la HTA son las principales causas de ERC en los países con índices sociodemográficos altos, y en la mayoría de los países con índices bajos1. Aunque está bien establecido que el manejo y el tratamiento adecuados de la DM, HTA y dislipidemia son efectivos para retrasar la progresión de la ERC11–13, la incidencia de los principales episodios adversos cardiovasculares y renales continúa siendo alta en los pacientes con ERC.
En la conferencia de KDIGO (Kidney Disease: Improving Global Outcomes) titulada Identificación e intervención tempranas en la ERC14, se identificaron estrategias para la detección, cribado, estratificación del riesgo y tratamiento óptimo y precoz de la ERC, como la promoción de estilos saludables de vida y el control de los principales FRCV, con el fin de retardar o retrasar su progresión, disminuir las complicaciones y la carga de la enfermedad. Los participantes consensuaron que estas medidas debían implementarse de inmediato para las personas de riesgo alto y que, idealmente, esto debería ocurrir en el ámbito de la atención primaria.
Los objetivos del estudio SIMETAP-ERC fueron determinar en la población adulta las tasas de prevalencia cruda y ajustada por edad y sexo de ERC según KDIGO5, valorando la albuminuria y el FGe según la ecuación Chronic Kidney Disease EPIdemiology collaboration (CKD-EPI)15, y evaluar las asociaciones existentes entre la ERC y factores cardiometabólicos y enfermedades cardiovasculares.
Material y métodosSIMETAP-ERC es un estudio observacional transversal, autorizado por el Servicio de Salud de la Comunidad de Madrid (SERMAS), en el que participaron 121 médicos de familia seleccionados competitivamente hasta alcanzar el tamaño muestral necesario, pertenecientes a 64 centros de atención primaria (25% de los centros de salud del SERMAS). Se realizó un muestreo aleatorio simple del 5,45% de toda la población diana con 18 o más años (194.073 adultos) asignada a los médicos de atención primaria del SERMAS que participaban en el estudio, mediante tablas de números aleatorios extraídas mediante la función Excel ALEATORIO.ENTRE(inferior, superior). La información sobre el material y métodos del estudio SIMETAP se detallaron en una publicación previa16. Por protocolo, se excluyó a pacientes terminales, institucionalizados, con deterioro cognitivo, embarazadas o sujetos sin información de variables bioquímicas. Se obtuvo el consentimiento informado de los sujetos del estudio, con una tasa de respuesta del 65,8%, reclutándose 6.588 sujetos de estudio con información clínica y de laboratorio suficiente para ser evaluados.
Se consideraron las siguientes variables: índice de masa corporal (IMC): peso/talla2 (kg/m2); sobrepeso: IMC 25–29,9kg/m2; obesidad: IMC≥30kg/m2; adiposidad o índice de grasa corporal CUN-BAE (Clínica Universitaria de Navarra-Body Adiposity Estimator)17 (−44,988+[0,503×edad]+[10,689×sexo]+[3,172×IMC]–[0,026×IMC2]+[0,181×IMC×sexo]–[0,02×IMC×edad]–[0,005×IMC2×sexo]+[0,00021×IMC2×edad]) sexo (masculino=0, femenino=1); CUN-BAE-obesidad (>25% [hombres]; >35% [mujeres]); obesidad abdominal: perímetro abdominal aumentado (≥102cm [hombres]; ≥88cm [mujeres]); índice cintura-talla (ICT): perímetro abdominal/talla; ICT aumentado: ICT≥0,55; HTA: presión arterial sistólica (PAS)≥140mmHg y/o presión arterial diastólica (PAD)≥90mmHg, o tener tratamiento antihipertensivo; hipercolesterolemia: colesterol total≥200mg/dL; hipertrigliceridemia: triglicéridos≥150mg/dL; colesterol unido a lipoproteínas de alta densidad (c-HDL); c-HDL bajo: c-HDL<40mg/dL (hombres), <50mg/dL (mujeres); colesterol no unido a HDL (c-no-HDL); colesterol unido a lipoproteínas de baja densidad (c-LDL); colesterol unido a lipoproteínas de muy baja densidad y remanentes (c-VLDL); índice aterogénico de plasma: log (TG/c-HDL). Índice TG y glucosa (ITyG): Ln [TGxGPA/2]; dislipidemia aterogénica: HTG y c-HDL bajo; DM según la Asociación Americana de Diabetes (ADA)18: glucosa plasmática en ayunas (GPA)≥126mg/dL o hemoglobina glucada A1c (HbA1c)≥6,5% determinada mediante métodos estandarizados (National Glycohemoglobin Standardization Program) según DCCT (por sus siglas en inglés Diabetes Control and Complications Trial) o determinación de glucosa plasmática≥200mg/dL a cualquier hora o con prueba de tolerancia oral a la glucosa; prediabetes en individuos sin DM según la ADA18 (GPA entre 100 y 125mg/dL o HbA1c entre 5,7 y 6,4%) y según la Sociedad Española de Diabetes (SED)19 (GPA entre 110 y 125mg/dL o HbA1c entre 6 y 6,4%); síndrome metabólico: según consenso armonizado IDF/NHLBI/AHA/WHF/IAS/IASO20; ECVA: enfermedad coronaria (EC), enfermedad cerebrovascular (ictus), enfermedad arterial periférica (EAP); EC: cardiopatía isquémica, infarto agudo de miocardio, síndrome coronario agudo, revascularización coronaria; ictus: isquemia cerebral, hemorragia intracraneal, ataque isquémico transitorio; EAP: claudicación intermitente, índice tobillo-brazo≤0,9; categorías de RCV (bajo, moderado, alto y muy alto) según SCORE21 y SCORE-OP22 para países de bajo riesgo; FGe según la ecuación CKD-EPI15; categorías de FGe según KDIGO5: G1 (≥90mL/min/1,73m2), G2 (60–89mL/min/1,73m2), G3a (45–59mL/min/1,73m2), G3b (30–44mL/min/1,73m2), G4 (15-29mL/min/1,73m2) y G5 (<15mL/min/1,73m2); FGe reducido: FGe<60mL/min/1,73m2; categorías de cociente albúmina-creatinina en orina (CAC) según KDIGO5: A1 (<30mg/g); A2 (30–300mg/g); A3 (>300mg/g); albuminuria: CAC≥30mg/g. ERC5: FGe reducido y/o albuminuria.
El análisis estadístico se realizó con el programa Statistical Package for the Social Sciences. Las variables cualitativas se analizaron mediante porcentajes, prueba chi-cuadrado, y odds-ratios (OR), con intervalo de confianza al 95% (IC95%). Las variables continuas se evaluaron mediante media con desviación estándar (±DE) y prueba t-Student o el análisis de varianza. Se determinaron las medianas y rangos intercuartílicos (RIC) de la variable edad y parámetros renales. Se determinaron las prevalencias crudas y las ajustadas por edad y sexo mediante método directo, usando grupos etarios decenales estandarizados de la población española en enero de 2015 según el Instituto Nacional de Estadística23.
Para valorar el efecto individual de comorbilidades y FRCV sobre la variable dependiente ERC, se realizó un análisis multivariante de regresión logística mediante el método paso a paso hacia atrás (backward stepwise), introduciendo inicialmente en el modelo todas las variables que mostraran asociación en el análisis univariado hasta un valor de p<0,10, excepto las variables CUN-BAE obesidad17 y síndrome metabólico20, por ser variables complejas cuyos criterios que los definen ya se incluían en el análisis; y disfunción eréctil, por afectar solo a hombres. Posteriormente, se eliminó en cada paso la variable que menos contribuía al ajuste del análisis. Todas las pruebas se consideraron estadísticamente significativas si el valor de p de 2 colas era inferior a 0,05. Se realizó una búsqueda bibliográfica en PubMed, Medline, Embase, Google Scholar y Web of Science, para comparar las tasas de prevalencia de ERC del presente estudio con otros similares publicados desde el año 2001.
ResultadosPoblación de estudioLa población de estudio fue de 6.588 adultos entre 18 y 102,8 años, cuya media (±DE) de edad era 55,1 (±17,5) años, y la mediana (RIC) era 54,69 (41,68–68,09) años. La diferencia del porcentaje entre hombres (44,1% [IC95%: 42,9–45,3%]) y mujeres (55,9% [IC95%: 54,7–57,1%]) era significativa (p<0,001). Las medianas (RIC) de edad de las poblaciones masculina y femenina eran 55,0 (42,4–67,5) años y 54,5 (41,0–68,8) años, respectivamente, no siendo significativa (p=0,634) la diferencia de las medias [±DE] de edad entre hombres (55,3 [±16,9] años) y mujeres (55,0 [±18,0] años).
Tasas de prevalencia de enfermedad renal crónicaLa prevalencia cruda de ERC fue 11,48% (IC95%: 10,72–12,27%), sin diferencia significativa (p=0,711) entre hombres (11,64% [IC95%: 10,49–12,86%]) y mujeres (11,35% [IC95%: 10,34–12,41%]). La tasa de prevalencia ajustada por edad y sexo de ERC fue 9,16% (8,61% en hombres; 9,69% en mujeres).
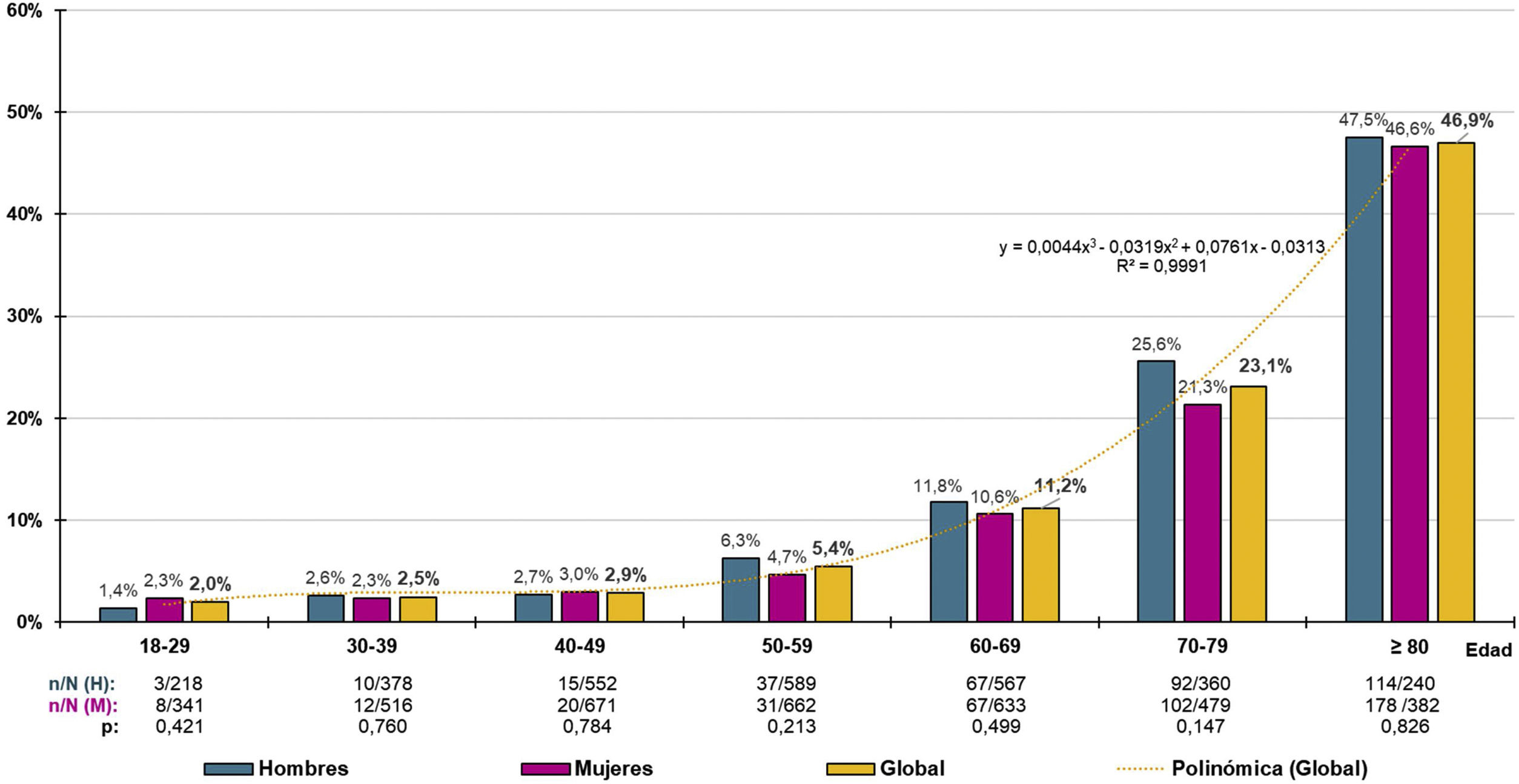
La distribución de las tasas específicas por grupos etarios decenales de prevalencia de ERC aumentaba con la edad de forma precisa (R2=0,999) según la función polinómica y=0,0044x3-0,0319x2+0,0761x-0,0313, sin detectarse diferencias significativas entre hombres y mujeres (fig. 1). La prevalencia ajustada por edad y sexo de ERC en la población≥60 años era de 23,75% (23,49% en hombres; 24% en mujeres), sin diferencia significativa (p=0,923) entre las prevalencias crudas de ERC en hombres (23,39% [IC95%: 20,99–25,93%]) y mujeres (23,23% [IC95%: 21,11–25,45%]). En la población≥70 años, la prevalencia ajustada por edad y sexo de ERC era del 33,56% (34,09% en hombres; 33,27% en mujeres), sin diferencia significativa (p=0,470) entre las prevalencias crudas de ERC en hombres (34,33% [IC95%: 30,54–38,29%]) y mujeres (32,52% [IC95%: 29,40–35,76%]).
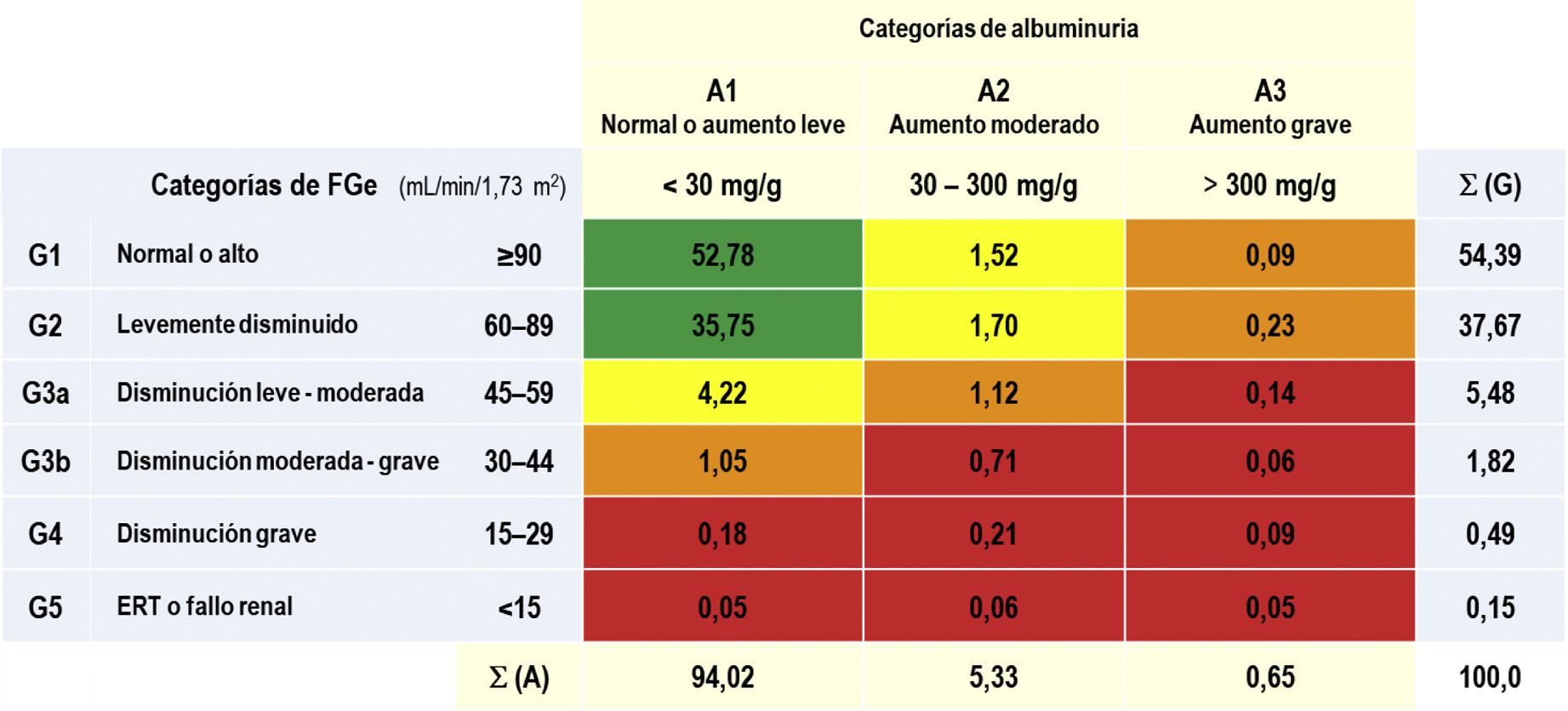
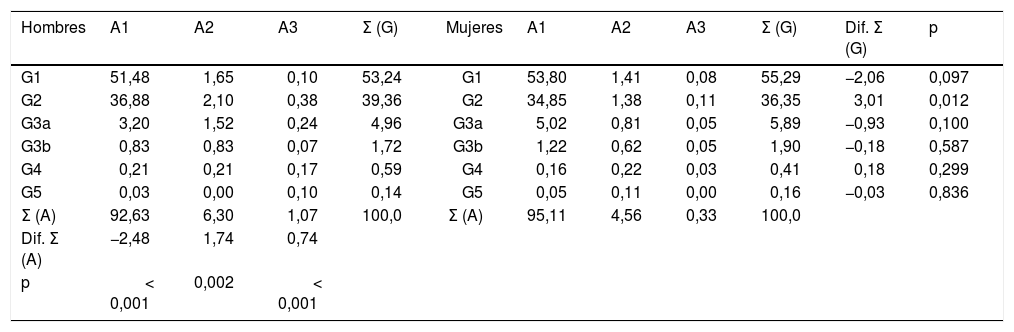
Las prevalencias de los distintos tipos de ERC según categorías de FGe y albuminuria según KDIGO5 eran las siguientes: G1 y G2 con albuminuria (CAC≥30mg/g): 3,54% (IC95%: 3,09–3,98); G3a con/sin albuminuria: 5,48% (IC95%: 4,93–6,03); G3b con/sin albuminuria: 1,82% (IC95%: 1,50–2,14); G4 con/sin albuminuria: 0,49% (IC95%: 0,32–0,65); G5 con/sin albuminuria: 0,15% (IC95%: 0,06–0,25) (tabla 1). No existían diferencias significativas entre hombres y mujeres en las categorías de ERC según el FGe, excepto en la categoría G2, que era significativamente mayor (p=0,012) en hombres (39,36% [IC95%: 37,58–41,16]) que en mujeres (36,35% [IC95%: 34,79–37,92]). El porcentaje de sujetos de estudio con FGe reducido (<60mL/min/1,73 m2) era del 7,95% (IC95%: 7,30–8,61), sin diferencia significativa (p=0,169) entre hombres (7,44% [IC95%: 6,48–8,39]) y mujeres (8,36% [IC95%: 7,47–9,25]) (tabla 2).
Porcentajes de las categorías de ERC según KDIGO5
ERC: enfermedad renal crónica; ERT: enfermedad renal en etapa terminal; FGe: tasas de filtrado glomerular estimado según CDK-EPI15; KDIGO5: Kidney Disease: Improving Global Outcomes; Σ (A): sumatorio de porcentajes de las categorías de albuminuria;Σ (G): sumatorio de porcentajes de las categorías de FGe.
Escalas de riesgo según KDIGO5: verde (riesgo bajo); amarillo (riesgo moderadamente aumentado); naranja (riesgo alto); rojo (riesgo muy alto).
Porcentajes de las categorías de FGe y albuminuria en hombres y mujeres
| Hombres | A1 | A2 | A3 | Σ (G) | Mujeres | A1 | A2 | A3 | Σ (G) | Dif. Σ (G) | p |
|---|---|---|---|---|---|---|---|---|---|---|---|
| G1 | 51,48 | 1,65 | 0,10 | 53,24 | G1 | 53,80 | 1,41 | 0,08 | 55,29 | −2,06 | 0,097 |
| G2 | 36,88 | 2,10 | 0,38 | 39,36 | G2 | 34,85 | 1,38 | 0,11 | 36,35 | 3,01 | 0,012 |
| G3a | 3,20 | 1,52 | 0,24 | 4,96 | G3a | 5,02 | 0,81 | 0,05 | 5,89 | −0,93 | 0,100 |
| G3b | 0,83 | 0,83 | 0,07 | 1,72 | G3b | 1,22 | 0,62 | 0,05 | 1,90 | −0,18 | 0,587 |
| G4 | 0,21 | 0,21 | 0,17 | 0,59 | G4 | 0,16 | 0,22 | 0,03 | 0,41 | 0,18 | 0,299 |
| G5 | 0,03 | 0,00 | 0,10 | 0,14 | G5 | 0,05 | 0,11 | 0,00 | 0,16 | −0,03 | 0,836 |
| Σ (A) | 92,63 | 6,30 | 1,07 | 100,0 | Σ (A) | 95,11 | 4,56 | 0,33 | 100,0 | ||
| Dif. Σ (A) | −2,48 | 1,74 | 0,74 | ||||||||
| p | < 0,001 | 0,002 | < 0,001 |
A1: cociente albúmina-creatinina en orina (CAC)<30mg/g; A2: CAC entre 30 y 300mg/g; A3: CAC>300mg/g; FGe: tasas de filtrado glomerular estimado según CKD-EPI15; G: categorías de FGe según KDIGO5; Σ (A): sumatorio de porcentajes de las categorías de albuminuria; Σ (G): sumatorio de porcentajes de las categorías de FGe; Dif. Σ (A): diferencia de los Σ (A) entre hombres y mujeres; Dif. Σ (G): diferencia de los Σ (G) entre hombres y mujeres; p: p-valor de la diferencia de porcentajes.
La prevalencia de albuminuria (CAC≥30mg/g) en hombres (7,37% [IC95%: 6,42–8,32]) fue significativamente más alta (p<0,001) que en mujeres (4,89% [IC95%: 4,19–5,58]). El porcentaje de albuminuria estadio A1 era significativamente mayor (p<0,001) en mujeres que en hombres. Los porcentajes de albuminuria estadios A2 y A3 eran significativamente mayores (p<0,001) en los hombres que en mujeres (Tabla 2).
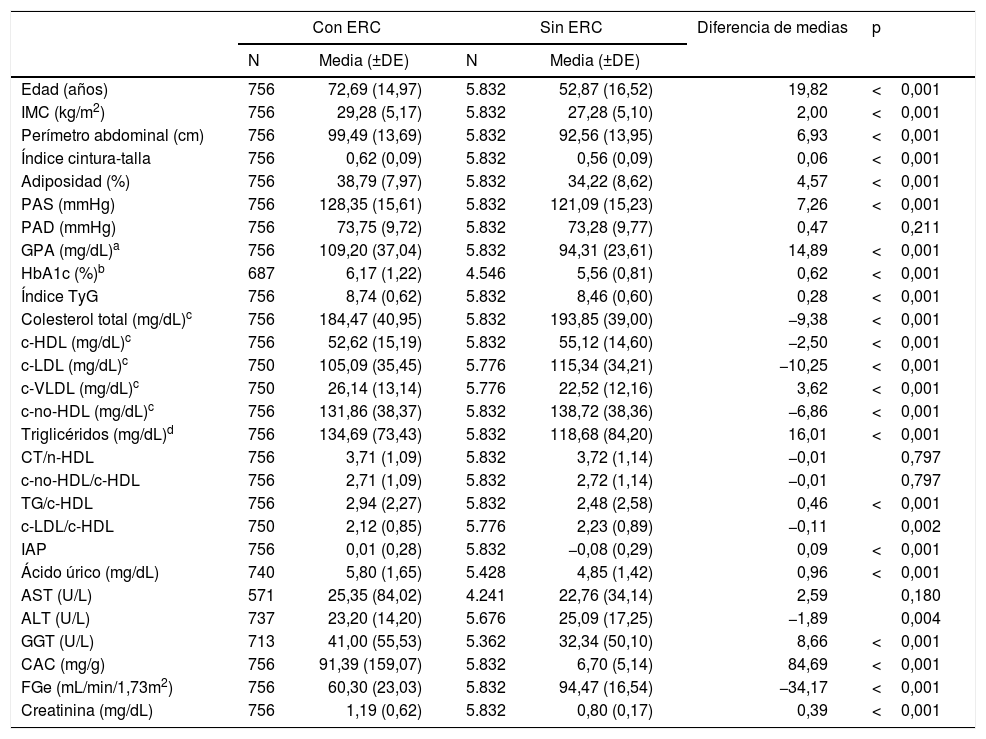
Análisis de las poblaciones con y sin ERCLas medianas (RIC) de edad de las poblaciones con y sin ERC eran 77,33 (65,22–83,38) años y 52,42 (40,33–65,18) años respectivamente, siendo significativa (p<0,001) la diferencia de las medias de edad (tabla 3). No había diferencia significativa (p=0,711) en el porcentaje de hombres y mujeres entre ambas poblaciones (tabla 4). Todas las variables clínicas cuantitativas eran significativamente mayores en la población con ERC que en la población sin ERC, excepto las concentraciones de CT, c-HDL, c-LDL, c-no-HDL, alanina-aminotransferasa y el FGe que fueron mayores en la población sin ERC, y la PAD, las concentraciones de aspartato-aminotransferasa, y los índices colesterol total/c-HDL y c-No-HDL/c-HDL, cuyas diferencias no eran significativas (tabla 3). Las medianas (RIC) de creatinina, FGe y CAC de la población con ERC eran 1,09 (0,91–1,30) mg/dL, 55,6 (46,5–73,3) mL/min/1,73m2, y 36,1 (5,1–100,9) mg/g, respectivamente. Las medianas (RIC) de creatinina, FGe y CAC de la población sin ERC eran 0,80 (0,68–0,90) mg/dL, 94,2 (82,7–106,0) mL/min/1,73m2, y 5,3 (3,0–8,7) mg/g, respectivamente.
Características clínicas de las poblaciones con y sin ERC
| Con ERC | Sin ERC | Diferencia de medias | p | |||
|---|---|---|---|---|---|---|
| N | Media (±DE) | N | Media (±DE) | |||
| Edad (años) | 756 | 72,69 (14,97) | 5.832 | 52,87 (16,52) | 19,82 | <0,001 |
| IMC (kg/m2) | 756 | 29,28 (5,17) | 5.832 | 27,28 (5,10) | 2,00 | <0,001 |
| Perímetro abdominal (cm) | 756 | 99,49 (13,69) | 5.832 | 92,56 (13,95) | 6,93 | <0,001 |
| Índice cintura-talla | 756 | 0,62 (0,09) | 5.832 | 0,56 (0,09) | 0,06 | <0,001 |
| Adiposidad (%) | 756 | 38,79 (7,97) | 5.832 | 34,22 (8,62) | 4,57 | <0,001 |
| PAS (mmHg) | 756 | 128,35 (15,61) | 5.832 | 121,09 (15,23) | 7,26 | <0,001 |
| PAD (mmHg) | 756 | 73,75 (9,72) | 5.832 | 73,28 (9,77) | 0,47 | 0,211 |
| GPA (mg/dL)a | 756 | 109,20 (37,04) | 5.832 | 94,31 (23,61) | 14,89 | <0,001 |
| HbA1c (%)b | 687 | 6,17 (1,22) | 4.546 | 5,56 (0,81) | 0,62 | <0,001 |
| Índice TyG | 756 | 8,74 (0,62) | 5.832 | 8,46 (0,60) | 0,28 | <0,001 |
| Colesterol total (mg/dL)c | 756 | 184,47 (40,95) | 5.832 | 193,85 (39,00) | −9,38 | <0,001 |
| c-HDL (mg/dL)c | 756 | 52,62 (15,19) | 5.832 | 55,12 (14,60) | −2,50 | <0,001 |
| c-LDL (mg/dL)c | 750 | 105,09 (35,45) | 5.776 | 115,34 (34,21) | −10,25 | <0,001 |
| c-VLDL (mg/dL)c | 750 | 26,14 (13,14) | 5.776 | 22,52 (12,16) | 3,62 | <0,001 |
| c-no-HDL (mg/dL)c | 756 | 131,86 (38,37) | 5.832 | 138,72 (38,36) | −6,86 | <0,001 |
| Triglicéridos (mg/dL)d | 756 | 134,69 (73,43) | 5.832 | 118,68 (84,20) | 16,01 | <0,001 |
| CT/n-HDL | 756 | 3,71 (1,09) | 5.832 | 3,72 (1,14) | −0,01 | 0,797 |
| c-no-HDL/c-HDL | 756 | 2,71 (1,09) | 5.832 | 2,72 (1,14) | −0,01 | 0,797 |
| TG/c-HDL | 756 | 2,94 (2,27) | 5.832 | 2,48 (2,58) | 0,46 | <0,001 |
| c-LDL/c-HDL | 750 | 2,12 (0,85) | 5.776 | 2,23 (0,89) | −0,11 | 0,002 |
| IAP | 756 | 0,01 (0,28) | 5.832 | −0,08 (0,29) | 0,09 | <0,001 |
| Ácido úrico (mg/dL) | 740 | 5,80 (1,65) | 5.428 | 4,85 (1,42) | 0,96 | <0,001 |
| AST (U/L) | 571 | 25,35 (84,02) | 4.241 | 22,76 (34,14) | 2,59 | 0,180 |
| ALT (U/L) | 737 | 23,20 (14,20) | 5.676 | 25,09 (17,25) | −1,89 | 0,004 |
| GGT (U/L) | 713 | 41,00 (55,53) | 5.362 | 32,34 (50,10) | 8,66 | <0,001 |
| CAC (mg/g) | 756 | 91,39 (159,07) | 5.832 | 6,70 (5,14) | 84,69 | <0,001 |
| FGe (mL/min/1,73m2) | 756 | 60,30 (23,03) | 5.832 | 94,47 (16,54) | −34,17 | <0,001 |
| Creatinina (mg/dL) | 756 | 1,19 (0,62) | 5.832 | 0,80 (0,17) | 0,39 | <0,001 |
Adiposidad: índice de grasa corporal CUN-BAE17; ALT: alanina-aminotransferasa; AST: aspartato-aminotransferasa; CAC: cociente albúmina/creatinina en orina; c-HDL: colesterol unido a lipoproteínas de alta densidad; c-LDL: colesterol unido a lipoproteínas de baja densidad; c-VLDL: colesterol unido a lipoproteínas de muy baja densidad y remanentes; c-no-HDL: colesterol no unido a lipoproteínas de alta densidad; DE: desviación estándar; ERC: enfermedad renal crónica; FGe: tasa de filtrado glomerular estimado según CKD-EPI15; GGT: gamma-glutamil transferasa; IAP: índice aterogénico de plasma; IMC: índice de masa corporal; Índice TyG: índice triglicéridos y glucosa; N: tamaño muestral; p: p-valor de la diferencia de medias; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
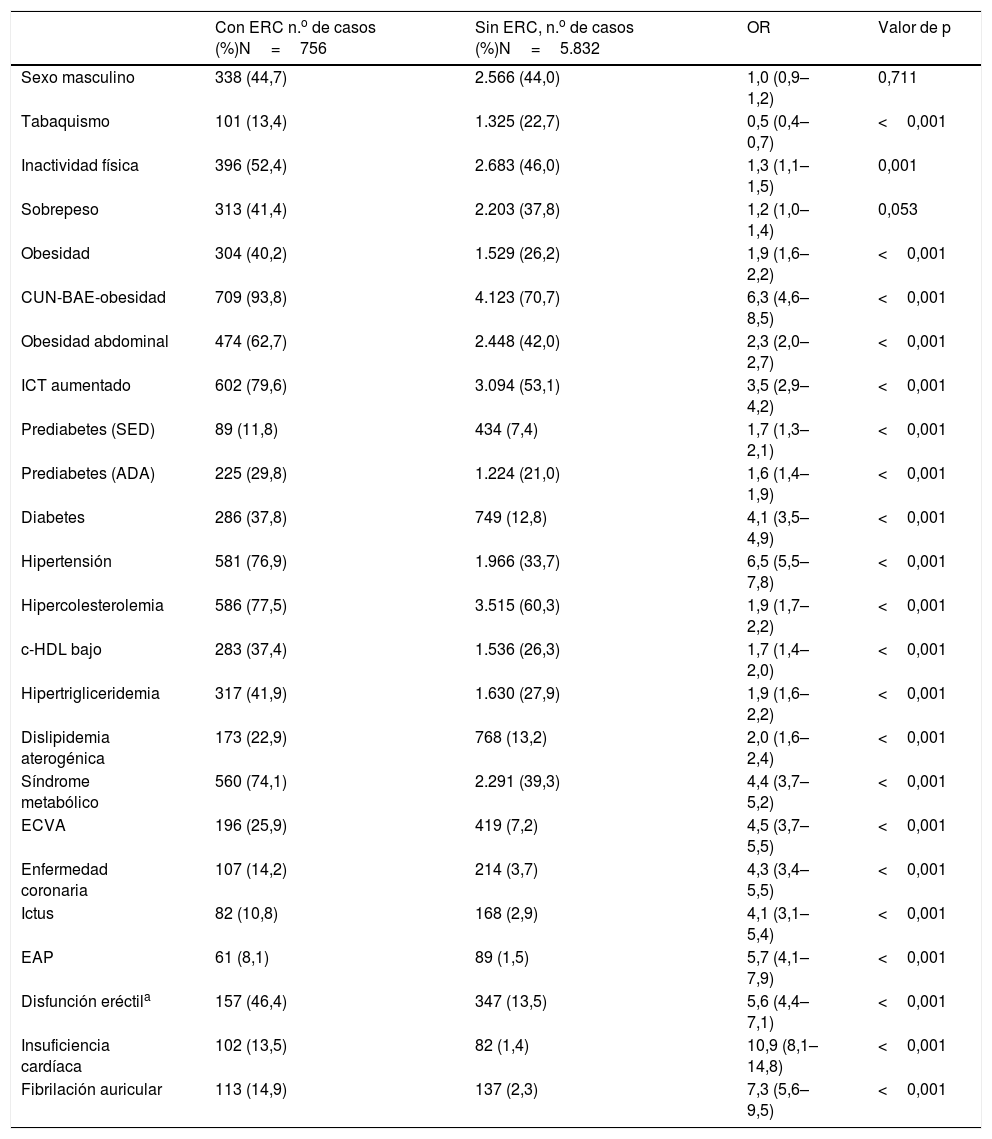
FRCV y comorbilidades en las poblaciones con y sin ERC
| Con ERC n.o de casos (%)N=756 | Sin ERC, n.o de casos (%)N=5.832 | OR | Valor de p | |
|---|---|---|---|---|
| Sexo masculino | 338 (44,7) | 2.566 (44,0) | 1,0 (0,9–1,2) | 0,711 |
| Tabaquismo | 101 (13,4) | 1.325 (22,7) | 0,5 (0,4–0,7) | <0,001 |
| Inactividad física | 396 (52,4) | 2.683 (46,0) | 1,3 (1,1–1,5) | 0,001 |
| Sobrepeso | 313 (41,4) | 2.203 (37,8) | 1,2 (1,0–1,4) | 0,053 |
| Obesidad | 304 (40,2) | 1.529 (26,2) | 1,9 (1,6–2,2) | <0,001 |
| CUN-BAE-obesidad | 709 (93,8) | 4.123 (70,7) | 6,3 (4,6–8,5) | <0,001 |
| Obesidad abdominal | 474 (62,7) | 2.448 (42,0) | 2,3 (2,0–2,7) | <0,001 |
| ICT aumentado | 602 (79,6) | 3.094 (53,1) | 3,5 (2,9–4,2) | <0,001 |
| Prediabetes (SED) | 89 (11,8) | 434 (7,4) | 1,7 (1,3–2,1) | <0,001 |
| Prediabetes (ADA) | 225 (29,8) | 1.224 (21,0) | 1,6 (1,4–1,9) | <0,001 |
| Diabetes | 286 (37,8) | 749 (12,8) | 4,1 (3,5–4,9) | <0,001 |
| Hipertensión | 581 (76,9) | 1.966 (33,7) | 6,5 (5,5–7,8) | <0,001 |
| Hipercolesterolemia | 586 (77,5) | 3.515 (60,3) | 1,9 (1,7–2,2) | <0,001 |
| c-HDL bajo | 283 (37,4) | 1.536 (26,3) | 1,7 (1,4–2,0) | <0,001 |
| Hipertrigliceridemia | 317 (41,9) | 1.630 (27,9) | 1,9 (1,6–2,2) | <0,001 |
| Dislipidemia aterogénica | 173 (22,9) | 768 (13,2) | 2,0 (1,6–2,4) | <0,001 |
| Síndrome metabólico | 560 (74,1) | 2.291 (39,3) | 4,4 (3,7–5,2) | <0,001 |
| ECVA | 196 (25,9) | 419 (7,2) | 4,5 (3,7–5,5) | <0,001 |
| Enfermedad coronaria | 107 (14,2) | 214 (3,7) | 4,3 (3,4–5,5) | <0,001 |
| Ictus | 82 (10,8) | 168 (2,9) | 4,1 (3,1–5,4) | <0,001 |
| EAP | 61 (8,1) | 89 (1,5) | 5,7 (4,1–7,9) | <0,001 |
| Disfunción eréctila | 157 (46,4) | 347 (13,5) | 5,6 (4,4–7,1) | <0,001 |
| Insuficiencia cardíaca | 102 (13,5) | 82 (1,4) | 10,9 (8,1–14,8) | <0,001 |
| Fibrilación auricular | 113 (14,9) | 137 (2,3) | 7,3 (5,6–9,5) | <0,001 |
ADA: prediabetes según Asociación Americana de Diabetes18; c-HDL bajo: colesterol unido a lipoproteínas de alta densidad<40mg/dL (hombres), <50mg/dL (mujeres); CUN-BAE-obesidad17: adiposidad o índice de grasa corporal (Clínica Universitaria de Navarra–Body Adiposity Estimator)>25% (hombres), >35% (mujeres); Dislipidemia aterogénica: hipertrigliceridemia y c-HDL bajo; EAP: enfermedad arterial periférica; ECVA: enfermedad cardiovascular arteriosclerótica; ERC: enfermedad renal crónica; FRCV: factores de riesgo cardiovascular; Hipercolesterolemia: colesterol total≥200mg/dL; Hipertrigliceridemia: triglicéridos≥150mg/dL; ICT aumentado: índice cintura-talla≥0,55; Inactividad física: actividad física<150min/semana; N: tamaño muestral; Obesidad: índice de masa corporal≥30kg/m2; Obesidad abdominal: perímetro abdominal≥102cm (hombres), ≥88cm (mujeres); OR: odds ratio entre ambas poblaciones (intervalo de confianza 95%); SED: prediabetes según Sociedad Española de Diabetes19; Sobrepeso: IMC 25,0–29,9kg/m2; Tabaquismo: consumo de cigarrillos o tabaco durante el último año.
Todas las OR de los FRCV y comorbilidades entre las poblaciones con y sin ERC mostraban asociación con la ERC, excepto el tabaquismo actual, que mostraba asociación con los sujetos sin ERC, y el sobrepeso, cuya OR no era significativa (tabla 4).
Según la valoración del RCV por SCORE21,y SCORE-OP22 para países de bajo riesgo, el 22,49% (IC95%: 19,56–25,63) de la población con ERC tenía un RCV alto y el 77,51% (IC95%: 74,54–80,49) tenía un RCV muy alto. Entre las poblaciones con y sin ERC, la OR de RCV alto era 1,7 (IC95%: 1,4–2,0) y la OR de RCV muy alto era 10,4 (IC95%: 8,7–12,4).
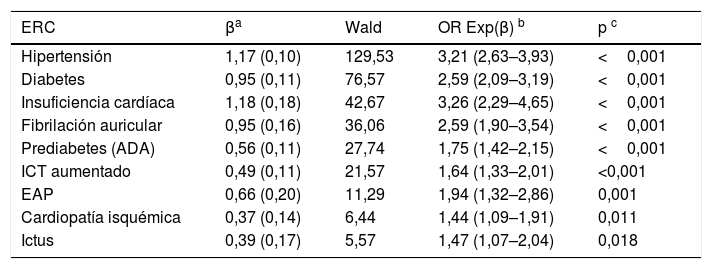
El análisis multivariante mostró que los FRCV y comorbilidades que se asociaban independientemente con la ERC eran HTA, DM, prediabetes según la ADA, ICT aumentado, insuficiencia cardíaca, fibrilación auricular, EAP, EC e ictus (tabla 5).
Análisis multivariante del efecto de comorbilidades y FRCV sobre la ERC
| ERC | βa | Wald | OR Exp(β) b | p c |
|---|---|---|---|---|
| Hipertensión | 1,17 (0,10) | 129,53 | 3,21 (2,63–3,93) | <0,001 |
| Diabetes | 0,95 (0,11) | 76,57 | 2,59 (2,09–3,19) | <0,001 |
| Insuficiencia cardíaca | 1,18 (0,18) | 42,67 | 3,26 (2,29–4,65) | <0,001 |
| Fibrilación auricular | 0,95 (0,16) | 36,06 | 2,59 (1,90–3,54) | <0,001 |
| Prediabetes (ADA) | 0,56 (0,11) | 27,74 | 1,75 (1,42–2,15) | <0,001 |
| ICT aumentado | 0,49 (0,11) | 21,57 | 1,64 (1,33–2,01) | <0,001 |
| EAP | 0,66 (0,20) | 11,29 | 1,94 (1,32–2,86) | 0,001 |
| Cardiopatía isquémica | 0,37 (0,14) | 6,44 | 1,44 (1,09–1,91) | 0,011 |
| Ictus | 0,39 (0,17) | 5,57 | 1,47 (1,07–2,04) | 0,018 |
ADA: Asociación Americana de Diabetes; EAP: enfermedad arterial periférica; ERC: enfermedad renal crónica; FRCV: factores de riesgo cardiovascular; ICT aumentado: índice cintura-talla≥0,55.
Las encuestas realizadas en países con ingresos altos mostraban unas tasas de prevalencia de ERC similares (11,3% en EE.UU.24, 12,5% en Canadá25 y 11,1% en Noruega26). Según el informe 2019 GKHA (Global Kidney Health Atlas)3 de la Sociedad Internacional de Nefrología (ISN), basado en 2 encuestas realizadas en 2017 y 2019, la prevalencia media de ERC en 21 países de Europa occidental era 10,1%, siendo en España del 9,6%. El estudio ISN-KDDC27, realizado en 12 países en desarrollo con muestreos no aleatorios de conveniencia, cuyo sesgo de selección podría sobrestimar la prevalencia, mostraba una prevalencia de ERC del 14,3%, con una alta variabilidad e incluso con diferencias significativas con otros estudios realizados en sus respectivos países. Mientras que el estudio ISN-KDDC27 mostraba unas prevalencias en India y China del 16,8% y del 29,9% respectivamente, otros estudios28,29 realizados con muestreo aleatorios en estos países mostraban prevalencias muy inferiores (7,5% y 16,8% respectivamente). Este sesgo también se comprobó en EE.UU. entre el programa KEEP30 con sujetos de estudio con derivación activa y la Encuesta de Salud Nacional y Examen de Nutrición (NHANES), con distintas tasas de prevalencias de ERC (28,7% y 13,1%, respectivamente). La prevalencia ajustada del presente estudio SIMETAP-ERC (9,2%) fue algo inferior a la del metaanálisis de Hill et al.9 (13,4%), y muy similar a la del metaanálisis de la GBD-CKD Collaboration10 (9,1%), ambos metaanálisis con una alta heterogeneidad entre los estudios analizados. La prevalencia de ERT en el estudio SIMETAP-ERC (0,15%) era similar a la del informe GKHA de la ISN3, que oscilaba entre el 0,1% en los países de ingresos medios altos y el 0,2% en los de ingresos altos.
En España, el Estudio ENRICA31 mostró una prevalencia cruda de ERC del 15,1%, similar al 14,4% de la cohorte de población en consultas de atención primaria del estudio IBERICAN32. Estos resultados difieren del estudio EPIRCE33, que empleando el método del grupo Modification of Diet in Renal Diseases (MDRD)34 para valorar el FGe, mostró una prevalencia de ERC del 9,2%, igual que la del presente estudio utilizando la ecuación CKD-EPI15. El estudio SIMETAP-ERC confirmó que la prevalencia de ERC aumentaba con la edad, duplicándose por cada tramo etario decenal a partir de los 40 años (fig. 1). Otros estudios realizados en España que utilizaron el método MDRD34 para valorar la prevalencia del FGe reducido muestran resultados dispares, como el estudio EPIRCE33 (21,4%) en la población≥65 años y los estudios PREV-ICTUS35 (25,9%) y el de Salvador González et al.36 (15,1%) en poblaciones con 60 o más años. Estos estudios33,35,36 muestran resultados inferiores a otros que valoraron el FGe con la ecuación CKD-EPI15, como el estudio ENRICA31, en el que la prevalencia cruda de ERC era del 37,3% en la población ≥65 años, o la del presente estudio, en el que las prevalencias de ERC ajustadas por edad en las poblaciones≥60 años y ≥70 años eran del 23,8 y del 33,6% respectivamente. La elección de la ecuación CKD-EPI15 en vez del método MDRD34 sigue las recomendaciones de las guías KDIGO5 y del consenso español para la detección y manejo de la ERC37, al relacionarse mejor con valores de FGe reducido, ser más precisa para valores>60mL/min/1,73 m2 y tener mayor capacidad para predecir mortalidad global, mortalidad cardiovascular o el riesgo de fallo renal37.
Todos los parámetros antropométricos eran significativamente mayores en la población con ERC, existiendo una asociación con obesidad, adiposidad, obesidad abdominal, y el ICT aumentado. Aunque la obesidad se ha asociado con un mayor riesgo de ERC38, en el presente estudio solo el ICT aumentado mostraba una asociación independiente con la ERC, junto con otras comorbilidades como HTA, DM, prediabetes, IC, FA, EAP, EC e ictus, que también aparecían asociadas en otros estudios26,31–33,36.
A pesar de la reducción del riesgo de los principales episodios adversos cardiovasculares durante las últimas décadas por el mejor control de la DM, HTA y dislipidemia, la prevalencia de individuos con DM2 y ERC en la población adulta sigue siendo muy alta y la tendencia continúa en aumento39, probablemente debido a que este mejor control contribuye al incremento de la longevidad, y por lo tanto a un mayor tiempo para poder desarrollar ERC40. El estudio SIMETAP-DM41 mostró que el 27,6% de la población adulta con DM tenía ERC, prevalencia inferior a la de la encuesta NHANES42 de EE.UU. (43,5%), y similar a la de otros estudios españoles como el de Fernández-Fernández et al.43 (25,3%), y al PERCEDIME244 (27,9%). En el presente estudio, el 37,8% de la población con ERC padecía DM, el 29,8% tenía criterios de prediabetes según la ADA18 y el 11,8% criterios según la SED19. A pesar de que las OR entre las poblaciones con y sin ERC de la prediabetes según la ADA18 y según la SED19 eran similares (1,6 y 1,7 respectivamente), solo la prediabetes según la ADA18 se asociaba de forma independiente con la ERC, como también se asocia la DM, lo que apoya la estrecha relación existente entre las alteraciones del metabolismo glucémico y la ERC9,11.
En el presente estudio, la PAS era significativamente mayor (7,3mmHg) en la población con ERC que sin ERC, y el 79,6% de la población con ERC tenía HTA, siendo este factor el que mejor se asociaba independientemente con la ERC.
El hecho de que todos los parámetros incluidos en las variables CUN-BAE obesidad17 y síndrome metabólico20 estuvieran asociados con la ERC justifica que ambas variables mostraran una asociación muy fuerte con la ERC (OR 6,3 y 4,4 respectivamente).
Por otra parte, el estudio SIMETAP-ERC mostró que el 25,9% de la población con ERC tenía ECVA (EC: 14,2%; ictus: 10,8%; EAP: 8,1%) y que tanto la ECVA considerada globalmente como la EC, el ictus o la EAP consideradas individualmente, mostraban una asociación independiente con la ERC. Aproximadamente el 55% de los pacientes con IC y el 50% de los pacientes con FA tienen algún grado de insuficiencia renal y cerca del 20% de los pacientes con ERC padecen FA45,46. En el presente estudio, el 13,5% y el 14,9% de los sujetos con ERC padecían IC y FA respectivamente, y ambas entidades se mostraban como factores independientes estrechamente asociados con la ERC. Más del 77% de la población con ERC tenía un RCV muy alto según SCORE21,22, que incluía a los pacientes con ERC grave (FGe<30ml/min/1,73 m2), con DM y lesión de órgano diana o FRCV principal (tabaquismo, HTA o hipercolesterolemia marcada), con ECVA clínica o documentada por imagen y a los sujetos con una puntuación≥10. Este elevado porcentaje está justificado por ser una población con una mediana de edad de 77 años y una frecuencia elevada de ECVA (26%) y factores cardiometabólicos (DM 38%; obesidad: 40%; síndrome metabólico 74%; HTA 77%; hipercolesterolemia 78%).
Entre las limitaciones del presente estudio cabe mencionar que no se valoró la presencia de daño renal objetivado directamente (biopsia renal) o indirectamente por pruebas de imagen, la incapacidad para determinar causalidad, la posible variabilidad entre los entrevistadores, el calibrado o la posible heterogeneidad de los aparatos de medición y laboratorio, y que no se incluyeron a mujeres en periodo de gestación, pacientes terminales, institucionalizados, o con deterioro cognitivo. Por otra parte, el diseño transversal del presente estudio no permitió valorar la persistencia de la albuminuria o del FGe reducido, estimar tasas de incidencia, ni inferir relaciones causales entre los factores de riesgo y la ERC.
Las diferentes metodologías de muestreo y determinaciones del FGe y las distintas medianas de edad de las poblaciones de los estudios de comparación podrían explicar las diferentes tasas de prevalencia de ERC. Una fortaleza del presente estudio fue el amplio muestreo aleatorio sobre una base poblacional que incluyó a todos los grupos de edad. El estudio SIMETAP-ERC muestra que la ERC está muy influenciada por la edad, por lo que se precisa ajustar las tasas por edad para poder comparar con otras poblaciones. Otras fortalezas del presente estudio fueron valorar la asociación de la ERC con numerosas variables cardiometabólicas, y las determinaciones de FGe según CKD-EPI15 y CAC en toda la población.
La derivación tardía a Nefrología de pacientes con ERT que padecen DM o HTA es frecuente en España47. La estrategia más eficiente para reducir la carga de la ERC y disminuir su progresión es la detección precoz mediante el cribado del FGe reducido y albuminuria en personas con DM, HTA, obesidad y ECVA, que permita el diagnóstico y el tratamiento en las primeras etapas de la ERC48–50.
El estudio SIMETAP-ERC muestra una progresiva prevalencia de ERC, sobre todo a partir de los 50 años, cuya carga sanitaria incrementa el riesgo de ERT, mortalidad global y mortalidad cardiovascular. La valoración de la de la situación epidemiológica de ERC es muy importante para optimizar los recursos de salud disponibles, planificar las intervenciones destinadas a prevenir este problema de salud y reducir la carga de la enfermedad mediante la implementación de estrategias de detección precoz y prevención de fácil aplicación en el ámbito de la atención primaria, como son las modificaciones de los estilos de vida y el adecuado control de los principales factores de riesgo asociados con la ERC.
ConclusionesLa prevalencia ajustada por edad y sexo de ERC en la población adulta era del 9,2% (FGe reducido: 8%; albuminuria: 6%). Las tasas específicas por grupos etarios decenales de prevalencia de ERC se incrementaban con la edad sin diferencias significativas entre hombres y mujeres, duplicándose por cada grupo etario decenal a partir de los 40 años, y siendo del 24% en la población con 60 o más años y del 34% a partir de los 70 años.
Las comorbilidades más frecuentes que se asociaban con la ERC eran HTA (77%) hipercolesterolemia (77%), síndrome metabólico (74%), obesidad abdominal (63%), hipertrigliceridemia (42%), obesidad (40%), DM (38%), c-HDL bajo (37%) y prediabetes (30%) y ECVA (26%). Las variables que se asociaban independientemente con la ERC eran HTA, DM, prediabetes, ICT aumentado, insuficiencia cardíaca, fibrilación auricular y ECVA. La elevada carga cardiovascular de la ERC (77% con RCV muy alto) en una población de avanzada edad justifica la necesidad de implementar medidas poblacionales de detección precoz y el óptimo control de los factores cardiometabólicos asociados.
FinanciaciónLa financiación del estudio SIMETAP (Código Beca: 05/2010RS) fue aprobada según la Orden 472/2010, de 16 de septiembre, de la Consejería de Sanidad, por la que se aprueban las bases reguladoras y la convocatoria de ayudas para el año 2010 de la Agencia «Pedro Laín Entralgo» de Formación, Investigación y Estudios Sanitarios de la Comunidad de Madrid, para la realización de proyectos de investigación en el campo de resultados en salud en atención primaria.
Comité Ético de InvestigaciónComisión de Investigación de la Gerencia Adjunta de Planificación y Calidad.
Gerencia de Atención Primaria. Servicio Madrileño de Salud (SERMAS).
Conflicto de interesesLos autores no tienen conflictos de intereses para esta publicación.
Se agradece el esfuerzo, dedicación y colaboración prestada de los siguientes médicos que han participado en el Grupo de Investigación del Estudio SIMETAP: Abad Schilling C., Adrián Sanz M., Aguilera Reija P., Alcaraz Bethencourt A., Alonso Roca R., Álvarez Benedicto R., Arranz Martínez E., Arribas Álvaro P., Baltuille Aller M.C., Barrios Rueda E., Benito Alonso E., Berbil Bautista M.L., Blanco Canseco J.M., Caballero Ramírez N., Cabello Igual P., Cabrera Vélez R., Calderín Morales M.P., Capitán Caldas M., Casaseca Calvo T.F., Cique Herráinz J.A., Ciria de Pablo C., Chao Escuer P., Dávila Blázquez G., de la Peña Antón N., de Prado Prieto L., del Villar Redondo M.J., Delgado Rodríguez S., Díez Pérez M.C., Durán Tejada M.R., Escamilla Guijarro N., Escrivá Ferrairó R.A., Fernández Vicente T., Fernández-Pacheco Vila D., Frías Vargas M.J., García Álvarez J.C., García Fernández M.E., García García Alcañiz M.P., García Granado M.D., García Pliego R.A., García Redondo M.R., García Villasur M.P., Gómez Díaz E., Gómez Fernández O., González Escobar P., González-Posada Delgado J.A., Gutiérrez Sánchez I., Hernández Beltrán M.I., Hernández de Luna M.C., Hernández López R.M., Hidalgo Calleja Y., Holgado Catalán M.S., Hombrados Gonzalo M.P., Hueso Quesada R., Ibarra Sánchez A.M., Iglesias Quintana J.R., Íscar Valenzuela I., Iturmendi Martínez N., Javierre Miranda A.P., López Uriarte B., Lorenzo Borda M.S., Luna Ramírez S., Macho del Barrio A.I., Magán Tapia P., Marañón Henrich N., Mariño Suárez J.E., Martín Calle M.C., Martín Fernández A.I., Martínez Cid de Rivera E., Martínez Irazusta J., Migueláñez Valero A., Minguela Puras M.E., Montero Costa A., Mora Casado C., Morales Cobos L.E., Morales Chico M.R., Moreno Fernández J.C., Moreno Muñoz M.S., Palacios Martínez D., Pascual Val T., Pérez Fernández M., Pérez Muñoz R., Plata Barajas M.T., Pleite Raposo R., Prieto Marcos M., Quintana Gómez J.L., Redondo de Pedro S., Redondo Sánchez M., Reguillo Díaz J., Remón Pérez B., Revilla Pascual E., Rey López A.M., Ribot Catalá C., Rico Pérez M.R., Rivera Teijido M., Rodríguez Cabanillas R., Rodríguez de Cossío A., Rodríguez de Mingo E., Rodríguez Rodríguez A.O., Rosillo González A., Rubio Villar M., Ruiz Díaz L., Ruiz García A., Sánchez Calso A., Sánchez Herráiz M., Sánchez Ramos M.C., Sanchidrián Fernández P.L., Sandín de Vega E., Sanz Pozo B., Sanz Velasco C., Sarriá Sánchez M.T., Simonaggio Stancampiano P., Tello Meco I., Vargas-Machuca Cabañero C., Velazco Zumarrán J.L., Vieira Pascual M.C., Zafra Urango C., Zamora Gómez M.M., Zarzuelo Martín N.