La enfermedad renal crónica representa un verdadero estado inflamatorio y está relacionada con múltiples factores de riesgo cardiovascular. La enfermedad arterial coronaria es una de sus principales complicaciones y usualmente ha sido asociada con factores de riesgo cardiovascular no clásicos o propios de pacientes urémicos como las alteraciones del metabolismo del calcio y el fósforo, entre otros. Evidencia clínica reciente muestra que el depósito de grasa órgano específico, como el tejido adiposo epicárdico, es un factor de riesgo adicional a tener en cuenta en el momento de la evaluación de riesgo cardiovascular en la población general y en los pacientes renales. La interacción directa de este tejido con los vasos coronarios y la consecuente mediación de sustancias proaterogénicas generan un proceso local que termina en la producción de daño endotelial. Aunque la población de enfermos renales ha sido evaluada escasamente, estudios futuros determinarán con precisión si un incremento en la adiposidad epicárdica está verdaderamente asociado a la morbimortalidad cardiovascular en este grupo de riesgo.
Chronic kidney disease represents a true inflammatory state, and is related to multiple cardiovascular risk factors. Coronary artery disease is the major complication, and has usually been associated with non-classical or uraemic related factors that include the disturbance of calcium and phosphorus metabolism, among others. Recent clinical evidence shows that specific body fat deposition like epicardial adipose tissue is an additional factor to consider when evaluating cardiovascular risk in the general population and kidney patients. Direct interaction of this tissue and coronary vessels with consequent mediation of pro-atherogenic substances have a local process ending in endothelial damage. Although the population of renal patients has been poorly evaluated, future studies should determine precisely whether an increase in epicardial fat is truly associated with cardiovascular morbidity and mortality in this risk group.
La enfermedad renal crónica (ERC) representa un verdadero estado inflamatorio y está relacionada con múltiples factores de riesgo cardiovascular (CV)1. De hecho, pacientes con ERC tienen significativamente más riesgo de presentar un evento CV que individuos de la población general con función renal normal2. Las principales causas de complicación CV en estos pacientes son la hipertrofia ventricular izquierda y la enfermedad arterial coronaria3,4.
La evidencia clínica ha demostrado que el tejido adiposo visceral (TAV) es un importante marcador de riesgo CV5,6. Por ejemplo, parece haber una conexión entre el TAV y la enfermedad CV en enfermedades tan frecuentes como el síndrome metabólico, la diabetes y la hipertensión arterial7. El reconocimiento del adipocito como un tipo celular con funcionamiento complejo y con capacidad endocrina, paracrina y autocrina ha despertado el interés investigativo de disciplinas como la biología molecular, la endocrinología, la nefrología, la cardiología y la inmunología, convirtiéndolo en una tierra fértil de debate científico a la luz de su amplia heterogeneidad por su localización, funciones, proteómica y metabolómica. De hecho, estas características cobran particular importancia en el TAV, cuyos cambios en función y volumen se asocian a un mayor riesgo cardiometabólico8.
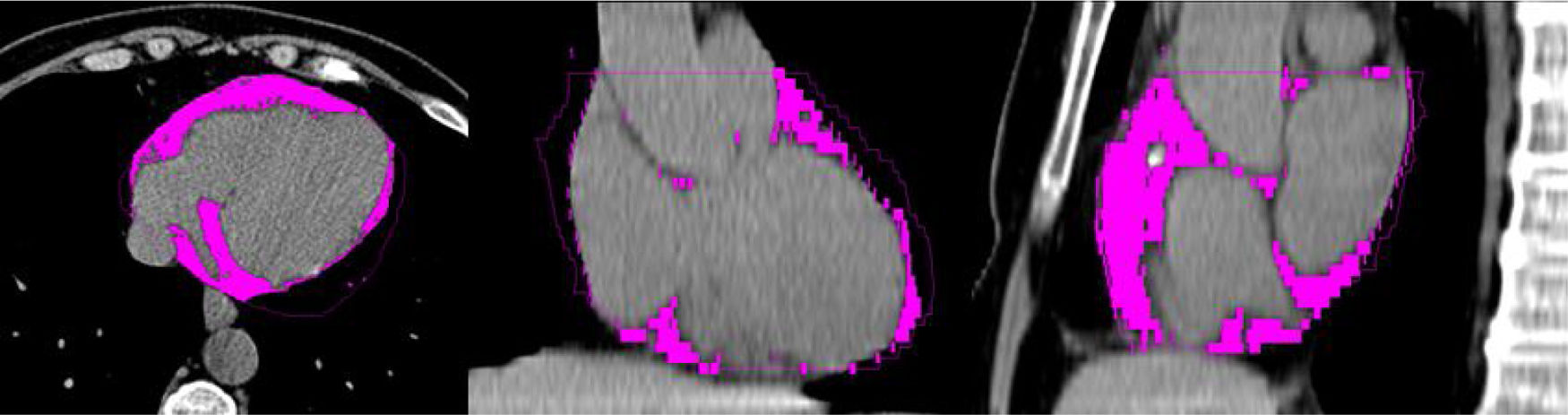
Tejido adiposo epicárdicoAnatomía y funciónEn años recientes, se han investigado diferentes áreas de tejido adiposo extraabdominal, así, el tejido adiposo epicárdico (TAE) se ha reportado como un marcador de riesgo específico en la enfermedad coronaria9,10. Específicamente, el TAE representa la grasa confinada dentro del saco pericárdico y está localizado en la superficie del corazón, cubriendo la porción epicárdica de las arterias coronarias11. Su volumen varía en un rango de 68 a 124cm3, representando aproximadamente del 15 al 20% del volumen cardíaco total y cubriendo aproximadamente el 80% de la superficie cardíaca10. En condiciones fisiológicas, ejerce funciones de naturaleza mecánica, bioquímica y de termorregulación12. Sin embargo, en condiciones patológicas, el TAE afecta localmente al corazón y a las arterias coronarias a través de una actividad paracrina y vasocrina con la secreción de citocinas proinflamatorias13-15.
El TAE puede ser detectado mediante diferentes técnicas de imagen. El ultrasonido, una de las primeras técnicas usadas para este fin, representa una técnica económica y rápida de usar, sin embargo, la resonancia magnética y la tomografía axial computarizada (TAC) ofrecen la capacidad de una mejor y adecuada visualización y medición del tejido por su alta resolución espacial16,17. Adicionalmente, la TAC permite la evaluación simultánea del calcio arterial coronario (CAC)18,19. En la figura 1 se describe un estudio de TAC cardíaco que muestra coloreado el TAE.
Otros depósitos grasos cardíacosEl TAE no debe confundirse con otro tipo de depósito de grasa localizado a nivel cardíaco: el tejido adiposo pericárdico (TAP) que, a diferencia del TAE, se localiza fuera del pericardio visceral sobre la superficie externa del pericardio parietal20. El origen de ambos tejidos es distinto: el TAE se origina de la hoja esplacnopleural del mesodermo, al igual que el TAV, mientras que el TAP se origina del mesénquima torácico primitivo; por este motivo, la circulación local es también diferente en ambos tejidos; así, la grasa epicárdica es irrigada por ramas de las arterias coronarias (comparte la misma microcirculación del miocardio), mientras que la grasa pericárdica recibe irrigación de las ramas pericardiofrénicas de la arteria mamaria interna12. Debido a esta íntima relación entre el TAE, el miocardio y las arterias coronarias, el volumen y la función del TAE se ha asociado a la génesis y la progresión de la ateroesclerosis coronaria.
Tejido adiposo epicárdico y metabolismoLa evidencia actual apunta a la posibilidad de que el tejido adiposo adyacente a la pared de los vasos coronarios permita la difusión o el transporte a través de la vasa vasorum de citocinas proinflamatorias o adipocitocinas producidas por los adipocitos, tales como el factor de necrosis tumoral alfa, la interleucina 6 (IL-6), la leptina, la resistina y la visfatina, entre otras14. Estos elementos en conjunto generan disfunción endotelial local con un incremento en la expresión de moléculas de adhesión y estrés oxidativo mediado por lipotoxicidad hacia el retículo endoplasmático vía sobreoferta de ácidos grasos libres a los tejidos circundantes, donde la hipertrigliceridemia y la insulinorresistencia asociadas a obesidad y síndrome metabólico empeorarían las condiciones de este microambiente14,21. Finalmente, este proceso favorece el anclaje y el aumento del tiempo de residencia en el subendotelio de las lipoproteínas de baja densidad y otras lipoproteínas ApoB proaterogénicas, tales como lipoproteína de densidad intermedia y la lipoproteína (a), cuyas modificaciones oxidativas y no oxidativas convierten el subendotelio en un nicho para células inmunocompetentes como macrófagos, células T, monocitos y células musculares lisas modificadas, que al interactuar en este medio producen las alteraciones funcionales y morfológicas típicas de la placa aterosclerótica22,23.
Mucho más interesante es la posibilidad de que el TAE active vías en el miocardiocito que alteren su patrón proteómico y esto, a su vez, su capacidad de secreción endocrina. En este sentido, el descubrimiento de los péptidos natriuréticos ha cambiado la visión del corazón más allá de una simple bomba mecánica a un órgano capaz de modificar su rendimiento al interactuar con el resto del organismo mediante la producción de estos mensajeros hormonales. Hasta la fecha, se han estudiado 3péptidos natriuréticos que incluyen el péptido natriurético auricular (PNA, producido en las aurículas), el péptido natriurético tipo B (PNB, producido en los ventrículos) y el péptido natriurético tipo C (PNC, producido en las células endoteliales). En general, el PNA y el PNB son liberados en cantidades muy pequeñas, pero algunas condiciones (p. ej., ERC), que cursan con un incremento de la carga mecánica y estrés de la pared como la hipertrofia ventricular, la hipertensión, la inflamación, la fibrosis y la hipoxia pueden estimular la producción y la liberación de estos mediadores. Así, niveles elevados de ambos son marcadores bien conocidos de riesgo cardiovascular24-26.
Clásicamente, la investigación en esta área se ha dedicado a explorar los efectos hemodinámicos de estas hormonas sobre el eje corazón-riñón, pero en la última década, el descubrimiento de receptores en el tejido adiposo para los péptidos natriuréticos ha abierto una productiva área de investigación sobre la señalización hormonal entre estos tejidos y sus efectos metabólicos más allá de la concepción inicial de que el tejido adiposo solo intervenía en la remoción de los péptidos natriuréticos de la circulación. Sin embargo, tiempo después se descubrió que el tejido adiposo expresaba la proteína natriuretic peptide receptor-1 y 2 (NPR-1 y NPR-2), capaz de interactuar tanto con el PNA o como con el PNB con alta afinidad, activando la traslocación de señal vía guanilato ciclasa-GMPc-protein cinasa G, activando a la lipasa sensible a hormonas dentro del adipocito y subsecuentemente a la lipólisis. Por otro lado, la activación de la cascada de las MAP cinasas/p38 genera un incremento en la oxidación de ácidos grasos y la activación de la termogénesis por inducción de la síntesis de UCP127. Así, la sobreoferta de ácidos grasos desde el tejido adiposo puede afectar muchos tejidos como el tejido hepático (estimulación de la producción de la glucosa hepática), célula beta (apoptosis y alteraciones en el patrón de secreción de insulina), tejido nervioso (alteración en la producción y clearence de las proteínas Tau), tejido muscular estriado (resistencia a la insulina) y al cardiomiocito (cambio en el patrón de consumo energético con mayor consumo de O2, cardiotoxicidad y arritmogénesis aumentada)28.
Por el contrario, la señalización por el receptor NPR-3 —cuya expresión se incrementa en la diabetes tipo 2 y en la obesidad— conduce a la internalización y la degradación de los péptidos natriuréticos contrarrestando cualquier efecto beneficioso sistémico de estas hormonas. De hecho, una baja concentración de PNA, PNB y PNC se asocia a la presencia de insulinorresistencia y diabetes29.
Tejido adiposo epicárdico y enfermedad renal crónicaAunque la literatura que evalúa el TAE en la ERC está en continuo desarrollo, investigaciones han reportado una relación entre TAE y la presencia de CAC en grupos reducidos de pacientes con afectación renal. Uno de los primeros estudios se llevó a cabo en 80 pacientes con ERC en diálisis y 27 controles30. Se evaluó la presencia del síndrome malnutrición-inflamación-aterosclerosis (MIA) mediante la medición de niveles séricos de albúmina, proteína C reactiva y la cuantificación de CAC y TAE mediante TAC. El TAE se relacionó significativamente con los componentes del síndrome MIA y hubo una relación proporcional entre el incremento en el volumen de TAE y la presencia de CAC. Por su parte, Kerr et al. evaluaron a 94 pacientes con ERC en grados 3-5 sin diálisis y reportaron una correlación lineal con incremento del TAE y CAC, incluyendo otras citocinas, como la IL-6 y el factor de crecimiento fibroblástico 23, entre otros31. Otra investigación realizada en una cohorte de 411 pacientes con ERC de grados 4-5 y 5 en diálisis que estaban siendo evaluados para trasplante renal reveló que el TAE es un factor de riesgo para alteraciones de la perfusión miocárdica al igual que la presencia del CAC19. El TAE mostró asociación independiente al CAC para predecir defectos de perfusión miocárdica. Recientemente, Karatas et al. demostraron que el espesor del TAE medido por ecocardiografía es significativamente mayor en pacientes en hemodiálisis en comparación con aquellos en etapas predialíticas o en sujetos sanos32. Así mismo, utilizando un subanálisis del estudio RIND (Renagel in new dialysis trial), que inicialmente evaluó la presencia de CAC y alteraciones del calcio y fósforo en pacientes iniciando tratamiento dialítico, se observó que cada incremento de 10 cc en el volumen de TAE incrementó en un 6% la mortalidad33. Factores como el CAC y la edad también fueron asociados a aumento de la mortalidad. Otras publicaciones han reportado resultados similares34-36. Contrariamente, otros investigadores no han encontrado el TAE como predictor de riesgo aislado, sino como un cofactor asociado al índice de masa corporal (IMC) y otros índices de obesidad37,38.
En poblaciones de riesgo y en pacientes con ERC, el TAE no solo se relaciona con el CAC. Investigaciones recientes han mostrado asociación entre el TAE y las calcificaciones vasculares extracoronarias como en la aorta, las válvulas cardíacas y las arterias carótidas35. Así mismo, se ha reportado una correlación lineal entre el aumento del volumen del TAE, el espesor íntima-media carotídeo y la hipertrofia ventricular izquierda39,40.
Obesidad, nutrición y riñónLas alteraciones a nivel nutricional son un hallazgo frecuente en los enfermos renales. El impacto de la enfermedad renal sobre la composición corporal constituye por sí mismo un factor de morbimortalidad en esta población41. Dentro de los factores condicionantes de morbimortalidad destacan la presencia de diabetes, hipertensión, dislipidemia, estados inflamatorios crónicos, desnutrición proteico-calórica, disfunción inmunitaria, depleción de masa magra, deficiencia de micronutrientes y balance nitrogenado negativo, entre otros42,43.
Aunque se sabe que la obesidad es un factor de riesgo CV y los pacientes obesos tienen mayor riesgo de presentar ERC e incluso progresar más rápidamente a ERC avanzada, ya en diálisis, paradójicamente la sobrevida es mayor mientras mayor sea el IMC (epidemiología inversa)43-45. Este fenómeno, aunque es contrario a lo observado en la población general, se ha observado en algunos grupos de riesgo (ancianos y pacientes con insuficiencia cardíaca congestiva)46,47. Dentro de las posibles explicaciones a estos hallazgos se encuentran el déficit proteico-calórico, la disminución de las reservas nutricionales, la acidosis metabólica y la inflamación48.
Más específicamente, esta paradoja observada en los pacientes con ERC está relacionada a la pérdida de proteína-energía o PEW (en inglés, protein-energy wasting) y a la inflamación49. Así, los pacientes que tienen un IMC o un peso corporal más bajo pueden tener mayor grado de PEW, que sería responsable de un incremento en la morbimortalidad. Por el contrario, los pacientes con sobrepeso tendrían una menor deficiencia en la ingesta de energía o proteínas, y una menor probabilidad de desarrollar PEW50,51. Más aun, se sabe que cuando los pacientes están desnutridos son más susceptibles a los estragos del proceso inflamatorio49.
ConclusiónFinalmente, el TAE se asocia a riesgo cardiovascular tanto en la población general como en enfermos renales. Quedaría por determinar si una vez que la ERC progresa a etapas avanzadas o tratamiento dialítico, se generen cambios a nivel del TAE que influyan en el pronóstico de los pacientes. Estudios futuros deberían diseñarse para abordar esta interesante pregunta.
- •
El riesgo de sufrir un evento cardiovascular es 10 veces más elevado en enfermos renales crónicos comparado con la población general.
- •
Las calcificaciones vasculares representan depósitos de calcio en la intima y media vascular; las calcificaciones de las válvulas cardiacas también se incluyen dentro de esta denominación. Pacientes con ERC exhiben todas sus formas.
- •
El tejido adiposo epicárdico es grasa confinada dentro del saco pericárdico localizado en la superficie del corazón; cubre la porción epicárdica de las arterias coronarias.
- •
Las alteraciones nutricionales son frecuentes en los enfermos renales. Esta afectación va desde un déficit proteico-calórico severo hasta estados inflamatorios crónicos.
Los autores declaran no tener ningún conflicto de intereses.