Comparar las concentraciones de interleucina 10 (IL-10) en pacientes con preeclampsia y embarazadas normotensas sanas.
Material y métodoSe seleccionó un total de 100 pacientes. Se incluyeron a 50 pacientes preeclámpticas como los casos grupo A y un grupo control que fue seleccionado por tener una edad y un índice de masa corporal similares al grupo de estudio y que consistió en 50 embarazadas sanas (grupo B). Las muestras de sangre para la determinación de IL-10 se recolectaron en todas las pacientes antes del parto e inmediatamente después del diagnóstico en el grupo de casos.
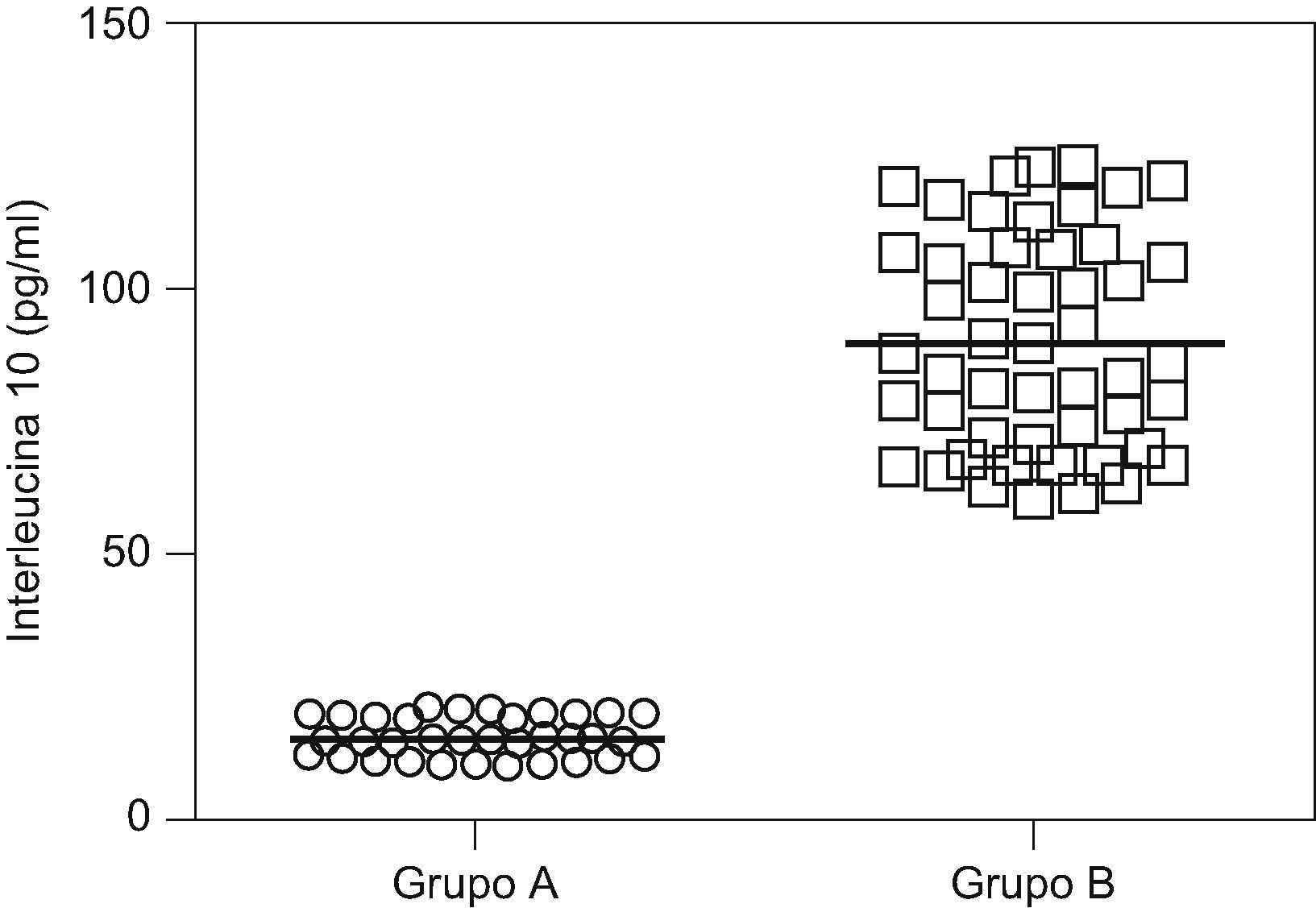
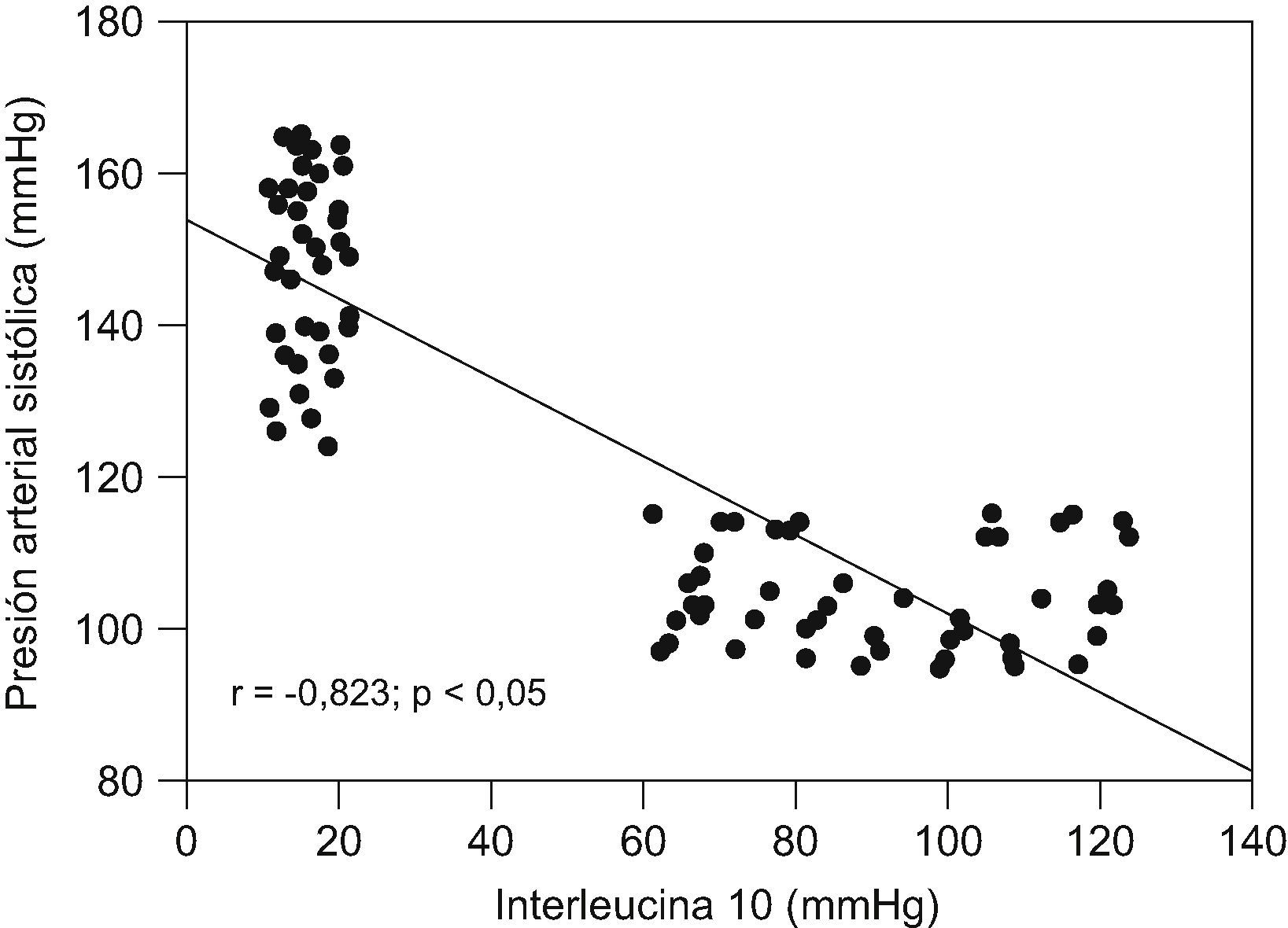
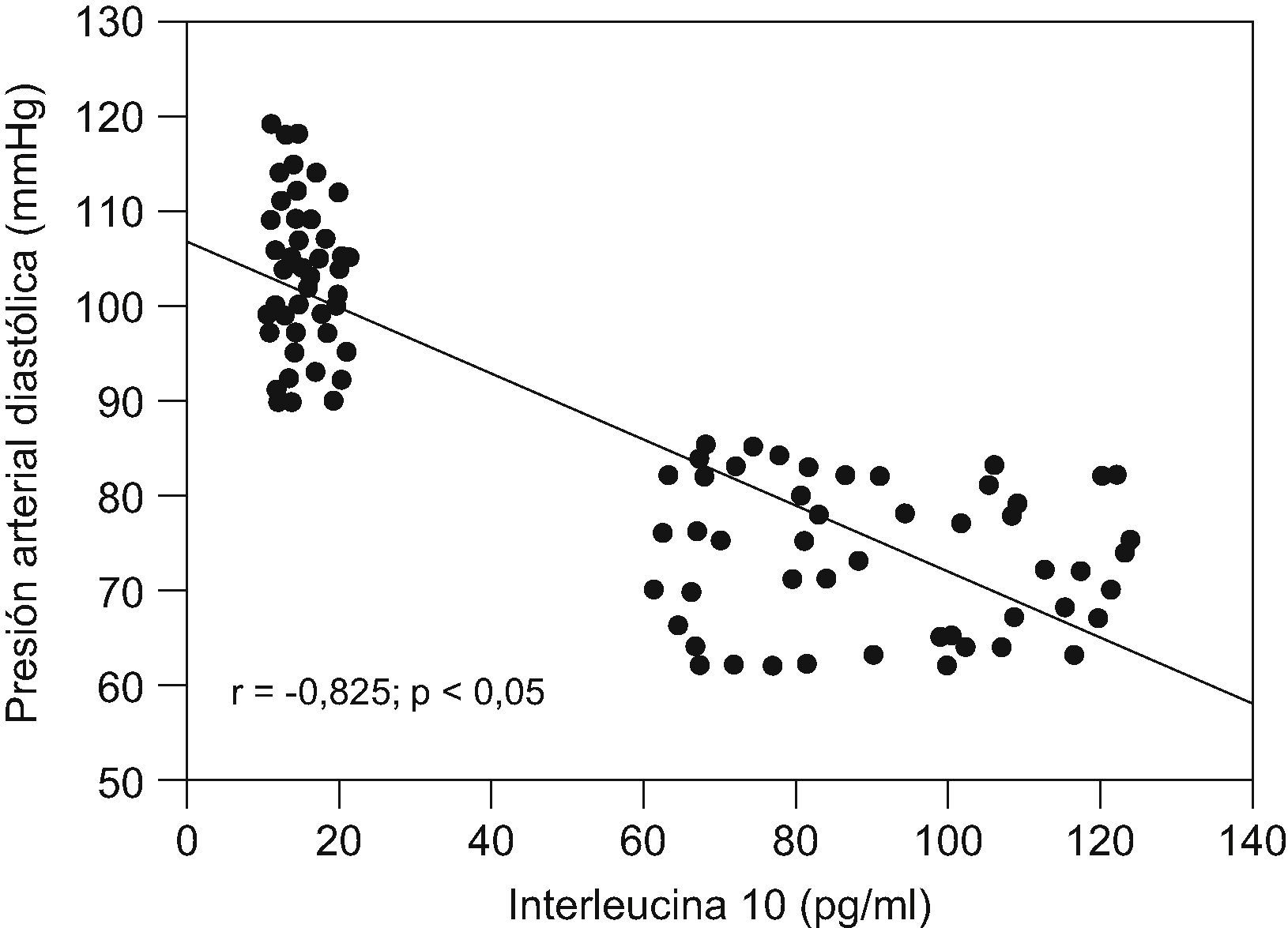
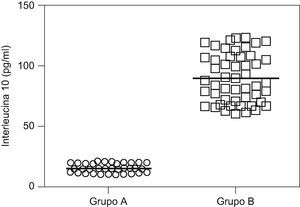
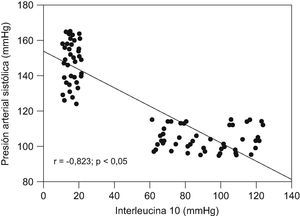
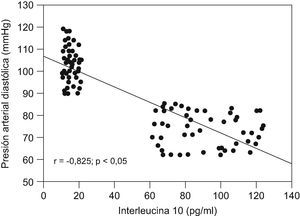
ResultadosNo se encontraron diferencias significativas con relación a la edad materna, edad gestacional e índice de masa corporal en el momento de la toma de la muestra (p=ns). Se observaron diferencias estadísticamente significativas entre los grupos en los valores promedio de presión arterial sistólica y diastólica (p<0,05). Se encontraron diferencias estadísticamente significativas en las concentraciones de IL-10 entre las pacientes del grupo A (15,9±3,1pg/ml) y las pacientes del grupo B (90,6±20,0pg/ml; p<0,05) y se observó una correlación fuerte, negativa y significativa con los valores de presión arterial sistólica (r=−0,823; p<0,05) y diastólica (r=−0,825; p<0,05).
ConclusioneLas preeclámpticas presentaron concentraciones significativamente más bajas de IL-10 al compararlas con embarazadas normotensas sanas.
To compare concentrations of interleukin-10 in patients with preeclampsia and healthy normotensive pregnant women.
Material and methodsOne hundred patients were selected. Fifty preeclamptic patients were selected as cases (group A) and 50 healthy pregnant women with a similar age and body mass index to those in the study group were selected as controls (group B). Blood samples for interleukin-10 determination were collected in all patients before labor and immediately after diagnosis in the study group.
ResultsThere were no significant differences in maternal or gestational age or body mass index at sample collection (p=ns). Significant differences were found between groups in mean values of systolic and diastolic blood pressure (p<0.05). Statistically significant differences were also found in interleukin-10 concentrations in patients in group A (15.9±3.1pg/ml) and patients in group B (90.6±20.0pg/ml p<0.05) and a strong, negative and significant correlation was found with systolic (r=−0.823; p<0.05) and diastolic blood pressure (r=−0.825; p<0.05).
ConclusionInterleukin-10 concentrations of were significantly lower in preeclamptic patients than in healthy normotensive pregnant women.
La preeclampsia es una de las principales causas de morbilidad y mortalidad materna y perinatal. Aunque la patogénesis de la preeclampsia es desconocida y lo más probable es que esta sea multifactorial, es claro que los procesos patológicos en la circulación materna contribuyen a las manifestaciones clínicas de la enfermedad. Las biopsias del lecho placentario han demostrado que la lesión básica es la invasión completa del trofoblasto en las arterias espirales maternas1,2. La proliferación, migración e invasión del trofoblasto extravelloso está regulado por mecanismos autocrinos, paracrinos y yuxtacrinos que involucran una gran cantidad de factores reguladores y de crecimiento en ese microambiente3,4.
El otro aspecto de la investigación en la preeclampsia se enfoca hacia la mala adaptación de las respuestas del sistema inmune. Esta respuesta materna inflamatoria excesiva, quizá dirigida contra los antígenos fetales extraños, resulta en una cadena de eventos que incluyen: escasa invasión trofoblástica, remodelación defectuosa de las arterias espirales, infartos placentarios, liberación de citokinas proinflamatorias y fragmentos placentarios a la circulación materna4. Durante el embarazo normal, el trofoblasto interactúa con la decidua y con las células natural killer uterinas, modificando su repertorio de citokinas y regulando las moléculas de adhesión y las metaloproteinasas de la matriz5.
La interleucina 10 (IL-10) actúa por inhibición de citokinas inflamatorias, algunos factores de crecimiento (como el factor estimulante de colonias de granulocitos y macrófagos), quimocinas producidas por fagocitos mononucleares (como la proteína inhibidora de macrófagos 1 alfa), el interferón gamma y el factor de necrosis tumoral alfa. Se le ha considerado una citokina Th2, aunque se afirma que pueda tener origen Th0, Th1 o Th26. Roth et al7 postulan que la producción de IL-10 por la placenta sirve para proteger al feto de la respuesta celular mediada por Th1. Además, se ha identificado como una citokina importante en el embarazo, ya que puede estar involucrada en la maduración y mantenimiento del cuerpo lúteo y la producción de progesterona8.
A simple vista, los efectos de esta citokina son aparentemente contradictorios. Por un lado, se encuentra la protección ya señalada, pero por el otro, puede afectar al flujo sanguíneo de la unidad fetoplacentaria como consecuencia de la menor producción de óxido nítrico e inhibir el factor estimulante de colonias de granulocitos y macrófagos. Ambos mecanismos podrían contribuir a la restricción del crecimiento intrauterino del feto9. Los estudios realizados hasta la fecha que han investigado los cambios de esta citokina en plasma, células mononucleares en sangre periférica y placenta en preeclámpticas han producido evidencia contradictoria.
El objetivo fue comparar las concentraciones de IL-10 en pacientes con preeclampsia y embarazadas normotensas sanas.
Material y métodoSe seleccionó un total de 100 pacientes. Se incluyeron a 50 pacientes preeclámpticas como los casos grupo A y un grupo control que fue seleccionado por tener una edad y un índice de masa corporal similares al grupo de estudio que consistió en 50 embarazadas sanas (grupo B). Todas las pacientes eran primigestas.
La preeclampsia se definió como la presión arterial sistólica de 140mm de Hg o más, o presión arterial diastólica de 90mm de Hg o más confirmada por 6h o más de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24h o 1–2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación.
Los criterios de exclusión fueron antecedentes de enfermedad hipertensiva preexistentes (antes de las 20 semanas); enfermedad cardiaca o renal; diabetes mellitus; embarazo múltiple y tratamiento con medicamentos que puedan alterar el metabolismo de la IL-10.
Las muestras de sangre se recolectaron de la vena antecubital en todas las pacientes de los grupos de casos antes del parto e inmediatamente después del diagnóstico y se las dejó coagular a temperatura ambiente. Posteriormente, fueron centrifugadas y almacenadas a −80°C. Se utilizó una prueba de inmunoabsorbencia ligada a enzima para la medición cuantitativa de la IL-10 en cada muestra. Todas las mediciones fueron hechas por duplicado y el promedio de las 2 mediciones fue el resultado final. La sensibilidad fue de 1pg/ml. El coeficiente de variación intra e interensayo fue menor del 7%.
Los valores obtenidos se presentaron como promedio±desviación estándar. La prueba t de Student para muestras no relacionadas se utilizó para el análisis de los grupos y comparar las variables continuas. Los coeficientes de correlación entre la IL-10 y la presión arterial sistólica y diastólica se evaluaron usando la prueba de Pearson. Se consideró p<0,05 como estadísticamente significativa.
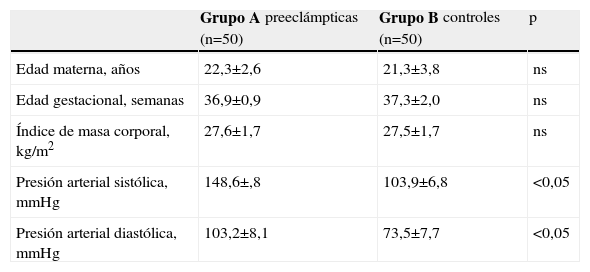
ResultadosLas características generales de los dos grupos de pacientes se muestran en la tabla 1. No se encontraron diferencias significativas con relación a la edad materna, edad gestacional e índice de masa corporal en el momento de la toma de la muestra (p=ns). Se observaron diferencias estadísticamente significativas entre los grupos en los valores promedio de presión arterial sistólica y diastólica (p<0,05).
Características generales
| Grupo A preeclámpticas (n=50) | Grupo B controles (n=50) | p | |
| Edad materna, años | 22,3±2,6 | 21,3±3,8 | ns |
| Edad gestacional, semanas | 36,9±0,9 | 37,3±2,0 | ns |
| Índice de masa corporal, kg/m2 | 27,6±1,7 | 27,5±1,7 | ns |
| Presión arterial sistólica, mmHg | 148,6±,8 | 103,9±6,8 | <0,05 |
| Presión arterial diastólica, mmHg | 103,2±8,1 | 73,5±7,7 | <0,05 |
En la tabla 2 se muestran los valores promedio de IL-10. Las concentraciones fueron significativamente más bajas en el grupo de estudio (15,9±3,1pg/ml) comparado con el grupo de controles (90,6±20,0pg/ml; p<0,05: fig. 1).
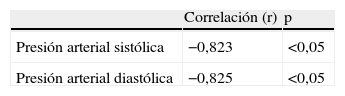
Al realizar la correlación entre las concentraciones de IL-10 y los valores de presión arterial (tabla 3), se observó una correlación fuerte, negativa y significativa con los valores de presión arterial sistólica (r=−0,823; p<0,05; fig. 2) y con los valores de presión arterial diastólica (r=−0,825; p<0,05; fig. 3).
A diferencia de lo reportado por Gratacós et al10, quienes hallaron concentraciones séricas normales de la IL-10, en la presente investigación, las pacientes con preeclampsia presentaron concentraciones significativamente más bajas de IL-10 en comparación con embarazadas normotensas sanas. Los valores anormales son secundarios al aumento de la producción, altas concentraciones y efectos negativos de citokinas proinflamatorias, las hacen más bien posibles generadores de disfunción en la preeclampsia. Contra esos efectos, la IL-10 tiene la capacidad de autorregularse, inhibiendo su propio ARNm6. Aunque se ha comprobado que las células mononucleares en sangre periférica y de la decidua producen menores cantidades de IL-10 en las preeclámpticas comparado con las embarazadas normales11.
Las citokinas inmunoreguladoras, como la IL-10, regulan la inmunoestimulación y la inflamación. La producción por las células natural Killer CD56+ y linfocitos CD56− está aumentada durante el embarazo12. El trofoblasto produce una citokina proinflamatoria (factor de necrosis tumoral alfa) y una citokina inmunoreguladora (IL-10). Hennessy et al13 reportaron una disminución de la IL-10 en el trofoblasto velloso de las preeclámpticas y también reportaron incrementos en la relación IL-2/IL-10 y FNT-alfa/IL-10 en tejidos placentarios de pacientes con el síndrome14. No solo las células inmunocompetentes, sino también el trofoblasto regulan la inmunoestimulación con la producción de IL-10. La inmunoestimulación excesiva por trofoblasto necrótico, condiciones hipóxicas o angiogénesis limitada puede superar el sistema de inmunoregulación produciendo condiciones de inflamación sistémica y disfunción endotelial.
Se ha encontrado por métodos inmunohistoquímicos la presencia de la IL-10 en el área de interfase entre los tejidos maternos y fetales y se expresa en altas concentraciones en los tejidos placentarios15. Las bajas concentraciones de IL-10 en las preeclámpticas de esta investigación puede ser debida al hecho de que la preeclampsia es una manifestación de rechazo16. Además, existe evidencia de incremento de los marcadores inflamatorios, principalmente del factor de necrosis tumoral alfa, en la placenta de las preeclámpticas17 y en la circulación materna18.
Los resultados de esta investigación y otras investigaciones previas demuestran que la disminución de las concentraciones de IL-10 en la circulación materna pueden contribuir de forma significativa a los parámetros de la enfermedad, particularmente a la disfunción endotelial sistémica y difusa, la cual se ha propuesto como el hallazgo fisiopatológico fundamental de la preeclampsia19,20. También existen reportes sobre las concentraciones durante el embarazo, el parto21 y en recién nacidos, pequeños para su edad gestacional22. La IL-10 tiene varias funciones, incluyendo la inhibición de la actividad y la función de los macrófagos, supresión de la inmunidad medida por células in vivo e inhibición de la producción de óxido nítrico15.
Las posibles causas de las diferencias en las concentraciones de IL-10 entre las preeclámpticas y los controles entre los diferentes reportes puede deberse, en parte, a la heterogenicidad de los pacientes estudiados. El síndrome hipertensivo del embarazo se clasifica por la severidad de los hallazgos clínicos y de laboratorio. Esta severidad varía entre los diferentes órganos y sistemas23. Las bajas concentraciones de IL-10 en las preeclámpticas sugiere que existe un estado de respuesta proinflamatoria, aunque esta respuesta no puede ser exclusivamente explicada por la falta de signos de cambio del balance Th1/Th224.
La disminución de las concentraciones de IL-10 en las preeclámpticas puede ser secundaria a la aparición de los efectos significativos que tiene sobre la producción de óxido nítrico y el factor estimulante de colonias 1. Lo primero generaría trastornos circulatorios y lo segundo se asocia a recién nacidos de bajo peso25. Las concentraciones de IL-10 observadas en esta investigación demostrarían un papel importante en la patogénesis de la preeclampsia. La alteración crónica de la producción de óxido nítrico en experimentos con animales produce un síndrome similar a la preeclampsia26,27.
Esta investigación también confirmó lo demostrado previamente por Madazli et al28 con respecto a la correlación existente entre las concentraciones de IL-10 y los valores de presión arterial diastólica, y en esta investigación también la presión arterial sistólica. Sin embargo, en esa investigación se encontraron valores de IL-10 más altos en las preeclámpticas que en los controles por lo que la correlación fue considerada positiva y significativa. Los resultados de las correlaciones demostrarían que las concentraciones de IL-10 tienen relación directa con la severidad de la preeclampsia.
Se concluye que las pacientes preeclámpticas presentaron concentraciones significativamente más bajas de IL-10 al compararlo con embarazadas normotensas sanas.