Comparar las concentraciones de IL-8 en pacientes con preeclampsia y embarazadas normotensas sanas.
Material y métodosSe seleccionó un total de 100 pacientes. Se incluyeron a 50 pacientes preeclámpticas como los casos (grupo A) y un grupo control que fue seleccionado por tener una edad y un índice de masa corporal similares al grupo de estudio, y consistió en 50 embarazadas sanas (grupo B). Las muestras de sangre para la determinación de IL-8 se recolectaron en todas las pacientes antes del parto e inmediatamente después del diagnóstico en el grupo de casos.
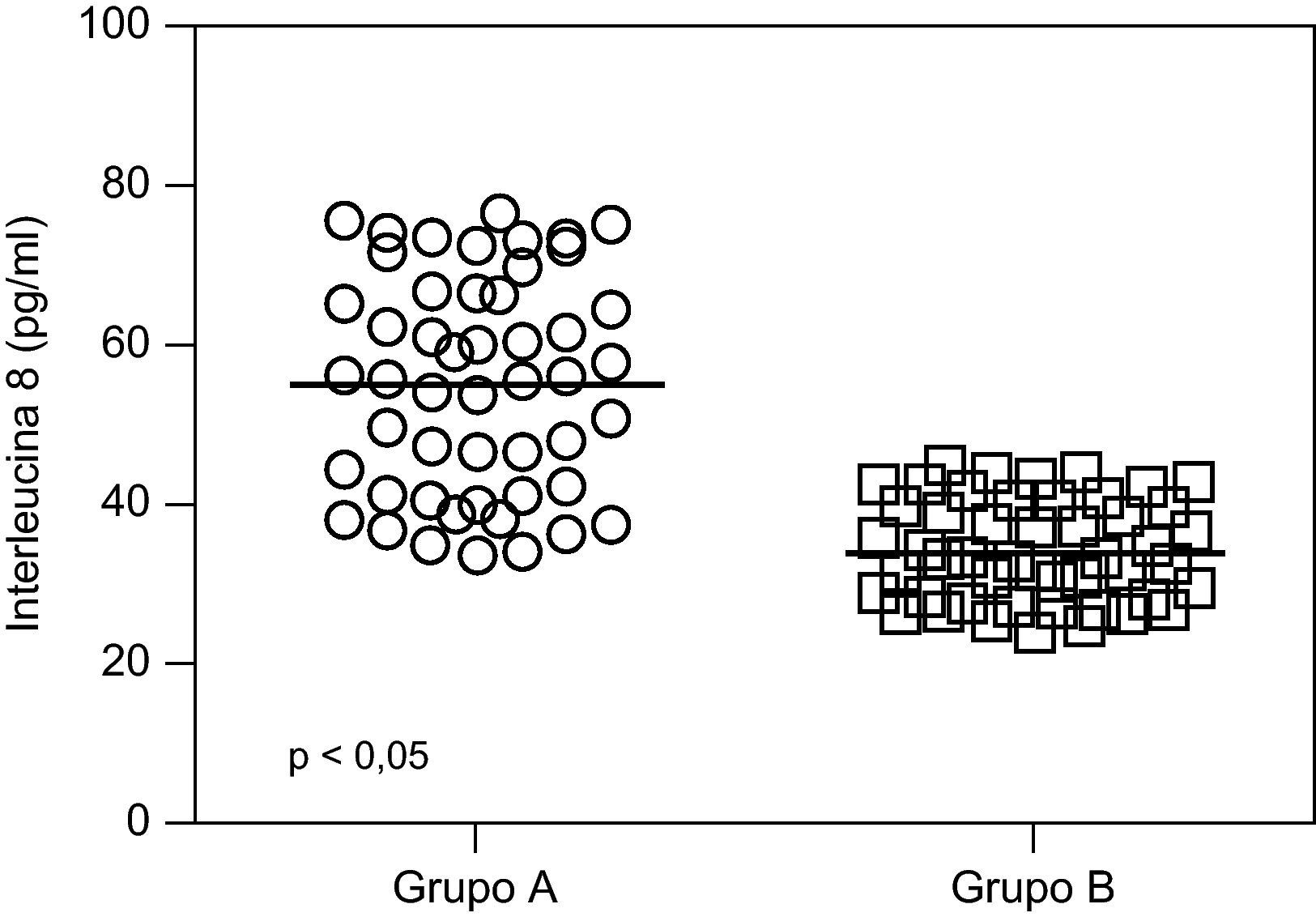
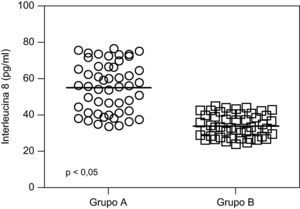
ResultadosNo se encontraron diferencias significativas con relación a la edad materna, edad gestacional e índice de masa corporal al momento de la toma de la muestra (p=ns). Se observaron diferencias estadísticamente significativas entre los grupos en los valores promedio de presión arterial sistólica y diastólica (p<0,05). Las concentraciones de IL-8 fueron significativamente superiores en el grupo A (54,8±13,6pg/ml) comparado con el grupo B (33,6±6,3pg/ml, p<0,05) y se observó una correlación fuerte, positiva y significativa con los valores de presión arterial sistólica (r=0,715; p<0,05) y con los valores de presión arterial diastólica (r=0,640; p<0,05).
ConclusiónLas pacientes preeclámpticas presentaron concentraciones significativamente más altas de concentraciones de IL-8 al compararlo con embarazadas normotensas sanas.
To compare concentrations of interleukin-8 in patients with preeclampsia and healthy normotensive pregnant women.
Material and methodsOne hundred patients were selected. Fifty preeclamptic patients were selected as cases (group A) and 50 healthy pregnant women with a similar age and body mass index to patients in group A were selected as controls (group B). Blood samples for interleukin-8 were collected in all patients before labor and immediately after diagnosis in the study group.
ResultsThere were no significant differences in maternal age, gestational age or body mass index at sample collection (p=ns). Statistically significant differences were found between groups in mean values of systolic and diastolic blood pressure (p<0.05). Interleukin-8 concentrations were significantly higher in group A (54.8±13.6pg/ml) than in group B (33.6±6.3pg/ml, p<0.05) and there was a strong, positive and significant correlation with values of systolic blood pressure (r=0.715; p<0.05) and diastolic blood pressure (r=0.640; p<0.05).
ConclusionInterleukin-8 concentrations were significantly higher in preeclamptic patients than in healthy normotensive pregnant women.
La preeclampsia es una enfermedad común del embarazo en humanos y es la principal causa de morbimortalidad materna y fetal1. La invasión trofoblástica inadecuada e incompleta y la posterior deficiencia en la remodelación de las arterias espirales está asociada con la preeclampsia. Numerosas teorías de los mecanismos fisiopatológicos han sido propuestas hasta la actualidad pero aún no se conoce una teoría que unifique todas estas alteraciones2.
Diferentes investigaciones han estudiado la capacidad de los monocitos circulantes maternos para producir citokinas proinflamatorias en las preeclámpticas y los informes sobre la alta síntesis intracelular espontanea indican, que los monocitos en la circulación materna representan una fuente de citokinas inflamatorias durante la preeclampsia2,3. La alteración del sistema inmune es el hallazgo central en la respuesta inflamatoria generalizada materna en la preeclampsia3. Las citokinas son los mensajeros parea la regulación de la cascada de inflamación, con el factor de necrosis tumoral, la IL 1β, la IL-6 y la IL-8 trabajando en forma sinergística. Aunque demostraron que ocurre activación de los neutrófilos en diferentes patologías, y en especial la preeclampsia, el mecanismo subyacente de esta activación aún no está claro4. Las citokinas pueden disparar la activación de los neutrófilos, expresión del factor de von Willebrand y la adhesión celular al endotelio lo cual lleva a la lesión endotelial.
La IL-8 es el miembro mejor caracterizado del grupo de las quimocinas, o citokinas quimiotácticas. Se le describió inicialmente como péptido activador de neutrófilos 15. Se produce principalmente en los macrófagos, neutrófilos, células natural killer y los tejidos de la interfase materno fetal. A diferencia de otras citokinas, de producción y acción rápida, la expresión del ARN mensajero de la IL-8 en los monocitos de los tejidos inflamados, persiste hasta por 24h. Su principal efecto parece ser mantener un flujo continuo de neutrófilos hacia el tejido, tiende a mantener la respuesta inflamatoria y contribuye a la producción de prostaglandinas como un mediador secundario6,7.
Existen informes conflictivos sobre las concentraciones de IL-8 en la preeclampsia. Koçyigit et al8 reportaron incrementos en las concentraciones de IL-6, pero concentraciones normales de IL-8 en la preeclampsia, mientras que Olusi et al9 encontraron concentraciones significativamente mas baja de esta sustancia en las preeclámpticas que en las embarazadas normales.
El objetivo de la investigación fue comparar las concentraciones de IL-8 en pacientes con preeclampsia y embarazadas normotensas sanas.
Material y métodosSe seleccionó un total de 100 pacientes. Se incluyeron 50 pacientes preeclámpticas como los casos (grupo A) y un grupo control seleccionado por tener edad e índice de masa corporal similares al grupo de estudio que consistió en 50 embarazadas normotensas sanas (grupo B). Todas las pacientes eran primigestas. El comité de ética del hospital aprobó el estudio.
La preeclampsia se definió como la presión arterial sistólica de 140mm de Hg o más, o presión arterial diastólica de 90mm de Hg o más, confirmada por 6h o más de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24h, o 1–2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación.
Los criterios de exclusión fueron antecedentes de enfermedad hipertensiva preexistente (antes de las 20 semanas), enfermedad cardiaca o renal, diabetes mellitus, habito tabáquico, embarazo múltiple y tratamiento con medicamentos que puedan alterar el metabolismo de la IL-8.
Las muestras de sangre (10ml) se recolectaron en todas las pacientes antes del parto e inmediatamente después del diagnóstico en el grupo de casos de la vena antecubital y se las dejo coagular a temperatura ambiente. Posteriormente fueron centrifugadas a 4.500g por 10min a los 30min de tomada la muestra y almacenadas posteriormente a −80°C. Se utilizó una prueba de inmunoabsorbencia ligada a enzima para la medición cuantitativa de la IL-8 en cada muestra. Todas las mediciones fueron hechas por duplicado y el promedio de las 2 mediciones fue el resultado final. La sensibilidad fue de 4pg/ml. El coeficiente de variación intra e interensayo fue menor del 9%.
Los valores obtenidos se presentaron como promedio±desviación estándar. La prueba t de Student para muestras no relacionadas se utilizó para el análisis de los grupos y comparar las variables continuas. Los coeficientes de correlación entre la IL-8 y la presión arterial sistólica y diastólica se evaluaron usando la prueba de Pearson. La precisión de la IL-8 para el diagnóstico de preeclampsia se presenta en función de sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo y precisión. Se utilizó el análisis receptor-operador para determinar el mejor valor de corte. Se consideró p<0,05 como estadísticamente significativa.
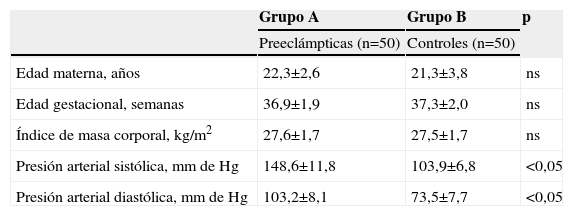
ResultadosLas características generales de los dos grupos de pacientes se muestran en la tabla 1. No se encontraron diferencias significativas con relación a la edad materna, edad gestacional e índice de masa corporal al momento de la toma de la muestra (p=ns). Se observaron diferencias estadísticamente significativas entre los grupos en los valores promedio de presión arterial sistólica y diastólica (p<0,05).
Características generales
| Grupo A | Grupo B | p | |
| Preeclámpticas (n=50) | Controles (n=50) | ||
| Edad materna, años | 22,3±2,6 | 21,3±3,8 | ns |
| Edad gestacional, semanas | 36,9±1,9 | 37,3±2,0 | ns |
| Índice de masa corporal, kg/m2 | 27,6±1,7 | 27,5±1,7 | ns |
| Presión arterial sistólica, mm de Hg | 148,6±11,8 | 103,9±6,8 | <0,05 |
| Presión arterial diastólica, mm de Hg | 103,2±8,1 | 73,5±7,7 | <0,05 |
En la tabla 2 se muestran los valores promedio de IL-8. Se encontraron diferencias estadísticamente significativa entre las pacientes en el grupo de estudio (54,8±13,6pg/ml) y las pacientes del grupo control (33,6±6,3pg/ml; p<0,05) (fig. 1).
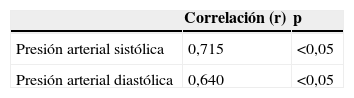
Al realizar la correlación entre las concentraciones de IL-8 y los valores de presión arterial (tabla 3), se observó una correlación débil, positiva y significativa con los valores de presión arterial sistólica (r=0,715; p<0,05) y con los valores de presión arterial diastólica (r=0,640; p<0,05).
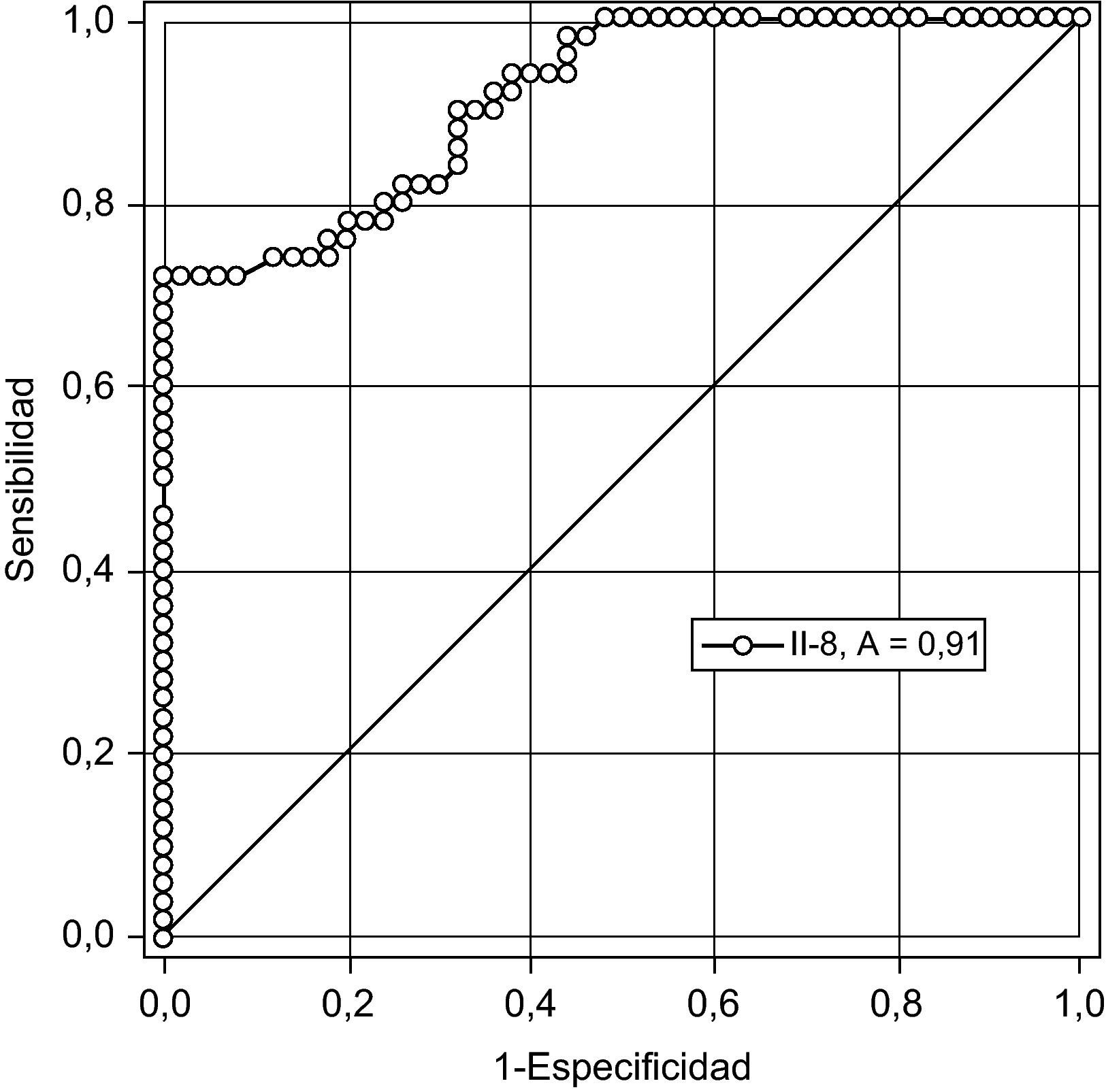
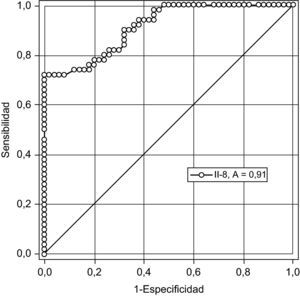
En la figura 2 se muestra la curva receptor operador para la precisión de la IL-8 para el diagnóstico de preeclampsia. Un valor de corte de 41,5pg/ml tienen una sensibilidad 76,3%, especificidad 77,1%, valor predictivo positivo 84,0% y valor predictivo negativo 67,5% con una exactitud diagnóstica de 76,6%.
DiscusiónEn el presente estudio, las pacientes con preeclampsia presentaron concentraciones significativamente mas altas de IL-8 en comparación con embarazadas normotensas sanas. La presencia de altas concentraciones de IL-8 en las preeclámpticas sugiere una afección sistémica o por lo menos sugiere una patogénesis inmune de la enfermedad.
El tejido placentario produce una variedad de citokinas y hormonas que son esenciales para la regulación de la unidad feto-materna mediante la regulación de los sistemas inmunes, reproductivos y endocrinos. La red de citokinas sintetizadas localmente no solo controla la respuesta inmune materna contra el tejido alogénico, sino que también promueve el desarrollo placentario regulando la angiogénesis y la remodelación, crecimiento y diferenciación de las células vasculares7. Estos hallazgos también pueden ser observados en otras complicaciones obstétricas como aborto espontáneo recurrente, restricción del crecimiento fetal, desprendimiento prematuro de placenta y muerte fetal. Aparentemente, entidades clínicas dispares, pueden tener una etiología común en la respuesta inmune, que incluye inflamación subclínica local del lecho placentario y sistémica (en la preeclampsia) en la circulación materna10.
La IL-8 es una quimiocina inflamatoria que se produce localmente en respuesta a la lesión tisular, llevando principalmente a la selección y activación de los neutrófilos11. Igualmente, se ha observado la presencia de esta citokina y sus receptores, CXCR1 y CXCR2, en las células endoteliales12, demostrando que juega un papel importante en la proliferación celular13,14. Concentraciones elevadas de IL-8 han sido reportadas en varias enfermedades inflamatorias sistémicas. El hallazgo de la presente investigación de concentraciones diferentes de IL-8 entre embarazadas normales y preeclámpticas son similares a lo reportado por investigaciones previas15–17, lo cual refuerza el papel de la IL-8 en la respuesta inflamatoria a la preeclampsia.
En la preeclampsia, aumentan las células Th1, disminuyen las células Th2, y ambos grupos celulares están activados. En estudios in vitro, cuando se acumulan ambos grupos celulares la elevación de las citokinas tipo Th1 superan a las Th2 debido a las diferencias en el número de células activas18. El hallazgo de esta investigación sugiere que la IL-8 domina en la respuesta inflamatoria en la preeclampsia, aunque esa respuesta no puede ser explicada exclusivamente por las modificaciones en el balance Th1/Th2.
Se ha reportado que en la preeclampsia existe una importante activación de los neutrófilos circulantes19. Esta activación está ligada a diferentes tipos de daño vascular. Se ha descrito que los gránulos de estos leucocitos liberan una serie de sustancias o mediadores como la elastasa, una proteasa capaz de ocasionar destrucción de las células endoteliales20. El número de neutrófilos deciduales y la cantidad de elastasa aumentan en la preeclampsia con respecto a embarazos no complicados, aunque en la placenta y decidua normales hay cierto grado de acumulación de neutrófilos y de activación celular5. La cantidad de elastasa decidual se correlaciona positivamente con los niveles sanguíneos de uratos, un reconocido indicador de severidad en la enfermedad21. Esto habla de la importancia de la activación de los neutrófilos en la fisiopatología de la preeclampsia, un proceso ligado, según algunos investigadores, a la secreción de ciertas citokinas, entre ella la IL-87.
Kauma et al22 encontraron elevadas concentraciones de IL-8 y la proteína 1 de quimioatracción de monocitos en preeclámpticas comparado con embarazadas normales. Aunque las células endoteliales vasculares activadas son probablemente responsables de esta elevación, otras potenciales fuentes de esta citokina durante el embarazo son la placenta, la decidua materna y los leucocitos circulantes23. Uno de los mecanismos potenciales por el cual se observa en la producción de IL-8 es a través de la peroxidación lipídica sobre el factor B de transcripción nuclear24. También es posible que otros factores no identificados presente en el plasma de las preeclámpticas produzca incremento de la peroxidación lipídica y pueda estimular la producción de IL-8 por las células endoteliales vasculares.
Se concluye que las preeclámpticas presentaron concentraciones significativamente mas altas de IL-8 al compararlo con embarazadas normotensas sanas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.