En la posmenopausia se presentan alteraciones en el metabolismo de los lípidos, sensibilidad a la insulina e incremento del tejido adiposo visceral, lo que se asocia a un aumento del riesgo cardiometabólico. La osteocalcina (OCN) es una proteína de remodelación ósea, que recientemente se ha observado que participa en la regulación del metabolismo de la glucosa, lípidos y del tejido adiposo. Son limitados los estudios de OCN en la etapa posmenopáusica. El objetivo de este trabajo fue investigar la relación de la concentración de OCN con la obesidad y el síndrome metabólico (SM) en mujeres pre y posmenopáusicas.
MétodosEstudio transversal que incluyó a 261 participantes de 45 a 60 años, quienes fueron evaluadas clínicamente y se les midió glucosa y perfil de lípidos. La OCN sérica y la insulina se determinaron por quimioluminiscencia.
ResultadosDe las participantes, 128 fueron premenopáusicas y 133 posmenopáusicas; el 33% de las participantes presentaban SM. En las mujeres posmenopáusicas, la concentración de OCN fue superior en comparación a las premenopáusicas (7,2±4,0 vs. 5,5±6,4 ng/mL, p<0,019). La concentración de OCN en la mujer posmenopáusica con SM fue más elevada en comparación al grupo control (8,4±5,1 vs. 6,3±2,8 ng/mL, p=0,003).
ConclusiónEn la posmenopausia, el déficit de estrógenos y la resistencia a la insulina se asocian a un incremento de la concentración de OCN.
Changes in lipid metabolism, insulin sensitivity, and visceral adipose tissue increase cardio-metabolic risk. Recent evidence suggests that osteocalcin (OCN) may play a role in metabolism. However, little is known about the OCN in post-menopausal women. The aim of this study was to investigate the relationship between the concentration of OCN with obesity and metabolic syndrome (MS) in pre-and post-menopausal women.
MethodsA cross-sectional study was conducted that included 261 participants who were reviewed clinically and underwent laboratory studies, including the determination of serum OCN and insulin by chemiluminescence.
ResultsOf the participants, 128 were pre-menopausal, 133 post-menopausal, and 33% had MS. OCN concentration was higher in post-menopausal women than in pre-menopausal (7.7±5.7 vs. 5.3 + 2.6 ng/mL, P<.001). OCN levels in post-menopausal women with MS were greater than those without MS (8.4±5.1 vs 6.3±2.8 ng/mL, P.003).
ConclusionOestrogen deficiency and insulin resistance are associated with increased OCN during the stage of post-menopausal stage.
Durante la menopausia se presentan cambios hormonales que incluyen la disminución en los niveles de los esteroides sexuales; estos tienen efectos sobre la grasa corporal, la grasa visceral y la resistencia a la insulina1,2. Esta etapa se relaciona con un aumento en la frecuencia de síndrome metabólico (SM) y un incremento del riesgo cardiovascular3.
Cada vez existen más datos de la interacción entre el metabolismo y el tejido óseo; esta interacción puede ser mediada por múltiples citocinas y hormonas. La OCN producida por el osteoblasto se ha utilizado como marcador de remodelación ósea; no obstante, recientemente se ha demostrado que afecta a la sensibilidad a la insulina y mejora la tolerancia a la glucosa en modelos murinos y algunos estudios clínicos4,5. También que se ha propuesto que la OCN es un marcador de riesgo cardiometabólico, ya que en diversos estudios se ha informado su relación con las concentraciones de glucosa, la resistencia a la insulina, la obesidad y otros factores de riesgo cardiovascular6,7. Las concentración de OCN es más elevada en las mujeres comparada con los hombres y también se observan variaciones en relación con la edad. En la etapa posmenopáusica existe poca informacion de la relación entre el nivel de OCN y SM; no es concluyente.
El objetivo de este trabajo fue investigar la relación de la concentración de OCN con el SM y la obesidad en población pre y posmenopáusica.
Material y métodosSe realizó un estudio transversal y comparativo en 261 mujeres con rango de edad de 45 a 60 años, que acudieron consecutivamente a la Unidad de Investigación Médica de Enfermedades Endocrinas del Hospital de Especialidades del Centro Médico Nacional Siglo XXI, IMSS. Se establecieron 2 grupos de estudio, mujeres pre y posmenopáusicas. El diagnóstico de SM se estableció de acuerdo con las definiciones para la práctica clínica de la Federación Internacional de Diabetes del Consenso del 20068. Estas son: obesidad central (definida por una circunferencia de la cintura≥80cm) y al menos 2 de los siguientes componentes: triglicéridos≥150mg/dL, glucosa≥100mg/dL, el colesterol-HDL<50mg/dL y presión sistólica≥130 y/o presión diastólica≥85mmHg, o seguir algún tratamiento para una hipertensión previamente diagnosticada. El estado posmenopáusico se determinó mediante los niveles de estradiol ≤ 30 pg/mL, FSH ≥ 30UI/mL y el antecedente de al menos un año de amenorrea.
Las mujeres con diagnóstico conocido de diabetes mellitus, insuficiencia renal o hepática, infecciones crónicas, endocrinopatías, enfermedades hematológicas, historia previa de enfermedad cardiovascular y trombosis fueron excluidas del estudio. También se excluyó a participantes que se encontraban en tratamiento con terapia hormonal, con anticoagulantes, esteroides y fármacos que afectaran al metabolismo óseo. El protocolo fue aprobado por el Comité de Investigación y Ética del Hospital de Especialidades del Instituto Mexicano del Seguro Social. Las participantes fueron informadas y firmaron la correspondiente carta de consentimiento.
Evaluación clínica. Se realizó una historia clínica completa y se tomaron sus medidas antropométricas. La altura y el peso corporal de las participantes se midieron con ropa ligera y sin zapatos en la báscula Mod. DGN 5282 Bame®. El índice de masa corporal (IMC) se calculó mediante la fórmula (IMC=peso/talla2). Se midió la circunferencia de la cintura y la cadera. La presión arterial sistólica y diastólica fue medida con un baumanómetro aneroide, en el brazo derecho de cada participante, sentada, después de 10 min de reposo.
Análisis bioquímico. De las participantes, se obtuvieron muestras de sangre venosa antecubital (10mL) a las 8:00 a.m., posterior a un reposo de 15 min. El suero se separó cuidadosamente centrifugando por 30 min en una centrifuga refrigerada de mesa a 2.500-3.000 r.p.m. a 4°C y se prepararon alícuotas en microtubos que se mantuvieron en congelación a –70°C hasta la realización de los ensayos.
Las determinaciones séricas de glucosa, colesterol-HDL, triglicéridos y colesterol total fueron medidas por el Analizador de Química semiautomático (Ekem control Lab, Mindray, China). La insulina se midió por radioinmunoanálisis en fase sólida (Millipore, Billerica. MS, EE. UU.); la sensibilidad de este ensayo fue de 2μU/mL y el coeficiente de variación (CV) intra e interensayo fue del 4,0 y el 8,6%, respectivamente. El índice de resistencia a la insulina se evaluó mediante homeostasis model assessment (HOMA) de acuerdo con la fórmula de Mathews et al.9: HOMA-IR=insulina (μU/mL)× glucosa (mmol/L)/22,5.
La OCN y el estradiol se cuantificaron en suero mediante un procedimiento inmunométrico de detección por quimioluminiscencia en un analizador IMMULITE 1, utilizando estuches comerciales Diagnostic Products Corporation (Los Ángeles, CA, EE. UU.) y de acuerdo con protocolos técnicos específicos. Para la OCN, la sensibilidad fue 0,5 ng/mL y el análisis de control de calidad mostró CV intra e interensayo<5%. Para el estradiol la sensibilidad del ensayo fue de 15 pg/mL y el CV intra e interensayo del 8,6 y el 6,4%, respectivamente.
Análisis estadístico. Las variables continuas distribuidas normalmente se expresaron como media±desviación estándar (DE). Las diferencias en las variables entre los grupos con SM y sin SM fueron evaluados por la prueba t de Student para muestras independientes. La correlación de OCN con los parámetros metabólicos fue analizada empleando el método de Pearson. Las diferencias se consideraron estadísticamente significativas con valores de p<0,05. El análisis estadístico se realizó mediante SPSS 20 (Statistical Package Social del Programa de Ciencias de la Computación de LEAD Technologies, Inc., Chicago, IL, EE. UU.).
ResultadosSe evaluó a 340 participantes, de las cuales se incluyó en el estudio a 261 que cumplieron con los criterios de selección. La edad promedio ± DE de las participantes fue de 50±7,2 años. De las participantes, 128 presentaban ciclos menstruales regulares (premenopáusicas) y 133 fueron mujeres posmenopáusicas.
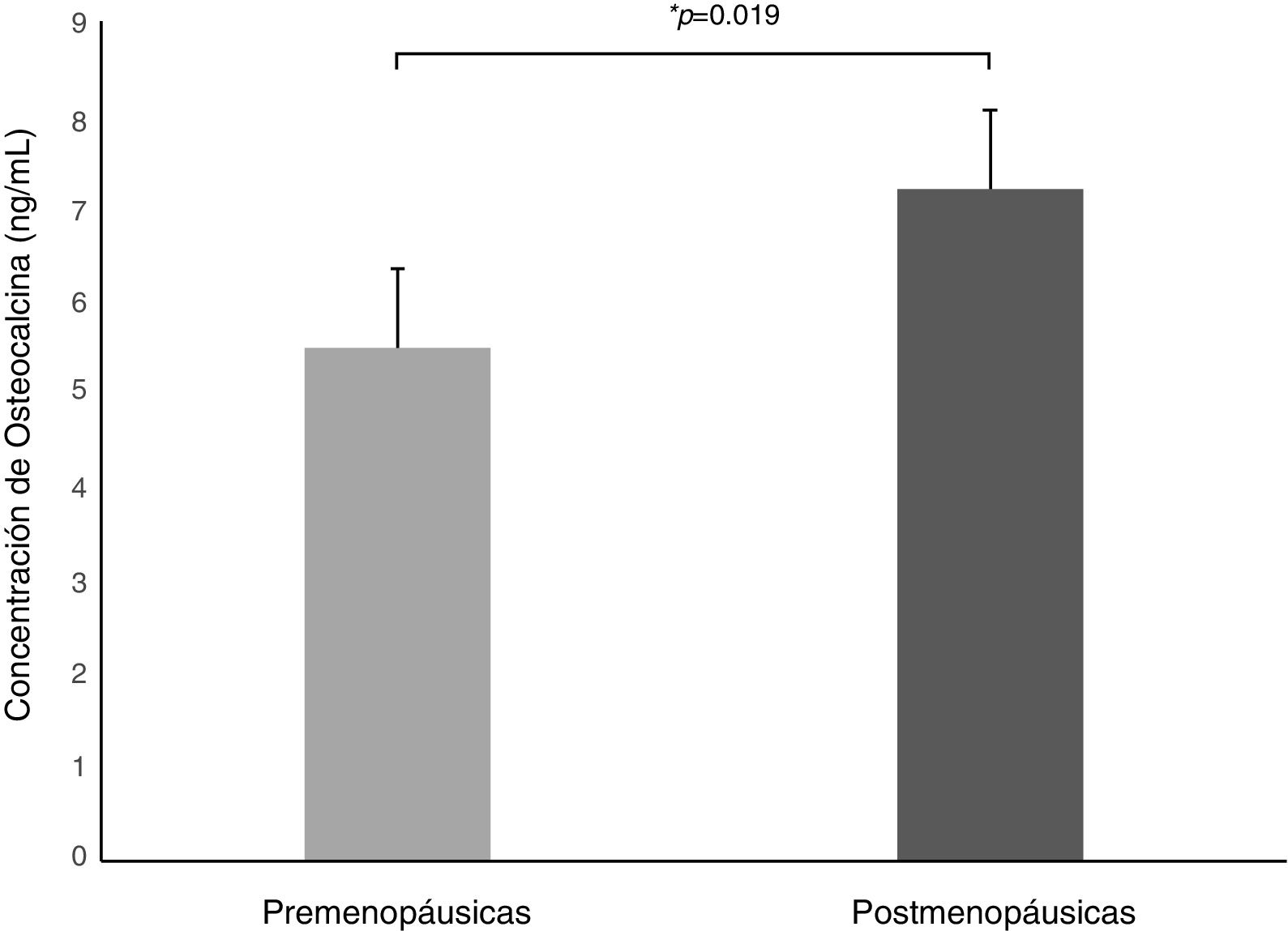
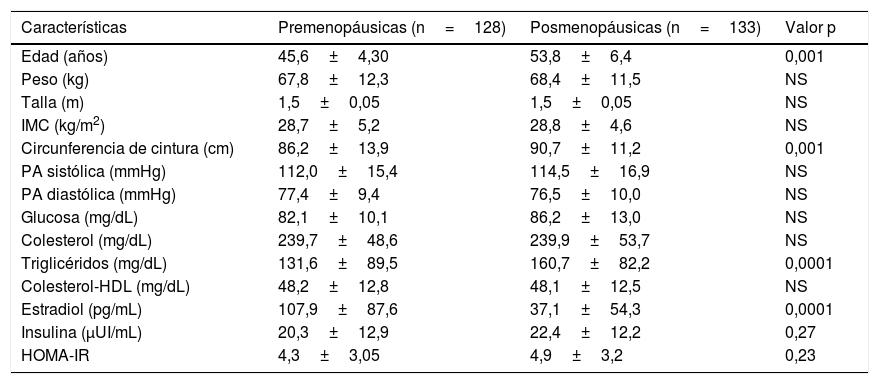
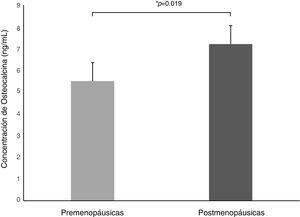
Análisis por estado hormonalEl peso y el IMC fueron similares en ambos grupos; solo se encontró aumento en la circunferencia de cintura y los niveles de triglicéridos en las mujeres posmenopáusicas (tabla 1). La concentración de OCN fue superior en mujeres posmenopáusicas en comparación a las premenopáusicas (7,2±4,0 ng/mL vs. 5,5±6,4 ng/mL, p=0,019) (fig. 1). Se encontró también asociación inversa entre OCN y el nivel de estradiol (r=–0,297, p=0,0003).
Características generales de las participantes en estudio
| Características | Premenopáusicas (n=128) | Posmenopáusicas (n=133) | Valor p |
|---|---|---|---|
| Edad (años) | 45,6±4,30 | 53,8±6,4 | 0,001 |
| Peso (kg) | 67,8±12,3 | 68,4±11,5 | NS |
| Talla (m) | 1,5±0,05 | 1,5±0,05 | NS |
| IMC (kg/m2) | 28,7±5,2 | 28,8±4,6 | NS |
| Circunferencia de cintura (cm) | 86,2±13,9 | 90,7±11,2 | 0,001 |
| PA sistólica (mmHg) | 112,0±15,4 | 114,5±16,9 | NS |
| PA diastólica (mmHg) | 77,4±9,4 | 76,5±10,0 | NS |
| Glucosa (mg/dL) | 82,1±10,1 | 86,2±13,0 | NS |
| Colesterol (mg/dL) | 239,7±48,6 | 239,9±53,7 | NS |
| Triglicéridos (mg/dL) | 131,6±89,5 | 160,7±82,2 | 0,0001 |
| Colesterol-HDL (mg/dL) | 48,2±12,8 | 48,1±12,5 | NS |
| Estradiol (pg/mL) | 107,9±87,6 | 37,1±54,3 | 0,0001 |
| Insulina (μUI/mL) | 20,3±12,9 | 22,4±12,2 | 0,27 |
| HOMA-IR | 4,3±3,05 | 4,9±3,2 | 0,23 |
IMC: índice de masa corporal; PA: presión arterial.
Los datos se expresan en media ± DS; NS: no significativo.
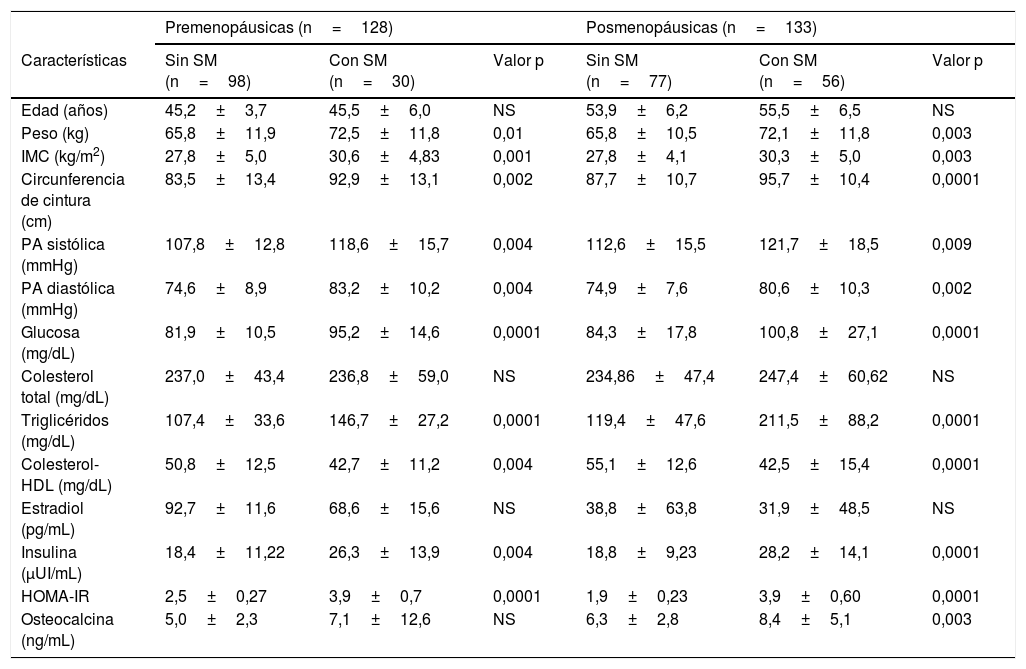
Del total de participantes, 33% tenía diagnóstico de SM. Las participantes con SM comparadas con el grupo sin síndrome presentaban incremento de peso, perímetro de cintura, IMC, presión arterial, glucosa, triglicéridos, resistencia a la insulina y disminución del colesterol-HDL. La concentración de OCN fue superior en las mujeres posmenopáusicas con SM (8,4±5,1 vs. 6,3±2,8 ng/mL, p=0,003) y no se observaron diferencias significativas en el grupo de mujeres premenopáusicas (tabla 2). En las mujeres premenopáusicas la OCN se correlacionó con la circunferencia de cintura (r=–0.172, p=0,03) y en las participantes posmenopáusicas con la glucosa (r=–0,528, p<0,05). Para explorar la relación entre el nivel de OCN y el estado metabólico se realizó un modelo de regresión multivariado. La variable dependiente fue la concentración de OCN y se incluyeron como variables independientes la edad, el IMC, la glucosa, los triglicéridos, el HOMA-IR y el estado hormonal, pre o posmenopáusico. El estado hormonal (coeficiente β = 0,211) y la resistencia a la insulina (β = 0,199) fueron predictores independientes de la concentración de OCN.
Características de las participantes de acuerdo con el estado hormonal y metabólico
| Premenopáusicas (n=128) | Posmenopáusicas (n=133) | |||||
|---|---|---|---|---|---|---|
| Características | Sin SM (n=98) | Con SM (n=30) | Valor p | Sin SM (n=77) | Con SM (n=56) | Valor p |
| Edad (años) | 45,2±3,7 | 45,5±6,0 | NS | 53,9±6,2 | 55,5±6,5 | NS |
| Peso (kg) | 65,8±11,9 | 72,5±11,8 | 0,01 | 65,8±10,5 | 72,1±11,8 | 0,003 |
| IMC (kg/m2) | 27,8±5,0 | 30,6±4,83 | 0,001 | 27,8±4,1 | 30,3±5,0 | 0,003 |
| Circunferencia de cintura (cm) | 83,5±13,4 | 92,9±13,1 | 0,002 | 87,7±10,7 | 95,7±10,4 | 0,0001 |
| PA sistólica (mmHg) | 107,8±12,8 | 118,6±15,7 | 0,004 | 112,6±15,5 | 121,7±18,5 | 0,009 |
| PA diastólica (mmHg) | 74,6±8,9 | 83,2±10,2 | 0,004 | 74,9±7,6 | 80,6±10,3 | 0,002 |
| Glucosa (mg/dL) | 81,9±10,5 | 95,2±14,6 | 0,0001 | 84,3±17,8 | 100,8±27,1 | 0,0001 |
| Colesterol total (mg/dL) | 237,0±43,4 | 236,8±59,0 | NS | 234,86±47,4 | 247,4±60,62 | NS |
| Triglicéridos (mg/dL) | 107,4±33,6 | 146,7±27,2 | 0,0001 | 119,4±47,6 | 211,5±88,2 | 0,0001 |
| Colesterol-HDL (mg/dL) | 50,8±12,5 | 42,7±11,2 | 0,004 | 55,1±12,6 | 42,5±15,4 | 0,0001 |
| Estradiol (pg/mL) | 92,7±11,6 | 68,6±15,6 | NS | 38,8±63,8 | 31,9±48,5 | NS |
| Insulina (μUI/mL) | 18,4±11,22 | 26,3±13,9 | 0,004 | 18,8±9,23 | 28,2±14,1 | 0,0001 |
| HOMA-IR | 2,5±0,27 | 3,9±0,7 | 0,0001 | 1,9±0,23 | 3,9±0,60 | 0,0001 |
| Osteocalcina (ng/mL) | 5,0±2,3 | 7,1±12,6 | NS | 6,3±2,8 | 8,4±5,1 | 0,003 |
IMC: índice de masa corporal; PA: presión arterial.
Los datos se expresan en media ± DS; NS: no significativo.
En este estudio se analizó la concentración de OCN considerando en conjunto tanto las variables metabólicas como el estado hormonal pre y posmenopáusico. En el presente trabajo se encontró una elevación en la concentración de OCN en mujeres posmenopáusicas en comparación con las premenopáusicas. El déficit de estrógenos durante la menopausia contribuye a cambios en la distribución de la grasa corporal, incremento de la grasa abdominal y alteraciones metabólicas3. Este déficit origina también un desequilibrio entre la formación y resorción ósea10,11. Los estrógenos en condiciones fisiológicas y vía su receptor α estimulan la proliferación y la diferenciación del osteoblasto12,13 y pueden afectar a la apoptosis de osteocitos y osteoclastos14-18.
Otra observación de este estudio fue el incremento del nivel de OCN en las mujeres con SM en etapa posmenopáusica. En trabajos previos, se había encontrado una menor concentración de OCN en mujeres premenopáusicas con SM19,20. En otros trabajos en mujeres posmenopáusicas se había observado una asociación inversa entre el nivel de OCN y la glucosa, la resistencia a la insulina y el SM6,21,22. En esos estudios las participantes mostraban un IMC inferior al de la población del presente estudio. Es probable que en una población con un mayor IMC se presente un comportamiento diferente.
Las mujeres del presente trabajo, en contraste a los estudios previos, mostraban un mayor IMC, elevación de insulina y un incremento en su resistencia, medida por HOMA-IR. La insulina es una molécula clave en la regulación y metabolismo óseo, aumenta la formación y resorción, y en este proceso se libera OCN descarboxilada23. Esta, a su vez, aumenta la expresión de genes relacionados con la insulina y las proteínas que inducen proliferación de células β-pancreáticas24. Por lo anterior, se ha descrito la existencia de un circuito endocrino entre hueso-páncreas, a través del cual la insulina induce la diferenciación del osteoblasto y estimula la producción de OCN descarboxilada; esta, a su vez, regula la sensibilidad a la insulina y su secreción pancreática25.
Los resultados del presente trabajo coinciden con uno previo en el que se observó que las concentraciones de OCN eran más elevadas en personas con SM26. Al respecto se ha propuesto que la elevación de OCN puede ser un mecanismo compensatorio secundario a la elevación de insulina27.
Una de las limitaciones de este estudio es que se determinó la OCN total y no obstante que con esta medición se encontraron asociaciones importantes, la medición de su fracción no carboxilada habría permitido probablemente establecer otras consideraciones en relación con el metabolismo de la glucosa. Sin embargo, no es claro aún si la fracción descarboxilada de la OCN tiene alguna relevancia en el metabolismo de la glucosa en el humano, como se ha observado en los modelos murinos28. Los resultados de los modelos animales no necesariamente pueden extrapolarse al humano, ya que existen diferencias especie-específicas, por ejemplo, en muchas especies se encuentra que la OCN está completamente carboxilada, mientras que en los humanos se presenta una fracción descarboxilada en el suero29.
Sobre la base de los resultados de este trabajo, como explicación a la elevación del nivel de OCN en las mujeres con SM, proponemos que el hipoestrogenismo, aunado a la disminución de la sensibilidad a la insulina que se observa en la etapa posmenopáusica, favorece la resistencia a la insulina, que a su vez impide la disminución de OCN. Esta propuesta también es apoyada por estudios recientes que demostraron en modelos animales, que el hueso contribuye activamente en la sensibilidad a la insulina, por un mecanismo celular diferente al que se presenta en otros tejidos insulinodependientes como el hepatocito30. El incremento en la concentración de ácidos grasos libres en estados de resistencia a la insulina induce además la degradación del receptor de insulina en los osteoblastos, provocando el aumento en la concentración de OCN31-33.
Se requieren más estudios que evalúen variables como etnicidad, clima, dieta, ingesta de calcio y vitamina K, por ser factores que pueden modificar la concentración de OCN.
ConclusiónEl tejido óseo tiene interconexión con el metabolismo; una de las vías es la OCN. En la mujer posmenopáusica el déficit de estrógeno se asoció a una elevación de OCN. Adicionalmente, en esta etapa se observó un mayor incremento de la OCN en las mujeres con SM, lo que está en relación probablemente con la resistencia a la insulina.
FinanciaciónEl presente estudio se realizó con financiación del Fondo de Investigación en Salud FIS-IMSS-G11-2/1021, del Instituto Mexicano del Seguro Social.
Conflicto de interesesTodos los autores declararan que no tienen ningún conflicto de intereses.