Los ésteres del ácido ftálico conocidos comúnmente como ftalatos son contaminantes ubicuos existentes en alimentos, aire, suelo, sedimentos, productos de belleza y materiales de construcción a los que las mujeres embarazadas se encuentran expuestas.
Exposiciones previas de ftalatos durante la fecundación pueden producir mayor riesgo de efectos adversos por contacto de la madre con estos. Muchas sustancias químicas pueden atravesar la placenta y llegar al embrión en el periodo de mayor diferenciación, pueden acumularse en los tejidos corporales y liberarse al torrente sanguíneo, para de esta manera producir un daño en el proceso de gestación. El objeto del presente estudio fue identificar la asociación de la presencia de metabolitos de ftalatos con efectos adversos en el embarazo.
El promedio del grupo de edad fue de 21,3±4,4 años, los recién nacidos tuvieron un peso de 2.927±490g, la presencia del metabolito monobenzil ftalato predominó en el 53,13% de las muestras, las fuentes de exposición a ftalatos son: jabón y crema en 93,7% y desodorante en 90,6%. El dimetil ftalato (DMP) se asoció con anemia con una p<0,01; el DMP se asoció a la disminución de la edad gestacional con p<0,04, el monobutil ftalato (MBP) se asoció a recién nacidos del sexo femenino con p<0,01, la presencia de monobutil ftalato se asocia a la disminución del perímetro cefálico, torácico y abdominal así como al peso de los recién nacidos con diferencias estadísticamente significativas.
Phthalic acid esters, commonly known as phthalates, are ubiquitous pollutants in foods, air, ground, sediments, beauty products and construction materials to which pregnant women are exposed.
Previous phthalate exposure during fertilization can increase the risk of undesired effects through maternal contact with these esters. Many chemical substances can cross the placenta and reach the embryo in the period of greatest differentiation. These substances accumulate in body tissues and are then released into the bloodstream, thus producing harmful effects in the pregnancy. The aim of the present study was to identify the association between the presence of phthalate metabolites and adverse effects in pregnancy.
The mean maternal age was 21.3±4.4 years. The mean birthweight was 2927±490 grams. Monobenzyl phthalate metabolite predominated in 53.13% of the samples. Sources of phthalate exposure were soap and cream in 93.7% and deodorant in 90.6%. Dimethyl phthalate was associated with anemia (P<0.01) and decreased gestational age (P<0.04). Mono butyl phthalate was associated with female sex in the neonate (P<0.01), decreased head, chest and abdominal circumference and lower birthweight, with statistically significant differences.
Entre los agentes plastificantes más usados por la industria se encuentran los ftalatos, que pueden desprenderse con el tiempo y uso y emigrar al medio ambiente, ocurriendo la exposición en humanos1. El ftalato de di-2-etilhexilo (FDEH) es el compuesto más utilizado en Europa y Estados Unidos de América, seguido por el ftalato de di-isononilo (FDIN) y el ftalato de di-isodecilo (FDID)2,3.
Existen numerosos productos que contienen ftalatos que incluyen productos en construcción y acabados del hogar, productos automotores, juguetes, calzado, empaques para alimentos y medicamentos, y diversos materiales médicos desechables, y se agregan, como aditivos y lubricantes, a cosméticos, esmalte de uñas, perfumes, lociones, jabones y detergentes, medicamentos, plaguicidas, repelentes de insectos, antiespumantes, aceite para bombas de vacío y fluidos dieléctricos2,4–7.
Durante la gestación existe el riesgo en el binomio materno-fetal de presentar exposición a diversos contaminantes ambientales, los cuales pueden asociarse al riesgo de desarrollar anomalías congénitas, complicaciones por bajo peso o parto prematuro. Entre estos contaminantes se encuentran los ftalatos8.
Se ha demostrado que el ftalato de di-2-etilhexilo (FDEH) afecta al sistema reproductivo vía disrupción endocrina con una afectación mayor del sistema reproductivo masculino9. El ftalato de di-n-pentilo (FDP) afecta tanto al sistema reproductivo femenino como al masculino, mientras que el ftalato de di-n-propilo (FDPr) es más tóxico para el sistema reproductivo femenino10.
Estudios de laboratorio muestran que la exposición crónica al ftalato de dibutilo provoca aborto11. Los efectos del ftalato de di-2-etilhexilo (FDEH) dependen de la dosis y el tiempo de exposición12. Estos ftalatos provocan disminución en la ganancia de peso corporal, alteración en los niveles de eritrocitos, hemoglobina y hematocrito3,13–15. Se ha observado una asociación entre la exposición a FDEH en mujeres embarazadas y el desarrollo de preeclampsia y anemia16 y una reducción del periodo gestacional17.
Las mujeres pueden tener exposición a ftalatos en productos de consumo diario y de belleza. Durante el embarazo y el parto, la madre y el feto pueden estar expuestos a DEHP a través de equipos médicos. La exposición de los fetos in utero se pone en riesgo debido a que algunos ftalatos, incluidos el DEHP y el DBP, son tóxicos para el desarrollo9.
La exposición ocupacional crónica de mujeres que trabajan en la industria de los ftalatos se ha asociado a disminución de las tasas de embarazo y frecuencia elevada de aborto18. La exposición al di-n-butil ftalato puede afectar la actividad tiroidea en mujeres embarazadas19, aumentando la probabilidad de abortos durante la etapa de la gestación20, reduciendo el tiempo de gestación y favoreciendo la presencia de partos pretérmino.
En la población en general, la exposición se da principalmente a través de la ingestión de residuos de plastificantes en alimentos, agua o por inhalación de aire contaminado con ftalatos21.
En México, existen 16 empresas que producen o utilizan los ftalatos o sus precursores (anhídrido ftálico o ácido ftálico)22.
El objetivo del presente estudio es explorar si existe asociación entre la presencia de metabolitos de ftalatos y la presencia de efectos adversos en el embarazo como: anemia materna, acortamiento del periodo de gestación y alteraciones en la somatometría del recién nacido.
Material y métodoSe realizó un estudio exploratorio prospectivo en 32 mujeres embarazadas, de las que se obtuvo una muestra de orina en el primer trimestre de la gestación para identificar la presencia de los metabolitos de ftalatos. Se continuó la vigilancia de los embarazos para identificar con oportunidad los eventos bajo estudio. Las mujeres elegidas presentaban ciclos menstruales regulares, sin enfermedades de tipo endocrino (diabetes, hipertiroidismo), y terminaron su embarazo en el Hospital de Ginecología y Obstetricia del Instituto Materno Infantil del Estado de México y aceptaron participar mediante firma de carta de consentimiento informado. El estudio fue aprobado por el comité de ética del hospital donde se realizó el estudio. Teniendo en cuenta que los valores de exposición a ftalatos en las embarazadas en otros estudios no han mostrado variación entre los trimestres de la gestación la muestra obtenida de orina fue del primer trimestre23.
Paralelamente se aplicó un instrumento para estudios de exposición ambiental, validado por Borja et al (1999) y adaptado para la exposición a este estudio con un total de 271 preguntas sobre información sociodemográfica, historia reproductiva y médica, posibles fuentes de exposición a ftalatos (como por ejemplo utilización de plásticos, cosméticos y perfumes), antecedentes de tabaquismo y alcohol. Se aplicó además un segundo cuestionario de seguimiento en el que se captó la información sobre el tipo de resolución del embarazo, la presencia de complicaciones, así como la somatometría del recién nacido.
Obtención de las muestrasLas muestras de orina se recogieron directamente en frasco de vidrio ámbar, previamente lavado con acetona y diclorometano. Se ultracongelaron a 20°C hasta su procesamiento. Para confirmar la edad gestacional se tomó en cuenta el primer día de sangrado de la fecha de última menstruación con características habituales y se contó en días a partir de ese momento y hasta la resolución del embarazo.
Procedimientos de laboratorioLa identificación y cuantificación de los metabolitos de ftalatos se realizó en el Laboratorio de Química Instrumental de la Facultad de Química de la Universidad Autónoma del Estado de México, mediante técnica modificada de Albro (1982) y Silva (2004). Las muestras extraídas se inyectaron en un cromatógrafo Varian modelo 6890N con detector de masas 5973 Network, con columna capilar marca Restek fase RTX-5MS de dimensiones 30 m x 0,25 Dl y 0,25μ, y posteriormente se detectó la presencia en orina de los metabolitos siguientes: dimetil ftalato (DMP), monoetil ftalato, monobutil ftalato (MBP), monoetilhexil ftalato, monobenzil ftalato y monooctil ftalato24,25.
Para identificar la cantidad de hemoglobina se realizó el promedio de 2 mediciones, que fueron la primera al inicio del control prenatal y la segunda cuando ingresaban al hospital para resolución de su embarazo. Se registró la fecha de resolución del embarazo así como las mediciones antropométricas y sexo del recién nacido: peso, talla, perímetro cefálico, perímetro torácico y perímetro abdominal.
ResultadosEl promedio de edad de las mujeres en el estudio fue de 21,3±4,4 años. La resolución del embarazo vía parto fue de 59,4%, cesárea 34,4% y legrado uterino instrumentado el 6,2%. La edad gestacional promedio para los embarazos que no terminaron en aborto fue de 37,3±6,4 semanas de gestación, el peso promedio de los recién nacidos fue de 2.927±490g. El 53,33% (16) de los recién nacidos fueron mujeres y el 46,67% (14) hombres. La frecuencia de anemia ocurrió en 19 casos (59,38%).
En lo que corresponde a los factores socioeconómicos de la población estudiada el 31,2% tiene un ingreso semanal de 2,8 a 8,2 salarios mínimos.
Con respecto a los hábitos personales el 50% de las mujeres había fumado alguna vez; sin embargo, al momento del estudio ninguna mujer fumaba. El 68,8% ha consumido alcohol en alguna ocasión y el 3,1%1 consume alcohol en el momento del estudio.
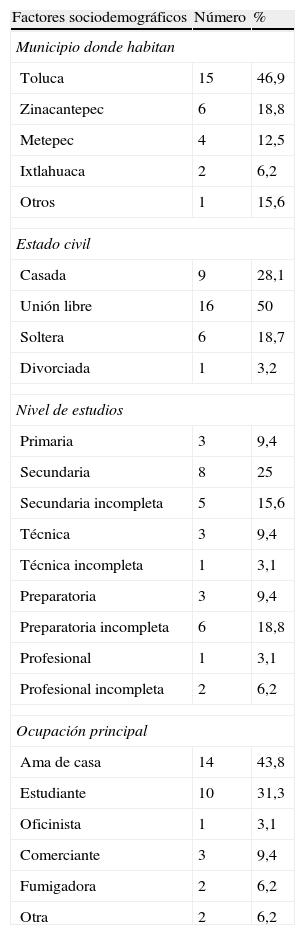
En la tabla 1 se describen los factores sociodemográficos: la mayor proporción de mujeres (46,9%) residen en el Municipio de Toluca, el 25% terminaron la secundaria, el 50% se encuentran en unión libre y el 43,8% son amas de casa.
Factores sociodemográficos de la población en estudio.
| Factores sociodemográficos | Número | % |
| Municipio donde habitan | ||
| Toluca | 15 | 46,9 |
| Zinacantepec | 6 | 18,8 |
| Metepec | 4 | 12,5 |
| Ixtlahuaca | 2 | 6,2 |
| Otros | 1 | 15,6 |
| Estado civil | ||
| Casada | 9 | 28,1 |
| Unión libre | 16 | 50 |
| Soltera | 6 | 18,7 |
| Divorciada | 1 | 3,2 |
| Nivel de estudios | ||
| Primaria | 3 | 9,4 |
| Secundaria | 8 | 25 |
| Secundaria incompleta | 5 | 15,6 |
| Técnica | 3 | 9,4 |
| Técnica incompleta | 1 | 3,1 |
| Preparatoria | 3 | 9,4 |
| Preparatoria incompleta | 6 | 18,8 |
| Profesional | 1 | 3,1 |
| Profesional incompleta | 2 | 6,2 |
| Ocupación principal | ||
| Ama de casa | 14 | 43,8 |
| Estudiante | 10 | 31,3 |
| Oficinista | 1 | 3,1 |
| Comerciante | 3 | 9,4 |
| Fumigadora | 2 | 6,2 |
| Otra | 2 | 6,2 |
Fuente: Encuesta aplicada a la población de estudio.
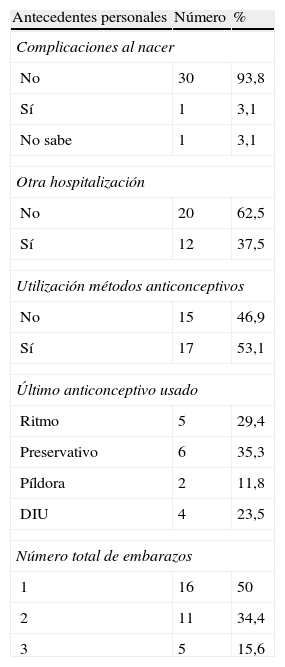
Con respecto a los antecedentes personales, el 3,1% refiere complicaciones al nacer, y el 37,5% ha estado hospitalizada, el 53,1% ha utilizado métodos anticonceptivos y el 50% es primigesta (tabla 2).
Antecedentes personales de la población en estudio.
| Antecedentes personales | Número | % |
| Complicaciones al nacer | ||
| No | 30 | 93,8 |
| Sí | 1 | 3,1 |
| No sabe | 1 | 3,1 |
| Otra hospitalización | ||
| No | 20 | 62,5 |
| Sí | 12 | 37,5 |
| Utilización métodos anticonceptivos | ||
| No | 15 | 46,9 |
| Sí | 17 | 53,1 |
| Último anticonceptivo usado | ||
| Ritmo | 5 | 29,4 |
| Preservativo | 6 | 35,3 |
| Píldora | 2 | 11,8 |
| DIU | 4 | 23,5 |
| Número total de embarazos | ||
| 1 | 16 | 50 |
| 2 | 11 | 34,4 |
| 3 | 5 | 15,6 |
Fuente: Encuesta aplicada a la población de estudio.
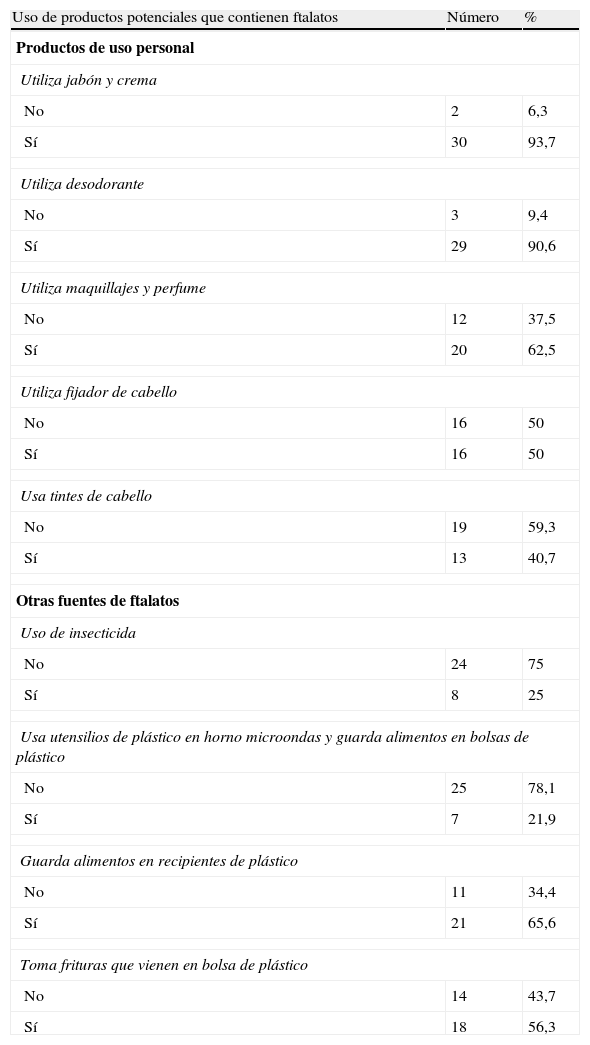
En lo que corresponde al uso de productos que contienen ftalatos se observa que 93,7% usa jabón y crema, 90,6% utiliza desodorante, 62,5% utiliza maquillaje y perfume, 50% usa fijador de cabello y 40,7% usa tintes de cabello (tabla 3).
Uso de productos potenciales que contienen ftalatos de la población en estudio.
| Uso de productos potenciales que contienen ftalatos | Número | % |
| Productos de uso personal | ||
| Utiliza jabón y crema | ||
| No | 2 | 6,3 |
| Sí | 30 | 93,7 |
| Utiliza desodorante | ||
| No | 3 | 9,4 |
| Sí | 29 | 90,6 |
| Utiliza maquillajes y perfume | ||
| No | 12 | 37,5 |
| Sí | 20 | 62,5 |
| Utiliza fijador de cabello | ||
| No | 16 | 50 |
| Sí | 16 | 50 |
| Usa tintes de cabello | ||
| No | 19 | 59,3 |
| Sí | 13 | 40,7 |
| Otras fuentes de ftalatos | ||
| Uso de insecticida | ||
| No | 24 | 75 |
| Sí | 8 | 25 |
| Usa utensilios de plástico en horno microondas y guarda alimentos en bolsas de plástico | ||
| No | 25 | 78,1 |
| Sí | 7 | 21,9 |
| Guarda alimentos en recipientes de plástico | ||
| No | 11 | 34,4 |
| Sí | 21 | 65,6 |
| Toma frituras que vienen en bolsa de plástico | ||
| No | 14 | 43,7 |
| Sí | 18 | 56,3 |
Fuente: Encuesta aplicada a la población en estudio.
Otras fuentes de ftalatos (tabla 3) son: uso de insecticida con 25%, uso de plástico en microondas, bolsas de plástico para guardar alimentos con el 21,9%, guarda alimentos en recipientes de plástico el 65,6% y 56,3% toma frituras que vienen en bolsa de plástico.
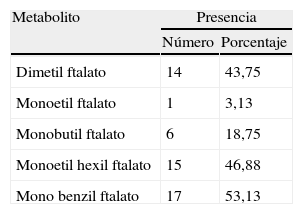
En la tabla 4 se observan los metabolitos detectados en las muestras de orina, encontrando el monobenzil ftalato como el más frecuente con el 53,13%; no se muestra el monooctil ftalato ya que no se encontró en ninguna de las muestras.
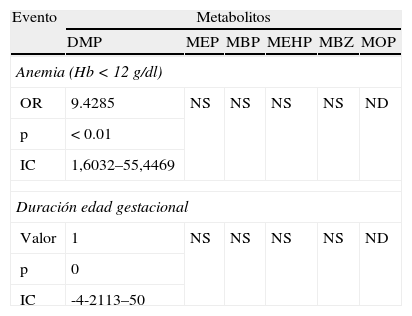
Se encontró la presencia de anemia en las pacientes a las que se detectó el DMP con una p<0,01 (IC 95%, 1,6032-55,4469) y OR 9,42. El resto de los metabolitos no reportan diferencias estadísticamente significativas (tabla 5).
Análisis bivariado de los eventos maternos y de la gestación con los metabolitos estudiados.
| Evento | Metabolitos | |||||
| DMP | MEP | MBP | MEHP | MBZ | MOP | |
| Anemia (Hb<12g/dl) | ||||||
| OR | 9.4285 | NS | NS | NS | NS | ND |
| p | < 0.01 | |||||
| IC | 1,6032–55,4469 | |||||
| Duración edad gestacional | ||||||
| Valor | 1 | NS | NS | NS | NS | ND |
| p | 0 | |||||
| IC | -4-2113–50 | |||||
Fuente: Base de datos.
Hb: hemoglobina; IC: intervalo de confianza; ND: no detectado; NS: no significativo; OR: odds ratio.
En lo que corresponde a la duración del embarazo (tabla 6), se observó que existe disminución del periodo gestacional con una diferencia estadísticamente significativa en las pacientes que cursan con la presencia del metabolito DMP con una p<0,04 (IC 95%, 253,7-281,5).
Análisis bivariado del sexo y somatometría del recién nacido con los metabolitos estudiados.
| Somatometría | Metabolitos | ||||
| DMP | MEP | MBP | MEHP | MBZ | |
| Sexo | |||||
| Valor | NS | NS | 9,1667 | NS | NS |
| p | < 0,01 | ||||
| Peso | |||||
| Valor | NS | NS | 2,4767 | NS | NS |
| p | 0,009 | ||||
| IC | 2753,35-3149,64 | ||||
| PC | |||||
| Valor | NS | NS | 2,6505 | NS | NS |
| p | < 0,007 | ||||
| IC | 33,36-34,78 | ||||
| PT | |||||
| Valor | NS | NS | 2,09 | NS | NS |
| p | < 0,023 | ||||
| IC | 31,07-33,07 | ||||
| PA | |||||
| Valor | NS | NS | 3,2557 | NS | NS |
| p | < 0,001 | ||||
| IC | 29,16-31,10 | ||||
| Talla RN | |||||
| Valor | NS | NS | 2,9742 | NS | NS |
| p | < 0,003 | ||||
| 48,93-51,06 | |||||
Fuente: Base de datos.
NS: no significativo; PA: perímetro abdominal; PC: perímetro cefálico; PT: perímetro torácico; RN: recién nacido.
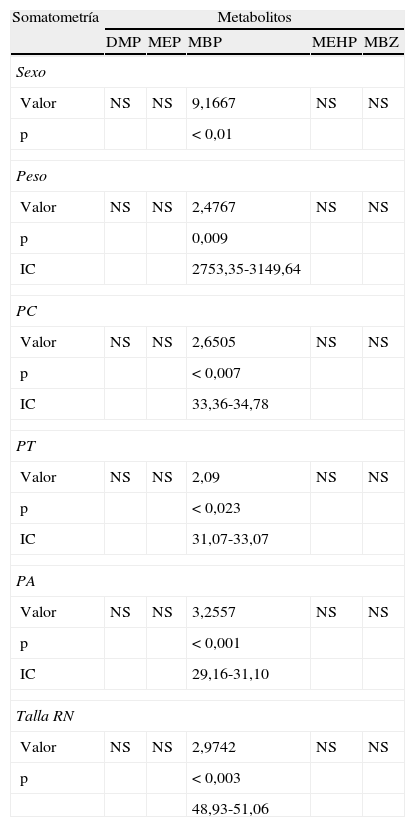
El análisis bivariado mostró que la presencia de MBP en relación con el sexo del recién nacido es mayor en el femenino con un valor de 9,1667, p<0,01 (tabla 6).
En la tabla 6 se observa que el peso es menor en los expuestos al MBP con una p<0,009, valor de 2,4767 (IC 95%, 2753,35-3149,64).
La presencia de MBP con una p<0,007 (IC 95%, 33,3-34,5) en relación con el perímetro cefálico indica que es más pequeño con diferencias estadísticamente significativas en los expuestos (tabla 6).
La presencia de MBP sí influye en los recién nacidos provocando una disminución en el perímetro torácico (tabla 6) con una p<0,023 (IC 95%, 31,03-33) y valor de 2,09.
En la tabla 6, se encontró que la presencia de MBP sí influye en la disminución del perímetro abdominal provocando una diferencia estadísticamente significativa con p<0,001 (IC 95%, 29,02-31,1) y valor de 3,2557.
En lo que corresponde a la talla del recién nacido se encontró que la presencia del metabolito MBP se relaciona con la disminución de este parámetro, encontrando una diferencia estadísticamente significativa con p<0,003 (IC 95%, 48,93-51,06) (tabla 6).
DiscusiónEl promedio de edad de las mujeres atendidas en el Hospital de Ginecología y Obstetricia del IMIEM se encuentra en la etapa fértil, con predominancia en la atención del parto vaginal; la población que acude para atención obstétrica en el hospital es de escasos recursos económicos, ya que únicamente perciben de 2,8 a 8,2 salarios mínimos, el 6% obtiene agua de pozo1, lo que puede favorecer la exposición a ftalatos por lixiviación de sustancias contaminantes en el suelo. El 50% de las pacientes ha fumado en alguna ocasión y el 22% ha consumido alcohol, aunque durante la etapa del embarazo prefieren no realizar ninguna de las dos cosas.
El 37,5% de las mujeres refiere haber estado expuesta a ftalatos por material médico, ya que ha sido hospitalizada en alguna etapa de su vida, muy pocas en tiempos menores a 6 meses, por lo que este parámetro no influiría en la presencia de metabolitos de ftalatos en las muestras de orina.
El 12,5% de las parejas que tiene la población se dedica al comercio en mercados públicos, lo cual hace que estén expuestos a infinidad de contaminantes ambientales, entre ellos los ftalatos.
En lo referente al uso de productos potenciales que contienen ftalatos se encuentran con mayor frecuencia la exposición por medio de jabón y crema en 93,7%, desodorante en 90,6%, maquillajes y perfume en 62,5%, fijador de cabello en 50%; en menor cantidad se encuentra el uso de aceites corporales y tintes de cabello. Esta población no adquiere o no está expuesta a metabolitos provenientes de aspectos laborales, como serían fábricas de plásticos o fertilizantes.
Otras fuentes a las que está expuesta la población en estudio es a insecticidas en 25%, al guardar los alimentos en recipientes de plástico con 65,6% e ingerir frituras en bolsas de plástico en el 56,3%; con menor porcentaje se encuentra el uso de utensilios de plástico en microondas y toma de refrescos en bolsa de plástico.
El metabolito que se detectó con mayor frecuencia en la población de estudio es el MBP, no encontrando el monooctil ftalato (MOP) en ninguna de las muestras.
Los casos de anemia se asocian con la presencia del DMP (Tavacoba, 1999); la disminución en la duración de la edad gestacional se ve afectada por el DMP (Latini, 2003). La duración de la edad gestacional tiene una diferencia estadísticamente significativa en las pacientes que cursan con la presencia del DMP.
El metabolito de MBP es el que predomina en las recién nacidas del sexo femenino.
La disminución del peso de los recién nacidos, perímetro cefálico, perímetro torácico, perímetro abdominal y talla del recién nacido (Lovekamp-Swan, 2003) se ven afectados en los productos expuestos a MBP.
Es necesario continuar con el estudio y determinar las concentraciones de ftalatos en orina de las mujeres de la cohorte mayor.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.