El principio básico de la fecundación in vitro en ciclo natural (FIV-CN) recae en el reclutamiento mediante la selección folicular espontánea, minimizando la manipulación del ciclo de la mujer. Recientemente esta técnica ha suscitado mayor interés y se han puesto en valor muchas de sus ventajas respecto a la FIV convencional (FIVc). FIV-CN y FIVc son tratamientos complementarios que permiten ampliar el espectro terapéutico en las parejas con indicación de FIV. La FIV-CN constituye un tratamiento a considerar especialmente en la paciente con mal pronóstico para la FIVc por baja reserva ovárica. La edad es su principal factor pronóstico y los resultados son aceptables hasta los 40 años. El principal factor limitante de la FIV-CN es el riesgo de cancelación por ovulación, que puede reducirse mediante diferentes estrategias. No obstante, los resultados por transferencia embrionaria son satisfactorios en diferentes series publicadas.
The basic principle of natural cycle in vitro fertilization (NC-IVF) lies in recruitment through spontaneous follicular selection, avoiding or minimizing the use of drugs and manipulation of the woman's cycle. In recent years, this technique has attracted growing interest and many of its advantages over conventional IVF (cIVF) have been highlighted. NC-IVF and cIVF should be considered complementary treatments, which broaden the therapeutic spectrum for couples for whom IVF is indicated. NC-IVF could be considered in patients with poor prognosis for cIVF due to low ovarian reserve. Age is the main prognostic factor and results are acceptable up to 40 years of age. The main limiting factor is the risk of cancellation due to ovulation, which can be reduced through different strategies. Pregnancy rate per embryo transfer results are encouraging.
La fecundación in vitro (FIV) en ciclo natural (FIV-CN) consiste en la monitorización de la foliculogénesis de un ciclo espontáneo de la mujer hasta el desarrollo de un folículo dominante para la obtención de un ovocito, que posteriormente será fecundado y el embrión resultante será transferido a la cavidad uterina1. El primer embarazo humano logrado con FIV en 1978 se consiguió mediante está técnica2. Desde entonces, el desarrollo de fármacos para la estimulación ovárica ha permitido realizar FIV en ciclos polifoliculares, permitiendo la recuperación simultánea de varios ovocitos, la fecundación y obtención de varios embriones, que a su vez posibilita la selección embrionaria y la vitrificación de los embriones restantes, permitiendo varias transferencias embrionarias en un mismo ciclo. Las ventajas del ciclo de FIV convencional (FIVc) mediante estimulación ovárica son evidentes. Sin embargo, en los últimos años, la FIV-CN ha experimentado un interés creciente como tratamiento alternativo a la FIVc en diferentes situaciones clínicas3.
En este artículo de revisión se pretende realizar una actualización sobre el conocimiento disponible en FIV-CN. A continuación, detallaremos los principios básicos y avanzados de esta técnica, atendiendo a sus ventajas e inconvenientes, sus potenciales indicaciones, su tasa de éxito en distintos contextos, así como los resultados perinatales obtenidos.
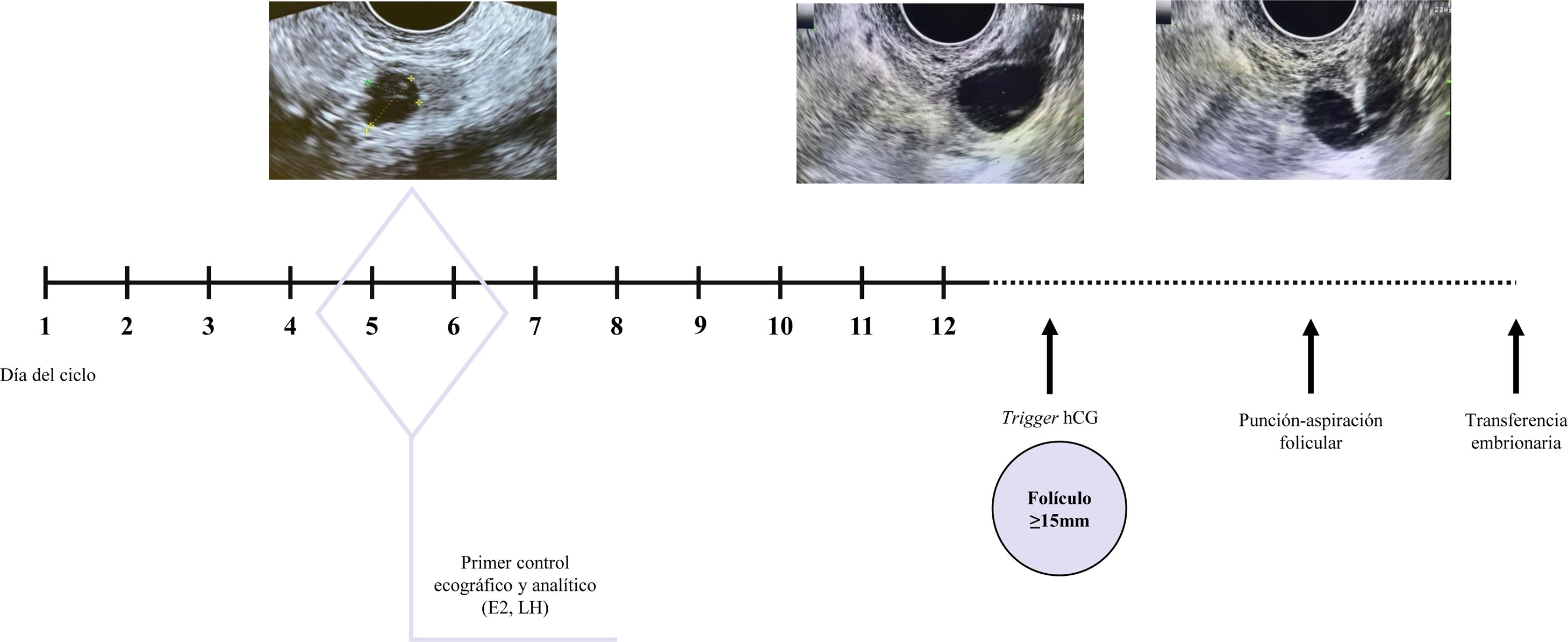
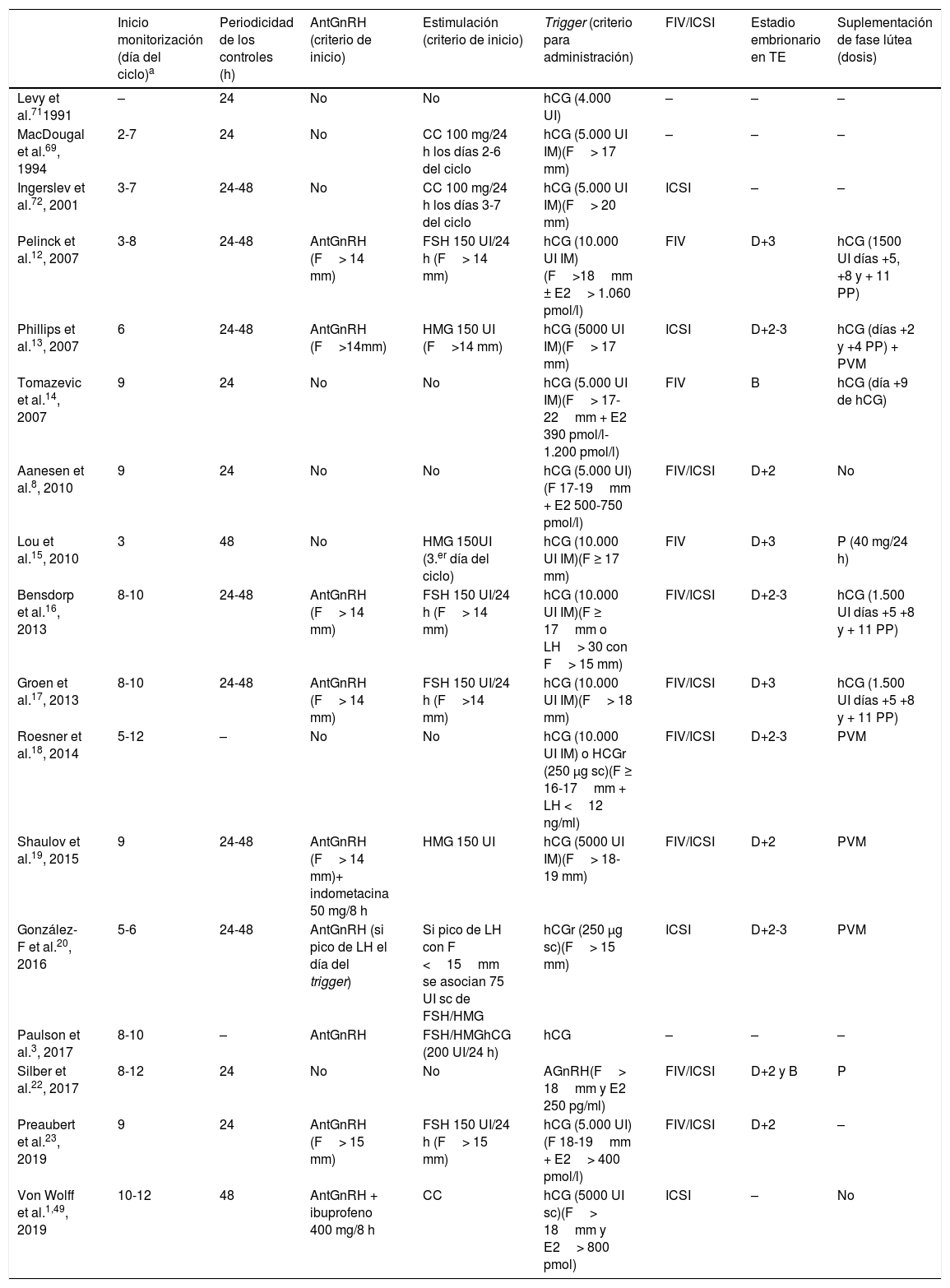
Definición y protocolos de FIV-CNEl principio fundamental de la FIV-CN se basa en la monitorización del crecimiento folicular, minimizando la manipulación del ciclo de la mujer y obteniendo un óvulo fruto de la selección folicular espontánea, para ser fecundado y transferir el embrión resultante al útero de la mujer4. Para ello, será fundamental una adecuada monitorización folicular ecográfica y hormonal seriada, y la inducción de la descarga ovulatoria en el momento ideal, es decir, con la mayor probabilidad de obtener un ovocito maduro y antes de que se produzca la ovulación prematura (fig. 1). Ello requiere un conocimiento específico de esta técnica, cuya monitorización y desarrollo es sustancialmente diferente de la FIVc.
La International Society for Mild Approaches in Assisted Reproduction (ISMAAR), en 2007, definió la FIV-CN como aquella técnica de FIV sin uso de medicación y FIV-CN modificado (FIV-CNM) la que incorpora el uso de medicación para inducir la maduración ovocitaria final o para disminuir el riesgo de ovulación prematura5. No obstante, la incorporación rutinaria de un fármaco como trigger ovulatorio hace que el tratamiento no sea ya puramente «natural» y habitualmente nos referimos a FIV-CN cuando no incorpora gonadotropinas u otros fármacos para estimular el crecimiento folicular, permitiendo el reclutamiento natural del folículo, aunque puede incorporar una inyección única de antagonistas de la GnRH (antGnRH) u otro fármaco para prevenir la ovulación precoz, así como el trigger ovulatorio con hCG. En cambio, nos referiremos a FIV-CNM al ciclo natural suplementado con gonadotropinas u otros fármacos estimuladores de la ovulación, tal como realizaremos en esta revisión y de forma análoga a la nomenclatura utilizada por otros autores1,3.
El principal factor limitante de la FIV-CN es la elevada tasa de cancelación por ciclo, es decir, la menor probabilidad de que un ciclo iniciado finalice en una transferencia embrionaria. Según los datos publicados en series de casos y estudios de cohortes, esta tasa oscila entre un 15 y 71% de los CN iniciados3,6. La tasa de transferencia por ciclo iniciado es fundamental para la efectividad de la FIV-CN1. El análisis de datos procedentes de los registros de la Society for Assisted Reproductive Technology (SART) y Clinical Outcome Reporting System (CORS) muestran una tasa de transferencia por ciclo iniciado del 36,6%7, mientras que otros autores reportan tasas de 42,1 al 46,5%8,9. Los diferentes pasos limitantes de la FIV-CN son:
- –
Desarrollo folicular anómalo o ciclo anovulatorio: tras iniciar la monitorización del ciclo, no se consigue objetivar el desarrollo de un folículo dominante o se determina una evolución anómala de los niveles hormonales del ciclo (descenso de estradiol, niveles excesivos de LH desde el inicio de la monitorización del ciclo, etc.).
- –
Ovulación prematura: detección de la ovulación del folículo dominante, durante la monitorización folicular o generalmente el día de la punción folicular, en la ecografía que se realiza inmediatamente antes del procedimiento.
- –
No obtención de ovocito en la punción folicular: la tasa de recuperación de un ovocito por folículo es limitada.
- –
Obtención de un ovocito inmaduro, no fecundación del ovocito o no desarrollo embrionario.
- –
No obstante, si tras estos pasos limitantes de la técnica se obtiene un embrión apto para trasferir, la tasa de implantación embrionaria es superior a la de la FIVc1,7,10. Por tanto, las parejas que realizan FIV-CN deben estar bien informadas de las limitaciones de la técnica, ya que en caso contrario se puede generar frustración y malestar, especialmente cuando han realizado previamente tratamientos como la FIVc, en los que la tasa de cancelación suele venir condicionada por la capacidad de respuesta a la estimulación ovárica y no por los aspectos señalados aquí. Ambos tratamientos presentan grandes diferencias y, antes de iniciar la FIV-CN, deben quedar bien claros los objetivos de esta técnica, su necesidad de monitorización estricta y la eventual cancelación en cada etapa del ciclo. Estos inconvenientes quedan compensados por las ventajas que señalaremos posteriormente y que constituyen el motivo por el que indicamos este tratamiento y defendemos su uso en determinadas situaciones clínicas.
A continuación, se revisará la evidencia disponible actual sobre los diferentes apartados del tratamiento de FIV-CN. Existen diferentes estrategias reportadas, por lo que los datos sobre monitorización y uso de fármacos de las principales series publicadas se resumen en la tabla 18,9,11-32.
Monitorización y administración de fármacos en la FIV-CN y FIV-CNM. Resumen de los datos reportados en las principales series publicadas
| Inicio monitorización (día del ciclo)a | Periodicidad de los controles (h) | AntGnRH (criterio de inicio) | Estimulación (criterio de inicio) | Trigger (criterio para administración) | FIV/ICSI | Estadio embrionario en TE | Suplementación de fase lútea (dosis) | |
|---|---|---|---|---|---|---|---|---|
| Levy et al.711991 | – | 24 | No | No | hCG (4.000 UI) | – | – | – |
| MacDougal et al.69, 1994 | 2-7 | 24 | No | CC 100 mg/24 h los días 2-6 del ciclo | hCG (5.000 UI IM)(F> 17 mm) | – | – | – |
| Ingerslev et al.72, 2001 | 3-7 | 24-48 | No | CC 100 mg/24 h los días 3-7 del ciclo | hCG (5.000 UI IM)(F> 20 mm) | ICSI | – | – |
| Pelinck et al.12, 2007 | 3-8 | 24-48 | AntGnRH (F> 14 mm) | FSH 150 UI/24 h (F> 14 mm) | hCG (10.000 UI IM)(F>18mm ± E2> 1.060 pmol/l) | FIV | D+3 | hCG (1500 UI días +5, +8 y + 11 PP) |
| Phillips et al.13, 2007 | 6 | 24-48 | AntGnRH (F>14mm) | HMG 150 UI (F>14 mm) | hCG (5000 UI IM)(F> 17 mm) | ICSI | D+2-3 | hCG (días +2 y +4 PP) + PVM |
| Tomazevic et al.14, 2007 | 9 | 24 | No | No | hCG (5.000 UI IM)(F> 17-22mm + E2 390 pmol/l-1.200 pmol/l) | FIV | B | hCG (día +9 de hCG) |
| Aanesen et al.8, 2010 | 9 | 24 | No | No | hCG (5.000 UI)(F 17-19mm + E2 500-750 pmol/l) | FIV/ICSI | D+2 | No |
| Lou et al.15, 2010 | 3 | 48 | No | HMG 150UI (3.er día del ciclo) | hCG (10.000 UI IM)(F ≥ 17 mm) | FIV | D+3 | P (40 mg/24 h) |
| Bensdorp et al.16, 2013 | 8-10 | 24-48 | AntGnRH (F> 14 mm) | FSH 150 UI/24 h (F> 14 mm) | hCG (10.000 UI IM)(F ≥ 17mm o LH> 30 con F> 15 mm) | FIV/ICSI | D+2-3 | hCG (1.500 UI días +5 +8 y + 11 PP) |
| Groen et al.17, 2013 | 8-10 | 24-48 | AntGnRH (F> 14 mm) | FSH 150 UI/24 h (F>14 mm) | hCG (10.000 UI IM)(F> 18 mm) | FIV/ICSI | D+3 | hCG (1.500 UI días +5 +8 y + 11 PP) |
| Roesner et al.18, 2014 | 5-12 | – | No | No | hCG (10.000 UI IM) o HCGr (250 μg sc)(F ≥ 16-17mm + LH <12 ng/ml) | FIV/ICSI | D+2-3 | PVM |
| Shaulov et al.19, 2015 | 9 | 24-48 | AntGnRH (F> 14 mm)+ indometacina 50 mg/8 h | HMG 150 UI | hCG (5000 UI IM)(F> 18-19 mm) | FIV/ICSI | D+2 | PVM |
| González-F et al.20, 2016 | 5-6 | 24-48 | AntGnRH (si pico de LH el día del trigger) | Si pico de LH con F <15mm se asocian 75 UI sc de FSH/HMG | hCGr (250 μg sc)(F> 15 mm) | ICSI | D+2-3 | PVM |
| Paulson et al.3, 2017 | 8-10 | – | AntGnRH | FSH/HMGhCG (200 UI/24 h) | hCG | – | – | – |
| Silber et al.22, 2017 | 8-12 | 24 | No | No | AGnRH(F> 18mm y E2 250 pg/ml) | FIV/ICSI | D+2 y B | P |
| Preaubert et al.23, 2019 | 9 | 24 | AntGnRH (F> 15 mm) | FSH 150 UI/24 h (F> 15 mm) | hCG (5.000 UI)(F 18-19mm + E2> 400 pmol/l) | FIV/ICSI | D+2 | – |
| Von Wolff et al.1,49, 2019 | 10-12 | 48 | AntGnRH + ibuprofeno 400 mg/8 h | CC | hCG (5000 UI sc)(F> 18mm y E2> 800 pmol) | ICSI | – | No |
| Estudios en pacientes con baja reserva ovárica | ||||||||
| Kolibianalis et al.25, 2004 | 8 | 24-48 | AntGnRH (F> 14 mm) | FSH 150 UI/24 h (F> 14 mm) | hCG (10.000 UI IM)(F ≥ 16 mm) | FIV/ICSI | D+3 | PVM |
| Morgia et al.10, 2004 | 7 | 24 | No | No | hCG (10.000 UI IM)(F ≥ 16 mm) | ICSI | D2-3 | P IM (50 mg/24 h) |
| Elizur et al.27, 2005 | 3 | 48-72 | AntGnRH (F> 13 mm) | HMG | – | FIV/ICSI | – | P |
| Kim et al.28, 2009 | 7-8 | 48 | AntGnRH (F> 14 mm) | FSH 150 UI/24 h (F> 14 mm) | hCGr (250 μg sc)(F 17-18 mm) | FIV/ICSI | D+3 | P (90 mg/24 h) |
| Schimberni et al.29, 2009 | 7 | 24 | No | No | hCG (10.000 UI IM)(F> 16 mm) | ICSI | D+3 | P IM (50 mg/24) |
| Polyzos et al.9, 2012 | 7-8 | 48 | No | No | hCG (5.000 UI IM)(F> 16 mm) | ICSI | D+3>>> B | PVM ± E2 |
| Kedem et al.30, 2014 | 3 | 48-72 | AntGnRH (F> 13 mm) | HMG | – | FIV/ICSI | – | P |
| Lainas et al.31, 2015 | 6 | 48 | AntGnRH (F> 14 mm) | FSH 150 UI/24 h (F> 14 mm) | hCG (10.000 UI IM)(F ≥ 16 mm) | FIV/ICSI | D+2-3 | PVM |
| Drakopoulos et al.32, 2019 | 7-8 | 48 | AntGnRH (F> 14 mm) | HMG 75 UI/24 h (F> 14 mm) | hCG (5.000 UI sc)(F> 16 mm) | ICSI | D+3 | PVM |
AGnRH: agonista de la GnRH; AntGnRH: antagonista de la GnRH; B: blastocisto; CC: citrato de clomifeno; D+2/3: transferencia embrionaria en segundo/tercer día de cultivo embrionario; F: folículo; FIV: fecundación in vitro; FSH: follicle-stimulating hormone; hCG: human chorionic gonadotropin; HMG: human menopausal gonadotropin; ICSI: intracytoplasmic sperm injection; IM: intramuscular; LH: luteinizing hormone; P: progesterona; PP: pospunción; PVM: progesterona vaginal micronizada (600 mg/24 h); Sc: subcutánea;TE: transferencia embrionaria.
Existen múltiples protocolos de seguimiento con diferencias en cuanto al día de inicio de la monitorización, a la periodicidad de los controles y a los criterios para la administración del trigger ovulatorio. Según diferentes autores, la monitorización folicular se puede iniciar entre los días 5 y 12 del ciclo (tabla 1)8,9,11-32, aunque el inicio de los controles debería estar determinado por la duración del ciclo de la paciente y por la evolución de ciclos previos. Cada control folicular habitualmente incluye analítica hormonal sérica con determinación de estradiol y LH, y control ecográfico del diámetro folicular y del grosor endometrial. Una vez se ha destacado un folículo dominante, los controles se realizan cada 24-48 h. La administración del trigger se indica habitualmente cuando el folículo alcanza un tamaño superior a 15mm y se observan niveles de estradiol concordantes. Las diferentes pautas de monitorización descritas en la literatura se resumen en la tabla 18,9,11-32.
En la FIV-CN, las concentraciones séricas de E2, P y LH están significativamente más elevadas en las pacientes que ovularon precozmente comparadas con aquellas que llegaron a la punción folicular, pero el diámetro folicular no resultó diferente entre ambos grupos33. Un descenso preovulatorio del estradiol sérico superior al 10% también constituye un marcador predictivo de ovulación precoz34. A continuación, se detallarán las diferentes estrategias para reducir la tasa de cancelación por ovulación precoz.
Prevención de la ovulación prematuraEl riesgo de ovulación precoz es uno de los principales factores limitantes del éxito de la FIV-CN. Se han reportado tasas de ovulación prematura de entre el 6,8 y el 20,6%1,3,20,29. Existen 3 estrategias farmacológicas para reducir este riesgo: antGnRH, antiinflamatorios no esteroideos (AINE) y citrato de clomifeno.
La estrategia más ampliamente utilizada es evitar el desarrollo de un pico de LH endógeno mediante la administración de antGnRH6. Se puede administrar una dosis de antGnRH si se detecta un pico de LH (definido como un valor que excede el 180% del valor basal) el día de la administración del trigger ovulatorio20. Si el pico de LH se desencadena con un diámetro folicular <15mm, debe añadirse terapia de rescate con gonadotropinas hasta alcanzar los criterios para la administración del trigger ovulatorio20,29.
Otra estrategia es la administración de AINE para la inhibición la ciclooxigenasa que cataliza la síntesis de la prostaglandina E2, inhibiendo el proceso inflamatorio desencadenado por el pico de LH y que finaliza con la rotura de la pared folicular. La administración de indometacina o ibuprofeno antes o al inicio de la elevación de la LH puede posponer la ovulación mediante este mecanismo35. El ibuprofeno reduce la concentración de PGE2 e IL-8 en líquido folicular1. La administración por vía oral de ibuprofeno 400mg/8h al detectarse una concentración sérica de LH superior a 10 UI/l el día del trigger y mantenido hasta la punción folicular se asoció a una tasa de ovulación prematura similar al grupo control sin elevación de LH y que no recibió AINE32. Las tasas de recuperación de ovocito maduro y de implantación, y la calidad embrionaria fueron también similares en ambos grupos36. El tratamiento por vía oral mediante indometacina 50mg/8h actuaría mediante un mecanismo de acción similar, retrasando la rotura folicular sin tener efectos aparentes sobre el estatus hormonal del folículo37,38.
La administración preovulatoria de citrato de clomifeno también puede inhibir el pico de LH, tal como ya se había demostrado en un estudio aleatorizado controlado en ciclos de inseminación artificial39. En un estudio en FIV-CN, el citrato de clomifeno administrado diariamente en dosis de 25mg desde el día 7 del ciclo hasta la administración de HCG redujo significativamente la tasa de ovulación prematura de un 27,8% a un 6,8% e incrementó la tasa de transferencia de un 39,8% a un 54,4%40.
Uso de gonadotropinas y otros fármacos estimulantes del desarrollo folicularAlgunos grupos realizan sistemáticamente una estimulación ovárica suave en el contexto de la FIV-CN al iniciarse el desarrollo folicular, utilizando gonadotropinas o citrato de clomifeno8,40,41. Por otro lado, las gonadotropinas se añaden como terapia de rescate cuando se requieren más de 24 h de frenación hipofisaria con antGnRH, ya que no únicamente se inhibe el pico de LH, sino que también afecta la secreción de FSH (y en este caso se utiliza siempre hCG para inducir la maduración ovocitaria final y se añade soporte de fase lútea)9,20,29. Por último, el uso de 200 UI/día de hCG como alternativa a las gonadotropinas puede comportar una disminución del coste del ciclo21.
Trigger ovulatorio y punción folicularEl uso de hCG como trigger de la ovulación es prácticamente universal en los trabajos publicados, aunque también se puede realizar la descarga ovulatoria con agonistas de la GnRH22. Con la administración de hCG, el soporte de fase lútea puede o no ser utilizado, tal como se detallará en el correspondiente apartado9,20,29.
La punción folicular se programa habitualmente a las 36 h de la administración de hCG, de forma similar a la FIVc1. Antes de realizar la punción folicular se realiza una ecografía para descartar una ovulación previa. El procedimiento de punción folicular no requiere habitualmente anestesia.
La recuperación ovocitaria en la punción folicular debe realizarse de la forma más eficaz posible, ya que suele tratarse de ciclos con desarrollo monofolicular. Los lavados foliculares o «flushing» tras la aspiración inicial podrían aumentar la tasa de recuperación ovocitaria42. Esta maniobra aplicada en ciclos de desarrollo multifolicular en pacientes con baja respuesta no ha demostrado representar un beneficio adicional43,44. Sin embargo, los estudios practicados en ciclos de FIV-CN sí muestran un incremento en la recuperación ovocitaria42,45,46. En una investigación se objetivó que la realización de 3 lavados foliculares aumentó la tasa de recuperación ovocitaria de un 44,5% a un 80,5% (p <0,01) y se asoció a un incremento en la tasa de transferencia embrionaria de un 20,1% a un 38,4% (p <0,01)42. Posteriormente, este mismo grupo realizó un estudio prospectivo aleatorizado incluyendo a 81 pacientes en las que se realizó únicamente aspiración del folículo y 83 en las que se realizaron 5 lavados foliculares después de la aspiración folicular inicial. La duración media del procedimiento fue significativamente superior en el grupo con lavado folicular pero no hubo diferencias en el dolor reportado por las pacientes. Se observó que la tasa de ovocito maduro obtenido y la tasa de fecundación fueron significativamente superiores en el grupo donde se realizó lavado folicular, así como la tasa de pacientes que llegaron a transferencia (62,7% vs. 46,9%; IC del 95%, 0,3-30,3%; p=0,06)46.
La aspiración de folículos secundarios es otra técnica encaminada a mejorar la tasa de recuperación ovocitaria. De estos folículos, se puede obtener un ovocito maduro (metafase ii) o inmaduro que podría desarrollarse mediante maduración in vitro (MIV)47,48. En un estudio retrospectivo se observó que un 25% de los ovocitos aspirados de folículos secundarios fueron ovocitos en metafase ii y un 85,6% de ellos fecundaron con éxito, con una tasa de nacido vivo del 8,6%48.
Técnicas de laboratorio y transferencia embrionariaEn una revisión realizada por Roesner et al.18 de un total de 27 trabajos de FIV-CN, en 17 de ellos utilizaron técnica de FIV para la fecundación y en 7 de ellos ICSI, mientras que en 3 estudios utilizaron una técnica u otra en función de la calidad seminal.
Posteriormente, el cultivo embrionario se realiza de forma análoga a la FIVc. En los trabajos publicados la transferencia embrionaria se ha realizado mayoritariamente a las 48-72h tras la fecundación, transfiriendo un embrión en estadio de células29,49, aunque algunas publicaciones recientes reportan transferencias en estadio de blastocisto9,22.
Soporte de fase lúteaDurante el proceso de FIVc se administra progesterona como soporte de fase lútea para compensar la insuficiencia lútea propiciada por los niveles elevados de estradiol, que son responsables de una supresión de la LH50. Por este motivo, en la FIV-CNM con estimulación ovárica el soporte de la fase lútea es necesario y habitualmente se realiza mediante progesterona natural micronizada por vía vaginal (600mg/24h)50. El desarrollo de la fase lútea no se vería comprometido en la FIV-CN sin estimulación ovárica y el soporte farmacológico no sería preceptivo, aunque en la práctica clínica se utiliza en muchos casos y más teniendo en cuenta el posible impacto de la punción y lavados foliculares en la función luteínica posterior50. No obstante, según los datos de un estudio prospectivo, no se objetivaron diferencias en la duración de la fase lútea y las concentraciones de progesterona y estradiol entre ciclos de FIV-CN no estimulados con administración de HCG, punción y 3 lavados foliculares respecto a ciclos de referencia en las mismas pacientes con ovulación inducida con HCG, pero sin punción-aspiración ovocitaria posterior51. Por tanto, aunque el soporte de la fase lútea no sería estrictamente necesario en la FIV-CN sin estimulación ovárica, varios autores lo utilizan en sus protocolos y otros lo indican en pacientes con mayor riesgo de presentar una fase lútea deficiente, especialmente en mujeres de más de 40 años o en aquellas con una fase lútea de duración inferior a 12 días52.
Otras estrategias en el CNSegún los resultados de un estudio retrospectivo, la acumulación de embriones de 3 FIV-CN con vitrificación embrionaria y transferencia posterior podría mejorar la tasa de nacido vivo en pacientes con baja reserva ovárica y edad superior a 35 años, en comparación con la estrategia de FIV-CN y transferencia en fresco53. No obstante, debe tenerse en cuenta que la edad media de las participantes en este estudio era de 40 años y los malos resultados en el grupo con transferencia en fresco se relacionarían con una elevada tasa de aborto en las pacientes mayores de 35 años. También se ha descrito la asociación de FIV-CN con la MIV de ovocitos recuperados de folículos de menor tamaño, incrementando la disponibilidad de ovocitos por ciclo y la posibilidad de finalizarlo, aumentando la eficiencia del tratamiento54, aunque otros autores objetivaron mayor tasa de nacido vivo cuando se recuperó el ovocito maduro en la punción folicular55. La FIV-CN en fase lútea constituye otra estrategia descrita por otro grupo para optimizar el tiempo necesario para conseguir un embrión en FIV-CN56. Por otro lado, la técnica de FIV-CN también se utiliza en pacientes con autotrasplante de tejido ovárico, especialmente en casos con baja probabilidad de gestación espontánea, reserva ovárica limitada o contraindicación para la estimulación ovárica57.
Resultados reproductivosLas tasas de embarazo reportadas por diferentes grupos son muy heterogéneas, a menudo procedentes de series con bajo número de pacientes y con diferencias entre los protocolos y en el perfil clínico de la paciente. Los datos de los principales estudios publicados se resumen en la tabla 28,9,11-20,22-32,58. En general, la FIV-CN se asocia a una tasa de gestación por ciclo inferior a la FIVc por su elevada tasa de cancelación y la menor probabilidad de llegar a la transferencia embrionaria en cada ciclo3,4,59. Así, la tasa de embarazo por ciclo iniciado en las principales series se sitúa entre el 10 y el 15%, aunque esto depende en gran medida de la edad de las pacientes incluidas1,8. No obstante, los resultados por transferencia son alentadores, tal como muestra el análisis de los registros SART y CORS, con una tasa de embarazo clínico por transferencia de 26% y una tasa de nacido vivo por transferencia del 19,9%7. Varios estudios han objetivado que los ciclos de FIV-CN con transferencia embrionaria presentan una tasa de implantación superior a los ciclos de FIVc, siendo en el registro SART del 40,4% en FV-CN frente al 23,8% en FIVc en las pacientes entre 35 y 37 años, del 28,4% frente al 15,4% en las pacientes entre 38 y 40 años, y del 19,4% respecto al 8,4% en las pacientes 41 y 42 años7. La mayor tasa de implantación por ovocito fecundado asociada a la FIV-CN respecto a FIVc podría estar relacionada con una mejor calidad ovocitaria o a una receptividad endometrial más adecuada1,4,60. La mejoría de la calidad ovocitaria podría atribuirse a la selección natural del folículo del que se obtiene el ovocito o por la ausencia de manipulación de la fisiología intrafolicular cuando no se administran fármacos estimulantes de la ovulación61. Un estudio que comparó células de la granulosa en cultivo obtenidas tras FIVc y FIV-CN mostró que las células procedentes del ciclo no estimulado presentaban mayor producción de mRNA para AMH y mayor secreción de AMH y progesterona bajo estimulación con FSH. Esto podría indicar que la estimulación ovárica mediante gonadotropinas podría favorecer la obtención de ovocitos procedentes de folículos no competentes62. Otra investigación mostró marcadas diferencias en el ambiente endocrinológico intrafolicular entre ambos tratamientos y la concentración en líquido folicular de potenciales marcadores de calidad ovocitaria como AMH fue marcadamente inferior en el ciclo de FIVc respecto a la FIV-CN40. En otro trabajo, las células de la granulosa procedentes de FIVc también presentaron menor viabilidad, menor expresión del receptor de LH y de los genes antiapoptópticos, entraron antes en apoptosis y no mantuvieron una adecuada producción de E2 y progesterona, comparado con células procedentes de FIV-CN63. Por otro lado, la administración de gonadotropinas exógenas podría tener un efecto en otros procesos fisiológicos intrafoliculares que también podrían influir en la calidad ovocitaria. Diferentes citocinas y células del sistema inmunitario están implicadas en procesos cruciales para el desarrollo folicular y, en este sentido, se han objetivado diferencias entre FIV-CN y FIVc en las concentraciones de citocinas, en el recuento de leucocitos CD45+ y en las poblaciones de células T tanto en sangre como en líquido folicular64. No obstante, esto no se traduce en una menor tasa de embriones aneuploides en FIV-CN respecto a FIVc65. Por otro lado, se ha observado que la estimulación ovárica se asocia a alteraciones en la fisiología endometrial y de la placentación60. La estimulación ovárica se ha asociado a una alteración histológica e inmunohistoquímica endometrial66 y de su expresión génica en la ventana de implantación67. También se ha observado en el modelo animal como concentraciones elevadas de estradiol comprometían la invasión de las arterias espirales uterinas68.
Resumen de los resultados reproductivos de FIV-CN y FIV-CNM publicados en la literatura
| Autores | Tipo de estudio | TRO por ciclo | TT por ciclo | TE por ciclo | TE por transferencia | TE por paciente | TNV por ciclo | TNV por paciente | Conclusión |
|---|---|---|---|---|---|---|---|---|---|
| Levy et al.71, 1991 | RCT:22 ciclos FIV–CNvs.26 ciclos FIVc protocolo AGnRH | – | – | – | – | FIV–CN:0%FIVc:6% | – | – | – |
| MacDougal et al.69, 1994 | RCT:FIV-CN (14 pacientes)vs.FIV-CNM (16 pacientes)Edad <38 a | – | – | – | – | FIV-CN:0%FIV-CNM:12,5% | – | FIV-CN:0%FIV-CNM: 12,5% | – |
| Ingerslev et al.72,2001 | RCT: 132 pacientes114 ciclos FIV–CNEdad media 30,7± 2,5 avs.111 ciclos FIV-CNM (uso de CC)Edad media 30,2±2,9 a | FIV-CN: 68 (0,92±0,40)aFIV-CNM: 174 (1,83±1,15)a | – | – | – | FIV-CN:4%FIV-CNM: 20% | – | – | – |
| Pelinck et al.12, 2007 | Estudio de cohortes: 268 pacientes1.048 ciclos de FIV-CNMEdad media 33,3 a | – | 36,5% | 7,9% | 20,7% | – | – | – | FIV-CNM es una opción a tener en cuenta en las pacientes candidatas a FIVc por su perfil de seguridad |
| Phillips et al.13, 2007 | Estudio retrospectivo134 ciclos FIV-CNMvs.370 ciclos FIVcEdad <39 a | – | FIV-CN<35 a: 54%≥ 35 a: 48%FIVc<35 a: 96%≥ 35 a: 92% | – | FIV-CN<35 a: 27%≥ 35 a: 8%FIVc<35 a: 47%≥ 35 a: 37% | – | - | – | En pacientes <35 a la FIV-CNM reduce el costo y los riesgos, permitiendo ciclos consecutivos con una tasa de éxito acumulada similar a FIVc |
| Tomazevic et al.14, 2007 | Estudio retrospectivo: 122 pacientes397 ciclos FIV-CN286 ciclos en pacientes ≤ 39 a111 ciclos en pacientes> 39 a | ≤ 39 a: 77%> 39 a: 75% | ≤ 39 a: 57%> 39 a: 52% | – | ≤ 39 a: 26%> 39 a: 9% | – | ≤ 39 a: 13%> 39 a: 2% | – | La edad materna es un factor pronóstico en FIV-CN |
| Aansen et al.8, 2010 | Estudio retrospectivo129 ciclos FIV-CN (43 pacientes)Edad media 34,2±3,3 avs.250 ciclos Mild-IVF (CC)(145 pacientes)Edad media 32,8±4,0 avs.FIVc | FIV-CN: 68,9%Mild-FIV: 86,8% | FIV-CN: 46,5%Mild-FIV: 60,4% | – | FIV-CN: 26,7%> 38 a: 0%Mild-FIV: 27,2%> 38 a: 17,5%FIVc:34,3%> 38 a: 27% | – | – | – | Tasas de gestación por transferencia aceptables en FIV-CN, con costo de mediación un 96% inferior que en FIVc y baja tasa de complicaciones |
| Lou et al.15, 2010 | RCTFIV-CNM (30 pacientes)Edad media 30,6±4,5 avs.FIVc protocolo AGnRH (30 pacientes)Edad media 31,2±4,7 a | – | – | FIV-CNM:30%FIVc:30% | – | – | – | – | No se observaron diferencias en TE por ciclo ni en tasas de implantación, FIV-CNM es una opción de tratamiento factible con un menor coste y riesgo de complicaciones |
| Bensdorp et al.16, 2013 | RCTFIV-CN 6 ciclos (194 pacientes)Edad media 33±3,3 avs.IA-HOC 6 ciclos (207 pacientes)Edad media 33±3,5 avs.FIVc SET 3 ciclos (201 pacientes)Edad media 34±3,6 a | – | – | – | – | FIV-CN: 59%IA-HOC: 64%FIVc SET: 67% | – | FIV-CN:51%IA-HOC:56%FIVc SET: 59% | Los resultados de FIVc y FIV-CN no fueron inferiores a la IA-HOC en tasa de recién nacido sano y mostraron bajo porcentaje de gestación gemelar |
| Gordon et al.7, 2013 | Análisis del registro SART795 ciclos FIV-CNM | <35 a:71,9%35-37 a: 69,3%38-40 a:69,6%41-42 a:67,2%> 42 a:61,6% | <35 a:53,8%35-37 a: 41,6%38-40 a: 41,6%41-42 a: 28,8%> 42 a:22,8% | <35 a:19,2%35-37 a: 16,8%38-40 a:11,8%41-42 a:5,6%> 42 a:0% | Globalmente26,1% | – | <35 a:15,2%35-37 a: 14,9%38-40 a:8,7%41-42 a:2,4%> 42 a:0% | – | Las TE y TNV por ciclo son superiores en pacientes <35 a. Las tasas de implantación son superiores en FIV-CN vs. FIVc |
| Groen et al.17, 2013 | Estudio retrospectivo de coste eficacia1994 ciclos FIV-CNMvs.392 FIVcEdad <36 a | FIV-CNM86,6%FIVc92,4% | FIV-CNM32,5%FIVc81,6% | FIV-CNM5,7%FIVc19,9% | FIV-CNM17,7%FIVc24,4% | – | FIV-CNM5%FIVc18,9% | FIV-CNM21,9%FIVc21,9% | Los resultados apuntan a que FIV-CNM podría ser una alternativa costo-eficiente a FIVc |
| Roesner et al.18, 2014 | Estudio retrospectivo463 ciclos FIV-CN (159 pacientes)Edad media: 36,4±4,7 a | – | – | – | Globalmente13,0% | ≤3 5 a: 14,3%36-39 a:11,8%≥ 40 a: 13,3% | – | – | La tasa de gestación en FIV-CN permanece por debajo del 15%, precisando nuevas medidas para aumentarla |
| Shaulov et al.19, 2015 | Estudio retrospectivo1.503 ciclos FIV-CNM (782 pacientes)Pacientes estratificados por edad y por reserva ovárica,BRO: criterios de Bolonia | ≤ 35 aBRO: 75,6%RON: 83,3%≥ 36 aBRO: 72,5%RON: 77,1% | ≤ 35 aBRO: 45,3%RON: 41,2%≥ 36 aBRO: 31,3%RON: 46,2% | ≤ 35 aBRO: 13,4%RON: 14,5%≥ 36 aBRO: 1,9%RON: 12,1% | ≤ 35 aBRO: 26,6%RON: 35,0%≥ 36 aBRO: 6,25%RON: 26,2% | – | – | – | FIV-CNM es una opción de tratamiento aceptable particularmente en pacientes ≤ 35 a o ≥ 36 a con reserva ovárica normal |
| González-Foruria et al.20, 2016 | Estudio retrospectivo947 ciclos FIV-CN (320 pacientes)Pacientes estratificadas por edad y por reserva ovárica,BRO: criterios de Bolonia | 64,6%≤ 35 a: 64,3%36-39 a:65,7%≥ 40 a: 61,3%BRO: 65,1%RON: 63,1% | 37,9%≤ 35 a: 39,2%36-39 a: 39,1%≥ 40 a: 32,1%BRO: 38,7%RON: 35% | 10,6%≤ 35 a: 11,4%36-39 a: 11,6%≥ 40 a: 5,9%BRO: 10,6%RON: 10,3% | 27,8%≤ 35 a: 29,2%36-39 a:29,6%≥ 40 a: 18,5%BRO: 27,5%RON: 29,3% | 31,2%≤ 35 a: 31,7%36-39 a: 33,2%≥ 40 a: 22,2%BRO: 33%RON: 26,2% | – | – | La FIV-CNM debe ofrecerse especialmente en pacientes jóvenes independientemente de su reserva ovárica |
| Silber et al.22, 2017 | Estudio retrospectivo14,185 ciclos de FIV-CNM | – | – | – | <35 a: 44,7%35-37 a: 37,4%38-40 a: 29,4%41-42 a: 67,2%> 42 a: 17,8% | – | <35 a: 26%42 a: 4% | – | La fertilidad intrínseca por ovocito en FIV-CNM es superior a la publicada para FIVc, con una TNV del 26% en pacientes de <35 a y del 4% a los 42 a |
| Preaubert et al.23, 2019 | Estudio retrospectivo638 pacientes ≤ 39 a FIV-CNMEstratificadas por valores de AMH (ng/ml)AMH <0,01-0,5: <percentil 25AMH 0,51-2,03: percentil 25-75AMH 2,04-6,56> percentil 7 | AMH <2590,8%AMH 25-7588,7%AMH>7592,9% | AMH <2542,1%AMH 25-7546%AMH> 7543,4% | AMH <2512,8%AMH 25-7515,9%AMH> 7518% | AMH <2530,4%AMH 25-7534,5%AMH>7542% | – | AMH <2511,6%AMH 25-7512,4%AMH> 7517% | – | Las TE y TNV en FIV-CNM no difieren significativamente según la concentración sérica de AMH |
| Wolff et al.49, 2019 | Estudio retrospectivo311 ciclos FIV-CNM (201 pacientes) | – | 65,3% | 21,9%<34 a:26,3%34-37 a: 25,7%38-42 a: 15,7% | – | – | 13,2%<34 a: 22,4%34-37 a: 18,9%38-42 a: 3,9% | – | Factores asociados con el pronóstico: edad y tiempo de esterilidad, Recomiendan la FIV-CNM especialmente en pacientes jóvenes y con una infertilidad de corta duración |
| Estudios en pacientes con baja reserva ovárica | |||||||||
| Kolibianalis et al.25, 2004 | Estudio prospectivoFIV-CNM (32 pacientes)Edad media 38,4±0,7 aBRO: FSH <12 UI/l/FIVc previa <5 ovocitos | 56,4% | 24,4% | 0% | – | – | – | – | La FIV-CNM no es una opción realista en pacientes con niveles elevados de FSH y respuesta previa deficiente a la estimulación ovárica, cuando se ofrece como último recurso antes de la ovodonación |
| Morgia et al.10, 2004 | RCT114 ciclos FIV-CN (59 pacientes)vs.101 ciclos FIVc protocolo AGnRH(70 pacientes)BRO: FIVc previa <3 ovocitos | FIV-CN: 77,2%≤35 a: 67,8%36-39 a:87,5%≥ 40 a: 72,6%FIVc: 82%≤ 35 a: 80,0%36-39 a:96,7%≥ 40 a: 80% | FIV-CN: 41,2%≤ 35 a: 42,8%36-39 a: 41,7%≥ 40 a: 40,3%FIVc: 68,3%≤ 35 a: 65,0%36-39 a: 80,6%≥ 40 a: 62% | FIV-CN: 6,1%≤ 35 a: 14,3%36-39 a:3,9%≥ 40 a: 76,0%FIVc: 3,2%≤ 35 a: 15,0%36-39 a:3,3%≥ 40 a: 6,0% | FIV-CN:14,9%≤ 35 a: 33,3%36-39 a:10,0%≥ 40 a: 8,0%FIVc: 10,1%≤35 a: 23,1%36-39 a:4,0%≥ 40 a: 9,7% | – | – | – | En BRO ambos protocolos mostraron TE por ciclo y por transferencia similares, Las pacientes tratadas con FIV-CN mostraron tasas de implantación estadísticamente superiores, Las pacientes <35 a mostraron mejores resultados |
| Elizur et al.27, 2005 | Estudio retrospectivo540 ciclos (433 pacientes)FIV-CNM (52 ciclos)Edad media 39±5,8 avs.FIVc (protocolo AntGnRH) (200 ciclos) Edad media 38,4±4,7 avs.FIVc (protocolo AGnRH) (288 ciclos)Edad media 38,1±6 aBRO: FIVc previa <4 ovocitos o E2 (hCG) <1.000 pg/ml | FIV-CNM 1,4±0,5aFIVc AntGnRH 2,3±1,1aFIVc AGnRH 2,5±1,1a | – | FIV-CNM: 9,6%FIVc AntGnRH: 8,5%FIVc AGnRH:8,6% | FIV-CNM: 14,3%FIVc AntGnRH: 10,2%FIVcAGnRH:10,6% | – | – | – | La FIV-CNM suplementada con AntGnRH es una alternativa factible a la estimulación ovárica en pacientes con BRO |
| Kim et al.28, 2009 | RCT45 ciclos FIV-CNMvs.45 ciclos FIVc protocolo AntGnRHBRO: FIVc previa <3 ovocitos | FIV-CNM:91,1%FIVc:95,6% | FIV-CNM: 82,2%FIVc:93,3% | FIV-CNM: 13,3%FIVc:17,8% | – | FIV-CNM: 16,2%FIVc:19% | – | FIV-CNM: 13,5%FIVc:16,7% | La FIV-CNM proporciona TE similares a FIVc con menor dosis de FSH y puede ser una alternativa como último recurso antes de recurrir a ovodonación en pacientes con BRO |
| Schimberni et al.29, 2009 | Estudio retrospectivo500 ciclos FIV-CN (294 pacientes)BRO: cancelación de FIVc previa | 78,1%≤ 35 a: 81,9%36-39 a:81,4%≥ 40 a: 76% | 57%≤ 35 a: 61,8%36-39 a: 56,1%≥ 40 a: 55,4% | 9,8%≤ 35 a: 18,1%36-39 a:11,7%≥ 40 a: 5,8% | 17,1%≤ 35 a: 29,2%36-39 a:20,6%≥ 40 a: 10,5% | 16,7%≤ 35 a: 31,7%36-39 a:20,3%≥ 40 a: 9,7% | 8,2% | – | En pacientes con BRO la FIV-CN es un tratamiento aceptable sobre todo en mujeres jóvenes |
| Polyzos et al.9, 2012 | Estudio retrospectivo469 ciclos FIV-CN (164 pacientes)BRO: criterios de Bolonia | BRO: 75%≤ 35 a: 77,9%36-39 a:73,2%≥ 40 a: 73%RON: 78% | BRO: 42%≤ 35 a: 47,5%36-39 a: 43,5%≥ 40 a: 33%RON: 59% | BRO: 4,6%≤ 35 a: 4,9%36-39 a:5,3%≥ 40 a: 3%RON: 5,2% | – | BRO: 12,5%≤ 35 a: 13,1%36-39 a: 16,7%≥ 40 a: 8,8%RON: 35,7% | BRO: 2,6%≤ 35 a: 2,5%36-39 a:2,4%≥ 40 a: 3%RON: 8,9% | BRO: 7,4%≤ 35 a: 7,9%36-39 a:7,4%≥ 40 a: 6,8%RON: 25% | La FIV-CN es un tratamiento prometedor en pacientes jóvenes con RON, pero con un potencial limitado en pacientes con BRO según criterios de Bolonia independientemente de la edad |
| Kedem et al.30, 2014 | Estudio retrospectivo111 pacientesFIV-CNMvs.FIVcEdad media 39±4 aBRO: Criterios de Bolonia/FIVc previa <3 ovocitos | FIV-CNM:61,2%FIVc:92,8% | FIV-CNM: 53%FIVc:85% | FIV-CNM: 0,9%FIVc:0% | – | – | FIV-CNM: 0,9%FIVc:0% | – | La FIV-CNM no aporta beneficio en pacientes con BRO y debe considerarse seriamente la ovodonación en dichos casos |
| Lainas et al.31,2015 | Estudio retrospectivo161 ciclos FIV-CNM (106 pacientes)vs.164 ciclos FIVc protocolo AntGnRH (236 pacientes)BRO: criterios de Bolonia | FIV-CN:83,9%FIVc:92,7% | FIV-CN: 48,4%FIVc:60% | FIV-CN:8,7%FIVc:9,1% | – | – | FIV-CN:7,5%FIVc:3,1% | – | Ambas técnicas presentan TNV bajas en pacientes con BRO, siendo estas superiores en FIV-CN respecto FIVc |
| Drakopoulos et al.12, 2019 | Estudio de cohortes retrospectivoFIV-CNM (189 pacientes)vs.FIVc protocolo AntGnRH(287 pacientes)Edad ≥ 40 aBRO: criterios de Bolonia | – | FIV-CNM: 45%FIVc:75% | – | – | FIV-CNM: 4,8%FIVc:17,4% | – | FIV-CNM:1,6%FIVc:8% | La FIV-CNM podría ser una alternativa en pacientes con BRO de edad avanzada de difícil tratamiento |
a: años; AGnRH: agonista de la GnRH; AMH: anti-Müllerian hormone; AntGnRH: antagonista de la GnRH; BRO: baja reserva ovárica; CC: citrato de clomifeno; E2: estradiol; FIV-CN: fecundación in vitro en ciclo natural; FIV-CNM: fecundación in vitro en ciclo natural modificado; FIVc: fecundación in vitro convencional; FSH: follicle-stimulating hormone; hCG: human chorionic gonadotropin; IA-HOC: inseminación artificial con hiperestimulación ovárica controlada; Mild-IVF: in vitro fertilization; RCT: randomized controlled trial; RON: reserva ovárica normal; SART: Society for Assisted Reproductive Technology; SET: single embryo transfer; TE: tasa de embarazo; TNV: tasa de nacido vivo; TRO: tasa de recuperación ovocitaria; TT: tasa de transferencia; vs.: versus.
Es fundamental destacar que el pronóstico de la FIV-CN viene condicionado por la edad de la paciente y no por otros factores como los marcadores de reserva ovárica o la causa de esterilidad1,8. En este sentido, las pacientes de mayor edad que conservan una reserva ovárica aceptable se benefician más de la FIVc que de la FIV-CN, ya que la última no permite disponer de varios embriones simultáneamente para la selección embrionaria, mientras que la FIV-CN constituye una excelente alternativa a FIVc en las pacientes jóvenes con baja reserva ovárica que conservan ciclos regulares1.
Pacientes con baja reserva ováricaLas pacientes con baja reserva ovárica presentan un peor pronóstico en los ciclos de FIVc, en los que el número de ovocitos recuperados es un factor pronóstico importante. Estas pacientes podrían ser buenas candidatas para FIV-CN, aunque existe controversia sobre ello. Los estudios publicados sobre FIV-CN en pacientes con baja reserva ovárica presentan metodologías diferentes y resultados contradictorios, reportando resultados desde pésimos69 hasta resultados alentadores, con tasas de nacido vivo por paciente del 13,5%28. Entre otras limitaciones, señalar que la mayor parte de estudios son retrospectivos, no todos se han basado en la definición de baja reserva ovárica según los criterios de Bolonia y la mayor parte de ellos no aporta resultados sobre la tasa de nacido vivo70. La metodología y los resultados principales de estos estudios se detallan en un apartado específico en las tablas 18,9,11-32,69,71,72 y 28,9,11-20,22-32,58,69,71,72.
Los estudios que han comparado FIV-CN entre pacientes con reserva ovárica baja y normal no han observado diferencias en los resultados19,20, aunque en una investigación se observaron mejores resultados en las pacientes normorrespondedoras en el grupo de edad superior a 35 años19. En otro estudio en el que no se utilizó estimulación ovárica ni antGnRH se observó peor pronóstico en las pacientes con baja reserva ovárica en todas las franjas de edad, con una tasa de nacido vivo por paciente del 7,4% comparado con un 25% en pacientes con reserva ovárica normal9.
Otras investigaciones han comparado los resultados de FIV-CN con FIVc. En 2estudios prospectivos aleatorizados se objetivaron resultados similares en ambos grupos con una tasa de nacido vivo acumulada por paciente del 13,5% en FIV-CN frente al 16,7% en FIVc28, aunque la tasa de implantación fue superior en FIV-CN (14,9% frente al 5,5%), de forma significativa en uno de ellos10. Otros análisis comparativos entre FIV-CN y FIVc reportan resultados similares entre ambas técnicas27,32, por lo que sus autores postulan que la FIV-CN constituye una alternativa razonable en estas pacientes por su carácter menos invasivo. Otro análisis comparativo entre FIV-CN y FIVc objetivó una tasa de nacido vivo por ciclo muy superior en FIV-CN (7,5% frente al 3,1%) pese a que este tratamiento se asoció a un menor número de ovocitos y de embriones disponibles31. No obstante, exceptuando los 2estudios aleatorizados, el resto de los estudios comparativos son retrospectivos27,31,32 o la FIV-CN se modificó con la administración de gonadotropinas27,28,31,32.
En general, la mayor parte de autores de estas investigaciones señala que la FIV-CN constituye una estrategia a considerar en pacientes con baja reserva ovárica, que presentan un mal pronóstico en cualquier estrategia de FIV y en las que la FIV-CN podría suponer un tratamiento menos invasivo que la FIVc. No obstante, la edad de la mujer es el principal parámetro pronóstico y la FIV-CN presenta mejores resultados en las pacientes por debajo de los 37 años, en las que la efectividad el tratamiento depende en menor medida de la selección embrionaria20,24, aunque también se han reportado resultados aceptables hasta la edad de 40 años, con tasas de embarazo por ciclo similares entre el grupo de menos de 35 años y el de 36 a 39 años (11,4% y 11,6%, respectivamente)20.
Resultados perinatalesLas gestaciones obtenidas mediante FIVc presentan un mayor riesgo de complicaciones perinatales en comparación con las gestaciones espontáneas. Se han propuesto varios mecanismos o factores que podrían explicarlo: la propia infertilidad de la pareja, las técnicas de laboratorio y de cultivo embrionario o el potencial impacto de la estimulación ovárica tanto sobre la calidad del ovocito como en la receptividad del endometrio para la implantación embrionaria68,70. Por tanto, las gestaciones conseguidas por FIV-CN podrían presentar mejores resultados perinatales respecto a FIVc, al no incorporar (o minimizar) este último elemento, la estimulación ovárica.
Algunos estudios que han comparado los resultados perinatales de FIVc con FIV-CN han objetivado un menor peso medio de los recién nacidos71,72 y un mayor riesgo de pequeño para edad gestacional en FIVc respecto FIV-CN, aunque otros trabajos no han podido confirmar estos hallazgos70,73. Finalmente, un metaanálisis que comparó los resultados perinatales entre FIVc y FIV-CN observó un mayor riesgo de parto pretérmino y de bajo peso al nacimiento en FIVc68. No obstante, el número de estudios publicados en este ámbito es limitado y es necesario seguir investigando sobre el potencial impacto de la estimulación ovárica sobre los resultados maternofetales en las gestaciones procedentes de FIV para establecer el perfil de seguridad de estas técnicas.
FIV-CN: balance de ventajas e inconvenientes respecto a la FIVcFIV-CN y FIVc son 2estrategias de tratamiento que pueden ser comparadas solo hasta cierto límite. Deberían ser considerados tratamientos complementarios, que permiten ampliar el espectro de estrategias disponibles para las parejas con indicación de FIV y ofrecer una atención más individualizada y orientada al paciente1. Deben considerarse las ventajas y los inconvenientes de ambas técnicas, y tomar una decisión fundamentada en la evidencia disponible y que esté en consonancia con las expectativas a la pareja.
La FIV-CN presenta ventajas e inconvenientes respecto a FIVc que debemos considerar para seleccionar adecuadamente a las parejas candidatas (tabla 3). Puede ser una opción preferente en pacientes que no deseen recibir tratamiento hormonal o bien que presenten una contraindicación médica para su uso. También es una alternativa para aquellas pacientes que han presentado una baja respuesta a la estimulación ovárica controlada, especialmente en pacientes jóvenes.
Ventajas e inconvenientes de la FIV-CN respecto FIVc
| Ventajas | Inconvenientes |
|---|---|
| Mayor tasa de implantaciónReducción del riesgo de gestación múltipleMejores resultados perinatalesReducción del riesgo de SHOPosibilidad de ciclos consecutivos cada mesNo requiere inyecciones diariasPosibilidad de punción folicular sin anestesiaNo necesidad de soporte en fase lúteaMenor coste económicoMenor percepción de estrés | Elevada tasa de cancelaciónMenor tasa de embarazo por cicloNecesidad de 2-3 ciclos para una tasa de éxito comparableTiempo medio para conseguir gestación superiorHabitualmente disponibilidad de un solo embriónRequiere mayor flexibilidad tanto de la pareja como por parte del centroNo posibilidad de selección embrionaria |
FIV-CN: fecundación in vitro en ciclo natural; FIVc: fecundación in vitro convencional; SHO: síndrome de hiperestimulación ovárica.
Otro aspecto a considerar es el factor temporal: se ha calculado que el tiempo medio para conseguir una gestación mediante FIV-CN sería un 30% más largo que con FIVc40. Otros autores han calculado que son necesarios 2,9 ciclos de FIV-CN para obtener un nacido vivo por gestación única en comparación con FIVc71. No obstante, con base en los resultados de uno de los grupos de referencia en FIV-CN, el coste económico por gestación sería un 15% menor para FIV-CN en comparación con FIVc1.
En cuanto al aspecto psicológico, la FIVc causa un importante estrés sobre la pareja, que puede condicionar una interrupción prematura del tratamiento. Haemmerli Keller et al. compararon el estrés psicológico tras FIVc respecto a 3 o más ciclos de FIV-CN y observó que estas últimas mostraban niveles inferiores de depresión y mayor satisfacción con el tratamiento72.
ConclusionesLa FIV-CN ha acompañado a los especialistas en reproducción desde sus inicios y en los últimos años se ha observado un aumento de interés por esta técnica y un incremento en la demanda por parte de las parejas con problemas reproductivos. Esto ha sido en gran parte porque se han puesto en valor muchas de sus ventajas y, a su vez, se han introducido estrategias para mejorar sus resultados. Existen cada vez más parejas interesadas en minimizar su tratamiento hormonal y reducir los riesgos de la FIVc.
Aunque las tasas de gestación por ciclo de la FIV-CN son inferiores a la FIVc, las estrategias para reducir la tasa de ovulación prematura han permitido incrementar los ciclos con transferencia. La tasa de implantación de FIV-CN es superior a la de FIVc y los resultados perinatales también podrían ser más favorables.
Existen múltiples estudios sobre FIV-CN, pero algunas publicaciones cuentan con más de 10 años, otras presentan limitaciones metodológicas en su diseño o bien proceden de series con bajo número de pacientes, en ocasiones con distintos perfiles clínicos y, en general, presentan diferencias en los protocolos de tratamiento utilizados. Por tanto, existe una gran heterogeneidad entre las publicaciones disponibles y en la calidad de las mismas: gran parte de los estudios publicados presentan un nivel de evidencia 3 y 4, pero se han publicado estudios aleatorizados10,15,16,28,69,71,72 con nivel de evidencia 2 y una revisión sistemática de estudios aleatorizados con nivel 111 (niveles de evidencia según OCEBM74). La gran variabilidad entre estudios dificulta proporcionar datos concretos sobre la efectividad de la técnica y, por este motivo, en la presente revisión adjuntamos información exhaustiva en las tablas, detallando la metodología y los resultados de las diferentes publicaciones.
La edad es el principal factor pronóstico20,24, por lo que la mejor candidata para este tratamiento es la paciente por debajo de los 37 años, aunque los resultados son aceptables en mujeres de menos de 40 años. La FIV-CN es una estrategia a considerar en la paciente con mal pronóstico para FIVc por baja reserva ovárica y, aunque existe controversia en la literatura sobre los resultados de la FIV-CN en estas pacientes, su carácter menos invasivo constituye una gran ventaja en esta situación clínica desfavorable.
Por último, la FIV-CN requiere un conocimiento específico de la técnica y mayor individualización entre pacientes e incluso entre ciclos respecto a los protocolos de FIVc, usados de forma homogénea y consistente en gran número de pacientes. Debe existir mayor flexibilidad en la programación de controles foliculares y procedimientos para evitar la manipulación del ciclo y los centros requieren ciertas adaptaciones logísticas. Las parejas deben conocer los objetivos del tratamiento con FIV-CN, sus expectativas ante cada etapa del ciclo y las diferencias respecto a la FIVc que a menudo ya han realizado previamente. FIV-CN y FIVc son tratamientos complementarios y establecer comparaciones entre ellos es complejo. Estos aspectos son fundamentales para ofrecer el máximo rendimiento de la técnica con el mínimo impacto para las parejas, lo que supone conseguir el óptimo balance entre las ventajas e inconvenientes inherentes a la FIV-CN.
FinanciaciónLos autores declaran no tener financiación.
Responsabilidades éticasProtección de personas y animales.Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos.Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado.Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses, así como la ausencia de financiación para la realización de esta revisión.