El paludismo o malaria es la enfermedad infecciosa vectorial más prevalente del mundo. En España se diagnostican más de 200 casos anuales en los hospitales.
Material y métodoReportamos un caso clínico-patológico de una infectación placentaria de una gestante de origen guineano.
ResultadosLa presencia de signos de intervellositis crónica con presencia de hematíes nucleados por la presencia de pigmento malárico son los signos característicos de esta afección.
ConclusionesLa necesidad de pensar en este proceso infeccioso parasitario, a menudo olvidado, resalta el hecho de que la pieza placentaria puede ser definitiva para el diagnóstico del proceso. El aumento del fenómeno inmigratorio es posible que eleve la aparición de estos casos, considerados hasta ahora como muy inusuales en nuestro medio.
Malaria is the most prevalent vector-borne disease in the world. In Spain, more than 200 cases are diagnosed annually in hospitals.
Material and methodsWe report a case of placental infestation in a pregnant woman from Guinea.
ResultsThe hallmarks of this entity are signs of chronic intervillositis with nucleated red blood cells and the presence of malaria pigment.
ConclusionsMalaria is often overlooked in the diagnostic process. The placenta may be definitive in establishing this diagnosis. The rise in immigration may lead to an increase in malaria cases, which to date have been considered uncommon in our setting.
El paludismo o malaria es la enfermedad infecciosa vectorial más prevalente del mundo, afectando al 40-60% de la población mundial. Se estima que se producen entre 300 y 500 millones de nuevos casos clínicos/año, causando más de 2 millones de muertes, de las cuales el 95% se producen en el África subsahariana1. Se trata, por lo tanto, de un grave problema mundial de salud pública, de alta incidencia, prevalencia y mortalidad en gran parte del mundo, y que presenta un difícil control dadas las condiciones de subdesarrollo de los países endémicos, así como el incremento de la resistencia al tratamiento antipalúdico2. Todo ello, pese a que se trata de una enfermedad teóricamente de fácil tratamiento si se diagnostica de forma temprana.
Los datos del informe mundial de paludismo de 20113 demuestran que cada vez se consiguen más avances significativos y sostenibles en la lucha contra uno de los mayores problemas de salud pública. La tasa de mortalidad en el paludismo ha descendido en más del 25% en el mundo entero desde el 2000 y en un 33% en la región del África. Gracias a un nuevo incremento en la cobertura de los países en riesgo a través de medidas de prevención y control de la enfermedad, se ha reducido la incidencia y mortalidad de la misma.
La malaria es una infección causada por protozoos intracelulares del género Plasmodium. La enfermedad la transmite la hembra del mosquito del género Anopheles. Hay 4 especies de Plasmodium que afectan al hombre: P. vivax, P. falciparum, P. malariae, P. ovale. El ciclo evolutivo del plasmodium comprende 2 fases: la fase asexual en el hombre y la fase sexual en el mosquito anófeles.
Los parásitos son introducidos a través de la picadura del mosquito en la sangre en forma de esporozoitos, alcanzan el hígado y penetran en las células hepáticas, donde se dividen y producen miles de merozoitos. Después de 8 días, los merozoitos son liberados a la sangre y penetran en los hematíes, iniciándose la enfermedad clínica. En los hematíes, los parásitos crecen hasta convertirse en parásitos semiadultos y, después, se dividen en un número determinado de merozoitos, provocando la destrucción de los hematíes y la liberación de parásitos jóvenes.
La malaria no se trasmite por la sangre, ni de mosquito a mosquito, ni de persona a persona, salvo de embarazadas a fetos4. Tiene que suceder que un mosquito que haya picado a alguien infectado con el parásito lo inocule luego a una persona sana. Los anófeles no viven más de 20 días y el parásito debe completar un ciclo de unos 15 días en el insecto para volverse infeccioso, por lo que la extensión de la enfermedad requiere de una importante población de anófeles.
El P. falciparum es el más lesivo, porque invade todos los hematíes, maduros e inmaduros, a diferencia del P. vivax y P. ovale que solo invaden hematíes inmaduros y del P. malariae que solo invade hematíes viejos. En zonas de alta endemnicidad de malaria, el P. falciparum está implicado hasta en el 80% de los casos de malaria gestacional. En zonas donde el P. vivax es prevalente, hasta el 40% de los casos de malaria en embarazadas son producidos por P. falciparum.
En España, la malaria fue erradicada en 19645. Eso no significa que en los hospitales no se trate la enfermedad. Se diagnostican unos 200 casos anuales importados en españoles que viajan al extranjero o en inmigrantes que la contraen en sus países.
Un medio para contener la emergencia del paludismo consiste en proporcionar pruebas diagnósticas a todos los pacientes con sospecha clínica6. Queda mucho camino por recorrer, pero mejorando la calidad diagnóstica y terapéutica, junto con las medidas educativas, higiénicas y preventivas, contribuiremos a la erradicación de la enfermedad. Nosotros reportamos un caso de infección placentaria por P. falciparum, confirmado tras estudios microbiológicos.
Material y métodoCaso clínico-patológico: Mujer de 29 años de edad, de raza negra, gestante a término, nacida en Guinea Ecuatorial, residente como emigrante en España desde hace varios años. Antecedentes previos de 2 gestaciones (2G1P, 0A), con marcada anemia durante el curso de la gestación actual. La paciente refiere haber efectuado un viaje de corta estancia a su país de procedencia, a las 32 semanas del embarazo, habiendo presentando, durante su estancia en Guinea, clínica de infección palúdica. En el momento actual presenta pruebas parasitológicas con antígeno de Plasmodium positivo, serología VIH negativa y VHB-AgS negativa. En parto espontáneo por vía vaginal, nace un recién nacido de sexo masculino, prematuro ponderal, que presenta al nacimiento un peso de 2.180 g (percentil 10-25) sin malformaciones externas evidentes, siendo su cariotipo normal. La relación ponderal feto/placentaria es de 4,3 (valores normales: 5,87-6,01 en zona urbana y rural respectivamente). La observación posnatal de la sangre del cordón mediante gota gruesa es negativa, así como la determinación de anticuerpo antiplasmodium. Se remite al Servicio de Anatomía Patológica la placenta obtenida tras alumbramiento mediante extracción manual.
En el Servicio de Anatomía Patológica se recibió una placenta que tras fijación y formol pesó 490g y midió 12 × 3 cm. Llevaba consigo cordón umbilical de inserción central que medía 6,5 × 1cm y tenía 3 estructuras vasculares. Las membranas eran de inserción marginal y de color normal (fig. 1 A y B). Se realizó estudio de hematoxilina/eosina del parénquima placentario, cordón umbilical y membranas amnióticas, así como posteriormente estudio de microscopia electrónica de una muestra del parénquima placentario.
A) Imagen macroscópica de placenta corioamniótica (de 500 g de peso y de 12 × 9 × 3 cm) junto a membranas placentarias y porción de cordón umbilical (10X).
B) Frotis de sangre obtenida por impronta directa de la pulpa placentaria (tinción Papanicolaou). Presencia de pigmento intraeritrocitario, que adopta un carácter de birrefringencia a la observación con luz polarizada (4X).
El diagnóstico anatomopatológico emitido fue de tejido placentario con signos de intervellositis crónica y abundantes hematíes con pigmento malárico, compatible con infectación por malaria.
DiscusiónLa malaria gestacional se define por la presencia de Plasmodium en sangre periférica materna o por el hallazgo del parásito en la placenta7. Esto hace necesario el análisis de sangre periférica y placenta para configurar un caso de malaria gestacional. La aparición de estas formas de malaria en nuestro país generalmente está ligada a la llegada de pacientes embarazadas emigrantes sin control clínico ni tratamiento previo o, como en el caso que nos ocupa, coincidiendo con un viaje de retorno de una zona endémica8,9. La placenta de las primigestantes está inmunológicamente virgen al parásito, por lo que tienen una mayor morbilidad a la infección y un mayor riesgo de aborto, de bajo peso al nacer, de prematuridad e, incluso, de muerte fetal intrauterina. La infección constante cursa con anemia marcada gestacional10–12.
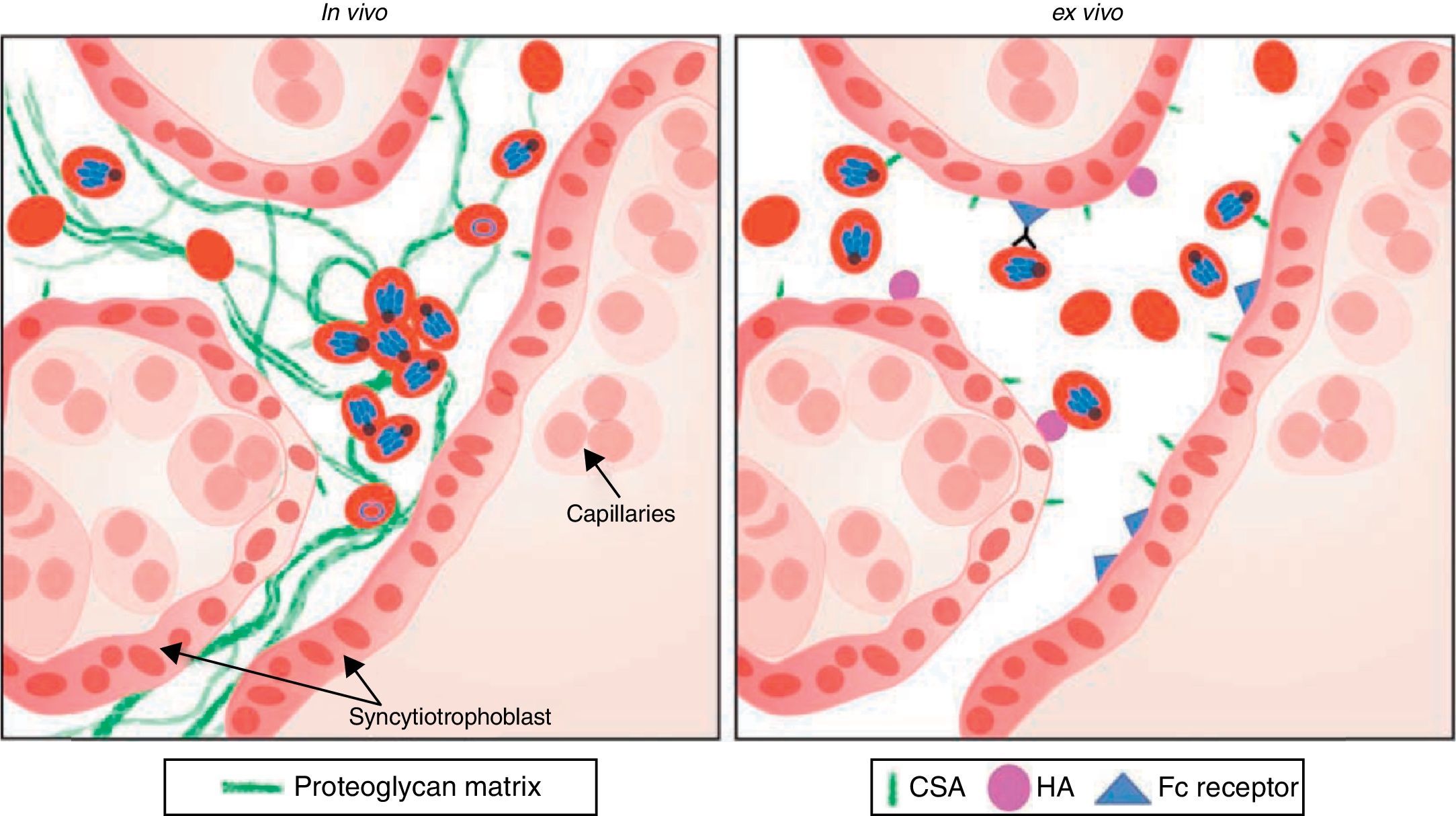
El secuestro de eritrocitos infectados en el espacio intervelloso revela procesos de citoadhesión a nivel placentario (fig. 2). La presencia exclusiva en la placenta de receptores, como el condroitín sulfato A (CSA) para ligandos de adhesión del parásito, hace a la gestante más susceptible de presentar enfermedad.
Esquema de representación de evento de citoadhesión de los eritrocitos infectados por el plasmodium en la placenta19–21.
Está demostrado que los eritrocitos infectados por el parásito se adhieren directamente a la superficie del sincitiotrofoblasto a través de la presencia de los receptores (CSA), produciendo una matriz extracelular de proteoglicano16,17. No obstante, existe controversia al respecto al constatar bajos niveles de condroitín sulfato a nivel de esta matriz. Se ha descrito además la presencia de estos receptores en el endotelio de las células del pulmón en humano18 y en el cerebro de pacientes fallecidos por malaria cerebral19.
El caso reportado en nuestro artículo es el de una gestante inmigrante que contrajo la enfermedad en un viaje a su país (Guinea) y que, en estudio histológico realizado en el Servicio de Anatomía, revela un tejido placentario en cuya cara materna muestra vellosidades coriales hidrópicas con cambios isquémicos en el sincitiotrofoblasto, engrosamiento de la lámina basal del trofoblasto y abundantes glóbulos rojos secuestrados en el espacio del sincitiotrofoblasto. Estos hematíes estaban rellenos de pequeños gránulos de un pigmento muy hipercromático que también se ve en forma libre en dicho espacio, en el trofoblasto y en el estroma placentario (fig. 3 A y B)13–15. También hay acúmulos de macrófagos e histiocitos en los espacios intervellosos, así como depósitos fibrinoides.
A y B) Técnica de hematoxilina/eosina de vellosidades coriales con cambios hidrópicos vellositarios y presencia de eritrocitos con signos de parasitación y pigmento malárico. Existen depósitos de material fibrinosos con ocasional presencia de elementos inflamatorios crónicos (intervellositis crónica) (A [20X] y B [40X]).
Es de destacar que estos cambios no se encuentran en la cara fetal. El cordón umbilical y las membranas corioamnióticas no muestran cambios relevantes.
El estudio de microscopia electrónica evidencia la presencia del parásito en los hematíes del espacio intervelloso y la presencia de material amorfo, electrodenso, compuesto por sialomucina en la interface materno-fetal (fig. 4 A y B), como lo descrito por Alkhalil et al.22 El diagnóstico fue confirmado por estudios microbiológicos al detectar un 2% de infectación parasitaria en sangre materna por P. falciparum y P. vivax.
Pensar en este proceso infeccioso parasitario, a menudo olvidado, resalta el hecho de que la pieza placentaria puede ser definitiva para el diagnóstico del proceso. El aumento del fenómeno inmigratorio es posible que aumente la aparición de estos casos, considerados hasta ahora como muy inusuales en nuestro medio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.











![A y B) Técnica de hematoxilina/eosina de vellosidades coriales con cambios hidrópicos vellositarios y presencia de eritrocitos con signos de parasitación y pigmento malárico. Existen depósitos de material fibrinosos con ocasional presencia de elementos inflamatorios crónicos (intervellositis crónica) (A [20X] y B [40X]). A y B) Técnica de hematoxilina/eosina de vellosidades coriales con cambios hidrópicos vellositarios y presencia de eritrocitos con signos de parasitación y pigmento malárico. Existen depósitos de material fibrinosos con ocasional presencia de elementos inflamatorios crónicos (intervellositis crónica) (A [20X] y B [40X]).](https://static.elsevier.es/multimedia/0210573X/0000004200000002/v2_201503280205/S0210573X13001056/v2_201503280205/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

