INTRODUCCION
La leptina fue descubierta en el año 19941. Esta proteína, producida por el gen ob en las células adiposas, pertenece a las citocinas y desempeña un importante papel en la regulación de la saciedad y del balance energético por medio de vías adipo-hipotálamo-hipofisarias. La leptina interviene igualmente en el desencadenamiento de la pubertad2 y la reproducción3. Los ratones ob/ob deficientes en leptina son obesos y estériles. La administración de leptina exógena a estos ratones normaliza su peso y restaura su fertilidad4. Por el contrario, la leptina no parece indispensable en el mantenimiento del embarazo.
LEPTINA Y EJE CEREBRO-INTESTINO-TEJIDO ADIPOSO
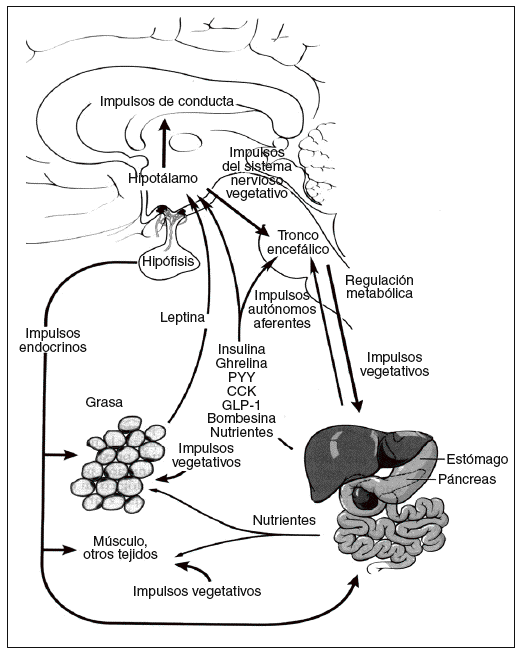
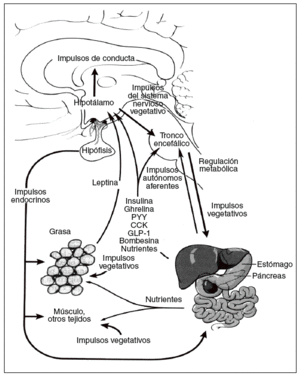
La energía «de reserva a largo plazo» almacenada en forma de grasa en el tejido adiposo se mantiene homeostáticamente por un sistema hipotalámico denominado hipostato o adipostato5. Los impulsos que llegan a este sistema son numerosos, incluidas señales hormonales, nutricionales y vagales agudas de las sensaciones de hambre y saciedad, las señales de energía, de las reservas a largo plazo, procedentes de la leptina del tejido adiposo y de las potentes señales olfatorias, visuales, emocionales y cognitivas procedentes de los centros cerebrales superiores. Entre los impulsos de salida destacan los dirigidos tanto a la ingesta de energía, especialmente los determinados por la conducta de alimentación, como al gasto de energía procedente del metabolismo basal, la actividad voluntaria e involuntaria y la termogénesis inducida por la dieta. Por lo tanto, la homeostasis de la energía se mantiene a través de un complicado eje (hipotálamo- tronco encefálico-órgano diana) conocido como eje cerebro-intestino-tejido adiposo (fig. 1)6.
Fig. 1. Regulación de la homeostasis de la energía por el eje cerebro-intestino-adiposo6. CCK: colecistocinina; GLP-1: péptido tipo glucagón; PYY: péptido YY.
La regulación del metabolismo y la conducta de la alimentación están determinados por los mecanismos de control a corto y largo plazo. El control a corto plazo implica el inicio y la finalización de las comidas. Un principal factor determinante de la cantidad de alimento ingerida es la percepción de la sensación de saciedad, que se produce durante la ingestión, por impulsos nerviosos, endocrinos y nutricionales. Por ejemplo, la distensión intestinal y la liberación de péptidos gastrointestinales como la colecistocinina llevan a finalizar la ingesta. Los valores plasmáticos de ghrelina, un péptido orexígeno, presentan un claro aumento preprandial y una disminución posprandial, lo que iría a favor de un posible factor fisiológico en el ser humano para iniciar la comida7. Las señales que a largo plazo reflejan los depósitos energéticos globales del organismo, como la leptina, derivada de los adipocitos, actúan como señal al sistema nervioso central (SNC) para que se produzcan cambios en la conducta relacionada con la alimentación y el gasto de energía. Todos estos factores, tanto a corto como a largo plazo, son coordinados por el eje cerebro-intestino-tejido adiposo para responder a los cambios de la homeostasis de la energía (fig. 1)6.
Bioquímica y evolución de la leptina
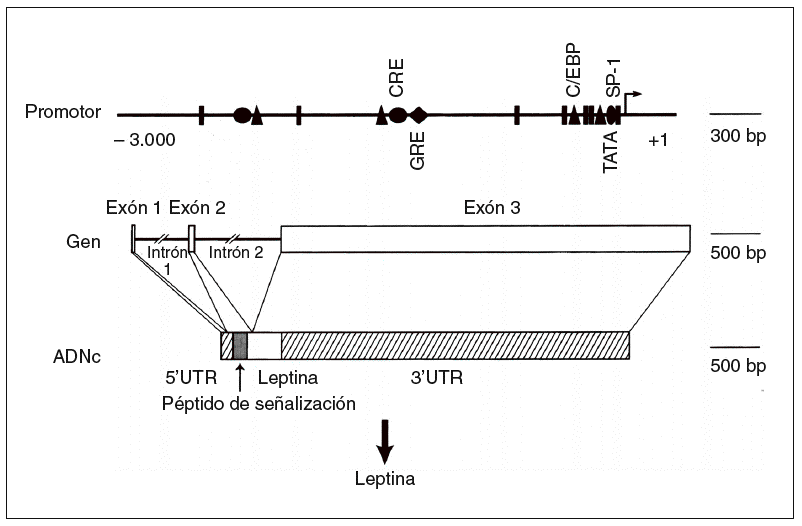
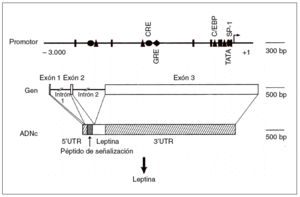
Un avance significativo en la comprensión de la homeostasis de la energía en el ser humano fue la identificación de la base de los síndromes de obesidad monogénicos descritos en los ratones ob/ob y db/ db8,9. Los experimentos de parabiosis, en que se realizaba una «fusión» quirúrgica de ratones para permitir la transferencia de moléculas de uno a otro, permitió hace 30 años establecer la hipótesis de que los ratones ob/ob y db/db presentaban un déficit en su receptor afín. En 1994 se consiguió la clonación del gen ob, que codifica a un solo miembro de la familia de citocinas denominado actualmente leptina (del griego leptos, que significa delgado [fig. 2])6. La proteína leptina ha mostrado recientemente un carácter conservador en la línea evolutiva, como lo demuestra que la leptina humana y la del ratón presenten una homología del 84%.
Fig. 2. Estructura del gen de la leptina humana6. ADNc: ácido deso xirribonucleico complementario; UTR: región sin traslación; triángulo: CCAAT/enhancer binding protein (C/EBP); círculo: elemento de respuesta del AMP cíclico (CRE); rombo: elemento de respuesta glucocorticoidea (GRE).
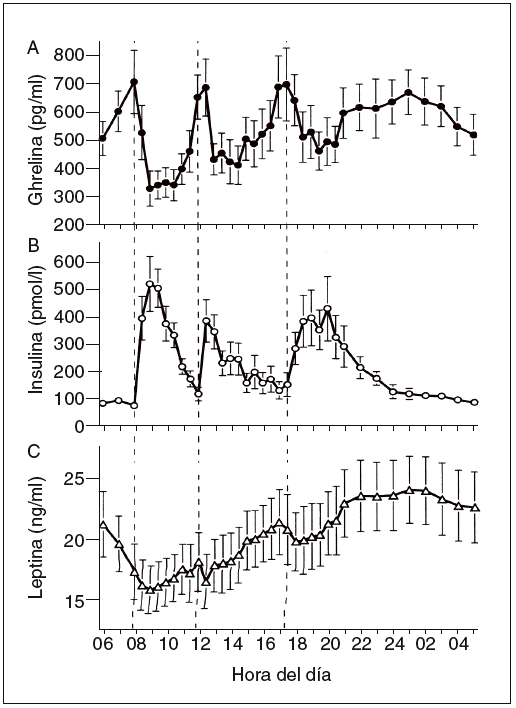
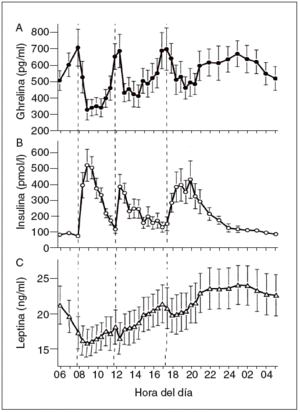
Hasta ahora la leptina se ha encontrado en los pájaros, pero no en los peces ni en los anfibios. Esta proteína está formada por 167 aminoácidos, tiene una masa de 16 kDa y circula por la sangre a unas concentraciones proporcionales con la cantidad de los depósitos de grasa. En la sangre, la leptina circula tanto en forma de proteína libre como en una isoforma soluble de su receptor (Ob-Re). Su secreción es de tipo pulsátil y muestra un ritmo con un máximo nocturno (entre la 1 y las 2 de la mañana) y un mínimo al mediodía (fig. 3)7,10. La leptina es segregada principalmente por los adipocitos. Sin embargo, también existen valores menores de expresión regulada de leptina en el músculo esquelético11, la placenta y el estómago.
Fig. 3. Concentraciones plasmáticas medias de ghrelina, insulina y lep-tina durante un período de 24 h durante el desayuno (B), la comida (L) y la cena (D) a las horas indicadas (a las 8.00, las 12.00 y las 17.30, respectivamente7.
Como hemos dicho, los adipocitos producen la leptina y la segregan al torrente sanguíneo. La leptina tiene efectos pleiotrópicos en la ingesta de alimentos, la regulación neuroendocrina hipotalámica, la función reproductora y el gasto energético12,13. Existe una relación directa entre las concentraciones plasmáticas de leptina y el índice de masa corporal (IMC) o el porcentaje de grasa corporal14. Sin embargo, puede observarse una considerable variabilidad en las concentraciones de leptina en las personas con el mismo IMC, lo que sugiere que la producción de leptina también está regulada por otros factores diferentes de la propia masa del tejido adiposo.
Los valores de leptina disminuyen rápidamente en las primeras 12 h de iniciado el ayuno. Por el contrario, aumentan como respuesta a la sobrealimentación15. Por este motivo las concentraciones plasmáticas de leptina reflejan la masa de tejido adiposo y están influidas por el balance energético. Con esta perspectiva, la leptina es una señal bidireccional que varía según la regulación fisiológica entre los estados de ayuno e ingesta. Las concentraciones plasmáticas de leptina aumentan con el incremento de la masa grasa y disminuyen rápidamente durante la fase inicial del ayuno. En el momento actual, la importancia relativa de los efectos periféricos frente a los efectos centrales de la leptina permanece todavía por dirimir16,17.
Efectos de la leptina en el hipotálamo y los ejes neuroendocrinos
La disminución de las concentraciones de leptina que se produce a consecuencia de una pérdida de masa adiposa, como en la anorexia nerviosa, la pérdida de peso causada por la dieta o el ejercicio físico o en el ayuno, es fundamental para la adaptación del metabolismo a un balance energético negativo. Esta adaptación metabólica incluye una disminución del metabolismo basal que permita una ampliación de los períodos de supervivencia, la inhibición de los ejes reproductor, de la GH y del tiroides18 y, al menos en los roedores, una inhibición de la actividad del sistema nervioso simpático19,20, y la activación del eje hipotálamo-hipófisis-suprarrenal.
Además, la leptina es también una señal esencial para el inicio de la pubertad. La leptina es una señal procedente del tejido adiposo y dirigida al SNC que transmite la disposición del organismo a entrar en la pubertad6. En las fases iniciales de la pubertad se pierde gradualmente la sensibilidad a la inhibición de los esteroides, lo que da lugar a la reactivación de la secreción de hormona liberadora de gonadotropina (GnRH). La leptina es una hormona producida por los adipocitos que puede desempeñar un papel de tipo permisivo en este proceso, dado que las personas con un déficit de leptina no llegan a desarrollar la pu bertad21.
La leptina es esencial para la fertilidad de los adultos. Presumiblemente, la señal de la leptina es un mecanismo mediante el cual el organismo determina si existen unos depósitos de energía adecuados para mantener una gestación hasta el final. Por ejemplo, la administración de leptina devolvió la fertilidad a ratones ob/ob22 y en ratas y en ratones hembras previno el retraso de la ovulación inducido por el ayuno18,23. Además, en los animales alimentados con una dieta ad limitum, la leptina no avanza al inicio de la pubertad, lo que sugiere, como ya señalamos, que más bien representa una señal permisiva en el complejo del inicio de la pubertad y la capacidad de reproducción. Asimismo, la leptina ejerció al menos una acción permisiva sobre la liberación hipotalámica de GnRH y estimuló la liberación hipofisaria de hormona luteinizante (LH) y hormona foliculostimulante (FSH) in vitro24.
LEPTINA Y GESTACION
Como ya sabemos, en el adulto, el tejido adiposo blanco es la principal fuente de leptina y las concentraciones circulantes son proporcionales al IMC y a la masa adiposa. Durante la gestación, el aumento de la leptinemia materna, superior y más precoz que el aumento de la masa adiposa, y la caída inmediata en el posparto señalan que la producción plasmática participa en las concentraciones circulantes de leptina en la mujer encinta.
Por otra parte, está presente en la placenta. La leptina es detectada en el líquido amniótico y el plasma fetal desde la semana 18 de amenorrea. En la actualidad el papel de la leptina fetal no está totalmente definido. En los recién nacidos, las concentraciones umbilicales de leptina están positivamente correlacio- nadas con el peso al nacimiento25,26.
La placenta: el lugar principal de producción de leptina
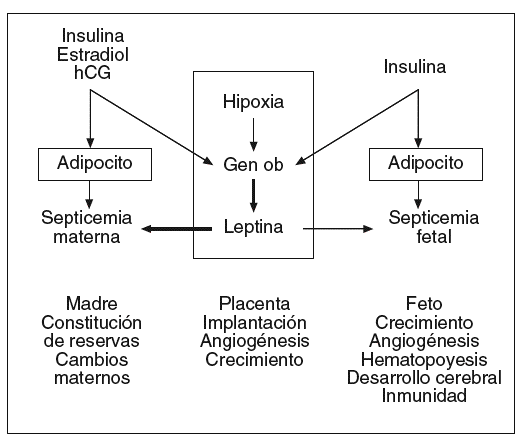
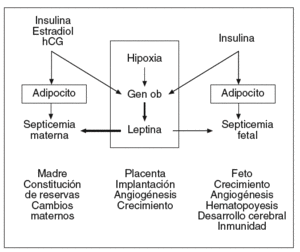
La placenta sintetiza numerosas hormonas esteroideas y polipeptídicas, factores de crecimiento, citocinas que intervienen en el mantenimiento de la gestación y la regulación de los metabolismos materno y fetal. La leptina es sintetizada en la placenta en concentraciones compatibles con las de la célula adiposa27. La leptina se localiza en las células cito y sincitiotrofoblásticas que están situadas sobre la cara materna de la placenta28. La leptina se ha detectado igualmente en las células endoteliales de los capilares fetales que están en contacto con la sangre fetal28. La leptina sintetizada en la placenta es liberada principalmente a la circulación materna y la circulación fetal, pero en valores más bajos que en la madre (fig. 4)29,31.
Fig. 4. Leptina y gestación: lugares de producción, posibles mecanismos de regulación y funciones actualmente consideradas. La leptina sintetizada en la placenta es liberada principalmente en la circulación materna e igualmente en la circulación fetal, pero en concentraciones mucho más bajas. Así, la leptinemia materna depende de la masa adiposa de la madre e igualmente de la producción placentaria, mientras que la leptinemia fetal depende esencialmente de la masa adiposa fetal. Los estrógenos, la hipoxia y la insulina son los principales factores conocidos que pueden aumentar la producción placentaria de leptina31.
El papel de la leptina placentaria no está actualmente definido. En tanto que hormona liberada en la circulación materna, la leptina placentaria podría participar en la regulación del metabolismo energético y de las reservas lipídicas. Se sabe que en el plasma materno la leptina circula en forma tanto libre como ligada. Aunque se supone que la proteína transportadora es una forma soluble del receptor de la leptina, se están evaluando otras alternativas32. En el ser humano, la semivida de la leptina es de aproximadamente 75 min33.
En tanto que citocina sintetizada en la placenta, la leptina podría actuar localmente mediante mecanismos autocrino y/o paracrino, es decir que, como tal citocina, hace que las vías nerviosas actúen como mediadoras de los efectos neuroendocrinos y vegetativos. Como citocina producida fuera del SNC, puede alterar las actividades y la función de poblaciones de neuronas hipotalámicas. Aunque las interacciones de las citocinas con el sistema nervioso han sido estudiadas ampliamente, todavía no se conocen los mecanismos por los que las señales inmunológicas influyen en el SNC6.
Este aspecto de la leptina, en tanto citocina, está apoyado por la presencia de receptores específicos de la leptina que podrían controlar las vías de señalización determinantes del crecimiento y la proliferación celular34,35. El receptor de la leptina es un miembro de la superfamilia de receptores de las citocinas. Este receptor se fija a las llamadas cinasas JANUS (JAK), unas tirosincinasas que participan en el proceso de las señales de las citocinas intracelulares. La activación de las JAK ocasiona la fosforilación de los miembros de la familia de las proteínas STAT (de traducción de señal y activación de la transcripción); a su vez, estas proteínas STAT activan la transcripción de los genes de la leptina.
La leptina intervendría en el crecimiento placentario25, la angiogénesis placentaria (tabla I)28,36 y tendría igualmente un papel inmunomodulador y antiinflamatorio37 necesario para la implantación.
Aumento de la producción placentaria de leptina en el curso de numerosas afecciones gravídicas
Mola hidatiforme, coriocarcinoma, preeclampsia o diabetes tipo 1 asociada a la gestación
En el curso de la gestación molar y en los coriocarcinomas, la leptinemia materna está aumentada sin relación con el IMC de la mujer. La leptinemia disminuye después de la evacuación uterina y se observa un aumento en el caso de recidiva tumoral27. En los coriocarcinomas la hiperleptinemia está asociada a un aumento de la expresión del gen ob y la producción de leptina celular, lo que refleja la síntesis in situ de la hormona28.
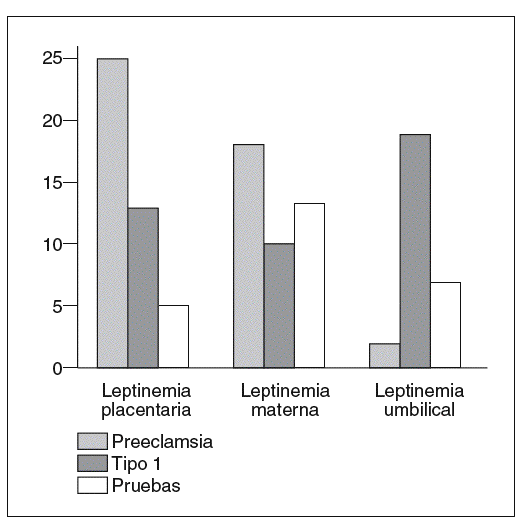
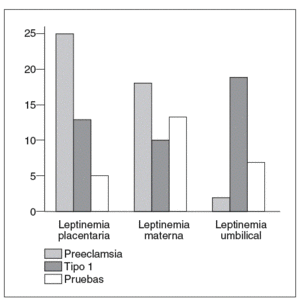
La producción de leptina placentaria está fuertemente incrementada en la preeclampsia38 y permitiría explicar el aumento de la leptinemia materna (fig. 5)31. En efecto, la leptina producida por la placenta es liberada principalmente en el compartimento materno29,30. Al contrario, los niños hipotróficos nacidos de gestaciones preeclámpsicas tienen concentraciones umbilicales de leptina bajas (fig. 5)31, en correlación con la severidad del retardo de crecimiento intrauterino y la débil producción de tejido adiposo39. No obstante, estos resultados están aún pendientes de ser verdaderamente confirmados, puesto que el incremento de la leptinemia materna en caso de preeclampsia no ha sido encontrado en otros estudios40,41.
Fig. 5. Concentraciones placentarias de leptina (ng/g tejido). Leptinemias maternas y umbilicales (ng/ml) en el curso de la preeclampsia (n = 12), de la diabetes tipo 1 (n = 11) y de la gestación normal (n = 38)31.
El incremento de leptinemia materna se ha propuesto como marcador predictivo de la aparición de preeclampsia en un estudio42, y una vía de búsqueda podría evaluar la leptinemia asociada a las eco-Doppler uterinas31.
En el curso de la gestación con diabetes tipo 1, la expresión del gen ob y la cantidad de leptina producida por la placenta están aumentadas43 en proporciones menores que en la preeclampsia. El incremento de la producción placentaria de leptina no está asociado a una hiperleptinemia materna (fig. 5)31. Por el contrario, los efectos de madres diabéticas son hiperleptonémicos. En estos casos, la hiperleptinemia fetal está en relación con el índice ponderal, que es un buen reflejo de la masa grasa de los recién nacidos44.
La regulación de la producción placentaria de leptina parece compleja y multifactorial
La heterogeneidad de las afecciones gravídicas en las que se observa un incremento de la producción de leptina placentaria sugiere que las regulaciones implicadas revelan mecanismos específicos en cada situación31.
Las observaciones clínicas sugieren que las hormonas esteroideas regulan la producción de leptina45,46. Durante la gestación la correlación positiva entre las concentraciones de estradiol y de leptina permite considerar un papel regulador en la producción placentaria y adipocitaria materna47. Estudios realizados in vitro muestran que el estradiol estimula la expresión del ARNm ob, así como la producción de leptina por los adipocitos aislados y por las células de la placenta humana en cultivo primario48,49. La unión entre cortisol y progesterona y producción de leptina placentaria está por confirmar31.
Fuera de la gestación, se sabe que la secreción de leptina se encuentra hiperregulada sinérgicamente por las hormonas insulina y cortisol e hiporregulada por las catecolaminas, la noradrenalina y la adrenalina6. En un estudio también se sugiere que la colecistocinina puede regular directamente la secreción de leptina50. En ausencia de gestación, Cone et al6 afirman saber poco acerca de las vías celulares relacionadas con la secreción de leptina. Sin embargo, los rápidos efectos que tiene la estimulación betaadrenérgica en la liberación de leptina por el tejido adiposo sugieren que su secreción está regulada por el AMPc.
En la gestación, la preeclampsia está relacionada con importantes alteraciones vasculares en el seno de la placenta, en general asociadas a un estrés hipóxico51. El efecto de un estímulo hipóxico sobre la expresión del gen ob placentario se ha estudiado en células trofoblásticas BeWo cultivadas en condiciones de hipoxia. La secreción de leptina es estimulada en las células cultivadas 72 h en hipoxia, lo que sugiere un papel estimulador en la producción de leptina por estas células38. En estas células, la hipoxia estimula igualmente la actividad promotriz del gen ob, lo que indica que se trata de una estimulación transcripcional52. Estas observaciones confirman el efecto estimulador de la hipoxia placentaria en la expresión del gen y de la leptina placentaria en mujeres gestantes con preeclampsia.
Existe un hiperinsulinismo materno severo en las gestantes diabéticas. Se puede proponer que, de forma análoga al promotor del gen adipocitario, la transcripción del gen placentario sea estimulado por la insulina53. Esta hipótesis requiere la confirmación en el plano molecular para la búsqueda de un efecto directo de la insulina en las secuencias promotrices del gen específicas del gen ob placentario54.
El conjunto de estos datos pone en evidencia una regulación compleja y multifactorial de la expresión del gen ob y de la leptina. Los estrógenos, el estrés hipóxico y la insulina son los principales factores conocidos que pueden aumentar la producción placentaria de leptina en condiciones fisiopatológicas.
Leptina materna
Durante la gestación, el aumento de la leptinemia materna es más elevada y más precoz que el incremento de la masa adiposa. En el primer trimestre, las concentraciones de leptina son significativamente más elevadas que en el caso de mujeres no gestantes de la misma edad y del mismo IMC. En el curso del segundo trimestre, la concentración circulante de leptina es, en promedio, un 160% más elevada que en el primer trimestre, y después describe un plano durante el tercer trimestre. Una vez tiene lugar el parto, la leptinemia cae rápidamente, para recobrar los valores preconcepcionales 24 h después del alumbramiento. Estos hechos son constataciones de producción placentaria de leptina en el curso de la gestación27.
La leptinemia está positivamente correlacionada con las concentraciones plasmáticas de hormona gonadotropina coriónica y estradiol, pero no con la insulina materna47. Además, la producción adipocitaria de leptina no está aumentada in vitro por la conjunción de gonadotropina humana (hCG) y de estradiol55, lo que sugiere una regulación positiva.
El aumento de la leptinemia materna no está correlacionado con un incremento de la masa adiposa56 ni a una disminución del apetito o un aumento de las reservas energéticas. Esta paradoja podría resultar de un estado de resistencia a la leptina destinada a optimizar los cambios materno-fetales, por una parte, y a la constitución de una reserva energética materna, por otra31.
Leptina fetal y neonatal
La leptina fue visualizada por inmunohistoquímica en las células preadipocitarias en el embrión de 6 semanas57. La leptina está producida por el adipocito fetal30 y se detecta en el plasma fetal a partir de las 18 semanas de amenorrea58.
En el momento del nacimiento, la masa adiposa representa el 3% del peso al nacer de los niños hipotróficos39, el 15% del peso al nacer en niños eutróficos59 y el 30% del peso al nacimiento en niños macrosómicos nacidos de gestaciones diabéticas60. Las concentraciones umbilicales de leptina están positivamente correlacionadas con el peso al nacimiento26,58 y a la masa adiposa44,61,62. No existe ninguna correlación entre la leptinemia materna y el peso al nacimiento. El papel de la leptina fetal no está aún bien definido, aunque el receptor de la leptina se ha encontrado en la mayor parte de los tejidos fetales63. La producción de leptina por el adipocito fetal podría estar regulada por la insulina43 e igualmente por la hipoxia64. La existencia de un dimorfismo sexual es actualmente controvertida, por el hecho de proporcionar resultados discordantes, y estaría mucho más unido a la proporción de masa adiposa, más importante en la niña, que a las diferencias en hormonas esteroideas circulantes45,59,65.
Después del nacimiento, las concentraciones circulantes de leptina son detectadas entre el tercero y el quinto día posparto66. Las causas de este declinar tan rápido son conocidas, pero el resultante sería una estimulación del apetito, indispensable en el caso del recién nacido.
Leptina y gestación: conclusión
Durante la gestación, la placenta es el principal lugar de producción de leptina, que es principalmente liberada a la circulación materna. La hiperleptinemia materna podría participar en la regulación homeostática energética de la madre. La leptina sintetizada en la placenta podría igualmente actuar localmente activando vías de señalización distinguidas por los receptores placentarios específicos. El aumento de la producción de leptina placentaria en las afecciones gravídicas distintas sugiere una regulación multifactorial y puntos de impacto que se resisten a ser determinados. El valor predictivo de la hiperleptinemia materna para la aparición de una preeclampsia está por confirmar. La leptinemia fetal está correlacionada con la masa adiposa fetal, pero su papel está aún por elucidar.
ANEXO: LEPTINA Y REPRODUCCION
Algunos apuntes en este sentido quedaron señalados al comienzo de la revisión. Vamos a extendernos un poco más en el binomio leptina-reproducción.
Distintas observaciones sugieren que la leptina interviene en la fisiología de la reproducción67:
1. La administración de leptina acelera el inicio de la pubertad en los roedores2.
2. En los varones, los valores de leptina aumentan en la pubertad68.
3. En los atletas y las personas con anorexia y retraso de la pubertad, los valores de leptina son bajos69.
4. El desarrollo sexual inicial en los ratones ob/ob es normal, pero permanecen prepúberes y nunca ovulan: la fertilidad se recupera con la administración de leptina2.
La hipótesis de que el momento de la pubertad es estimulado, al menos en parte, por una señal metabólica que alerta al control central del eje reproductor, que indica que el cuerpo del sujeto es suficientemente grande y que existe una adecuada energía metabólica para desarrollar la función reproductora, ha sido objeto de una gran atención en las últimas décadas70.
En muchas especies, la prevención del crecimiento corporal normal por desnutrición puede retrasar el comienzo de la pubertadlo que indica que el retraso puberal causado por la desnutrición actúa en el SNC más que en la hipófisis o en las gónadas72. Por consiguiente, si la desnutrición puede retrasar el desarrollo central del eje reproductor, algunos aspectos del estado nutricional deben de ser parte de la señal normal que actúa en el eje reproductor conduciendo a la pubertad. En muchas especies, incluido el ser humano, las situaciones de desnutrición pueden generar que el eje reproductor del adulto retorne al estado prepuberal. Este hecho queda bien ilustrado en las niñas que padecen trastornos de la alimentación, especialmente anorexia nerviosa73,74. Durante el tiempo en que el peso corporal está disminuido, las pacientes con anorexia nerviosa presentan concentraciones séricas muy bajas de LH y FSH con pocos picos de LH y ausencia de función ovárica.
La función reproductora suele restaurarse tan pronto como las pacientes con anorexia nerviosa ganan el suficiente peso cuando reciben una dieta adecuada. El reinicio de la función del eje reproductor sigue el patrón del desarrollo reproductor normal durante la pubertad, con la presencia de los pulsos nocturnos de LH75.
Un nuevo factor se ha integrado dentro del conjunto de sustancias que pueden intervenir en la activación del gonadostato: la leptina. La leptina, como dijimos, el producto del gen ob1, es un péptido recientemente descubierto con un peso molecular de 16 kDa, producida por los adipocitos, que informa al cerebro del estado de los depósitos corporales de energía y, por tanto, funciona como un sensor del balance energético. Su acción central, mediada por péptidos entre los que destaca el neuropéptido Y, regula el consumo de alimentos y el gasto de energía. El neuropéptido Y es un estimulador potente del consumo alimentario e inhibe la termogénesis a partir del tejido adiposo marrón. En ratones obesos con un déficit genético de producción de leptina, la administración de esta sustancia disminuye las concentraciones de neuropéptido Y antes de que se produzcan cambios significativos en el peso corporal. También se ha implicado la leptina en cambios periféricos de la regulación energética, como la resistencia insulínica76.
Las concentraciones séricas de leptina se correlacionan muy positivamente con el IMC y, consiguientemente, transmiten la información sobre la energía almacenada disponible al cerebro y otros órganos. La leptina también ejerce efectos relevantes en la homeostasis energética y la función neuroendocrina77. Las alteraciones genéticas que previenen la producción de esta molécula (ob/ob) o la respuesta a ésta (db/db) producen obesidad severa en el ratón con disminución en el gasto energético e hiperfagia78. El tratamiento del ratón ob/ob con leptina invierte su obesidad, incrementa el gasto energético y restablece la ferti-lidad4. La administración diaria de leptina acelera el comienzo de la pubertad en el ratón normal2, lo que confirma la propuesta función de la leptina como una señal metabólica relevante para el eje reproductor neuroendocrino.
Estudios realizados en humanos también sugieren que la leptina pueda servir como un elemento metabólico importante en el comienzo de la pubertad. Comparadas con los valores basales prepuberales, las concentraciones de leptina en los niños aproximadamente se duplican antes del comienzo de la pubertad, disminuyen a valores similares a los basales tras el inicio de la pubertad y permanecen estables durante 2 años68. Las concentraciones de leptina se incrementan en las niñas durante la pubertad, pero disminuyen en los niños al iniciarse la pubertad en el estadio 2 de maduración gonadal79. La mayoría de los estudios muestra diferencias sexuales en la sensibilidad a la leptina; las niñas presentan mayores concentraciones de leptina que los niños en un nivel dado de adiposidad, incluido en el período prepuberal, aunque existen datos algo conflictivos80. Alternativamente, los andrógenos pueden ser parcialmente causantes de las concentraciones más bajas de leptina en los niños, dado que el tratamiento con testosterona en adolescentes con retraso en la pubertad genera una disminución significativa de los valores de leptina81. Las diferencias en las concentraciones séricas de leptina entre niños y niñas pueden reflejar cambios en la composición corporal que ocurren durante la pubertad. Se ha demostrado la existencia de correlaciones significativas entre las concentraciones séricas de leptina y los diferentes depósitos grasos en ambos sexos79.
Los cambios hormonales hipofisarios asociados al comienzo de la pubertad se deben al aumento de la secreción de LH asociado al sueño. Los valores de leptina siguen también un ritmo circadiano, con concentraciones más elevadas durante la noche82, lo que sugiere que esta señal puede ser parte de una vía para los cambios nocturnos en la secreción de LH que caracteriza los estadios iniciales de la pubertad.
Además de la grasa, otros factores pueden influir en los valores de leptina en animales experimentales y en el hombre82. Los factores positivos incluyen la insulina83 y los glucocorticoides84; los factores negativos incluyen agonistas adrenérgicos85 y, posiblemente, otros factores lipolíticos82. Todos estos factores contribuyen, junto con cambios en la masa grasa, al incremento prepuberal en las concentraciones de leptina y su subsiguiente disminución al progresar el desarrollo de los niños
Aún se desconoce el mecanismo exacto mediante el cual se incrementan los valores de leptina que pueden afectar al comienzo de la pubertad. En los roedores, es bien conocido que la leptina actúa en los centros hipotalámicos que intervienen en la regulación del balance energético y que el núcleo arcuato es una diana relevante82,86. El neuropéptido Y, ya citado, un objetivo de la acción de la leptina en el núcleo arcuato86, regula la secreción de GnRH in vivo e in vitro87. Se acepta que la secreción intermitente de GnRH se regula por un «oscilador» neuronal88. Por el contrario, se continúa desconociendo hasta qué punto la función del oscilador de la función neuronal causante de la secreción intermitente de GnRH es intrínseco a las células productoras de GnRH88,89 o es inducido por otros neuropéptidos o neurotransmisores del SNC. En resumen, como hemos comentado, se ignora cuáles son los mecanismos que correlacionan el estado nutricional con la actividad del sistema reproductor. Además, en los cambios en la composición corporal y en la masa corporal total, la leptina podría ser el mensajero adecuado para informar de esta situación y tener, por tanto, un papel protagonista en la actividad del gonadostato. Los valores de leptina aumentan transitoriamente antes de la pubertad, tanto en el ratón como en los varones humanos76. Los valores de leptina se encuentran bajos en los casos de amenorrea hipotalámica relacionados con el ejercicio físico y la anorexia nerviosa.
La leptina podría influir en la actividad reproductiva a varios niveles, ya que en el animal de investigación se han localizado receptores en el ovario, el tes tículo, el hipotálamo y la hipófisis. En condiciones experimentales, los tratamientos con leptina aumentan la secreción de gonadotropinas, pero también interviene en los procesos esteroidogénicos gonadales. Sin embargo, lo más sugestivo es pensar que la función reproductora, inducida por la leptina, se da por su capacidad de estimular el eje gonadotropo. Ya comentamos que el neuropéptido Y influye en la libe ración de GnRH. Se cree que los aumentos en la producción del neuropéptido Y inhiben las vías descendentes que estimulan las neuronas productoras de GnRH. La administración de leptina al animal de investigación disminuye la expresión del neuropéptido Y en el núcleo arcuato y, en consecuencia, desbloquea la inhibición de la liberación de GnRH. Esta explicación, que contribuiría a completar el cuadro de regulación de la función gonadal prepuberal, está todavía en vías de experimentación76,90.
Probablemente, la hipótesis más próxima a la realidad es la que integra los distintos factores mencionados. Durante la infancia, el mecanismo de feedback negativo estaría bloqueado por un conjunto de sustancias del SNC, entre las que destacan los opiáceos y los neurotransmisores. El crecimiento estrictamente vegetativo conduce a un desarrollo progresivo que favorece la actividad episódica de varias hormonas hipofisarias, entre ellas la hormona del crecimiento, las gonadotropinas y posiblemente la TSH. Con ello se entra en un proceso en espiral que facilita la redistribución de la masa corporal, el crecimiento estatural, el desarrollo fenotípico de los caracteres sexuales secundarios y, finalmente, la menarquia. En este estadio es donde podría encajar la acción de la leptina potenciando la liberación de GnRH y la secreción gonadotropa. Es posible que existan factores como el ejercicio excesivo, la restricción alimentaria o el estrés psíquico capaces de bloquear este proceso madurativo por varias vías, mientras que situaciones como la obesidad mórbida no se asocian a la actividad menstrual, pero no por un bloqueo directo de la actividad hipotalámica, sino por la acción aromatizadora periférica de la masa adiposa76.
Los valores de leptina son más elevados en mujeres que en varones, y también más elevados en mujeres premenopáusicas que en las posmenopáusicas91. En las niñas, los valores de leptina son más altos y disminuyen con el avance en las etapas de Tanner en la pubertad92. Por tanto, con la pubertad aumenta la sensibilidad a la leptina. Otro modo de examinar esta relación es: tal vez la disminución de la leptina en la pubertad permita una mayor ingestión para el crecimiento, por medio de la disminución de la señal de la saciedad67.
Se puede considerar que el efecto de la leptina en la reproducción es una función adicional para mantener las respuestas al estrés. Se sabe que la pérdida de peso se asocia a un aumento de la respuesta suprarrenal y a una disminución de la función tiroidea; en ratones privados de alimentos, se observan estos cambios endocrinos, junto con la supresión del ciclo estro. Los cambios se revierten con el tratamiento con leptina18.
No se sabe por qué la CRH está aumentada en la amenorrea por estrés (en especial, asociada con la pérdida de peso), a diferencia de lo que ocurre con el ayuno en individuos normales y obesos. Una posibilidad es que la disminución de la leptina y el aumento del neuroléptico Y, asociados con la pérdida de peso relacionada con el estrés, sea la respuesta esperada, pero que resulte inadecuada para suprimir el aumento de CRH inducido por estrés. Los patrones disminuidos en las atletas amenorreicas avalan esta hipótesis. El aumento de CRH y el hipocortisolismo resultante aumentan ulteriormente el metabolismo y la pérdida de peso.
Los ritmos diurnos de los valores de leptina en las atletas con menstruaciones cíclicas son normales. Sin embargo, en las atletas amenorreicas, no se observa un patrón diurno93. Ambas tienen valores de leptina bajos (3 veces menores) que se correlacionan con la disminución de la grasa corporal, pero la hipoinsulinemia y la hipercortisolemia bajan aún más los valores de leptina. Además, en las atletas amenorreicas, la respuesta de la leptina al aumento de la insulina de las comidas está disminuida76.
En las mujeres posmenopáusicas, los valores de leptina disminuyen con el entrenamiento de resistencia: el tratamiento hormonal no tiene ningún efecto en la leptina94. Esto indica que la diferencia entre los sexos (niveles superiores en mujeres) se debe a una diferencia en relación con las grasas, no a una diferencia hormonal.
Debido a la estrecha conexión entre los valores de insulina y leptina en los ratones, y a la actualmente reconocida prevalencia de hiperinsulinismo en mujeres con ovarios poliquísticos, resulta lógico examinar los valores de leptina en estas mujeres76.
Un estudio comunicó un aumento de leptina en mujeres con ovarios poliquísticos, pero fue criticado porque en él no se realizó el ajuste por el peso corporal95. Por lo menos en 3 estudios en los que se controló el peso, no se hallaron diferencias respecto de los valores de leptina entre mujeres con ovarios poliquísticos y sin esta enfermedad96-98. En mujeres con ovarios poliquísticos, la relación entre leptina y peso corporal se mantiene. Por tanto, a diferencia de lo que se observó en modelos con roedores, en estas mujeres la hiperinsulinemia y la resistencia a la insulina no afectan los valores de leptina.
Sin embargo, aún no se debe descartar que la leptina desempeñe algún papel en los cambios asociados con ovarios poliquísticos. Puede haber diferencias sutiles que tengan consecuencias biológicas. Por lo menos un estudio ha mostrado una correlación entre los valores de leptina y de insulina en 24 h, en mujeres con ovarios poliquísticos96. Además, el fármaco que reduce la resistencia a la insulina, la troglitazona, inhibe la transcripción del gen Lep y puede ser especialmente adecuado para las mujeres obesas con ovarios poliquísticos99.
¿Es posible que la leptina intervenga en la reproducción en tejidos determinados? Una isoforma de la leptina se ha identificado en el ovario; in vitro, esta sustancia ejerce acciones específicas en la esteroidogénesis100-101. En células de la granulosa de las ratas, la leptina inhibe la acción sinérgica del factor de crecimiento tipo insulina-1 (IGF-1) en la producción de estradiol estimulada por la FSH (pero no sobre la progesterona), y también inhibe la acción de estímulo de FSH sobre la producción de IGF-1. Además, en las hormonas, la leptina se expresa en las células de la granulosa y el cúmulo, y está presente en los oocitos y en el líquido folicular; por tanto, aparentemente la leptina es secretada por el folículo ovárico102. El aumento de los valores de leptina maternos, después de la administración de HCG y antes de la remoción del huevo, se correlacionó con una mayor tasa de embarazos102. Por tanto, es posible que la leptina intervenga en muchísimos procesos metabólicos y de desarrollo importantes67.
El estudio de la leptina ha devuelto credibilidad a la hipótesis del peso crítico, originariamente propuesta por Frisch103 en la década de los setenta, quien sugirió que el inicio y la regularidad de la función menstrual requieren un peso corporal superior a un peso crítico y, por tanto, a una cantidad crítica de grasa corporal. Siempre ha sido un misterio el modo en que la grasa total del cuerpo dialoga con el cerebro. Ya no lo es76. La grasa se comunica con el cerebro mediante la leptina, y el sistema de la leptina afecta a la reproducción.
Sin embargo, existe una diferencia entre la pérdida de peso común y la inducida por estrés (p. ej., ejercicio físico o problemas psicológicos como la anorexia). En el primer caso, disminuye la secreción de CRH y se cree que el hipercortisolismo es mediado por señales de neuropéptido Y en el hipotálamo. En la pérdida de peso inducida por estrés, la secreción de CRH aumenta.
La CRH inhibe directamente la secreción hipotalámica de hormona liberadora de gonadotropina (GnRH) probablemente mediante la secreción de opioides endógenos. Las mujeres con amenorrea hipotalámica (incluidas las deportistas y las mujeres con trastornos de la alimentación) tienen hipercorticalismo por aumento de la CRH y la ACTH, tal vez, debido a la estimulación de la secreción de ACTH por parte del neuropéptido Y, lo que sugiere que ésta es la vía por la cual el estrés interrumpe la función reproductiva104. Con respecto a la reproducción, la vía final es la supresión de la GnRH, una respuesta a múltiples señales que indican la disponibilidad de combustible metabólico. La representación clínica (fase progestacional inadecuada, anovulación, amenorrea) depende de la magnitud de la supresión de la GnRH.
Existe una hipótesis unificadora que gira alrededor del balance energético105. Creando la energía disponible se desvía en exceso, como en el ejercicio, o cuando es insuficiente, como ocurre en los trastornos de la alimentación, la reproducción se interrumpe para sostener el metabolismo esencial para la vida. Por tanto, tal vez el grado de grasa corporal no afecte directamente a la reproducción, sino que puede ser un indicador del estado de la energía metabólica, y los valores extremadamente bajos de leptina en las mujeres anoréxicas es un intento adecuado para reinstalar el apetito, un intento que no logra impedir el aumento de la CRH inducido por estrés ni sus consecuencias. Esto es compatible con el hallazgo de que el neuropéptido Y estimula la secreción de GnRH y amplifica la respuesta de las gonadotropinas a la GnRH en los roedores106. Desde un punto de vista teleológico, estas relaciones tienen una lógica; la respuesta que ayuda al organismo a soportar el estrés también inhibe la función menstrual, porque un período de estrés no es el ideal para la reproducción.
En resumen, debido a los altos valores de leptina observados en las personas con exceso de peso, es posible que la leptina actúe solamente cuando existen concentraciones bajas. Un valor bajo de leptina circulante puede servir como una señal de que la grasa almacenada no es suficiente para el crecimiento y la reproducción. Por tanto, los valores bajos de leptina, por lo general, estimulan la hiperfagia, disminuyen el gasto de energía y suprimen la secreción de gonadotropinas y la reproducción. Los valores altos de leptina y la supuesta resistencia a la acción de esta sustancia, asociados con el exceso de peso y el exceso de grasa corporal, no reflejan resistencia entonces, sino ausencia de efecto fisiológico.
El mecanismo de la leptina abre la puerta a menos tratamientos para la obesidad, pero esta posibilidad no es inmediata. La leptina, que es un polipéptido, no se puede administrar por vía oral y, en vista de los altos valores observados en las personas con exceso de peso, se debe hallar otro método para combatir la falta de efecto o la supuesta resistencia a la leptina. Por el momento, se considera que los defectos genéticos en el gen Lep son raros; de todas maneras, la administración de un agonista de la leptina puede resultar terapéutica en los individuos afectados. Aun cuando este complejo sistema produzca nuevos tratamientos, es poco probable que podamos ignorar los hábitos alimentarios y el ejercicio físico adecuado6,76.
Existe una hipótesis unificadora, centrada en el balance energético105,107. Cuando la energía disponible se gasta en exceso, como en el ejercicio, o es insuficiente, como en los trastornos de la alimentación, la función reproductora se interrumpe, para sostener el metabolismo esencial para la supervivencia. Por tanto, la función reproductora no está directamente afectada por el grado de grasa corporal, sino que la grasa corporal es un marcador del estado metabólico energético. Desde un punto de vista teleológico, estas relaciones tienen sentido; las respuestas que permiten al cuerpo soportar el estrés también inhiben la función menstrual, porque un período estresante no es el ideal para la reproducción.
Se puede considerar que el efecto de la leptina en la reproducción es otro mecanismo para mantener la respuesta al estrés. Se sabe que la pérdida de peso se asocia a un aumento de la respuesta suprarrenal y una disminución de la función tiroidea; estos cambios endocrinos, junto con la supresión del celo, se observan en ratones en ayuno forzado, y revierten con el tratamiento con leptina18.
El dilema es por qué aumenta la CRH en la amenorrea causada por el estrés (en especial en la asociada con la pérdida de peso), a diferencia de lo que ocurre en personas normales y obesas privadas de alimentos. Una posibilidad es que la disminución de la leptina y el aumento del neuropéptido Y asociados con la pérdida de peso secundaria al estrés sea la respuesta esperada, pero que resulte inadecuada para suprimir el aumento de CRH por el estrés. Los patrones de disminución en las atletas amenorreicas avalan esta idea. El aumento de la CRH y el hipercortisolismo resultante aumentan más el metabolismo y la pérdida de peso107.
Las atletas con menstruaciones cíclicas muestran un ritmo diurno normal en los valores de leptina. Sin embargo, en las amenorreicas el patrón diurno está ausente94. Ambas tienen valores bajos de leptina (3 veces más bajos), que se correlacionan con la reducción de la grasa corporal, pero las concentraciones bajan aún más por la hipoinsulinemia y la hipocortisolemia. Además, en estas atletas amenorreicas la respuesta de la leptina al aumento de insulina después de las comidas es escasa. El aumento de las irregularidades menstruales y la amenorrea se correlacionan con una disminución de la grasa corporal, que llega a representar menos del 15% del peso corporal y con valores de leptina inferiores a 3 ng/ml108.
Como en las personas con sobrepeso los valores de leptina son altos, es posible que la leptina sólo ejerza su función en un contexto de valores bajos. Las concentraciones circulantes de leptina bajas pueden actuar como una señal que indica que la grasa almacenada no es suficiente para el crecimiento y la reproducción. Por tanto, los valores bajos habitualmente estimularían la hiperfagia, reducirían el gasto de energía y suprimirían la secreción de gonadotropinas y la función reproductora. En consecuencia, los valores altos de leptina y la aparente resistencia a la acción de la leptina con el sobrepeso y el exceso de grasa no reflejarían resistencia, sino falta de efecto fisiológico.