El parto prematuro está asociado a múltiples complicaciones, con un aumento de la morbimortalidad perinatal. Sin embargo, muchos estudios apoyan el uso de corticoides y sulfato de magnesio para mejorar los resultados en estos recién nacidos prematuros. El objetivo de nuestro estudio es describir la incidencia de morbimortalidad en recién nacidos prematuros de nuestro entorno y cómo el uso tanto de corticoides como de sulfato de magnesio ha mejorado el pronóstico a corto plazo de estos recién nacidos.
Material y métodosEstudio retrospectivo observacional de 564 recién nacidos prematuros nacidos entre 2018-2019 en el área hospitalaria del Hospital Juan Ramón Jiménez. El tratamiento con corticoides y sulfato de magnesio se realizó según los protocolos actuales de la Sociedad Española de Ginecología y Obstetricia.
ResultadosLa incidencia de prematuridad fue del 7,9% en nuestro entorno. La gestación gemelar junto con la enfermedad hipertensiva del embarazo fueron las afecciones obstétricas más frecuentes. La cesárea fue la vía de finalización más común en todos los grupos de prematuridad, excepto en la tardía. El síndrome de distrés respiratorio fue la enfermedad más frecuente (más del 33%) en todos los grupos. La tasa de mortalidad neonatal total fue del 1,8%. En cuanto a los corticoides, el principal resultado de nuestra muestra fue una disminución en la morbimortalidad neonatal, estadísticamente significativa en el síndrome de distrés respiratorio y la retinopatía del prematuro. En cuanto al sulfato de magnesio, el principal resultado fue la disminución de la hemorragia intraventricular, la leucomalacia periventricular y la displasia broncopulmonar. Respecto a la mortalidad neonatal, no hubo diferencias significativas.
ConclusionesLa morbimortalidad registrada en nuestra muestra fue similar a la descrita en la bibliografía. El tratamiento con corticoides para la maduración pulmonar redujo la morbimortalidad neonatal en general; sin embargo, esta reducción solo fue estadísticamente significativa en el síndrome de distrés respiratorio y la retinopatía del prematuro. El tratamiento con sulfato de magnesio también reveló mejoría en algunas enfermedades y en la mortalidad, aunque no de manera estadísticamente significativa.
Preterm labour is associated with multiple complications, with an increased risk of perinatal morbidity and mortality. Nevertheless, many studies support the use of corticosteroids and magnesium sulphate to improve outcomes in preterm birth. The objective of this study is to describe the morbidity and mortality incidence in preterm birth in a Spanish hospital and how the use of corticosteroids and magnesium sulphate has improved the short-term prognosis in these newborns.
Material and methodsObservational retrospective study of 564 preterm births between the years 2018 to 2019, in the hospital area Juan Ramón Jiménez (Huelva). The treatment with corticosteroids and magnesium sulphate was performed based on current protocols of the Spanish Society of Gynaecology and Obstetrics.
ResultsThe incidence of prematurity in this study was 7.9%. Twin pregnancies and hypertensive pregnancy disease were the most common obstetric disorders. The most common type of delivery was caesarean section in all prematurity groups, except late prematurity. Respiratory distress syndrome was the most frequent pathology (more than 33%) in all groups. Overall neonatal mortality was 1.8‰. As regards the use of corticosteroids, the main outcome was a decrease in neonatal morbidity and mortality, which was statistically significant in respiratory distress syndrome and preterm retinopathy. The use of magnesium sulphate caused a decrease in the incidence of intraventricular haemorrhage, periventricular leukomalacia, and bronchopulmonary dysplasia. There were no significant differences in neonatal mortality.
ConclusionsMorbidity and mortality registered in this study were similar to that described in the literature. Although the use of corticosteroids reduced neonatal morbidity and mortality in this study, it was only statistically significant in premature retinopathy and respiratory distress syndrome. The use of magnesium sulphate also showed an improvement in some pathologies and in mortality, but were not statistically significant.
La prematuridad sigue siendo un problema de gran importancia en la actualidad. La presencia de un recién nacido prematuro (RNP) está asociada a un 75% de la mortalidad perinatal y a más de la mitad de la morbilidad a largo plazo. Aunque la mayoría de los RNP sobreviven, se ve incrementado el riesgo de desarrollo de complicaciones neurológicas, respiratorias y gastrointestinales1. Las principales complicaciones asociadas al RNP son: i) el síndrome de distrés respiratorio (SDR); ii) la hemorragia intraventricular (HIV); iii) la enterocolitis necrosante; iv) la displasia broncopulmonar; v) la persistencia del conducto arterioso; vi) la retinopatía, y vii) la sepsis.
La administración de corticosteroides previa al parto prematuro es una de las terapias más importantes de las que se dispone para mejorar los resultados neonatales de estos recién nacidos2. La primitiva indicación del uso de corticoides era disminuir la incidencia del SDR neonatal, pero estudios posteriores demostraron que reducía en general la morbimortalidad neonatal3.
Los beneficios de la administración de corticoides sobrepasan ampliamente los potenciales riesgos y deben ser administrados a todas las gestantes con riesgo de un parto pretérmino entre las semanas 24 y 34+6 de gestación4. Tras la administración de corticoides se ha descrito que la mortalidad o la presentación de SDR o de HIV comienzan a disminuir antes de transcurridas las primeras 24h.
Se han descrito diversos efectos secundarios maternos, tales como un riesgo aumentado de hiperglucemia con descompensación metabólica (en gestantes con diabetes) o de edema agudo de pulmón (en casos de administración simultánea de betamiméticos o sulfato de magnesio), susceptibilidad a la infección (por disminución de la respuesta inmunitaria) y un aumento de la dinámica uterina en gestaciones múltiples4. La información sobre los posibles efectos secundarios fetales es poco consistente y, a veces, contradictoria. A pesar de que todos estos efectos secundarios son posibles, los resultados de los diferentes ensayos controlados informan que la administración de corticoides prenatales no se asocia a complicaciones maternofetales a corto plazo (Evidencia IA)5.
Estudios observacionales han evidenciado el beneficio en cuanto a neuroprotección de la exposición antenatal a sulfato de magnesio, asociándose el uso de este fármaco con la disminución del riesgo de desarrollar parálisis cerebral e, incluso, con la disminución del riesgo de mortalidad perinatal6. La evidencia disponible hasta el momento indica que el sulfato de magnesio como neuroprotector tendría un efecto beneficioso al reducir en un 30-40% el riesgo de parálisis cerebral y disfunción motora gruesa a corto plazo7. La indicación de uso del sulfato de magnesio como neuroprotector es la inminencia de parto prematuro antes de las 32 semanas.
El objetivo de nuestro estudio fue analizar la morbimortalidad de los RNP en nuestro centro y conocer si existió relación con el uso de corticoides y sulfato de magnesio, con su aplicación en los protocolos correspondientes.
Material y métodosSe realizó un estudio observacional de carácter retrospectivo en el que se incluyeron los 564 RNP nacidos entre 2018-2019 en el área hospitalaria del Hospital Juan Ramón Jiménez, de Huelva, Andalucía, España.
El uso de corticoides se ha basado en las directrices emanadas del protocolo de la Sociedad Española de Ginecología y Obstetricia4. En dicho documento se recomienda la administración de corticoides antenatales a todas las gestantes con riesgo de parto pretérmino entre las semanas 24+0 y 34+6 de gestación, excepto si el parto es inminente (tiempo esperado para el parto<1h). Las pautas recomendadas eran: betametasona 12mg intramuscular cada 24h (2 dosis) o dexametasona 6mg intramuscular cada 12h (4 dosis); en nuestro centro, la pauta con betametasona es la de uso consensuado.
De la misma forma, para la administración de sulfato de magnesio se siguieron las recomendaciones del documento de la Sociedad Española de Ginecología y Obstetricia pertinente8. En este se indica que ante la sospecha de un parto pretérmino inminente y con el objetivo de reducir el riesgo de parálisis cerebral, la gestante debe recibir sulfato de magnesio hasta el momento del parto o durante 12-24h (el hecho que antes ocurra). El sulfato de magnesio debe ser considerado desde la viabilidad hasta la semana 31+6 de gestación. Se debe administrar en una dosis inicial de 4g por vía intravenosa a pasar en 30min, seguidos de 1g/h como dosis de mantenimiento hasta el parto. En casos de compromiso fetal o materno, no debe retrasarse el parto para su administración.
La muestra se estratificó en los 4 grupos mayoritariamente descritos en la bibliografía: prematuros extremos (de la semana 24 a la 28), muy prematuros (de la semana 28 a la 31+6), prematuridad moderada (de la semana 32 a la 34+6) y prematuridad tardía (de la semana 35 a la 36+6).
No se incluyeron en la muestra los recién nacidos con un peso inferior a 500g y una edad gestacional menor de 24 semanas al nacimiento.
Las variables recogidas fueron: edad materna, afección obstétrica (tales como diabetes y enfermedad hipertensiva del embarazo), tipo de gestación (única o múltiple), enfermedad fetal (crecimiento intrauterino retardado), vía del parto, peso al nacer, sexo, morbilidad neonatal asociada a la prematuridad (HIV, SDR/enfermedad de la membrana hialina, enterocolitis necrosante, ductus arterioso persistente, sepsis precoz, retinopatía del prematuro, displasia broncopulmonar, leucomalacia periventricular), casos de muerte neonatal y días de estancia hospitalaria.
Se define mortalidad neonatal como aquella ocurrida en los RNP antes de alcanzar los 28 días de vida. La tasa de mortalidad neonatal se expresa como el número de RNP fallecidos antes de alcanzar los 28 días de edad por cada 1.000 nacidos vivos en un año determinado.
Por último, se estratificó la muestra total de prematuros en 2 grupos respecto al tratamiento con corticoides (sí/no), y en otros 2 grupos respecto al tratamiento con sulfato de magnesio (sí/no). En ambos, se calculó el riesgo relativo (bruto) de las distintas entidades de morbimortalidad neonatal de cada grupo según su exposición o no al tratamiento con corticoides o sulfato de magnesio. El riesgo relativo es una medida relativa del efecto, ya que indica cuántas veces más tiende a desarrollarse el evento en el grupo de sujetos expuestos al factor de exposición en relación con el grupo no expuesto.
El análisis estadístico se realizó con MedCalc® Statistical Software versión 18.5 (MedCalc Software Bvba, Ostend, Bélgica, 2018; http://www.medcalc.org).
ResultadosEn nuestro medio, la incidencia de prematuridad fue del 7,96% (564 RNP de 7.085 nacidos vivos). Al clasificar por grupo de prematuridad: un 4,4% fueron de prematuridad extrema, un 9% fueron muy prematuros, un 28,7% de prematuridad moderada y un 57,8% de prematuridad tardía.
La edad gestacional media al nacimiento fue de 34±2,5 semanas. La edad media de las gestantes fue de 31,7 años y un 18,3% fueron gestaciones múltiples. Un 44,5% finalizaron en cesárea, un 47% con partos eutócicos y un 8,5% con partos instrumentales. Como dolencia maternofetal asociada a la prematuridad, se objetivó un 17,2% de enfermedad hipertensiva del embarazo, un 9,8% de crecimiento intrauterino retardado y un 9,8% de diabetes. El peso medio de los RNP fue de 2,249±0,672kg y predominaron los varones (53,4%).
La morbilidad neonatal presente en nuestra muestra fue de un 33,4% de SDR y/o enfermedad de la membrana hialina, un 7,8% de ductus arterioso persistente, un 2,5% de enterocolitis necrosante, un 6,2% de displasia broncopulmonar, un 3,7% de retinopatía del prematuro, un 9,1% de sepsis precoz, un 4,4% de HIV y un 0,9% de leucomalacia. La tasa de mortalidad neonatal en nuestra muestra fue del 1,8‰ respecto al total de nacidos vivos.
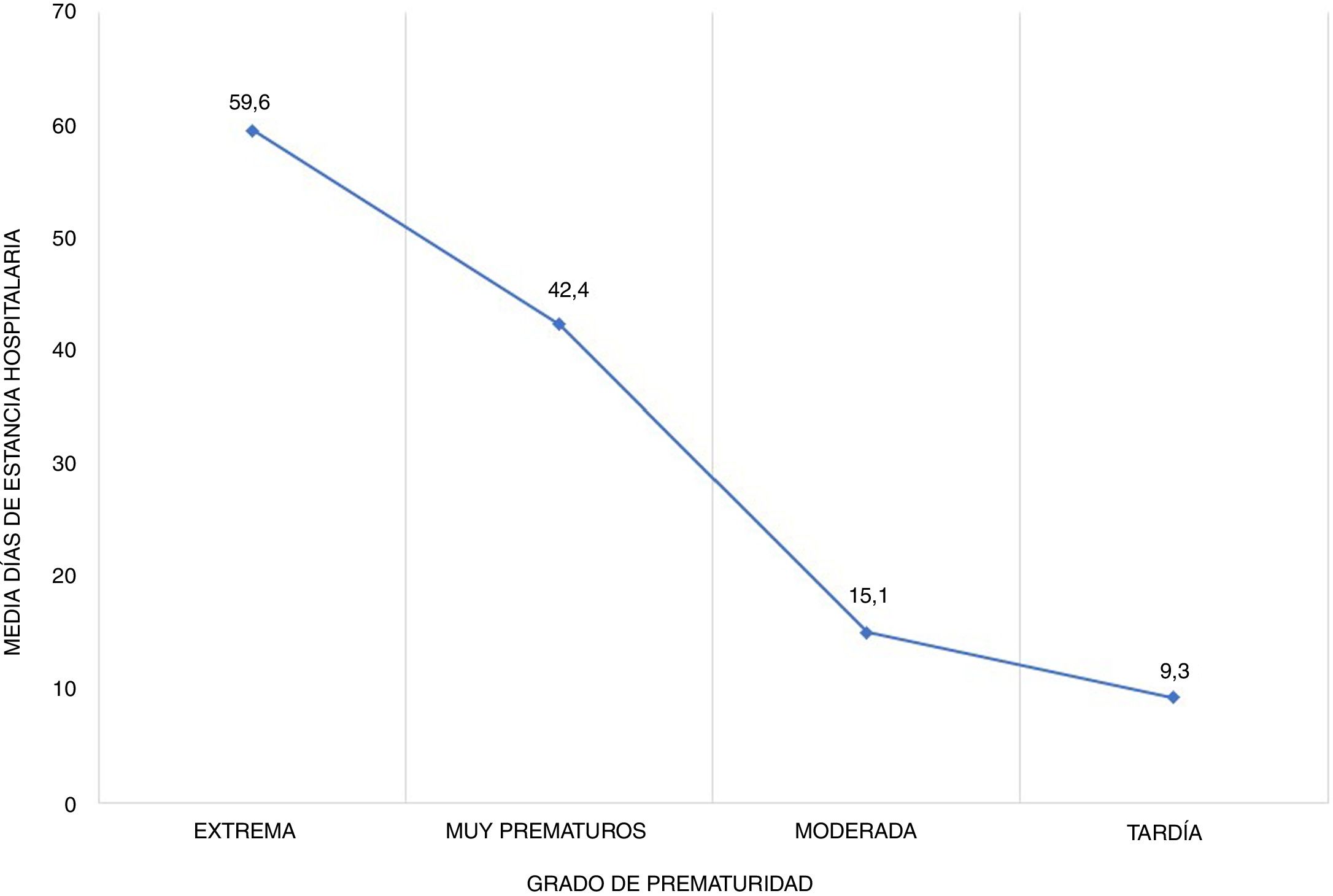
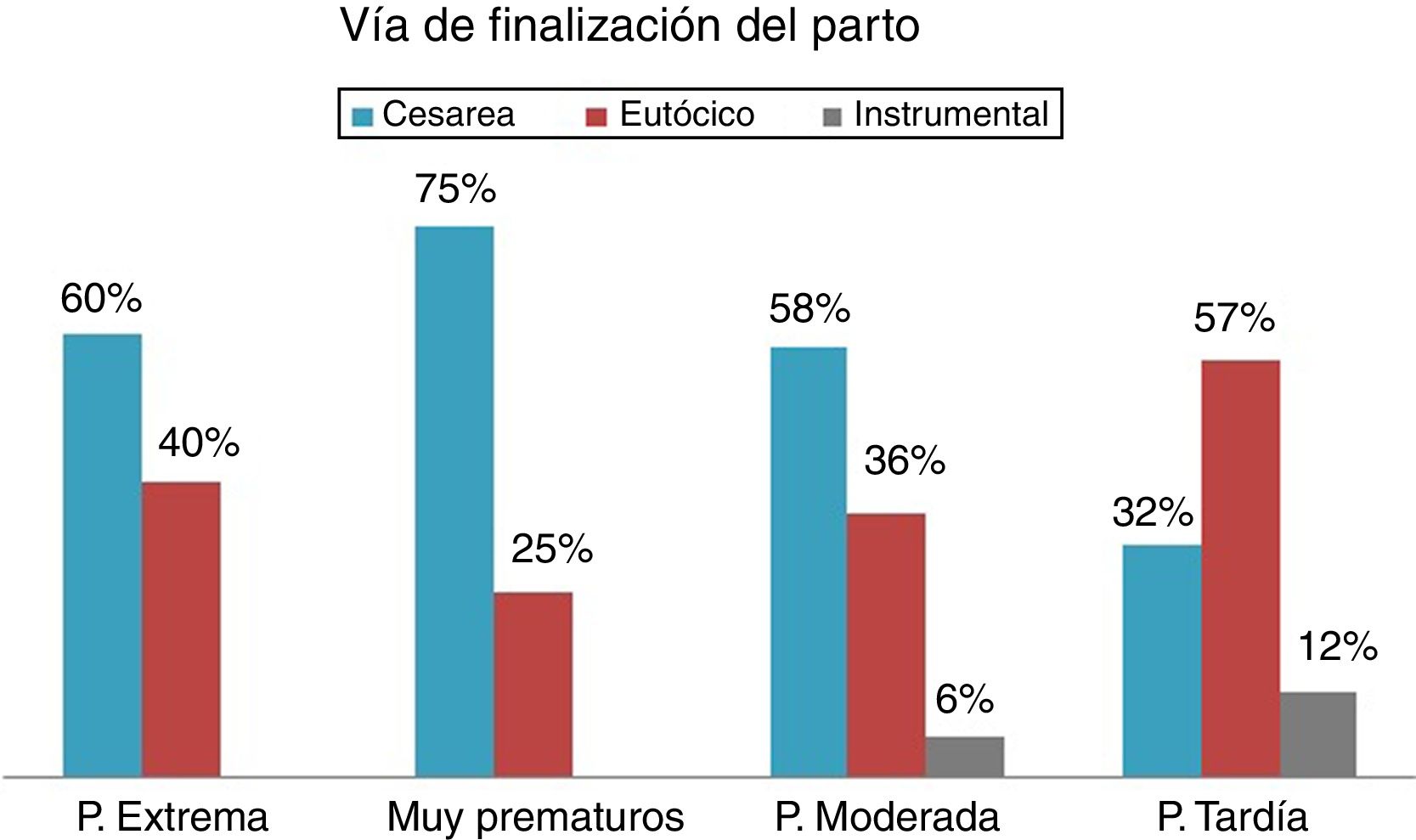
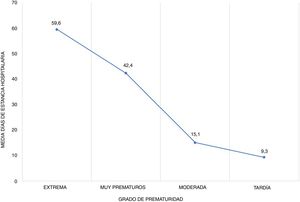
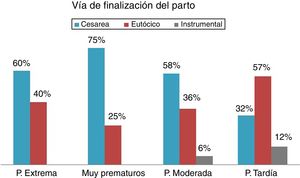
Los resultados obtenidos para cada grupo de prematuridad se resumen en las tablas 1 y 2 y las figuras 1 y 2.
Resultados según los grupos de prematuridad
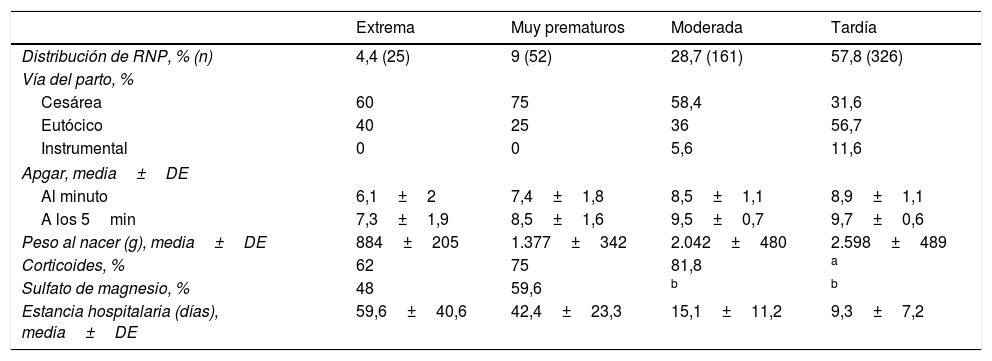
| Extrema | Muy prematuros | Moderada | Tardía | |
|---|---|---|---|---|
| Distribución de RNP, % (n) | 4,4 (25) | 9 (52) | 28,7 (161) | 57,8 (326) |
| Vía del parto, % | ||||
| Cesárea | 60 | 75 | 58,4 | 31,6 |
| Eutócico | 40 | 25 | 36 | 56,7 |
| Instrumental | 0 | 0 | 5,6 | 11,6 |
| Apgar, media±DE | ||||
| Al minuto | 6,1±2 | 7,4±1,8 | 8,5±1,1 | 8,9±1,1 |
| A los 5min | 7,3±1,9 | 8,5±1,6 | 9,5±0,7 | 9,7±0,6 |
| Peso al nacer (g), media±DE | 884±205 | 1.377±342 | 2.042±480 | 2.598±489 |
| Corticoides, % | 62 | 75 | 81,8 | a |
| Sulfato de magnesio, % | 48 | 59,6 | b | b |
| Estancia hospitalaria (días), media±DE | 59,6±40,6 | 42,4±23,3 | 15,1±11,2 | 9,3±7,2 |
DE: desviación estándar; RNP: recién nacido prematuro.
Morbimortalidad neonatal según los grupos de prematuridad
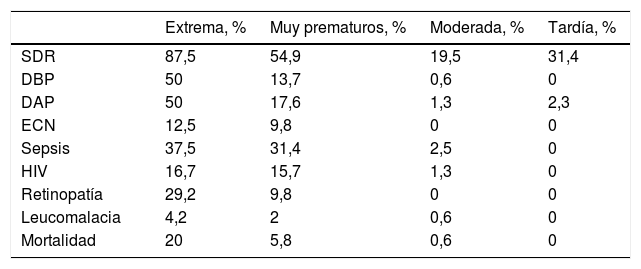
| Extrema, % | Muy prematuros, % | Moderada, % | Tardía, % | |
|---|---|---|---|---|
| SDR | 87,5 | 54,9 | 19,5 | 31,4 |
| DBP | 50 | 13,7 | 0,6 | 0 |
| DAP | 50 | 17,6 | 1,3 | 2,3 |
| ECN | 12,5 | 9,8 | 0 | 0 |
| Sepsis | 37,5 | 31,4 | 2,5 | 0 |
| HIV | 16,7 | 15,7 | 1,3 | 0 |
| Retinopatía | 29,2 | 9,8 | 0 | 0 |
| Leucomalacia | 4,2 | 2 | 0,6 | 0 |
| Mortalidad | 20 | 5,8 | 0,6 | 0 |
DAP: ductus arterioso persistente; DBP: displasia broncopulmonar; ECN: enterocolitis necrosante; HIV: hemorragia intraventricular; SDR: síndrome de distrés respiratorio.
Se usaron corticoides (excluyendo prematuridad tardía) en 238 prematuros.
En nuestra muestra, un 74,3% de los prematuros incluidos recibieron maduración pulmonar completa con corticoides. Se incluyeron para este análisis los prematuros nacidos con anterioridad a la semana 35.
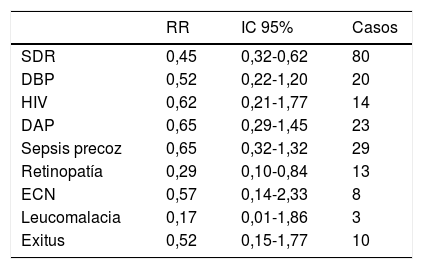
La morbimortalidad en cuanto al uso de este fármaco se ve reflejada en la tabla 3.
Morbimortalidad con el uso de corticoides
| RR | IC 95% | Casos | |
|---|---|---|---|
| SDR | 0,45 | 0,32-0,62 | 80 |
| DBP | 0,52 | 0,22-1,20 | 20 |
| HIV | 0,62 | 0,21-1,77 | 14 |
| DAP | 0,65 | 0,29-1,45 | 23 |
| Sepsis precoz | 0,65 | 0,32-1,32 | 29 |
| Retinopatía | 0,29 | 0,10-0,84 | 13 |
| ECN | 0,57 | 0,14-2,33 | 8 |
| Leucomalacia | 0,17 | 0,01-1,86 | 3 |
| Exitus | 0,52 | 0,15-1,77 | 10 |
DAP: ductus arterioso persistente; DBP: displasia broncopulmonar; ECN: enterocolitis necrosante; HIV: hemorragia intraventricular; IC 95%: intervalo de confianza al 95%; RR: riesgo relativo; SDR: síndrome de distrés respiratorio.
El sulfato de magnesio (excluyendo prematuridad tardía y moderada) se usó en 76 prematuros.
En nuestra muestra, un 67,1% de los prematuros incluidos recibieron neuroprotección con sulfato de magnesio. Se incluyeron para este análisis los prematuros nacidos con anterioridad a la semana 32.
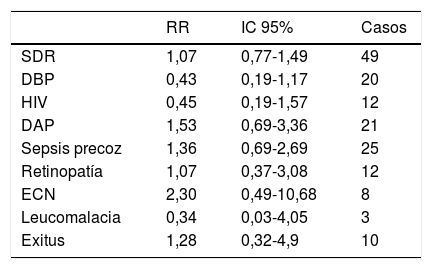
La morbimortalidad en cuanto al uso de este fármaco se ve reflejada en la tabla 4.
Morbimortalidad con el uso de sulfato de magnesio
| RR | IC 95% | Casos | |
|---|---|---|---|
| SDR | 1,07 | 0,77-1,49 | 49 |
| DBP | 0,43 | 0,19-1,17 | 20 |
| HIV | 0,45 | 0,19-1,57 | 12 |
| DAP | 1,53 | 0,69-3,36 | 21 |
| Sepsis precoz | 1,36 | 0,69-2,69 | 25 |
| Retinopatía | 1,07 | 0,37-3,08 | 12 |
| ECN | 2,30 | 0,49-10,68 | 8 |
| Leucomalacia | 0,34 | 0,03-4,05 | 3 |
| Exitus | 1,28 | 0,32-4,9 | 10 |
DAP: ductus arterioso persistente; DBP: displasia broncopulmonar; ECN: enterocolitis necrosante; HIV: hemorragia intraventricular; IC 95%: intervalo de confianza al 95%; RR: riesgo relativo; SDR: síndrome de distrés respiratorio.
La prematuridad es la principal causa de mortalidad neonatal y una de las más importantes causantes de morbilidad grave. Por ello, consideramos de vital importancia conocer su incidencia en cada uno de los centros; la tasa de incidencia de RNP en el complejo hospitalario de Huelva entre 2018-2019 ha sido en los últimos años del 7,96%.
A nivel mundial, la tasa de prematuridad se ha situado en el 11% de los nacidos vivos. En Europa esta cifra disminuye hasta un 5% en Europa, mientras que en países de menor nivel socioeconómico, como en ciertas zonas de África, se eleva hasta un 18%9. En España, según datos registrados en el Instituto Nacional de Estadística para 2018, la incidencia se sitúa en el 6,5%, dato ligeramente inferior a los descritos en este trabajo10.
La distribución de RNP por cada grupo de prematuridad en nuestra muestra es similar a la descrita en la literatura9.
La mortalidad estratificada por los distintos grupos de prematuridad difiere de la descrita en otras series9; nuestra muestra presenta un mejor porcentaje para el grupo de RNP extremos (20 vs. 37%) y RNP moderados (0,6 vs. 1,6%). Sin embargo, en el caso del grupo de RNP muy prematuros, la mortalidad en nuestra muestra es algo mayor (5,8 vs. 3,5%) (tabla 2).
La morbilidad neonatal (tabla 2) nos deja entrever la disminución de la incidencia de cada una de sus entidades en relación con el aumento de la edad gestacional. Se puede destacar una diferencia entre el grupo de RNP moderada, menor, frente al grupo RNP tardío, mayor, en la incidencia de SDR, hecho inusual y escasamente descrito, sobre el que podemos establecer una hipotética relación con el posible beneficio del uso de corticoides en una situación aún sin indicación, como es la prematuridad tardía, pero que se encuentra entre los objetivos de diversos estudios11,12.
Es bien conocido que el tratamiento con corticoides antenatales reduce la incidencia de SDR, de HIV, de enterocolitis necrosante, de displasia broncopulmonar y la mortalidad neonatal en un 50% aproximadamente13,14. El principal resultado en nuestra muestra ha sido la disminución en la morbilidad en general y en la mortalidad neonatal respecto al grupo de RNP no tratados con corticoides.
Sin embargo, esta disminución solo ha tenido significación estadística en los casos de SDR/enfermedad de la membrana hialina y de retinopatía del prematuro. El motivo de esta diferencia puede ser que la muestra de nuestro estudio no alcance el número de casos suficientes para demostrar la magnitud de tal efecto, tan ampliamente descrito en la literatura13.
En las gestantes en las que se indicó el uso de sulfato de magnesio7,8, los principales resultados han sido la disminución de la HIV, de la leucomalacia periventricular y de la displasia broncopulmonar, aunque estas relaciones no fueron estadísticamente significativas.
No existieron diferencias significativas en la mortalidad neonatal entre los recién nacidos expuestos y no expuestos al sulfato de magnesio, de manera similar a lo descrito en la bibliografía6.
La investigación futura debería centrarse en la evaluación de los niños a edades más tardías para valorar los efectos a largo plazo del fármaco sobre las funciones motoras y cognitivas. Debido a la heterogeneidad entre los estudios publicados hasta este momento, no existe consenso en relación con la edad gestacional límite para indicar este medicamento, por lo que en los distintos países se rigen por protocolos diferentes12.
Una de las limitaciones de nuestro estudio ha sido el carácter retrospectivo de este, el cual limita la solidez científica de las afirmaciones llevadas a cabo y su capacidad a la hora de extraer conclusiones con una validez apropiada. Como ya se ha comentado previamente, otra de las limitaciones sería el tamaño de la muestra, el cual podría resultar insuficiente para conseguir una relación significativa en ciertas variables analizadas.
Llama la atención el hecho de que en los grupos de prematuridad anterior a la semana 32 haya un mayor porcentaje de administración de corticoides que de sulfato de magnesio (tabla 1). Para ello es necesario aclarar que, en nuestro centro, la primera dosis de corticoides, por lo general, se administra al ingreso, por lo que si en 24h no ocurre el parto se administra una segunda dosis, completándose la maduración pulmonar. Sin embargo, el sulfato de magnesio (administrado antes de las 32 semanas) se inicia en el caso de que la situación clínica empeore y se prevea la finalización de la gestación; esto hace que en determinadas pacientes esta finalización sea tan inminente que este tratamiento no se pueda completar.
ConclusionesLa prevalencia de la prematuridad en nuestro centro (7,96%) es mayor a la descrita en nuestro país (6,5%) y en Europa (5%). Sin embargo, la morbimortalidad registrada en nuestra muestra fue similar a las descritas en la bibliografía, dentro de cada grupo de prematuridad.
Dada la incidencia algo más elevada de SDR en nuestra muestra en el grupo de prematuridad tardía respecto a la moderada, la administración prenatal de corticoides podría llegar a ser una medida preventiva eficaz en este grupo de prematuridad, aunque esta no sea una indicación a día de hoy según el protocolo. En relación con la eficacia de los corticoides en la prematuridad tardía, existen pocos estudios publicados en la actualidad4.
En nuestra muestra, el tratamiento con corticoides para la maduración pulmonar redujo la morbimortalidad neonatal en general; sin embargo, esta reducción solo fue estadísticamente significativa en el SDR y la retinopatía del prematuro. El tratamiento con sulfato de magnesio también reveló una mejoría en algunas enfermedades y en la mortalidad, aunque no de manera estadísticamente significativa.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLos autores declaran que esta publicación no ha sido financiada por ninguna entidad.
Conflicto de interesesLos autores declaran que en esta publicación no existe conflicto de intereses.