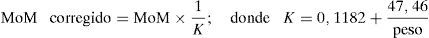Determinar si los niveles plasmáticos de proteína A asociada a la gestación (PAPP-A) expresada en múltiplos de la mediana (MoM) se pueden emplear para predecir la macrosomía fetal, independientemente de otros parámetros clínicos o ecográficos.
Determinar el riesgo que puede presentar una gestante de tener un feto macrosómico en función de los valores de la PAPP-A.
Material y métodosEstudio epidemiológico, observacional, analítico, tipo casos y controles, desarrollado entre junio de 2011 y julio de 2012 con pacientes del Complexo Hospitalario Universitario de Ourense.
ResultadosLos resultados del presente estudio apuntan a que los niveles maternos de PAPP-A (MoM) se asocian positivamente al peso fetal.
Por cada punto que se incrementa la PAPP-A, aumenta 2,6 veces el riesgo de tener un recién nacido macrosómico.
ConclusionesLos valores de PAPP-A expresados en MoM se comportan como un predictor independiente de macrosomía fetal, sin estar influidos por factores maternos o parámetros ecográficos fetales precoces.
Un valor de PAPP-A (MoM) por encima de 1,89 puede predecir la macrosomía fetal con una especificidad superior al 80%.
Los valores de PAPP-A (MoM) son capaces de discriminar entre un futuro recién nacido de peso normal y macrosómico en el 75% de los casos.
To determine whether plasma levels of pregnancy-associated plasma protein-A (PAPP-A) expressed in multiples of the median (MoM) can be used to predict fetal macrosomia, independently of other clinical or ultrasound parameters, and to determine the risk of having a macrosomic fetus in pregnant women, based on PAPP-A values.
Material and methodsAn epidemiological, observational, analytical, case-control study was performed between June 2011 and July 2012 in patients at the the University Hospital of Ourense.
ResultsThe results of this study suggest that maternal levels of PAPP-A (MoM) are positively associated with fetal weight. A 2.6-fold increment in the risk of having a macrosomic neonate was found for each point-increase in PAPP-A.
ConclusionsPAPP-A values expressed in MoM are an independent predictor of fetal macrosomy and are not influenced by maternal factors or early fetal ultrasound parameters. PAPP-A (MoM) values exceeding 1.89 can predict fetal macrosomia with a specificity of above 80%. In 75% of cases, PAPP-A (MoM) values discriminate between future neonates with normal weight and those with macrosomia.
La proteína plasmática A asociada al embarazo (PAPP-A) es una enzima fijadora de cinc perteneciente a la familia de las metaloproteinasas1,2, de alto peso molecular, identificada por primera vez en 1974 por Lin et al.3 como una proteína circulante en el suero de mujeres con gestaciones avanzadas. Además de sintetizarse en la placenta, la PAPP-A se presenta en una amplia variedad de tejidos y órganos reproductores (como los testículos y el endometrio) y no reproductores (como el riñón y el colon)4, pero en concentraciones mucho más bajas que en la gestación. La PAPP-A es secretada también por osteoblastos, células de la capa granulosa del ovario y por las células musculares lisas vasculares.
Su expresión se regula mediante un gen localizado en el cromosoma 9q33.15.
En 1992 encontramos las primeras publicaciones que apuntan a que los niveles plasmáticos bajos de PAPP-A son capaces de predecir el riesgo fetal de padecer síndrome de Down6,7 y, actualmente, el cribado combinado del primer trimestre se emplea en la mayoría de los hospitales para el tamizado poblacional de algunas cromosomopatías.
Desde el año 1981 podemos encontrar múltiples publicaciones que relacionan las variaciones en los niveles de la PAPP-A con complicaciones fetales. Así, la primera de ellas que asocia los niveles bajos de PAPP-A con los estados hipertensivos de la gestación se debe a Toopk et al.8. En la actualidad, esta relación es una realidad clínica, empleada en muchos hospitales en el protocolo de predicción de la preeclampsia cuando los valores de la PAPP-A son inferiores a 0,4 múltiplos de la mediana (MoM)9.
Con posterioridad, han aparecido en la bibliografía internacional artículos que correlacionan los niveles bajos o extremadamente bajos de este marcador bioquímico con el retraso de crecimiento intraútero10,11, el aborto precoz12 y la diabetes gestacional13. Sin embargo, en la práctica clínica ninguna de esas relaciones se está empleando en el cribado poblacional y son necesarios más estudios sistemáticos para conocer su aplicación real.
Por otro lado, al repasar la literatura médica, encontramos muy pocos trabajos que relacionen los valores altos de PAPP-A, obtenidos al realizar el cribado cromosómico, y las complicaciones obstétricas.
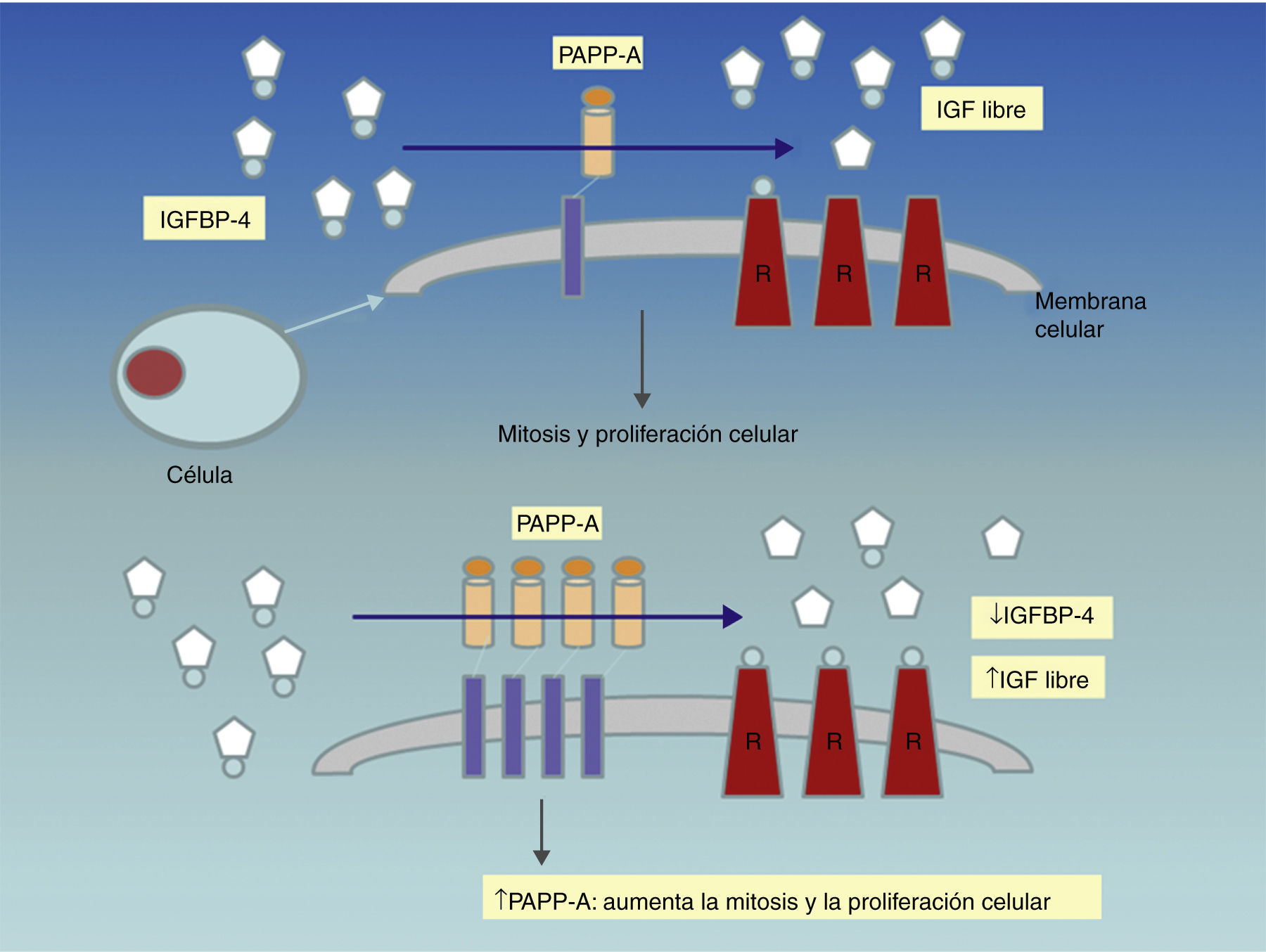
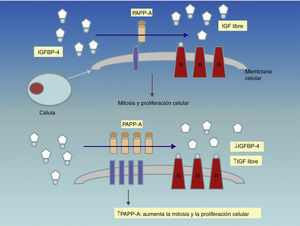
Es importante recordar el mecanismo de acción de la PAPP-A. Hasta 1999 su función era desconocida. Ese año, Lawrence et al. demostraron la actividad proteasa del IGF (factores de crecimiento insulin–like) unido a la proteína-4 (IGFBP-4)13 (17): cuando los IGF están unidos a la BP-4, no pueden interaccionar con su receptor de superficie. Sin embargo, cuando la PAPP-A fragmenta dicho complejo, los IGF se liberan, permitiendo su unión con los receptores celulares. Los IGF promueven localmente la mitosis y la diferenciación celular y son de especial relevancia tanto en la embriogénesis como en la regulación del crecimiento fetal y placentario. Al actuar liberando IGF, la PAPP-A se comporta como modulador del crecimiento y proliferación celular.
Este mecanismo de acción explica la relación de los niveles bajos de PAPP-A con el retraso de crecimiento intraútero y lógicamente es capaz de justificar por qué niveles elevados de PAPP-A se relacionan con fetos macrosómicos, siendo esta la base teórica de nuestro estudio.
Objetivos- -
Determinar si los niveles de PAPP-A (expresados tanto en valores absolutos: mUI/ml, como en MoM) obtenidos en el cribado de aneuploidías del primer trimestre se pueden utilizar para la predicción de la macrosomía fetal en gestantes no diabéticas, independientemente de otros parámetros clínicos maternos o ecográficos del primer trimestre (traslucencia nucal [TN] y longitud craneocaudal [CRL]).
- -
Calcular el riesgo que puede presentar una paciente de tener un recién nacido (RN) macrosómico en función de los valores de PAPP-A.
Estudio epidemiológico, observacional, analítico, tipo casos y controles.
El estudio se desarrolla entre junio de 2011 y julio de 2012 con pacientes controladas en el Complexo Hospitalario Universitario de Ourense. La muestra estuvo formada por 121 pacientes, distribuidas en 2 grupos.
Grupo casosPacientes con RN a término de peso ≥4.000g que habían realizado el cribado combinado del primer trimestre (CPT) en nuestro Servicio (n=58).
Exclusiones: pacientes con diabetes pregestacional o gestacional.
Grupo controlesGestaciones consecutivas que finalizaron en nuestro Servicio con pesos al nacimiento a término de<4.000g que habían realizado CPT (n=63).
Exclusiones: presencia de complicaciones perinatales.
Definimos como RN macrosómico aquel que superó los 4.000g. de peso al nacimiento.
Posteriormente, llevamos a cabo un subestudio tipo casos y controles con datos apareados.
Análisis estadísticoRealizamos el análisis descriptivo de los datos. Las variables continuas se muestran como media, mediana, mínimo, máximo y desviación típica, con las pruebas de normalidad de Kolmogorov Smirnov.
Para la determinación de las diferencias en las PAPP-A entre casos y controles utilizamos la prueba U de Mann-Whitney.
Realizamos la representación gráfica mediante modelos GAM (modelos aditivos generalizados) con respuesta gaussiana y binaria para conocer el comportamiento de los valores de la PAPP-A con respecto a los pesos de los RN y del riesgo de ser macrosómico, respectivamente.
Mediante curvas relative operating characteristic (ROC), determinamos el punto de corte óptimo (o punto diagnóstico óptimo) para predecir el riesgo de feto macrosómico; así como el cálculo del valor predictivo positivo y negativo, la sensibilidad y especificidad de dicho punto.
El análisis del subestudio de casos y controles con datos apareados se realizó mediante regresión logística condicional. Comprobamos la dependencia entre los valores de PAPP-A (MoM) y la macrosomía fetal.
En todos los casos consideramos estadísticamente significativo p<0,05.
En el análisis utilizamos el programa SPSS 15.0, Epidat 3.0 y el software libre R.
Los valores de la PAPP-A fueron obtenidos de las muestras extraídas para el CPT entre las semanas 11+3 y 13+5 de amenorrea.
Las determinaciones de los marcadores bioquímicos se llevaron a cabo en el autoanalizador Inmulite 2000. El principio de análisis para la determinación de la PAPP-A es un ensayo enzimático inmunométrico quimioluminiscente en fase sólida, con una sensibilidad de 0,025mIU/ml, empleando anticuerpos monoclonales murino anti-PAPP-A. Para el cálculo de los MoM de la PAPP-A empleamos el programa PRISCA.
ResultadosEn nuestro centro, la prevalencia de macrosomía fetal que encontramos en el periodo de tiempo estudiado fue de un 4,56%. Del total de fetos macrosómicos estudiados, tan solo el 11,84% eran hijos de madres diabéticas.
De los RN macrosómicos, el 75,86% (n=44) fueron varones, frente al 52,38% (n=33) del grupo control (p<0,001).
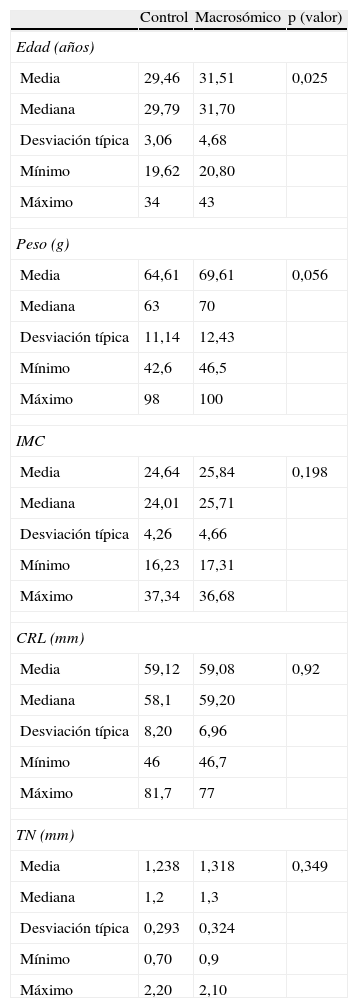
Estadísticos descriptivos continuos de ambos grupos (tabla 1).
- -
Edad materna: la edad media del grupo control fue inferior respecto al grupo casos, con significación estadística (p=0,025), pero este parámetro presenta poca relevancia clínica, dado que la diferencia de las medias entre ambos grupos es de 2 años y al valorar la mediana (estadístico que valora el grado de dispersión de la muestra) observamos que la diferencia era menor a 2.
- -
Peso materno al inicio de la gestación: ambos grupos a estudio fueron similares al comparar el peso materno (p=0,056). Si procedemos a comparar el índice de masa corporal (IMC), parámetro mucho más objetivo para valorar el estado nutricional dado que tiene en cuenta el peso y la talla de la paciente, observamos que tampoco existía diferencia estadística entre ambos grupos (p=0,198).
- -
Hábito tabáquico: en el grupo de madres de fetos macrosómicos encontramos una prevalencia de tabaquismo del 6,9%, mientras que en el grupo control fue del 22,2%. Este parámetro no alcanzó significación estadística (p=0,072).
- -
CRL: se realizó la comparación de la CRL de los fetos de ambos grupos en el momento de la determinación de la PAPP-A, dado que en la bibliografía encontramos que los valores de PAPP-A aumentan paralelamente a la CRL, y queremos demostrar que ambos grupos son similares en sus características. En el grupo macrosómico, la media fue de 59,08mm y en el grupo control de 59,12mm. Los valores encontrados de CRL fueron prácticamente idénticos (p=0,92).
- -
TN: existen artículos médicos que encuentran que un incremento de TN puede constituir un marcador de macrosomía. En nuestro trabajo pretendíamos eliminar cualquier factor de confusión en la predicción de macrosomía, por lo que se procedió a comparar esta variable. En el grupo a estudio su media fue de 1,318mm con un máximo de 2,1 y un mínimo de 0,9mm, mientras que en el grupo control la media fue de 1,238mm con un máximo de 2,2 y un mínimo de 0,7mm (p=0,349).
- -
Paridad: en el grupo de mujeres que tuvieron un RN macrosómico observamos que el 37, 9% eran nulíparas y solo el 3,44% eran multíparas; mientras que en el grupo control el 52,38% (n=33) eran nulíparas y el 6,35% multíparas. El grupo casos presenta menor incidencia de multíparas, sin significación estadística (p=0,107), y el grupo control una mayor incidencia de nulíparas (p=0,175).
- -
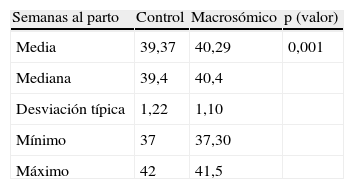
Semanas al parto: el grupo control presenta una edad gestacional al parto mayor que el grupo casos, con significación estadística (p=0,001) (tabla 2).
- -
Peso de los RN: en el grupo macrosómico la media encontrada fue de 4.187,24g con una desviación típica de 260,77, entre un máximo y un mínimo de 5.120g y 4.000g, respectivamente. En el grupo control la media fue de 3.178,8g con una desviación típica de 338,8, siendo el máximo y el mínimo de 3.810g y 2.600g.
- -
Tipo de parto: en nuestro grupo a estudio encontramos que el 37,93% (n=22) finalizaron la gestación mediante cesárea, siendo el 95,45% de estas realizadas intraparto con la indicación de parto estacionado. Si nos limitamos al grupo control, la finalización mediante cesárea ocurrió en el 11% (n=7).
Al comparar ambos grupos, observamos que la finalización mediante cesárea fue 3 veces más frecuente en el grupo de fetos macrosómicos (p<0,003; IC95%: 0,476-0,055).
La frecuencia encontrada de partos instrumentales también fue mayor en el grupo de fetos macrosómicos (17,24%; n=10) que en el grupo control (11%; n=7), pero sin alcanzar significación estadística.
Es interesante resaltar que el RN encontrado con mayor peso (5.120g) finalizó la gestación mediante vacuum extractor y no se produjeron complicaciones maternas ni neonatales.
- -
Proteína A asociada a la gestación (PAPP-A): los valores de la PAPP-A podemos expresarlos en mUI/ml o como MoM.
- 1.
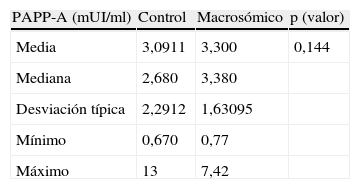
PAPP-A expresada en mUI/ml: en nuestro trabajo observamos que estos valores fueron superiores en el grupo de fetos macrosómicos, pero sin alcanzar significación estadística (p=0,144) (tabla 3).
- 2.
PAPP-A expresada en MoM: ¿qué son los MoM? En el cribado de cromosomopatías, el primer paso para obtener la razón de probabilidad dependiente de los marcadores (tanto ecográficos como bioquímicos) es la estandarización del valor de dichos marcadores. Para esta estandarización se usa como unidad de medida el MoM, el cual se obtiene dividiendo el valor del marcador por la mediana propia del centro para ese marcador y para la edad gestacional.
- 1.
Estadísticos descriptivos
| Control | Macrosómico | p (valor) | |
| Edad (años) | |||
| Media | 29,46 | 31,51 | 0,025 |
| Mediana | 29,79 | 31,70 | |
| Desviación típica | 3,06 | 4,68 | |
| Mínimo | 19,62 | 20,80 | |
| Máximo | 34 | 43 | |
| Peso (g) | |||
| Media | 64,61 | 69,61 | 0,056 |
| Mediana | 63 | 70 | |
| Desviación típica | 11,14 | 12,43 | |
| Mínimo | 42,6 | 46,5 | |
| Máximo | 98 | 100 | |
| IMC | |||
| Media | 24,64 | 25,84 | 0,198 |
| Mediana | 24,01 | 25,71 | |
| Desviación típica | 4,26 | 4,66 | |
| Mínimo | 16,23 | 17,31 | |
| Máximo | 37,34 | 36,68 | |
| CRL (mm) | |||
| Media | 59,12 | 59,08 | 0,92 |
| Mediana | 58,1 | 59,20 | |
| Desviación típica | 8,20 | 6,96 | |
| Mínimo | 46 | 46,7 | |
| Máximo | 81,7 | 77 | |
| TN (mm) | |||
| Media | 1,238 | 1,318 | 0,349 |
| Mediana | 1,2 | 1,3 | |
| Desviación típica | 0,293 | 0,324 | |
| Mínimo | 0,70 | 0,9 | |
| Máximo | 2,20 | 2,10 | |
Esta simple operación nos permite la comparación de los valores (expresados en MoM) entre distintos centros que usen técnicas de medición diferentes.
Existen algunos factores maternos (peso, raza, hábito tabáquico, gestación espontánea/fecundación in vitro o diabetes) que pueden afectar a la precisión de los marcadores bioquímicos, por lo que es necesario realizar ajustes. Para ello, la forma más simple de corrección consiste en multiplicar el valor del marcador (MoM) por un factor de corrección ya conocido: por ejemplo, para estandarizar el MoM por el factor peso materno usaríamos la siguiente fórmula:
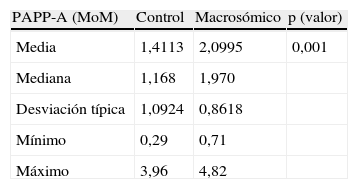
En nuestro trabajo, al comparar los valores de la PAPP-A (MoM) observamos que el grupo de casos presenta valores muy superiores al grupo control, siendo la media en los primeros de 2,099 frente a 1,411 en los segundos, para una p<0,001 (tabla 4).
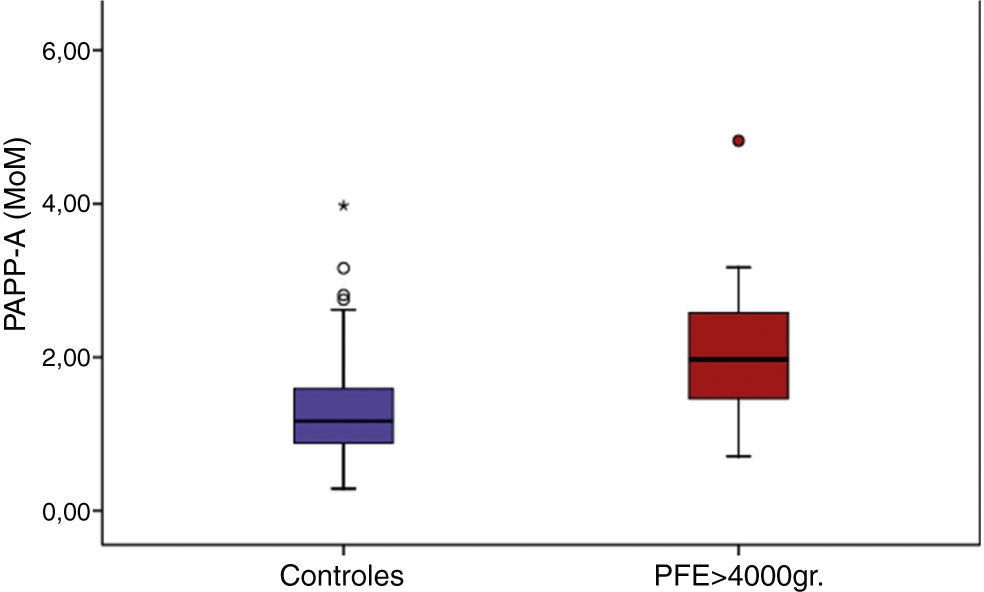
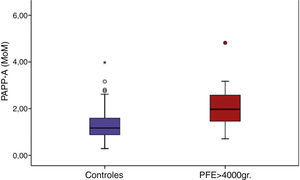
Si procedemos a representar nuestros datos en un diagrama de cajas, observamos que prácticamente el 100% de los valores de PAPP-A del grupo control (caja azul) se sitúan por debajo de 2 MoM, y tan solo encontramos un valor por encima de este nivel próximo a los 4 MoM. Por el contrario en el grupo de casos, representados en rojo, observamos cómo más del 50% (percentil 50 de la gráfica) tiene valores superiores a los 2 MoM, encontrándose el 75% de la muestra por encima de 1,75 MoM (fig. 1).
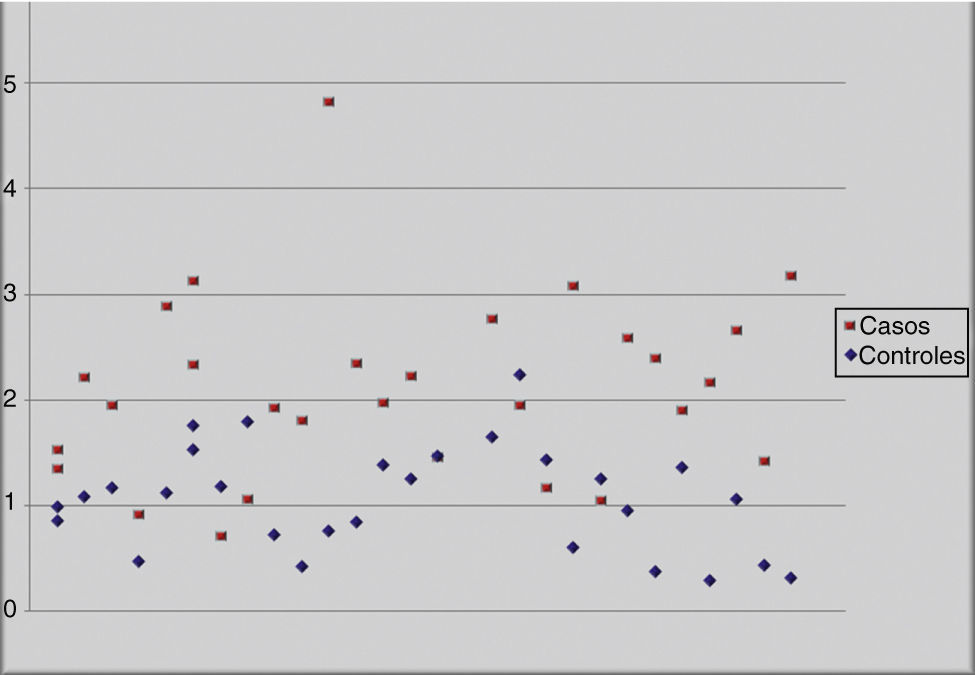
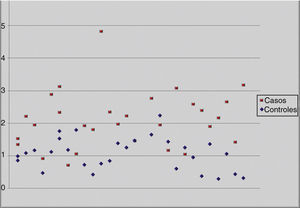
Esa misma relación la podemos evidenciar gráficamente mediante un diagrama de dispersión (fig. 2), donde casi el 100% de los controles (excepto uno) se encuentran por debajo de 2 MoM y más del 75% de los casos tienen valores superiores a 2 MoM.
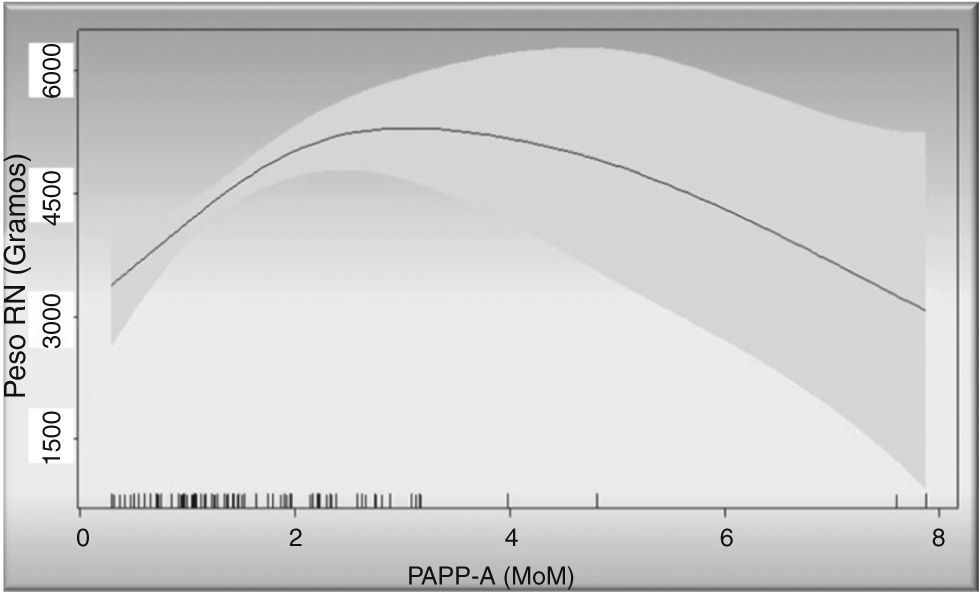
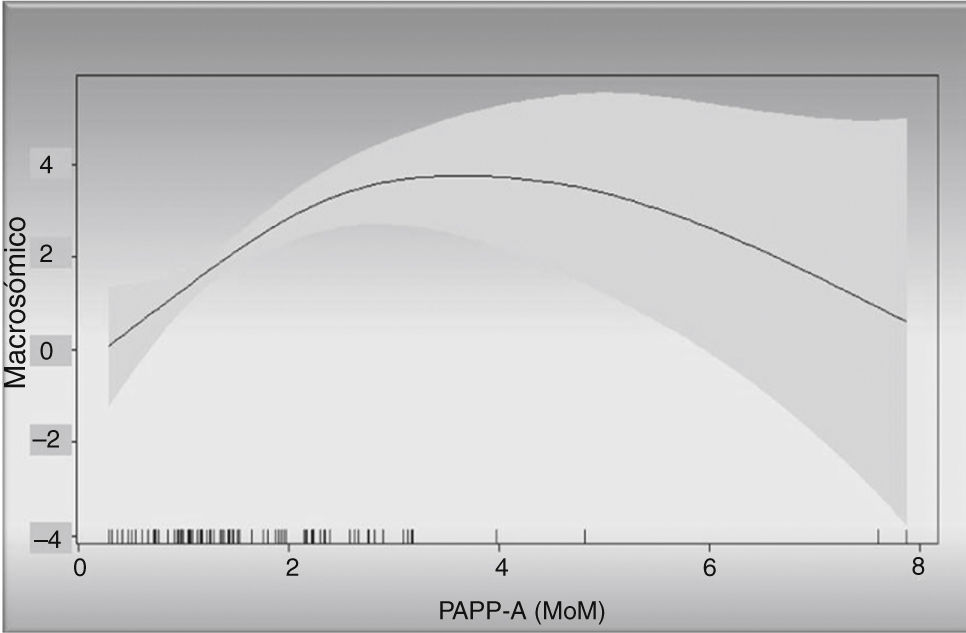
Con el modelo de regresión GAM suavizado mediante p-spline con respuesta logística y gaussiana se obtuvo que los valores de la PAPP-A poseían un comportamiento lineal y además significativo (p=0,005 para los pesos fetales y p<0,001 para el riesgo de ser macrosómico).
La elección de un modelo GAM con suavización se debe a que este tipo de modelos resultan ser óptimos para confirmar el comportamiento lineal o no lineal de las variables. De esta forma, conocemos que, tanto el «riesgo de macrosomía» como el valor «peso fetal» aumentan de forma lineal a medida que se incrementan los valores de PAPP-A.
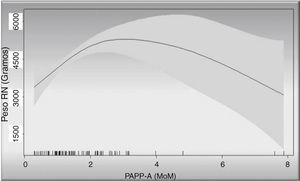
En la figura 3 observamos la relación entre PAPP-A y pesos fetales: vemos como a medida que se incrementan los valores de la PAPP-A se incrementan los pesos fetales. La relación entre ambos sigue una línea ascendente hasta los 3MoM, luego la gráfica deja de ser valorable por el pequeño número de casos con valores mayores a 3MoM de los que disponemos, pero sería de esperar que la línea se mantuviese en meseta, dado que es imposible pensar que los pesos fetales se incrementasen infinitamente. Podemos observar como para un valor de PAPP-A de 2MoM sería de esperar un peso fetal superior de 4.500g para un intervalo de confianza del 95%.
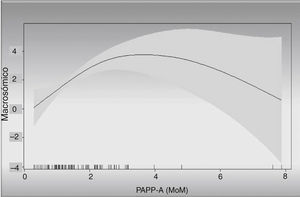
Igual ocurre con la relación PAPP-A y «riesgo de ser macrosómico» (fig. 4); así observamos que con una PAPP-A de 2 MoM el riesgo de ser macrosómico es 2,5 veces al del grupo control.
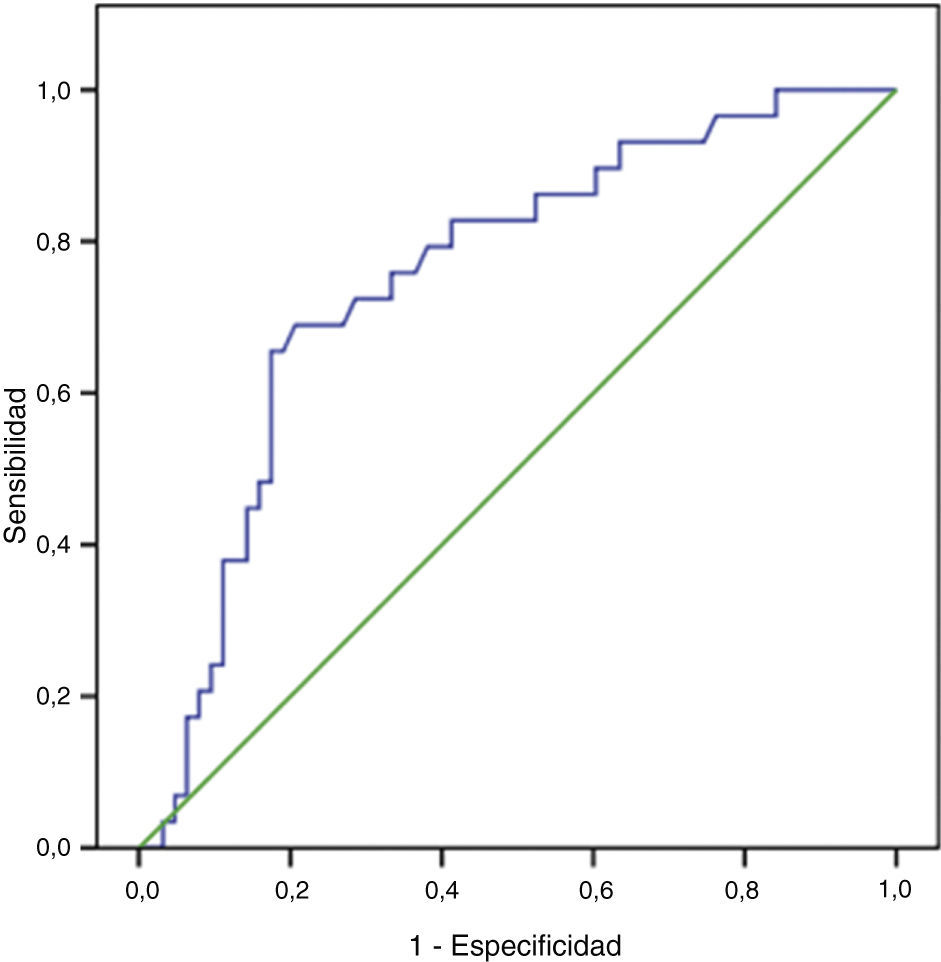
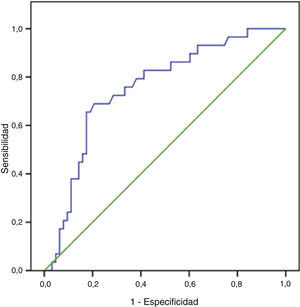
Mediante la realización de la curva ROC vamos a representar de manera gráfica la tasa de éxito, es decir, la capacidad discriminatoria que tiene la PAPP-A (MoM) para predecir fetos que van a ser macrosómicos o que van a tener un peso normal (fig. 5).
Para ello, el parámetro a estimar es el área bajo la curva ROC (area under the curve [AUC]), que refleja «cuán exacta» es la PAPP-A para discriminar a fetos que van a ser macrosómicos a lo largo de todo el rango de puntos de corte posibles.
En nuestro estudio encontramos un AUC de 0,7531, es decir, puede predecir la macrosomía fetal en el 75,31% (IC95%: 65,23-83,71).
Cuanto mayor sea el AUC, más capacidad tendrá el test para discriminar entre fetos macrosómicos y fetos con peso normal, de manera que si el AUC fuese 1 el test sería perfecto. En nuestro caso, la PAPP-A predecirá con acierto la macrosomía fetal en 3 de cada 4 ocasiones.
Con la curva ROC, también es posible calcular el «punto óptimo» con las mayores sensibilidad y especificidad (es el mejor punto de corte posible para realizar un diagnóstico o una predicción). Nosotros encontramos que el punto óptimo para la predicción de la macrosomía usando el valor de la PAPP-A (MoM) es 1,89; con una sensibilidad de 65,52% (IC95%: 47,35-80,06) y una especificidad de 82,54% (IC95%: 71,38-89,06), siendo el valor predictivo positivo 63,33 y el valor predictivo negativo 83,87. Se trata de un punto con una alta especificidad, ya que desde el punto de vista médico se puede considerar un «buen test» diagnóstico aquel que presenta una especificidad superior al 80%.
Finalmente, realizamos un subestudio de casos y controles apareados (1:1), con el fin de evitar los posibles factores de confusión. Para el apareamiento de un control con cada caso tuvimos en cuenta los siguientes criterios: hábito tabáquico (sí/no, variable continua excluyente), edad (diferencia máxima aceptada entre casos y controles: 2 años), IMC (diferencia máxima aceptada de 2 puntos) y paridad (variable en la que no aceptamos diferencias entre casos y controles). Para el cálculo de resultados aplicamos como prueba estadística la regresión logística condicional.
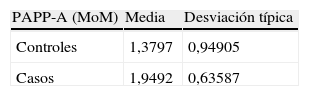
Los resultados se pueden observar en la tabla 5.
Con los resultados del estudio casos y controles apareados podemos afirmar que la PAPP-A expresada en MoM es un factor independiente de predicción de macrosomía fetal y que por cada punto que se incrementa la PAPP-A (MoM) aumenta el riesgo de tener un RN macrosómico en 2,6 veces para un intervalo de confianza del 95%.
Como resumen de nuestros resultados podemos afirmar:
- -
Los RN macrosómicos presentan valores de PAPP-A (MoM) más elevados entre la semana 11 y 13 de gestación.
- -
Los valores de PAPP-A expresados en MoM se comportan como un predictor independiente de macrosomía fetal, sin estar influidos por factores maternos o parámetros ecográficos fetales precoces.
- -
Un valor de PAPP-A (MoM) por encima de 1,89 puede predecir la macrosomía fetal con una especificidad superior al 80%.
- -
Los valores de PAPP-A (MoM) son capaces de discriminar entre un futuro RN de peso normal y macrosómico en el 75% de los casos.
- -
Por cada punto que se eleva el valor de PAPP-A (MoM) aumenta el riesgo de ser macrosómico en 2,6 veces.
Macrosomía es el término utilizado para describir a un RN demasiado grande14. En la actualidad la definición más universalmente aceptada es «aquel RN cuyo peso se encuentra por encima del percentil 90 para la edad gestacional»15. Sin embargo, algunos autores sugieren un peso mayor de 4.000g, mientras que otros proponen un peso superior a 4.500g o incluso 5.000g14.
La macrosomía fetal puede asociarse a diferentes factores clínicos de riesgo: masa corporal previa al embarazo, tercera década de la vida, no fumadoras, diabetes materna, multiparidad, embarazo prolongado, antecedente de hijo previo macrosómico, entre otros14.
Se asocia con un incremento de riesgos para la madre, incluyendo el aumento de incidencia de cesáreas, traumatismos del canal del parto, hemorragias posparto; y para el RN, la distocia de hombros, parálisis del plexo braquial, fractura del húmero o clavícula, alteraciones del nervio facial15.
Es realmente difícil predecir la macrosomía fetal, ya que los métodos diagnósticos disponibles son sobremanera imprecisos: la valoración clínica solo presenta una sensibilidad del 10-43% (ACOG 2000) y la estimación ecográfica del peso fetal está expuesta a presentar grandes errores14. Así, solo con la estimación clínica, autores como Zamorski y Biggs plantean que solo el 50% de los fetos clasificados como macrosómicos también lo fueron al nacer14. Debido a todo ello, parece interesante la utilización de marcadores bioquímicos para un diagnóstico más objetivo de embarazos de alto riesgo de desarrollar macrosomía fetal.
La prevalencia de macrosomía fetal oscila entre el 5 y el 7%. En nuestra población obtuvimos una prevalencia del 4,56%, ligeramente inferior a la estimada y de estos, solo un 11,84% fueron hijos de madre diabética. La estrecha relación existente entre macrosomía fetal y diabetes materna se ha estudiado en detalle y es de sobra conocida. No obstante, autores como Leperg et al. encontraron que el 80% de los RN macrosómicos son de madres no diabéticas14, incluso esta cifra es ligeramente inferior a las nuestras, que se aproxima al 89%.
Clásicamente el sexo varón es un factor de riesgo clínico de feto macrosómico y en nuestro estudio encontramos esta relación estadísticamente significativa. Sin embargo, existen múltiples controversias en cuanto a la relación entre los niveles de PAPP-A y el sexo fetal, correlación que no hemos investigado en nuestro trabajo por este motivo: en la literatura encontramos artículos que relacionan niveles más elevados de PAPP-A en fetos hembra que en fetos varón16, resultados cuestionados por otros autores17,18, y estudios donde no se encuentran diferencias estadísticamente significativas entre ambos sexos19.
La edad mayor de 35 años es un factor de riesgo significativo para macrosomía fetal, tal como está descrito en la literatura clásica y como se demuestra en estudios más recientes, llegando a ser 3 veces mayor en el grupo de macrosomías frente a un grupo control20,21. En nuestro trabajo, la edad de las pacientes del grupo control fue inferior respecto al grupo casos con significación estadística; al analizar la medida de dispersión, observamos que la diferencia es menor de 2 años y en ambos grupos la media es inferior a los 35 años, por lo que consideramos que este resultado carece de relevancia clínica.
La asociación entre la obesidad materna y la macrosomía fetal está también bien documentada14,15. Los mecanismos por los cuales el sobrepeso materno induce la macrosomía fetal están pendientes de ser determinados, pero parecen ser independientes del de la diabetes y de la intolerancia a los hidratos de carbono15. Parece ser un factor metabólico adicional relacionado con el sobrepeso materno el que influye en el crecimiento fetal15. En nuestro estudio no existen diferencias significativas en ambos grupos cuando se analiza el peso y el IMC, aunque ambos parámetros son mayores en el grupo casos.
Características como la paridad y el hábito tabáquico y su relación con el peso fetal son bien conocida por todos. Así, clásicamente, mujeres nulíparas y fumadoras presentaban mayor riesgo de un parto de RN con bajo peso, y mujeres multíparas no fumadoras mayor riesgo de feto grande para edad gestacional22,23. Poon et al. examinaron 33.000 gestaciones únicas, concluyendo que el riesgo de feto macrosómico aumenta con la paridad y es más bajo en fumadoras24, resultados similares a los recogidos en la literatura clásica22,25. El riesgo en multíparas es 2-3 veces mayor que en nulíparas según Poon22,25, llegando hasta de 7 a 15 veces mayor si la mujer ha tenido un parto anterior con feto macrosómico22,26. Cuando analizamos el hábito tabáquico en nuestra serie de pacientes, obtuvimos que el grupo casos presenta menor incidencia de mujeres fumadoras que el grupo control, resultados que apoyan los recogidos en la literatura hasta la actualidad. Sin embargo, un dato interesante en nuestro trabajo, aunque sin significación estadística, es que en el grupo de pacientes con RN macrosómicos obtuvimos menor incidencia de multíparas, resultado completamente discordante con lo recogido como factor de riesgo de macrosomía en los libros.
Pocos trabajos han examinado la contribución de la CRL en la predicción de las desviaciones del peso fetal. Existen algunos estudios interesantes que concluyen que los valores de la CRL en el primer trimestre son predictores independientes de macrosomía fetal. Hackmon et al. compararon las CRL entre macrosomas extremos a término (pesos>p 97) con un grupo control y concluyeron que la macrosomía fetal podía manifestarse a la temprana edad gestacional de las 11-14 semanas27. Asimismo, Bukowski et al.28 y, más recientemente Pardo et al.29, encontraron que el tamaño de los fetos en el primer trimestre de gestación se asociaba con el peso fetal. En el 2012, Papastefanou et al.22 utilizaron delta CRL (ΔCRL) para expresar las discrepancias entre las CRL esperadas de las encontradas en los fetos pequeños y los fetos macrosómicos, y que además esta ΔCRL podía significar un predictor de fetos pequeños y grandes cuando se empleaba un modelo multivariante. Concluyeron, finalmente, que la CRL también podía ser un importante predictor de desviaciones del crecimiento fetal, como un indicador de la trayectoria del crecimiento fetal. En nuestro trabajo, las medias de las CRL de ambos grupos fueron prácticamente idénticas, sin significación estadística; este resultado nos permitió eliminar este parámetro como factor de confusión a la hora de analizar la relación de la PAPP-A como factor independiente de macrosomía fetal.
La asociación entre la TN y el peso fetal ha sido investigada más tardíamente22. Los estudios efectuados inicialmente determinaban que no existía una relación obvia entre el aumento de la TN y la macrosomía fetal30. Sin embargo, posteriormente, autores como Keleckci et al.31 confirman una TN aumentada en fetos macrosómicos, así como Poon et al.24 que encuentran una asociación positiva entre delta TN (ΔTN) y el percentil del peso al nacimiento24. Papastefanou et al. afirman que la ΔTN está relacionada con fetos macrosómico y fetos pequeños para la edad gestacional22. El mecanismo propuesto para esta asociación de ΔTN con el crecimiento fetal en mujeres diabéticas fue la hiperglucemia, que produce un aumento de la permeabilidad capilar y, como consecuencia, un incremento de la TN. El mecanismo fisiopatológico de la asociación de la TN en las desviaciones del peso por exceso o por defecto independiente de la diabetes es desconocido en la actualidad. En nuestro trabajo no encontramos diferencias estadísticamente significativas en ambos grupos respecto a los valores medios de la TN. Una justificación de este resultado es que hemos eliminado las pacientes diabéticas del grupo casos.
Dentro de las complicaciones asociadas a la macrosomía se describen el incremento de la incidencia de la gestación cronológicamente prolongada, el parto instrumental y el aumento de la tasa de cesáreas, entre otras14. En nuestro estudio hemos encontrado significación estadística al analizar la diferencia entre semanas al parto en ambos grupos, como reporta la literatura14. Existen discrepancias entre los diferentes autores en relación con la vía del parto. En general, no se recomienda una cesárea electiva en casos de sospecha de macrosomía fetal: debe intentarse parto vaginal siempre que no existan contraindicaciones para ello14. Sin embargo, otros autores recurren a la realización de una cesárea electiva en casos de fetos extremadamente macrosómicos (peso>5.000g). Lo que sí está suficientemente claro es que no debe inducirse el parto por existencia de macrosomía fetal y se prefiere una evolución espontánea; a menor número de inducción de fetos macrosómicos, menor número de cesáreas y menor morbilidad. En nuestro trabajo, existe mayor porcentaje de cesáreas en el grupo de RN macrosómicos y, prácticamente, todas ellas fueron trabajos de parto espontáneos, no inducidos. En el grupo casos también existe un aumento de partos instrumentales, pero sin significación estadística.
Consideramos que el resultado más interesante de nuestro estudio es la asociación estadísticamente significativa entre los niveles elevados de PAPP-A en MoM entre las 11+6 y 13+6 semanas de gestación y los fetos macrosómicos.
La PAPP-A asociada al embarazo es una hormona placentaria cuyos niveles se incrementan en la circulación de las mujeres gestantes y que se ha demostrado ser útil como marcador de cromosomopatías fetales en el primer trimestre32–34. Hasta 1999 la función de la PAPP-A era desconocida, año en que Lawrence et al. demostraron su actividad proteasa del IGFBP-4 (factor de crecimiento insulin–like unido a la proteína-4)30. La regulación de la biodisponibilidad de los IGF en la superficie celular se muestra esquemáticamente en el figura 6: cuando los IGF están unidos a la BP-4 no pueden interaccionar con su receptor de superficie; sin embargo, cuando la PAPP-A fragmenta dicho complejo, los IGF se liberan, permitiendo su unión con los receptores celulares. Los IGF promueven localmente la mitosis y diferenciación celular, y son de especial relevancia tanto en la embriogénesis como en la regulación del crecimiento fetal y placentario. Los niveles de PAPP-A en suero materno puede que reflejen los niveles locales de PAPP-A y la disponibilidad de los IGF. Por lo tanto, parece lógico que niveles bajos de PAPP-A indiquen bajos niveles de IGF y un pobre crecimiento fetal y placentario consecuentemente y, elevados niveles de PAPP-A, excesivos niveles de IGF y crecimiento fetal y placentario extremos30,35.
Existen numerosos estudios en los que los niveles de PAPP-A se asocian con resultados adversos del embarazo en fetos cromosómicamente normales15,32,36,37. Niveles extremadamente bajos de PAPP-A en el primer trimestre de gestación afectan negativamente al crecimiento fetal, aumentando el riesgo de preeclampsia, de retraso de crecimiento intrauterino, de parto pretérmino y de abortos espontáneos16,30,36–38.
Los resultados son más controvertidos cuando asociamos los elevados niveles de PAPP-A con fetos macrosómicos. Trabajos como el de Tul N et al. en 2003 encuentran correlación entre estos niveles elevados de PAPP-A en suero materno entre las 10-14 semanas de gestación en un análisis multivariante combinando el peso materno, la paridad y el sexo fetal30. En este estudio también se incluyen pacientes diabéticas con fetos macrosómicos, hallando en este subgrupo niveles disminuidos de PAPP-A. Concluyen, sin poder demostrarlo, que los fetos grandes de madres diabéticas son diferentes a los grandes de no diabéticas30. Esta información decidimos tenerla en cuenta a la hora de diseñar nuestro estudio, descartando a las pacientes diabéticas para evitar este posible factor de confusión. A esta misma conclusión llegan Poon et al.24 que, al comparar el grupo macrosómico con el control, observaron que en el primero fue más elevada la PAPP-A; al igual que Peterson y Siham que demostraron también una asociación entre PAPP-A>p 90 con macrosomía39. Sin embargo, otros autores como Goetzinger et al. demostraron la ausencia de significación estadística entre niveles de PAPP-A y BHCG y fetos macrosómicos, aunque existe una tendencia a disminuir el riesgo de fetos macrosómicos cuando los valores de PAPP-A están por debajo del p 1038. En nuestra serie de casos hemos encontrado significación estadística entre los niveles de PAPP-A en MoM con el riesgo de feto macrosómico, calculando incluso un punto de corte óptimo en 1,89 MoM para el cual se obtienen las mejores sensibilidad y especificidad. Así pues, afirmamos que la PAPP-A en MoM es un factor independiente de predicción de macrosomía fetal.
ConclusiónEl crecimiento fetal es un complejo proceso influido por varios determinantes: genéticos, ambientales y hormonales tanto a nivel materno como fetal. Con las investigaciones efectuadas hasta la actualidad, impresiona que el aumento de factores de crecimiento y sus receptores influyen en la interacción materno-fetal, una relación que es probable que sea importante en el peso fetal16. Se sabe que la PAPP-A promueve el crecimiento fetal y el desarrollo de mecanismos metabólicos y de diferenciación y, debido a ello, parece razonable pensar que existe relación entre los niveles de PAPP-A y la macrosomía fetal.
Existe elevada evidencia de que la combinación de características maternas junto con los resultados de parámetros bioquímicos del cribado de primer trimestre pueden emplearse para la identificación precoz de embarazos de alto riesgo de desarrollar preeclampsia, retraso de crecimiento intrauterino y muerte fetal15,21,33. Nuestro estudio expande este concepto a la predicción de la macrosomía fetal. Y aunque la intensidad de esta relación es pobre en comparación con el cribado de aneuploidías y preeclampsia, creemos que nuestro hallazgo puede sentar las bases de futuros trabajos centrados en la mejoría de los diagnósticos a través de nuevos marcadores bioquímicos. Así pues, con el análisis de la PAPP-A en MoM podremos identificar un porcentaje sustancial de pacientes cuyos fetos se prevé que serán grandes para la edad gestacional. Además, consideramos que el conocimiento del riesgo específico individual de cada paciente para macrosomía mediante el cribado de primer trimestre puede mejorar la supervivencia antenatal y la prevención de la macrosomía en sí misma.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.