La exenteración pélvica total es una intervención radical que incluye la resección en bloque del aparato reproductor, la vejiga y el recto-sigma. En ginecología oncológica, la indicación más común es el tratamiento de la recurrencia local o la ausencia de respuesta al tratamiento neoadyuvante.
Es una técnica efectiva, con una media de supervivencia a los 5 años de alrededor del 50%. La exenteración pélvica puede ser curativa para pacientes con cáncer de cérvix bien seleccionadas.
En nuestro estudio hemos revisado trabajos donde se publican grandes series de casos de exenteración pélvica por cáncer de cérvix y la tasa de complicaciones mayores puede ser del 50%. Numerosos autores consideran que debería reconsiderarse la indicación paliativa de la exenteración pélvica en ciertos casos.
Comparamos nuestros resultados de exenteración pélvica en mujeres con cáncer localmente avanzado o recurrente con los publicados en la bibliografía. Concluimos que nuestros resultados son similares a los publicados.
Total pelvic exenteration is a radical intervention, involving block resection of pelvic organs, including reproductive structures, the bladder, and the rectosigmoid colon. In gynecologic oncology, this procedure is most commonly indicated for the treatment of locally recurrent cancer or lack of response to neoadjuvant therapy.
Total pelvic exenteration is an effective technique with a high percentage of long-term survivors. Overall, the mean 5-year survival is around 50%. Pelvic exenteration can be curative for carefully selected patients with cervical cancers.
In this study, we reviewed publications of large series of patients treated with pelvic exenteration for cervical cancer. The rate of serious complications can be 50%. Many authors believe palliative intent should be reconsidered in certain patients.
When we compared our results with those of prior studies, we found similar outcomes of pelvic exenteration in women with locally advanced primary or recurrent cervical cancer.
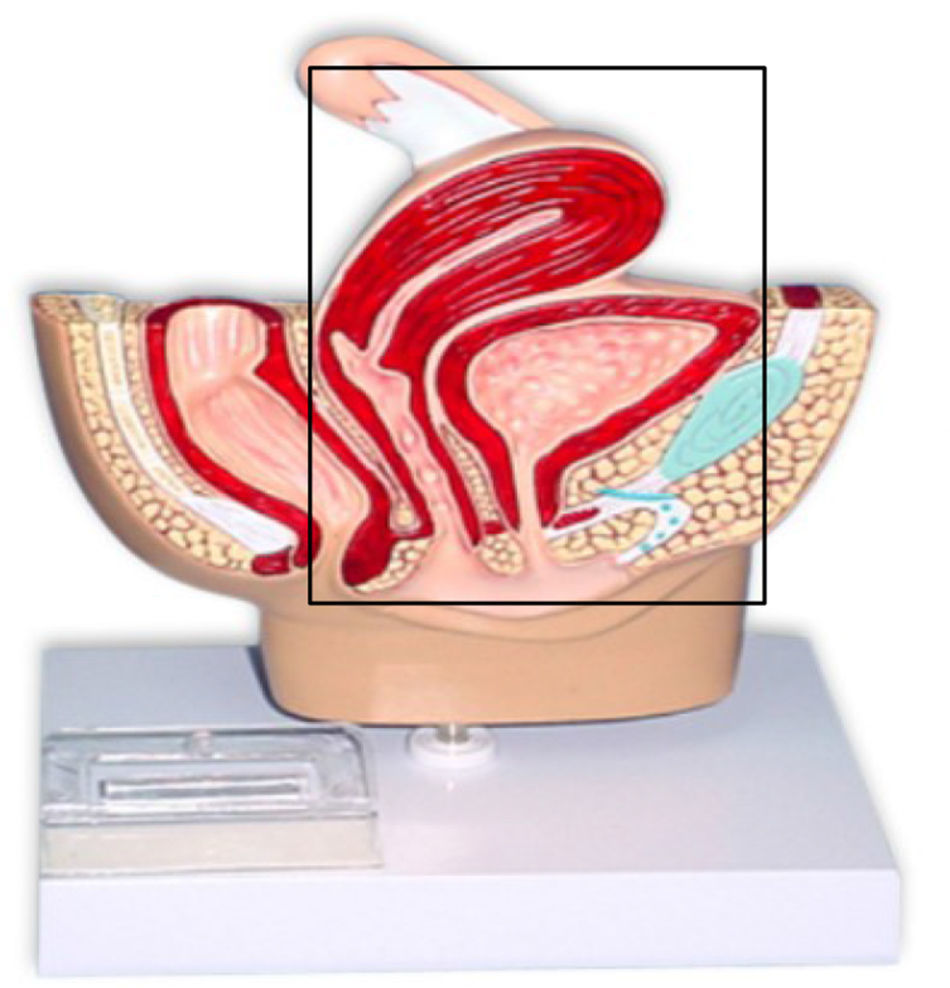
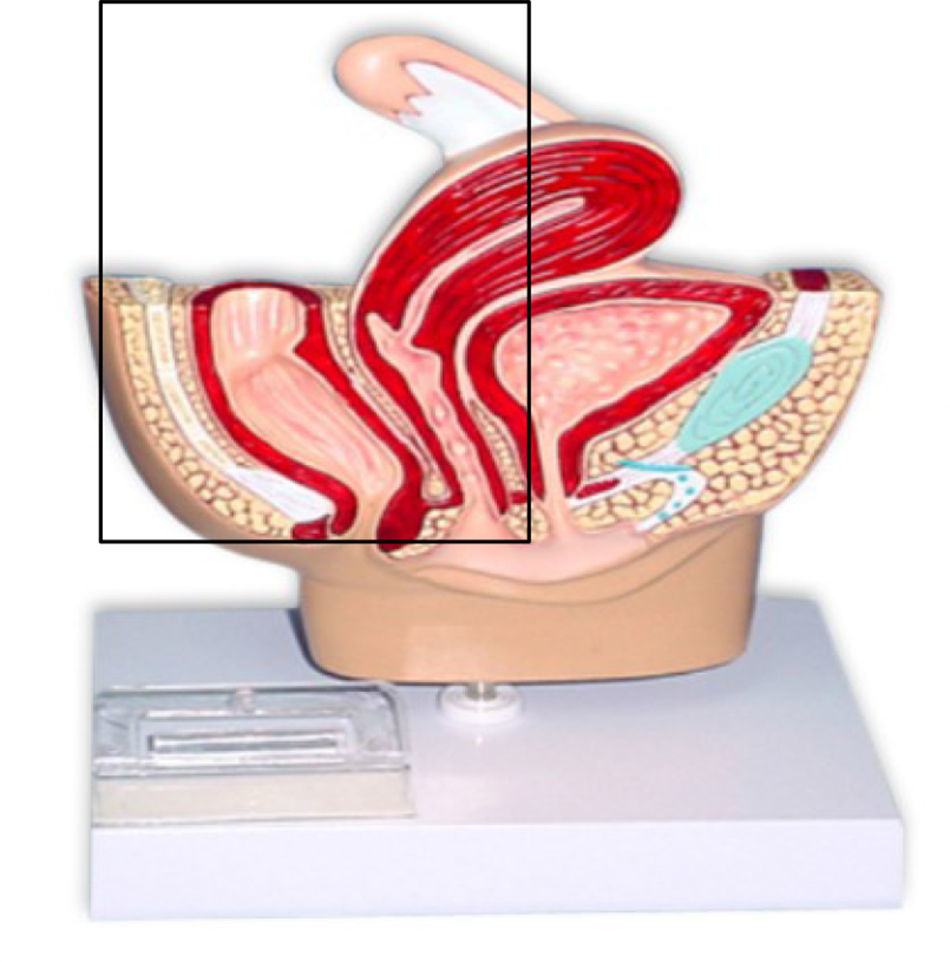
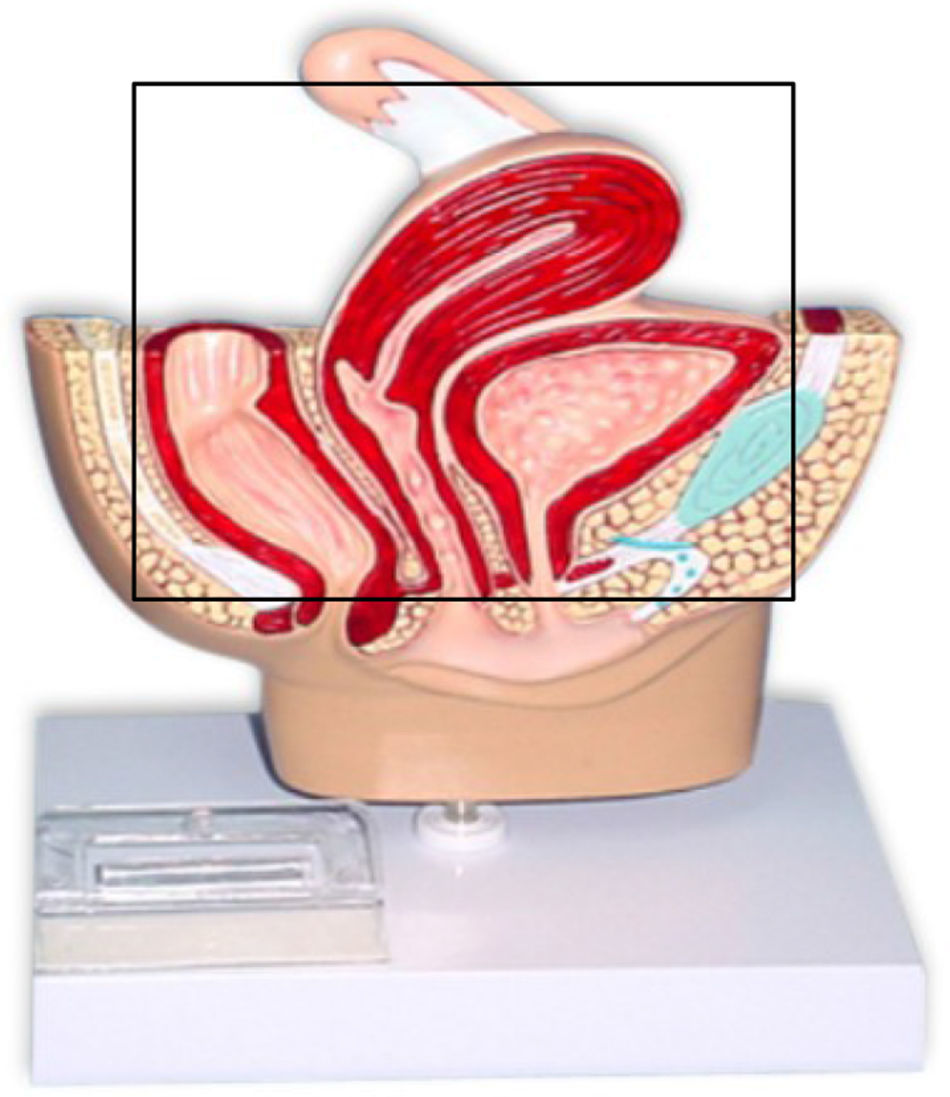
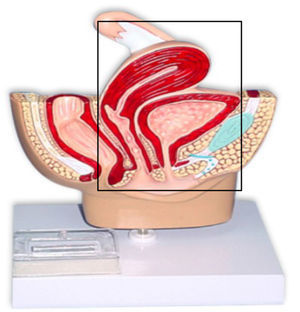
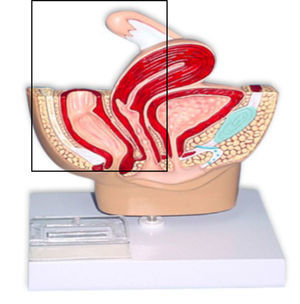
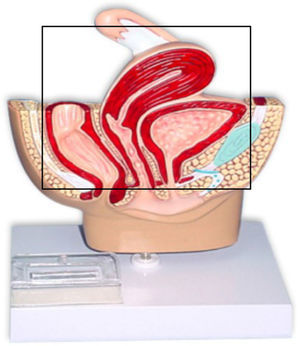
La exenteración pélvica (EP) fue descrita en 1948 por Brunschwig, y consiste en una histerectomía radical con extirpación de la vejiga (exenteración anterior; fig. 1) y/o del recto (exenteración posterior; fig. 2), o de ambos (exenteración total; fig. 3). Esta intervención, que es relativamente reciente en el tiempo, está sometida a duras críticas entre los profesionales, no solo por el inevitable impacto fisiológico y psicológico que supone para la paciente la pérdida del control esfinteriano (intestinal y urinario), sino también por la elevada morbilidad e incluso mortalidad que conlleva, que aunque no es tan alta como en sus inicios (23%), tampoco es despreciable1–5.
No obstante, los autores que la defienden, la destacan como la única alternativa terapéutica en algunos tumores localmente avanzados. Serían pacientes condenadas a una mala calidad de vida, marcada por un intenso dolor pélvico, el sangrado, la infección local, la fistulización a órganos vecinos y, finalmente, la muerte. La inexistencia de órganos vitales a este nivel hace posible la curación de la paciente con la escisión radical de la neoformación. La EP va consiguiendo su lugar en el arsenal terapéutico del cirujano, dado que mejora las perspectivas de vida y de bienestar de algunas pacientes, y eso nos anima a publicar nuestra experiencia sobre el tema.
Antecedentes bibliográficosLa justificación teórica de esta intervención viene dada por las características biológicas de algunos tumores localizados en la pelvis menor, como el cáncer de cérvix, el de vagina y algunos tumores de recto, que son capaces de alcanzar grandes dimensiones, incluso infiltrar órganos vecinos, sin originar metástasis a distancia ni afectación ganglionar pelviana. Son tumores que producen la muerte de la paciente por invasión local. Y es que ya Brunschwig y Pierce en 19486 y Bartzen et al. en 19567 comprobaron que entre un 30 y un 50% de las autopsias que realizaron a mujeres fallecidas por cáncer de cérvix presentaban una clara delimitación del proceso sin tener metástasis a distancia.
Los resultados de esta técnica han mejorado en los últimos años gracias a que se han definido mejor las indicaciones de EP, se ha seleccionado mejor a las pacientes (gracias, entre otros, a los avances en el estudio de extensión y de imagen preoperatorios), y se han incorporado nuevos esquemas de tratamiento neoadyuvante. El manejo postoperatorio intensivo también ha beneficiado los resultados quirúrgicos, disminuyendo la morbilidad postoperatoria, y así se ha conseguido obtener cifras razonables de supervivencia a largo plazo1–3.
Las condiciones generales exigidas para la realización de una EP son:
- 1.
Paciente con buen estado general tanto físico como mental.
- 2.
Tumor confinado a la pelvis en el estudio de metástasis a distancia.
- 3.
Tumoración libre sin fijación a estructuras musculoesqueléticas.
Entran dentro de estas indicaciones los cánceres de cérvix que no han respondido a la radioterapia y los de grado iv, aunque se sepa de antemano que tienen muy mal pronóstico4. En estos últimos sería una indicación paliativa, con una media de supervivencia de 6 meses, lo que supone una controversia para el equipo quirúrgico, pero al excluirlas del procedimiento probablemente estaríamos disminuyendo la calidad de vida de estas pacientes8.
Otra indicación de EP serían los casos de necrosis pélvica por radiación, donde la pelvis menor se convierte en un magma abscesificado y fistuloso, y la única posibilidad de curación es este tipo de cirugía.
Muchos centros han publicado trabajos exponiendo su experiencia en EP, y analizando los factores pronóstico. Así, se sabe que son factores de mal pronóstico:
- -
La tríada fatal: dolor irradiado del ciático y del obturador+edema de miembros inferiores+invasión ureteral en el extremo superior de la pelvis1.
- -
El deterioro de la función renal3.
- -
El tiempo que trascurre entre el tratamiento del carcinoma y la recidiva es menor de un año1,3.
- -
Afectación de los parametrios o fijación de estos a la pared pélvica2,3,9.
- -
Volumen de la recurrencia mayor a 3cm1.
- -
Tumor no central2,9,10.
- -
Edad de la paciente mayor de 35 años9. Este es un tema en discusión, ya que hay trabajos que incluso tienen mejores resultados en pacientes mayores de 65 años8,11,12.
- -
Presencia de 3 o más ganglios linfáticos positivos2,9,10.
- -
Invasión del miometrio o de los anejos9.
- -
Invasión de la vejiga o del recto9.
- -
Hidronefrosis9.
48 años G2 P2.
Consulta en noviembre de 2009 por coitorragias de 6 meses de evolución. Citología cervical de screening negativa en 2008.
Exploración: cérvix engrosado de 6cm de diámetro con mamelones y zonas friables. Sangrado moderado.
Tacto rectal: parametrios fijos hasta la pared pélvica.
Ecografía transvaginal: sin hallazgos.
Biopsia de cérvix: adenocarcinoma endocervical bien diferenciado.
RM de pelvis: masa pélvica en cérvix de 7cm de diámetro que invade ambos parametrios. Sin adenopatías pélvicas. Se aprecia plano de separación con la vejiga; no se puede descartar la afectación del colon. Afectación del tercio superior de la vagina.
Con un estadio clínico iv de la FIGO se deriva al Servicio de Oncología para tratamiento neoadyuvante, donde se le administra quimioterapia seguida de radioterapia y braquiterapia.
Tras la finalización del tratamiento neoadyuvante se repite RM, que informa de cambios secundarios a radioterapia y quimioterapia, con probable afectación del parametrio izquierdo. Se realiza nueva biopsia de cérvix, que es informada como infiltración por carcinoma de células escamosas.
Ante estos hallazgos se decide realizar una EP.
Los hallazgos operatorios fueron: tumoración en cérvix de 3cm de diámetro, fija a la cara posterior de la vejiga a nivel del meato urinario y a la cara anterior del recto con ambos parametrios rígidos y engrosados. En la biopsia intraoperatoria se confirma la no invasión del recto, por lo que se conserva. Se realiza EP anterior con exteriorización de los uréteres a la pared abdominal.
La Anatomía Patológica definitiva informa márgenes de resección libres de enfermedad.
Pasa las primeras 24h del postoperatorio en la UVI, después pasa a planta, siendo dada de alta a los 14 días, con buen estado general.
Actualmente se encuentra en remisión completa (27 meses hasta el momento de la presente revisión), y la única secuela que presenta es infecciones urinarias de repetición.
Caso 240 años G3 P3.
En julio de 2009 consulta por metrorragia escasa de varios meses de evolución.
Exploración ginecológica: cérvix hipertrófico, irregular y sangrante, sin evidencia de invasión vaginal.
Tacto rectal: parametrios rígidos, engrosados, sin llegar a la pared pélvica.
Citología cervical: H-SIL. Cultivo de VPH negativo.
Biopsia de cérvix: carcinoma de células escamosas pobremente diferenciado.
RM: tumoración cervical que invade ambos parametrios y el tercio superior de la vagina. No infiltra vejiga ni recto.
Se etiqueta como carcinoma de cérvix estadio clínico FIGO IIB y se remite a Oncología para tratamiento con radioterapia, braquiterapia y quimioterapia.
En la RM posterior al tratamiento: prácticamente desaparecida la masa del cérvix que infiltraba los parametrios. Sin adenopatías patológicas.
PET-TAC: enfermedad maligna a nivel de endometrio y un implante en FII.
Se evidencia hidronefrosis bilateral e invasión rectal por la neoplasia.
Durante este último periodo de tiempo, la paciente presenta un dolor pélvico muy intenso, difícil de controlar por la Unidad del Dolor.
Ante estos hallazgos y la sintomatología de la paciente se decide realizar una EP.
Se realiza EP total en bloque de útero, vejiga y recto, con cierre vaginal a 2-3cm del introito y del muñón rectal en el suelo pélvico, extirpación de nódulos tumorales en ciego y en mesocolon, resección de recto-sigma con colostomía terminal, ligadura de ambos uréteres con nefrostomía bilateral.
Los hallazgos quirúrgicos fueron: tumoración cervical de 10cm de diámetro que ocupa parametrios hasta la proximidad de la pared pélvica, la vejiga, la vagina hasta el tercio inferior próximo al introito, y el apéndice. Además, hay un nódulo tumoral de 1cm en ciego, y 2 de 3×1cm en mesocolon. No se tactan adenopatías regionales.
Informe de Anatomía Patológica: lavado peritoneal positivo para células malignas. Útero, vejiga y recto con carcinoma poco diferenciado compatible con escamoso que afecta al cuello uterino, la pared endometrial, la pared vesical y el recto. Implantes en mesocolon y ciego infiltrados por carcinoma.
Pasa las primeras 48h de postoperatorio en la UVI, posteriormente vuelve a planta de Ginecología, donde a los 20 días presenta una obstrucción intestinal por adherencias que precisa de 2 laparotomías para liberación de las mismas; en la primera se realiza partición pélvica con malla de Vicryl®, en la segunda se realiza una resección de íleon terminal e ileocequectomía laterolateral. Este postoperatorio transcurre en la UVI durante 72h; a los 15 días es dada de alta de la planta de Ginecología, con buen estado general.
Se realiza seguimiento por parte de los servicios de Oncología y de Cuidados Paliativos. Fallece a causa de la enfermedad, con dolor controlado, a los 6 meses de la intervención.
Caso 347 años G2 P2.
Consulta en julio de 2010 por leucorrea sanguinolenta de meses de evolución.
Exploración física: masa tumoral dependiente de cérvix que infiltra parametrios. Biopsia de cérvix: carcinoma de células escamosas moderadamente diferenciado.
RM: masa en cérvix de 5,4×7×6,5cm, que invade los dos tercios superiores de la vagina y ambos parametrios. No infiltra vejiga ni recto. Adenopatías patológicas en ambas cadenas ilíacas. Estadío clínico FIGO IIB.
Se remite a la paciente al Servicio de Oncología Médica para tratamiento, donde se la somete a quimioterapia, radioterapia y braquiterapia.
RM posterior a tratamiento: disminución importante de la masa tumoral, que presenta unos diámetros de 17×8mm en cérvix; parametrios con tractos fibrosos residuales. Sin adenopatías significativas.
La paciente presenta dolor exacerbante; el tratamiento en la Unidad del Dolor de nuestro hospital no tiene éxito.
Exploración tras tratamiento: nódulo de 2×3cm en la cara anterior de la vagina, fondo vaginal irregular, por donde fluye leucorrea maloliente.
RM: cavidad en cérvix uterino con masa de partes blandas y desflecamiento de los parametrios, que evidencian recidiva tumoral.
TAC: indicativa de recidiva tumoral a nivel pélvico que produce ectasia pielocalicial y ureteral derecha.
PET-TAC: no hay metástasis a distancia.
Ante el diagnóstico de recidiva de cáncer de cérvix, estadio clínico iiiB, se decide realizar a la paciente una EP.
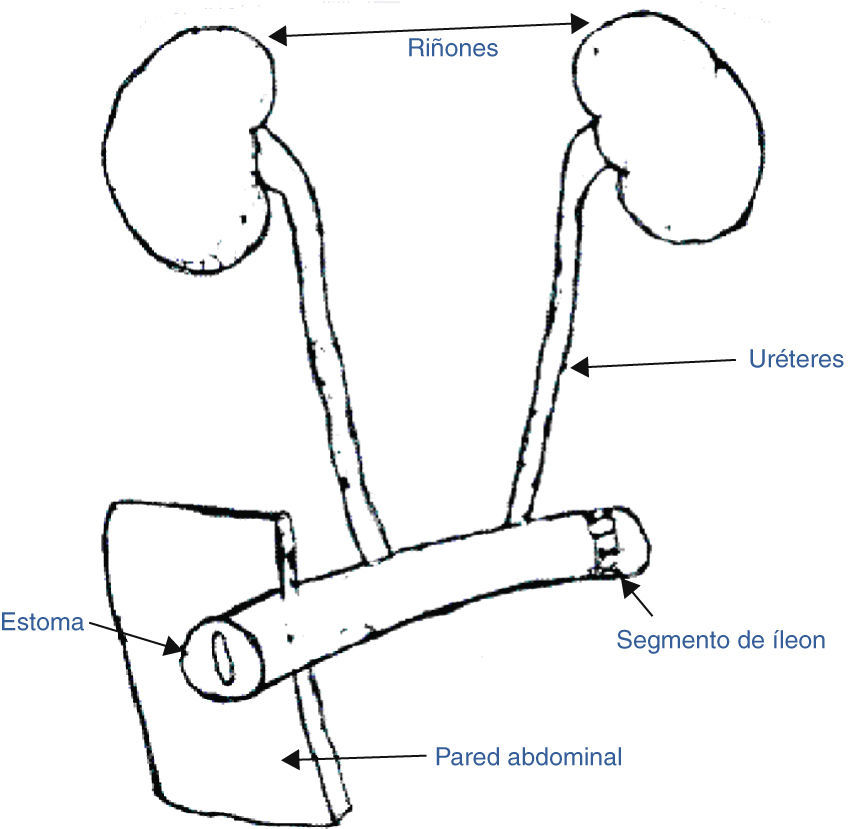
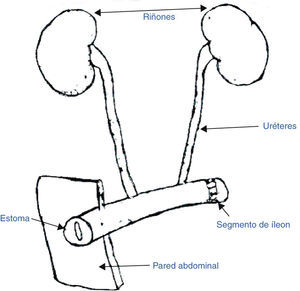
Se realiza EP anterior, con ureteroileostomía cutánea tipo Bricker-Wallace II (fig. 4), reconstrucción del intestino delgado con anastomosis laterolateral manual biplano, apendicectomía, y malla tipo BIO-A pélvica.
Hallazgos quirúrgicos: tumoración de 8cm en cérvix y útero, que invade los dos tercios superiores de la vagina con parametrios y ligamento uterosacro derecho engrosados, que engloban el apéndice en su punta e infiltra la pared posterior de la vejiga.
Anatomía Patológica: carcinoma de células escamosas no queratinizante de cérvix de 6,5cm que infiltra toda la pared e invade la vejiga con bordes circunferenciales libres. Anejos y apéndice sin tumor. Estadio quirúrgico ivA.
Las primeras 48h del postoperatorio las pasa en la UVI, y posteriormente es trasladada a planta de Ginecología.
Allí tiene una buena evolución, salvo por una polineuropatía distal sensitivomotora por afectación distal de ambos nervios ciáticos, que mejora con tratamiento rehabilitador, y fiebre causada por una bacteriemia por Staphylococcus epidermidis que responde a antibioterapia sin mayores problemas. Al mes y medio es dada de alta, con buen estado general, deambulando con una leve cojera.
Pasa a control por parte de Oncología.
A los 6 meses hay hallazgos en una TAC que muestran una segunda recidiva neoplásica; se evidencia una gran masa pélvica de 7cm compatible con recidiva que atrapa el uréter. Se la somete a nefrostomía izquierda.
En la RM se evidencia invasión rectal y de los obturadores, así como adenopatías pélvicas sospechosas en la cadena ilíaca izquierda y líquido libre.
Se inicia de nuevo quimioterapia y comienza a ser tratada por el Servicio de Cuidados Paliativos.
Varios meses después le es imposible la deambulación por el dolor inguinal y presenta una fístula vaginorrectal, cada vez más importante, llegando a defecar solo por la vagina, hasta que se le realiza colostomía por oclusión intestinal, con lo cual se resuelve el problema de la fístula.
Actualmente la paciente se encuentra bien, con tolerancia adecuada, buen estado nutricional, sin dolor, con colostomía funcionante (han trascurrido 12 meses hasta el momento de la redacción del presente trabajo) y en seguimiento por la Unidad de Paliativos.
DiscusiónEn la mayoría de los centros europeos, esta cirugía la realizan conjuntamente ginecólogos, urólogos y cirujanos generales, como es el caso de nuestro centro, donde todas las indicaciones fueron discutidas en sesión clínica del Comité de Tumores entre los Servicios de Ginecología, Urología y Cirugía General. Aunque nuestra serie es escasa, solo 3 casos en 3 años, no debemos olvidar que nuestro hospital dispone de 284 camas y atiende a un Área Sanitaria de 155.000 habitantes. Las series publicadas por otros centros de renombre internacional tampoco son muy abundantes, dadas las escasas indicaciones de esta técnica. Por ejemplo:
- -
Memorial Sloan-Kettering Cancer Center: 22 casos de EP en 11 años13.
- -
Instituto de Oncología de Milán: 106 EP en 11 años14.
- -
Hospital General de México: 161 casos en 40 años9.
- -
Hospital Universitario de Leuven, Bélgica: 36 casos en 11 años12.
- -
Departamento de Obstetricia y Ginecología de la Facultad de Medicina de la Universidad de Washington, Seattle: 44 casos en 18 años15.
- -
Florence Nightingale Hospital, Dusseldorf, Alemania: 33 casos5.
- -
Hospital Universitario Campus Virchow Clinic, Berlín: 47 casos en 6 años8.
- -
Centro Médico Nacional 20 de Noviembre, ISSSTE, México, D.F.: 19 casos en 9 años3.
- -
Hospital Universitario de Zurich en Suiza y Hospital General de Neumarkt en Alemania: suman 282 casos en 30 años16.
Los 3 casos expuestos de EP eran pacientes con factores de mal pronóstico, no obstante, en el caso 1, la EP resulta curativa.
Numerosos trabajos han demostrado que cuando la paciente presenta dilatación de las vías urinarias, las posibilidades de supervivencia disminuyen. Tenorio-Torres et al.3 en 2010 demostraron que a los 3 años la supervivencia disminuía hasta el 13,3% en las pacientes con dilatación de las vías urinarias, frente al 68,4% en las que no tienen dicha dilatación. Ocurre igual con la invasión vesical, rectal, miometrial y de los anejos, que disminuye la supervivencia libre de enfermedad al 24% a los 3 años. Otro de los factores pronósticos más importantes fue la presencia de ganglios metastásicos, estas pacientes tenían una supervivencia a los 3 años del 31%, frente al 62% de aquellas en las que los ganglios fueron negativos.
Torres-Lobatón et al.9 publican una revisión en 2010 sobre los factores pronósticos apoyándose en 429 EP. Los factores de buen pronóstico más relevantes para estos autores fueron:
- -
Tumores centrales (el más importante),
- -
Edad≤35 años.
- -
Ausencia de metástasis ganglionares.
Estos datos coinciden con los publicados por Shingleton et al.10: cuando se cumplían estos factores pronósticos, la supervivencia a los 5 años era del 58%, frente a un 42% de supervivencia cuando no se cumplían los requisitos anteriores. Y con lo publicado por Fleisch et al. en 2007, donde analizan las EP de 5 hospitales alemanes (203 EP), de las cuales el 65,5% fueron por carcinoma cervicouterino2. Como factores pronósticos adversos destacaron la infiltración del cuerpo uterino y de la pared pélvica. No encontraron diferencias significativas en cuanto a la supervivencia libre de enfermedad al comparar los diferentes tipos de EP.
Nuestros casos 2 y 3 son pacientes ya en estadio iv en el momento de la EP, con prácticamente todos los factores de mal pronóstico. La EP se indicó para mejorar en la medida de lo posible la calidad de vida de la paciente, disminuir el dolor y evitarle la fistulización, el sangrado y la necrosis. Es una indicación quirúrgica muy controvertida, ya que la esperanza de vida de estas pacientes es del 0% a los 6 meses (como ocurrió en el caso de nuestra paciente del caso 2).
No obstante, no podemos pasar por alto las malas condiciones en que se encuentran estas pacientes debido a la progresión lenta de la enfermedad. El control del dolor es el mayor problema de estas enfermas. Autores como Fotopoulou et al.8, Kiselow y Bricker4 y Diver et al.17 apoyan la indicación paliativa de la EP con el objeto de mejorar la calidad de vida de las pacientes. Aunque de entrada no parezca una alternativa razonable como tratamiento paliativo, en algunas ocasiones puede ser la opción más plausible.
Hay muchos trabajos que demuestran que no hay diferencias significativas en cuanto a la supervivencia de las pacientes con carcinoma epidermoide y con adenocarcinoma3,9,14. Nuestro único caso de adenocarcinoma se encuentra actualmente en remisión completa de la enfermedad, probablemente gracias a que en el momento de la cirugía la tumoración no superaba los 3cm, se trataba de un tumor central, y a que no afectaba en ese momento a los parametrios. Podríamos estar ante el ejemplo de cómo esta cirugía puede ser curativa cuando se realiza una buena selección de las pacientes.
La mortalidad operatoria en nuestra serie fue del 0%. La morbilidad también ha disminuido en los últimos años, no solo por los avances de la técnica, sino también por el uso de antibioterapia y HBPM profiláctica. También tienen su lugar los mejores cuidados en la UCI durante el postoperatorio inmediato8.
Con respecto a las mejoras en la técnica, recordemos cómo las colostomías húmedas, además de incómodas para la paciente, tienen como inconveniente el riesgo de infecciones urinarias de repetición. La desviación de los uréteres a un asa desfuncionalizada de íleon terminal que se exterioriza como una ileostomía urinaria en la pared abdominal, comúnmente conocida como «intervención de Bricker», resuelve este problema clásico de la EP.
La morbilidad descrita en los diferentes centros oscila entre el 43 y el 68,4%3,8,13,18; este dato es muy difícil de comparar, porque las complicaciones y su gravedad no se etiquetan de la misma manera, y quedan recogidas de un forma muy heterogénea. Sí se sabe que estas suponen una carga adicional que aumentará la mortalidad de las pacientes, cosa que puede deberse a la propia complicación, o ser el estado previo de la paciente el que propicie dicha complicación. La más frecuente es la obstrucción intestinal. En nuestra serie, solo una paciente (caso 2) precisó reintervención por obstrucción intestinal. No cabe pensar en este caso que la complicación disminuyera realmente la supervivencia, sino que probablemente fue el estadio tan avanzado el que propició dicha obstrucción intestinal.
Controversias en la indicación de la exenteración pélvicaCon respecto a los ganglios linfáticosPara algunos autores18 la intervención comienza con la linfadenectomía abdominopélvica radical, mientras que para otros11 la linfadenectomía es innecesaria ya que aumenta la morbilidad y no supone ninguna ventaja para la paciente, más allá de establecer un pronóstico. Se apoyan en el hecho de que si los ganglios son negativos, no mejoraremos la supervivencia, y si son positivos, sabemos que el pronóstico es peor. Hay trabajos que publican supervivencias a los 18 meses del 0%, y muchos autores se basan en este dato para contraindicar la EP en pacientes con ganglios positivos19.
Algunos autores consideran que la presencia de enfermedad ganglionar o en parametrios es una contraindicación para la cirugía, dada la alta morbilidad operatoria y las escasas posibilidades de supervivencia (0% a los 5 años)1, aunque hay trabajos publicados con supervivencias a los 2 años del 19 al 24%16, y que invitan a reconsiderar las contraindicaciones clásicas de la técnica, como la edad avanzada de la paciente y la presencia de adenopatías pélvicas patológicas.
Con respecto a la edad de la pacienteSegún unas revisiones más antiguas (Flores en 1986), esta técnica no estaría indicada en mujeres mayores de 69 años11, pero para Fotopoulou et al. la edad límite está en 80 años8.
A este respecto hay varios trabajos que descartan la edad de las pacientes como contraindicación para la EP, como los de Schmidt et al.16 y Kaur et al.12, ambos publicados en 2012. Compararon la morbilidad postoperatoria de las pacientes de 65 años o más con las de menos de 65 años. Curiosamente, en el primer grupo la supervivencia a los 5 años fue mayor que en el segundo (71 frente a 42%), y las tasas de complicaciones fueron similares en ambos grupos de edad. Concluyen que la edad no está asociada a una mayor morbimortalidad en su serie.
Conclusión- -
La EP es la única alternativa de curación para ciertos cánceres ginecológicos localmente avanzados en pacientes bien seleccionadas. La principal indicación en cáncer de cérvix es la recidiva de la enfermedad y la no respuesta o respuesta incompleta al tratamiento neoadyuvante.
- -
El retraso de indicación puede ser fatal para el pronóstico.
- -
Se puede indicar en pacientes de mal pronóstico cuando se trate de la única alternativa para mejorar la calidad de vida de estas pacientes.
- -
Los porcentajes de supervivencia publicados por los diferentes trabajos se encuentran alrededor del 50% a los 5 años, independientemente del estadio y de los factores pronósticos.
- -
Las mejoras de la técnica y de los cuidados postoperatorios han reducido considerablemente la morbimortalidad. Gracias a ello se puede indicar la EP en pacientes candidatas a cirugía curativa sin necesidad de esperar a que el pronóstico sea infausto.
- -
Probablemente en un futuro se podría valorar la posibilidad de EP en pacientes con respuesta completa al tratamiento neoadyuvante, sin esperar la recidiva, con el objetivo de mejorar el pronóstico de la enfermedad.
Los autores declaran no tener ningún conflicto de intereses.