El síndrome del folículo vacío es una situación en la cual, repetidamente, no se recuperan ovocitos durante la punción-aspiración folicular. Existen 2 tipos de síndrome del folículo vacío: el falso y el genuino. Se presenta el caso clínico de una paciente de 38 años con esterilidad primaria de un año de evolución. Ante un estudio básico de esterilidad normal, se realizaron 4 ciclos de IAC, que resultaron fallidos. Se decidió realizar FIV-ICSI, llevándose a cabo un total de 3 ciclos; el primero, protocolo de estimulación con análogo largo, y los ciclos restantes, protocolo de estimulación con antagonista. En todos los casos se constató la ausencia de errores en la medicación y unos niveles de gonadotropina coriónica humana óptimos. Se llega al diagnóstico de síndrome del folículo vacío genuino, pues a pesar de obtener un desarrollo folicular y niveles adecuados de gonadotropina coriónica humana prepunción, no se obtienen ovocitos durante la misma. La ovodonación actualmente es la mejor alternativa.
Empty follicle syndrome is a situation in which there is repeated failure to retrieve oocytes during follicular puncture-aspiration. There are 2 types of empty follicle syndrome: false and genuine. We report the case of a 38-year-old woman with a one-year history of primary sterility. After basic study of normal sterility, the patient underwent 4 unsuccessful artificial insemination cycles. We decided to carry out IVF-ICSI, and the patient underwent a total of 3 cycles. A long-agonist protocol was used in the first stimulation and an antagonist protocol in the remaining 2. In all stimulations, we confirmed the absence of medication errors and optimal levels of human chorionic gonadotropin. A diagnosis of genuine empty follicle syndrome was made because no oocytes were obtained during aspiration despite obtaining follicular development and appropriate levels of human chorionic gonadotropin pre-puncture. Oocyte donation is currently the best alternative.
El síndrome del folículo vacío (SFV) se define como la ausencia repetida de recuperación de ovocitos tras un ciclo de fecundación in vitro, con desarrollo folicular y niveles séricos de estradiol adecuados1. Fue descrito por primera vez por Coulam et al. en 1986 en una mujer con infertilidad de causa desconocida2. Su incidencia oscila entre el 0,5 y el 7%3–8, siendo más frecuente en ciclos con análogos de la hormona liberadora de gonadotropinas.
Su etiología es desconocida, aunque se barajan distintas hipótesis que van desde errores en la administración de la gonadotropina coriónica humana (hCG) hasta alteraciones en el desarrollo folicular9,10. Se distinguen 2 tipos: el falso y el genuino (SFVG). El primero se debe a errores en la administración de hCG o a razones farmacocinéticas (hCG caducada o con biodisponibilidad disminuida), lo que supondría niveles circulantes de dicha hormona insuficientes. El segundo se podría definir como la incapacidad de recuperar ovocitos de folículos maduros tras una inducción, desarrollo folicular y esteroidogénesis aparentemente normales y con niveles óptimos de hCG el día de la punción folicular. Estas pacientes no parecen responder a un protocolo de rescate (administración de nueva dosis de hCG), y siguen sin obtenerse ovocitos en punciones posteriores. Varias hipótesis evidencian que el SFVG está relacionado con una foliculogénesis disfuncional, según la cual se produciría una atresia folicular precoz11. Esta alteración se ha relacionado con el envejecimiento de los ovarios12, que podría suponer alteraciones en el crecimiento y maduración ovocitaria, y también se han propuesto determinados factores genéticos como responsables de algunos casos de SFVG11,12.
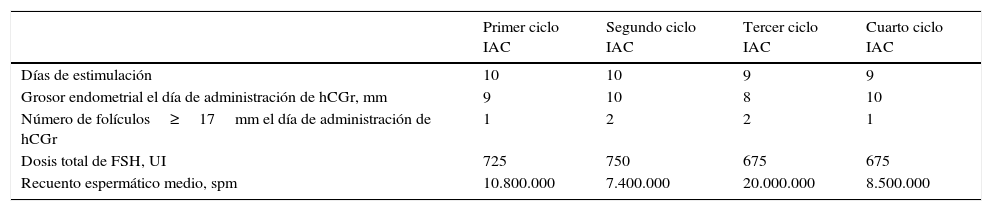
Caso clínicoSe trata de una paciente de 38 años, sin antecedentes de interés, que consulta por esterilidad primaria de un año. Pareja de 37 años, fumador de un paquete diario. Tras el estudio básico de esterilidad se clasificó el caso como esterilidad de causa desconocida, y se realizaron 4 ciclos de inseminación artificial conyugal sin conseguir gestación, a pesar de una adecuada respuesta folicular y una óptima recuperación espermática (tabla 1).
Características de los ciclos de inseminación artificial conyugal realizados
| Primer ciclo IAC | Segundo ciclo IAC | Tercer ciclo IAC | Cuarto ciclo IAC | |
|---|---|---|---|---|
| Días de estimulación | 10 | 10 | 9 | 9 |
| Grosor endometrial el día de administración de hCGr, mm | 9 | 10 | 8 | 10 |
| Número de folículos≥17mm el día de administración de hCGr | 1 | 2 | 2 | 1 |
| Dosis total de FSH, UI | 725 | 750 | 675 | 675 |
| Recuento espermático medio, spm | 10.800.000 | 7.400.000 | 20.000.000 | 8.500.000 |
FSH: hormona foliculoestimulante; hCGr: coriogonadotropina humana; recombinante; IAC: inseminación artificial conyugal; spm: espermatozoides por mililitro; UI: unidades internacionales.
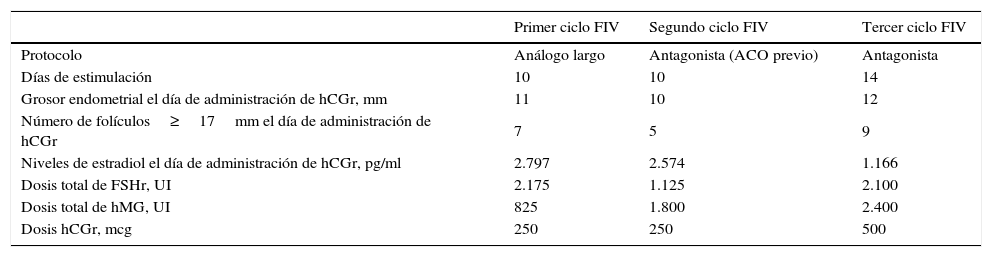
Se inició un ciclo de fecundación in vitro siguiendo un protocolo de estimulación con análogo largo, hormona foliculoestimulante recombinante y menotropina humana. A los 11 días de estimulación, con 7 folículos≥17mm, se administró hCGr 250mcg/0,5ml (tabla 2).
Características de los ciclos de fecundación in vitro realizados
| Primer ciclo FIV | Segundo ciclo FIV | Tercer ciclo FIV | |
|---|---|---|---|
| Protocolo | Análogo largo | Antagonista (ACO previo) | Antagonista |
| Días de estimulación | 10 | 10 | 14 |
| Grosor endometrial el día de administración de hCGr, mm | 11 | 10 | 12 |
| Número de folículos≥17mm el día de administración de hCGr | 7 | 5 | 9 |
| Niveles de estradiol el día de administración de hCGr, pg/ml | 2.797 | 2.574 | 1.166 |
| Dosis total de FSHr, UI | 2.175 | 1.125 | 2.100 |
| Dosis total de hMG, UI | 825 | 1.800 | 2.400 |
| Dosis hCGr, mcg | 250 | 250 | 500 |
ACO: anticonceptivo oral; FIV: fecundación in vitro; FSHr: hormona foliculoestimulante recombinante; hCGr: coriogonadotropina humana recombinante; hMG: menotropina; UI: unidades internacionales.
A las 36h se realizó la punción folicular, que resultó sin incidencias, a pesar de lo cual no se obtuvo ningún ovocito. Se constató con la paciente la ausencia de error en la medicación.
En un segundo ciclo, se empleó un protocolo con antagonista tras anticonceptivo oral previo. Del mismo modo, se obtuvo una respuesta folicular adecuada (5 folículos≥17mm), administrándose de nuevo hCGr en el día 11 del ciclo y realizando la punción 36h después de administrar la medicación (tabla 2).
De nuevo la punción tuvo lugar sin incidencias, no se produjo ningún error en la medicación y en este caso se determinó la concentración sérica de hCG el día de la punción, que fue de 162mUI/ml. A pesar de todo no se obtuvieron ovocitos. Ante la sospecha de encontrarnos ante un SFVG, se determinó el cariotipo de la paciente, que resultó normal (46XX), y se decidió realizar un tercer ciclo siguiendo un protocolo con antagonista, sin anticonceptivo oral previo. Al igual que en los casos anteriores, se obtuvo una buena respuesta (9 folículos≥17mm), administrando doble dosis de hCGr el día 14 del ciclo (tabla 2).
Nuevamente, la punción se realizó sin incidencias, no hubo errores de la medicación, los niveles de hCG circulantes fueron óptimos (243mUI/mL), pero no se obtuvo ningún ovocito. Con el diagnóstico de SFVG se propuso a la pareja una ovodonación como recurso disponible en estos casos en la actualidad.
DiscusiónEl SFV es considerado como una situación clínica que aparece de forma esporádica en la mayoría de los casos, existiendo una recuperación exitosa de folículos en ciclos previos y/o sucesivos. Esto supone que estaría relacionado con un desarrollo folicular anormal de forma puntual13.
La mayoría de los casos publicados en la literatura de SFV eran en realidad evitables, sin presentar ningún tipo de enfermedad potencial en los pacientes afectos, siendo el riesgo de SFVG mucho menor de lo que se pensaba. Algunos casos podrían ser consecuencia de una ovulación prematura que no se reconoció en el momento, lo cual disminuye aún más la incidencia estimada. Debería establecerse un registro de todos los SFVG para identificar de este modo el riesgo potencial de desarrollarlo, así como los factores etiológicos que lo condicionan. Además, será necesario conocer los datos relativos a la demografía de la paciente, el protocolo de estimulación empleado, los niveles hormonales obtenidos, la reserva ovárica previa y los niveles de hCG obtenidos el día de la punción para completar la información relativa al caso14. En el nuestro, todos estos factores se tienen en cuenta, confirmando la presencia de un SFVG.
Los mecanismos etiológicos responsables de su aparición siguen siendo inciertos, aunque debemos considerar las alteraciones en la foliculogénesis como una de las posibles causas de su aparición15. Durante la ovulación, la hormona luteinizante desencadena una serie de mecanismos que implican un reblandecimiento del tejido conectivo del folículo, permitiendo que el complejo ovocito-cúmulo se comience a desprender de la pared folicular. Algunos autores han propuesto que la falta de despegamiento de los mecanismos de anclaje del complejo ovocito-cúmulo podría ocasionar la aparición del SFV16,17.
La administración de hCG como desencadenante del pico endógeno preovulatorio de hormona luteinizante es fundamental para desencadenar los eventos intrafoliculares que se producen antes de la recuperación ovocitaria. Esto explicaría los casos del SFV en relación con la administración de hCG o su biodisponibilidad10. En nuestro caso, se constata con la paciente la adecuada administración de la medicación, así como su biodisponibilidad, puesto que a partir del segundo ciclo de estimulación se determinaron los valores de hCG en sangre, que siempre se encontraron dentro de la normalidad. Estos fueron datos fundamentales para orientar nuestro diagnóstico hacia un SFVG.
Meniru y Craft16 reseñaron la importancia de la relación entre la administración de hCG y la punción folicular, de modo que la realización de la misma antes de 36h tras la administración de hCG puede conllevar la no recuperación de ovocitos. En los casos en los que el intervalo entre la administración y la punción haya sido inferior a 36h se puede realizar una segunda punción al llegar al tiempo estipulado. En los casos donde el intervalo es el apropiado, se debe realizar una determinación sérica de hCG, de modo que si los valores obtenidos son inferiores a 40mUI/ml, estas pacientes se podrían beneficiar de la administración de una segunda dosis, pero de un diferente lote18.
La mala biodisponibilidad de hCG estaría en relación con la obtención de una concentración sérica de progesterona baja. De hecho, se ha observado un aumento de los niveles de progesterona en pacientes a las que se administró una segunda dosis de hCG19. Nosotros no realizamos la determinación de los niveles de progesterona, pero se constataron niveles óptimos de hCG, por lo que se puede considerar que la biodisponibilidad de la misma fue la adecuada.
Stevenson y Lashen15 encontraron, tras realizar una revisión de una serie de 34 casos, que el 41% de las parejas presentaba factor masculino como causa de esterilidad, determinando que la mayoría de las pacientes no presentaban ninguna enfermedad de base. La edad media de las pacientes que presentaban SFVG fue de 33 años, y en su mayor parte mostraban una reserva ovárica compatible con la normalidad. El seguimiento a largo plazo de estas pacientes podría aportar datos más concluyentes acerca de su etiología. De las pacientes con SFVG, el 83% presentaban esterilidad primaria. En el caso que nos ocupa, la edad de la paciente es superior a la media, a pesar de lo cual se constata una reserva ovárica óptima. Asimismo, el motivo de consulta fue la presencia de esterilidad primaria sin causa aparente.
Algunos autores han propuesto la foliculogénesis disfuncional como teoría etiopatogénica del SFVG, puesto que se produciría una atresia temprana de los ovocitos con la consecuente ausencia de los mismos en la punción folicular8,20.
Onalan et al.12 describieron la recurrencia de SFVG en 3 ciclos en 2 hermanas gemelas con sordera congénita, por lo que postulan la presencia de un factor genético hereditario, responsable de la etiología tanto del SFVG como de la pérdida de audición.
El efecto del protocolo de estimulación sobre el riesgo de SFV es desconocido. Stevenson y Lashen15 evidenciaron la presencia de SFVG en un caso al cual se aplicó un protocolo de estimulación con antagonistas, frente a 3 casos en los cuales se realizó protocolo con análogo largo.
Se ha propuesto repetir el ciclo con hCG recombinante, hormona luteinizante recombinante o bien desencadenar la maduración de ovocitos con un agonista de la hormona liberadora de gonadotropinas en un ciclo de antagonista. Si a pesar de todo persiste el SFVG la donación de óvulos podría ser una opción, dependiendo de la edad de la paciente y otros criterios. En nuestro caso, se emplearon ambos protocolos de estimulación con resultados similares, por lo que finalmente se propone a la pareja la ovodonación para obtener gestación.
En conclusión, ante una sospecha de SFV hay que distinguir entre SFVG y SFV falso, de modo que después de hacer una distinción entre ambos, se estima una incidencia mucho menor del primero, lo cual es un aspecto positivo, dadas las consecuencias económicas y la carga emocional que condiciona para la paciente. Si estamos ante un SFVG, debemos ofrecer a la pareja la ovodonación como una opción alternativa ante la imposibilidad de conseguir un embarazo mediante el uso de los óvulos propios de la paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.