La vacunación frente al virus del papiloma humano (VPH) constituye una herramienta preventiva muy novedosa y de un gran impacto en la prevención primaria oncológica. El flujo de información es continuo y requiere una permanente puesta al día. Inmunogenicidad, eficacia, seguridad y eficiencia de las dos vacunas disponibles, Cervarix®, bivalente VPH 16/18, y Gardasil®, tetravalente 6/11/16/18, son actualizadas y discutidas en esta revisión.
Vaccination against human papillomavirus (HPV) is a recently developed preventive tool with a major impact on primary cancer prevention. Because of the pace at which new data appear, a constant effort is required to keep up to date. The present review discusses and provides an update on the immunogenicity, efficacy, safety and efficiency of the two currently available vaccines, Cervarix®, a bivalent vaccine for the prevention of HPV 16- and 18-associated cervical cancer, and Gardasil®, a tetravalent vaccine against HPV types 6, 11, 16, and 18.
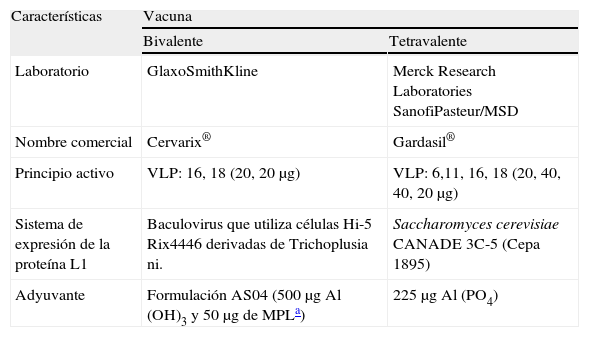
Las vacunas frente al VPH están compuestas por partículas semejantes a los virus nativos (VLP)1. Se trata de estructuras esféricas conformadas a partir de la propiedad de autoensamblaje de la proteína L1, gen estructural inmunógeno mayor de la cápside viral, obtenida por recombinación génica en el laboratorio. Las proteínas L1 utilizadas en cada una de las vacunas no son exactamente iguales y siguen procesos de elaboración distintos, lo que les confiere propiedades biológicas diferenciales, sin que hasta la fecha se haya demostrado el impacto real de dichas diferencias en el perfil de eficacia clínica de ambas vacunas. Cada VLP está constituida por 72 pentámeros de L1. No contienen otro elemento viral, por lo que la ausencia de los oncogenes E6 y E7 les confiere máxima seguridad. Las VLP son morfológica e inmunogénicamente similares a los viriones nativos, pero carecen de capacidad infectiva, replicativa y oncogénica al no poseer ADN viral (tabla 1).
Comparación entre vacunas
| Características | Vacuna | |
| Bivalente | Tetravalente | |
| Laboratorio | GlaxoSmithKline | Merck Research Laboratories SanofiPasteur/MSD |
| Nombre comercial | Cervarix® | Gardasil® |
| Principio activo | VLP: 16, 18 (20, 20μg) | VLP: 6,11, 16, 18 (20, 40, 40, 20μg) |
| Sistema de expresión de la proteína L1 | Baculovirus que utiliza células Hi-5 Rix4446 derivadas de Trichoplusia ni. | Saccharomyces cerevisiae CANADE 3C-5 (Cepa 1895) |
| Adyuvante | Formulación AS04 (500μg Al (OH)3 y 50μg de MPLa) | 225μg Al (PO4) |
El «desarrollo de los ensayos clínicos» está regulado en España por la Ley del Medicamento 25/1990, de 20 de noviembre, publicada en el BOE el 22 de diciembre de 1990 y que sigue vigente. En ella se especifican las características de cada fase según las siguientes precisiones:
Fase I: análisis a corto plazo de seguridad y pauta de administración (dosis) más adecuada en un número limitado de sujetos.
Fase II: seguridad y respuesta inmune en algunos centenares de sujetos. Indicios de eficacia.
Fase III: eficacia clínica, seguridad y tolerancia en miles de sujetos, intentando reproducir las condiciones de uso habituales.
Fase IV: efectividad y seguridad en la utilización clínica diaria.
La Organización Mundial de la Salud (OMS) definió al CIN 2+ histológicamente documentado y a la infección persistente por VPH como «variables subrogadas de eficacia», ante la imposibilidad ética y metodológica de establecer el cáncer de cuello de útero como variable final de eficacia en los ensayos2. El concepto de «infección persistente» se basa en el momento del seguimiento en que aparece el incremento significativo del riesgo de desarrollar CIN2+. Informaciones recientes la sitúan por encima de los 12 meses de infección3,4.
«La vacuna bivalente (®)» ha sido evaluada en «dos ensayos clínicos» de fase II y III aleatorizados, doble ciego, controlados con placebo que incluyeron un total de 19.778 mujeres de 15 a 25 años de edad. Se realizó en el reclutamiento cribado citológico y de presencia de VPH5.
«La vacuna tetravalente (Gardasil®)» ha sido evaluada en «cuatro ensayos clínicos» de fase II y III aleatorizados, doble ciego, controlados con placebo que incluyeron un total de 20.541 mujeres de 16 a 26 años de edad, reclutadas sin cribado previo ni citológico ni de presencia de infección por VPH6.
C. InmunogenicidadNo está validada una técnica única para la determinación de anticuerpos frente al VPH ni un sistema estándar de cuantificación. Únicamente para el VPH 16 la OMS tiene un sistema validado con definición de unidades internacionales7.
En los ensayos de Gardasil® se han medido anticuerpos neutralizantes con técnica cLIA (inmunoensayo competitivo Luminex®) y en los de «Cervarix®» anticuerpos totales con técnica ELISA (ensayo de inmunoadsorbente ligado a enzima), una técnica que ha demostrado ser un excelente test subrogado de medición de la actividad neutralizante8.
No conocemos el umbral de correlación nivel de anticuerpos/eficacia: ¿a partir de qué nivel de anticuerpos se produce la protección frente a lesión? Es una pregunta por el momento sin respuesta, aunque los indicios preclínicos en modelos animales orientan hacia que niveles muy bajos pueden ser eficaces9.
En su fase II, 1.113 mujeres entre 15 y 25 años seguidas hasta 7,3 años, «Cervarix®» ha demostrado una sostenida y alta inmunogenicidad para los dos tipos vacunales, 10–11 veces superior a la inmunidad natural10. Los mismos resultados de estabilidad e intensidad de la respuesta inmune para ambos tipos vacunales se observan en seguimiento a 5,5 años en mujeres entre 15 y 55 años11. También en mujeres vacunadas con «Cervarix®» existe buena correlación de niveles de anticuerpos frente a los tipos vacunales 16 y 18 en moco cervical y en suero12.
«Cervarix®» ha sido bien tolerada y ha sido muy inmunógena en varones de edad entre 10 y 18 años, induciendo niveles de anticuerpos no inferiores a los previamente informados en mujeres de más edad en las que la eficacia ha sido ya demostrada13.
La duración de la protección ofrecida por «Cervarix®» ha sido explorada aplicando tres modelos diferentes de proyección a los resultados de inmunogenicidad obtenidos en la prolongación a 6,4 años de su ensayo fase II. Se concluye que para cada uno de ellos, los títulos de anticuerpos frente a los VPH 16 y 18, permanecen muy por encima de los obtenidos en la infección natural por al menos 20 años14.
En un ensayo comparativo de inmunogenicidad entre las dos vacunas disponibles15, «Cervarix®» ha demostrado ser más inmunogénica que «Gardasil®» en el mes siguiente a la última dosis del esquema a tres dosis de ambas vacunas (mes 7) y para cada uno de los tres grupos etarios estudiados, 18–25 años, 27–35 y 36–45. La inmunogenicidad se ha medido utilizando el PBNA, test de neutralización de seudoviriones16. Además, «Cervarix®» ha generado, en el mes 7, mayor frecuencia de liberación de linfocitos B de memoria inmune que «Gardasil®» magnitud medida por el ELISPOT17. La reactogenicidad local y los acontecimientos adversos generales (artralgia, fatiga, fiebre, trastornos digestivos, cefalea, mialgias y urticaria) han sido mayores para «Cervarix®», aunque siempre fueron leves y de corta duración.
Los datos publicados de «Gardasil®» muestran la persistencia de altos niveles de anticuerpos protectores a medio plazo y además evidencia de memoria inmune. Una dosis administrada en el mes 61 de seguimiento de mujeres vacunadas generó una inmediata e intensa subida del nivel de anticuerpos para los cuatro tipos vacunales, sobrepasando el nivel obtenido después de la tercera dosis18.
También se ha publicado ausencia de interferencia inmunológica entre tipos. Los títulos de anticuerpos detectados para VPH 16 en las mujeres vacunadas con «Gardasil®» eran similares a los encontrados en las mujeres que recibieron vacuna monovalente tipo 1619.
En 4.606 varones de 16 a 26 años «Gardasil®» ha demostrado que los títulos de anticuerpos para los cuatro tipos vacunales 6, 11, 16 y 18 medidos al mes 7 son equivalentes a los previamente encontrados en mujeres de la misma edad en la que la eficacia ha sido ya demostrada. Las tasas de seroconversión se situaron para los 4 tipos entre el 97 y el 99%20.
En dos comunicaciones recientes «Gardasil®» ha documentado los primeros datos de inmunogenicidad para una vacuna VPH en sujetos inmunocomprometidos.
Una niña de 12 años con síndrome WHIM (verrugas, hipogammaglobulinemia e infecciones bacterianas recurrentes), un desorden inmunológico grave asociado a una mutación de CXCR4, seroconvirtió para los cuatro tipos vacunales después de ser vacunada con «Gardasil®» , con rangos 1:50 para los tipos 6, 11 y 16 y 1:200 para el 18 en comparación con sujetos inmunocompetentes21.
71 niñas y 55 niños de 7 a 12 años de edad VIH+ recibiendo terapia antirretroviral, fueron divididos en 3 grupos de acuerdo con su status CD4. Se administró «Gardasil®» en las semanas 0, 8 y 24 y el control inmunitario se realizó en la postsemana 28. Se registró 100% de seroconversión para los tipos 6, 11 y 16 y 97% para el 18, con títulos menores de los encontrados en chicos saludables de las mismas edades para 6 y 18, iguales para 11 y 16. No se registraron efectos adversos graves22.
Para demostrar si los anticuerpos inducidos por la vacunación con «Gardasil®» cruzan la placenta se midieron en un estudio piloto los anticuerpos neutralizantes tipo específicos para los cuatro tipos vacunales en sangre de cordón umbilical y en suero materno por el método cLIA23. Los niveles encontrados de anticuerpos neutralizantes en las dos localizaciones fueron similares para los 4 tipos vacunales.
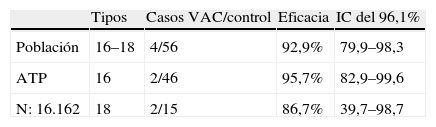
D. EficaciaSe han publicado24 los resultados de eficacia obtenidos en el análisis por protocolo en el ensayo fase II (776 mujeres) de «Cervarix®» con seguimiento hasta 6,4 años (media 5,9) con una eficacia del 100% frente a infección persistente a 12 meses por VPH 16/18 del 100% (IC del 95%: 80,5–100) y similar del 100% frente a CIN I+ (IC del 95%: 73–100) y frente a CIN II+ (IC del 95%: 51–100).
Los resultados de un análisis de la fase III de Cervarix®, que incluyó a 18.644 mujeres de entre 15 y 25 años aleatorizadas a dos grupos: 9.528 recibieron «Cervarix®» y 9.267 recibieron vacuna de la hepatitis A como placebo, con un seguimiento de 39,4 meses, han sido publicados25.
Las poblaciones estudiadas han sido definidas según los siguientes parámetros:
ATP (According To Protocol)
- 1.
Pauta de vacunación correcta.
- 2.
Recuento de casos a partir del 1.er día post 3.a dosis.
- 3.
Citología negativa o L.SIL en reclutamiento.
TVC (Total Vaccinated Cohort)
- 1.
Al menos 1 dosis administrada.
- 2.
Recuento de casos a partir del 1.er día post 1.a dosis.
- 3.
Citología negativa o L/H SIL en reclutamiento.
TVC – naïve
- 1.
Al menos 1 dosis administrada.
- 2.
Recuento de casos a partir del 1.er día post 1.a dosis.
SERO/PCR negativas (vacunales+14 tipos de AR) en reclutamiento.
Los resultados publicados son los siguientes (tabla 2).
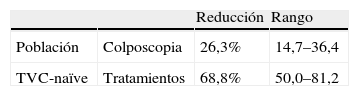
En esta misma publicación, se ha informado del impacto reductor de la vacunación con «Cervarix®» en el número de colposcopias y de tratamientos derivados que recibirían las mujeres vacunadas (tabla 3).
Estos números, junto a los de protección cruzada que se comentan a continuación, han sido estimados para España26, concluyendo que en una cohorte de niñas de 12 años la vacunación con «Cervarix®» con una cobertura del 80% provocaría en su seguimiento de por vida 13.000 citologías anómalas menos y una reducción del 54% en los tratamientos derivados de su evaluación.
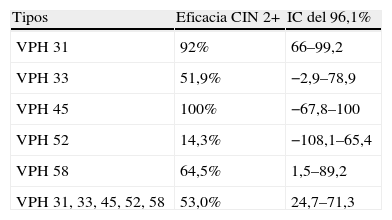
La protección cruzada, es decir, frente a tipos no vacunales, ha sido también publicada en los datos del estudio PATRICIA25 con los siguientes resultados (tabla 4).
La protección ofrecida por Cervarix® a mujeres con evidencia de infección ha sido evaluada en un informe inicial de su fase II en mujeres entre 15 y 25 años. No se precisa en la publicación el rango de esta protección, que se confirma, al tiempo que se objetiva que la tasa de aclaramiento del VPH tanto a los 6 meses como a los 12 es la misma en la cohorte vacunada que en la de control27.
La vacuna monovalente 16 ensayada por Merck publicó en 2002 sus datos de eficacia28. Fueron considerados por la OMS como la prueba de principio de la validez de los ensayos para la vacunación frente al VPH29.
Se han comunicado los resultados de inmunogenicidad y eficacia de esta vacuna en un seguimiento hasta 9,5 años (media, 8,5). El 83,6% de las mujeres vacunadas permanecían seropositivas con una eficacia del 100% frente a CIN (IC del 95%: 47–100)30.
La «vacuna tetravalente (Gardasil®)» fue evaluada en cuatro ensayos clínicos de fase II y III aleatorizados, doble ciego, controlados con placebo que incluyeron un total de 20.541 mujeres de 16 a 26 años de edad. Se definieron dos tipos de población para el análisis:
- •
PP, población por protocolo:
- ○
Cumplimiento del esquema de vacunación.
- ○
VPH (−) a 14 tipos de AR antes de la 1.a dosis (73% de las mujeres) y al mes 7.
- ○
Recuento de casos a partir del mes 7.
- ○
- •
ITT, intención de tratar.
- ○
Al menos 1 dosis administrada.
- ○
Independiente del status VPH en el reclutamiento.
- ○
Recuento de casos 1 mes después de la 1.a dosis.
- ○
Se han comunicado31 y publicado32 los resultados finales del análisis combinado de sus cuatro ensayos fases II–III. Los resultados del análisis de cada una de las fases son consistentes con los del combinado. La potencia de estos resultados ha provocado que el independiente Data and Saffety Monitoring Board haya recomendado el cierre de los ensayos y la vacunación, por razones éticas, de las mujeres del grupo placebo. Estos resultados con seguimiento a cuatro años son los siguientes:
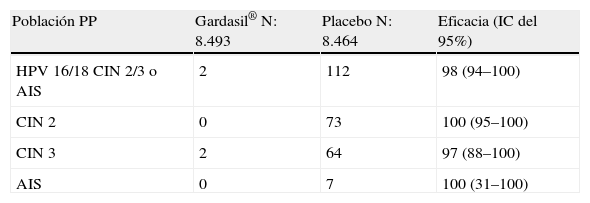
100% de eficacia frente a infección persistente por VPH 16 (IC del 95%: 94–100) y por VPH 18 (IC del 95%: 80–100) tabla 5.
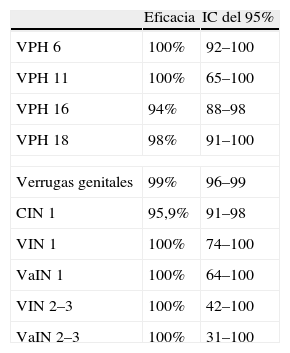
También se han comunicado33 y publicado34 datos de eficacia de Gardasil® en la prevención de CIN 1, la neoplasia intraepitelial de vagina (VaIN) 1–2–3, de vulva (VIN 1–2–3) y de las verrugas genitales asociados al VPH 6, 11, 16, 18. Los resultados se expresan en PP (tabla 6).
Además se han comunicado y/o publicado resultados sobre la eficacia de Gardasil® en mujeres con perfiles diferentes a las incluidas en los análisis iniciales:
- •
Mujeres hasta 45 años35. PP: 90,5% de eficacia (IC del 95%: 73,7–97,5) frente a infección persistente y lesiones clínicas cervicales o en genitales externos asociadas a VPH 6,11,16,18.
- •
Mujeres con evidencia de infección por VPH36. La vacunación con Gardasil® ha sido 100% efectiva (IC del 95%: 79–100) en prevenir CIN 2–3 o adenocarcinoma in situ (AIS) incidente causados por el tipo o los tipos de VPH a los que la mujer era negativa al entrar en el estudio. La eficacia en prevenir lesiones vulvares y vaginales ha sido del 94% (IC del 95%: 81–99).
- •
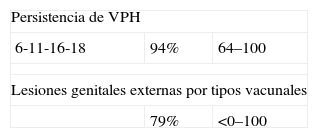
Mujeres con antecedente de infección, sin DNA viral detectable pero anticuerpos presentes (PCR negativas/seropositivas)37, con los siguientes resultados a cuatro años de seguimiento: 100% de eficacia frente a CIN (cualquier grado) o AIS (IC del 95%; 29–100) y 100% de eficacia frente a lesiones genitales externas (IC del 95%; 40–100).
La protección cruzada de Gardasil® ha sido publicada38,39 e incorporada a su ficha técnica (tabla 7).
Dos comunicaciones40,41 han precisado, siguiendo la estratificación recomendada por el Sistema Bethesda de información de resultados citológicos, cuál es el impacto reductor de Gardasil® sobre cada uno de estos tipos de resultados y sobre los tratamientos derivados de su evaluación y diagnóstico:
ASC.US: 23%.
ASC.H: 35%.
L.SIL: 16%.
H.SIL: 43%.
Tratamientos: 42%.
La estimación de la aplicación de estos resultados al contexto español, se ha publicado42 para un programa de vacunación global, estimándolo en una reducción anual de 96.254 resultados citológicos anómalos. Una comunicación43 ha fijado esta reducción para un programa de vacunación a mujeres entre 15 y 24 años en 17.627 resultados citológicos anómalos menos anuales.
Gardasil® ha comunicado44 los primeros resultados de eficacia en hombres. Se trata de una fase II, 4.605 hombres entre 16 y 26 años con 3 años de seguimiento. Los resultados se comunican en PP (tabla 8).
Un subanálisis en 602 homosexuales (MSM) a los 2 años de seguimiento45 ha producido en PP estos resultados (tabla 9).
E. EfectividadLos primeros datos de efectividad (resultados de eficacia en práctica clínica) de una vacuna frente al VPH han sido comunicados por Gardasil®46. Se ha medido el impacto poblacional en la presentación de verrugas genitales (VG) del programa australiano de aplicación de Gardasil® desde abril/07, que se aplica en mujeres según el siguiente esquema:
- •
12–18 años: vacunación en escuelas cubierta por el Programa Nacional de Salud.
- •
19–26 años: práctica general, financiada.
Hubo menos consultas por VG en 2008 que en el período 2004–07 tanto en hombres (RR 0,82, IC del 95%: 0,75–0,90) como en mujeres (RR 0,62; IC del 95%: 0,54–0,72) pero este impacto se registró únicamente en mujeres <28 años (vacunadas) (RR 0,52; IC del 95%: 0,44–0,63) y hombres heterosexuales (compañeros sexuales de las mujeres vacunadas) (RR 0,83; IC del 95%: 0,74–0,92), pero no en mujeres >28 años (no vacunadas) u hombres homosexuales (sin relaciones sexuales con mujeres).
ComentariosContamos con dos excelentes vacunas frente al VPH, y los nuevos datos que han venido apareciendo y que hemos tratado de resumir aquí, confirman y amplían el perfil de seguridad y eficacia con el que ambas vacunas fueron licenciadas en su día.
El debate debe centrarse en la variable subrogada de eficacia de las vacunas establecida por la OMS4,47, la protección frente a la infección persistente y a las lesiones precancerosas, que es obvio que son las cuestiones que interesan al clínico. La inmunogenicidad tiene un valor cierto que según apreciaciones últimas del máximo nivel48 se centra en:
- 1.
Su valor como control de calidad de la fabricación y de la estabilidad durante el almacenamiento y distribución de la vacuna.
- 2.
El concepto de inmunogenicidad puente para extender la protección a poblaciones no analizadas en las fases III iniciales.
- 3.
El estudio de su tendencia como marcador de duración de protección.
En este último punto ambas vacunas aportan excelentes informaciones. Como ya se ha dicho14, Cervarix® muestra una tendencia inmunogénica que predice protección a largo plazo y Gardasil® ha documentado desarrollar memoria inmune18, el más importante marcador de protección duradera9.
Tenemos que tener presente que no conocemos el punto de correlación título de anticuerpos/protección: ¿qué nivel de anticuerpos garantiza la prevención frente a lesión precancerosa? Este umbral de eficacia no ha sido definido. Sabemos algunas cosas relativas a este punto. Los datos recientes sobre la vacuna monovalente 16 nos informan30 que en un seguimiento de hasta 9,5 años mantiene una eficacia del 100% frente a CIN cuando la seropositividad del conjunto de las mujeres vacunadas está situada en un 83,6%. Gardasil® con cuatro años de seguimiento sigue protegiendo a un 98% de mujeres vacunadas frente a CIN vinculado al VPH 18 a pesar de que el porcentaje de mujeres seropositivas es del 60%32.
Las causas de esta discordancia, del hecho de que la eficacia clínica se mantenga muy por encima de los títulos de seroconversión, pueden ser múltiples:
- 1.
Protección vía memoria inmune18.
- 2.
El test cLIA usado por Merck puede que sea relativamente insensible, aunque muy específico, por lo que puede haber una fracción de mujeres falsamente negativas en el ensayo48.
- 3.
Protección con niveles bajos o indetectables de anticuerpos: en el modelo animal, niveles muy bajos protegen frente a lesión condilomatosa9.
- 4.
Existen otros mecanismos de protección frente a la infección (humorales y no humorales) inducidos por la vacuna y que no estamos midiendo con ninguna de las técnicas actualmente empleadas.
Con estas consideraciones en mente, debemos evaluar el ensayo de inmunogenicidad comparada comunicado recientemente en el XX IPC de Malmö15, un esfuerzo interesante. A la espera de su publicación completa para poder ser analizado en detalle, debemos ser cautelosos en su interpretación puesto que:
- •
Informa únicamente de respuesta en mes 7 posprimera dosis.
- •
No informa sobre niveles en la población de máximo interés vacunal, el grupo etario 9–14 años.
- •
No se ha establecido ni se conoce ninguna relación entre la respuesta inmune frente a las vacunas VPH y su eficacia clínica.
- •
Se han usado las VLP vacunales de cada compañía, diferentes entre sí y con probable impacto sobre los resultados.
Recordemos, tal como se citó previamente, que la inmunogenicidad en sí misma no es una variable de eficacia reconocida por las agencias reguladoras; sí lo es la protección frente a neoplasia intraepitelial, no contemplada en este ensayo.
Los datos adicionales de inmunogenicidad comunicados por Gardasil® son muy interesantes.
La demostración de inmunogenicidad en sujetos inmunocomprometidos incorpora las primeras evidencias al respecto informadas por una vacuna. La población con problemas de inmunidad, muy especialmente la VIH+, es de muy alto riesgo para el desarrollo de enfermedades neoplásicas. Este incremento del riesgo de presentar cánceres de tracto genital inferior femenino, ano y pene ha sido recientemente actualizado49.
La transmisión transplacentaria de los anticuerpos inducidos por la vacunación con Gardasil® genera sólidas expectativas de protección para el recién nacido frente a la papilomatosis respiratoria recurrente, una enfermedad de curso tórpido y frecuentemente grave causada por los tipos 6 y 11 del VPH50.
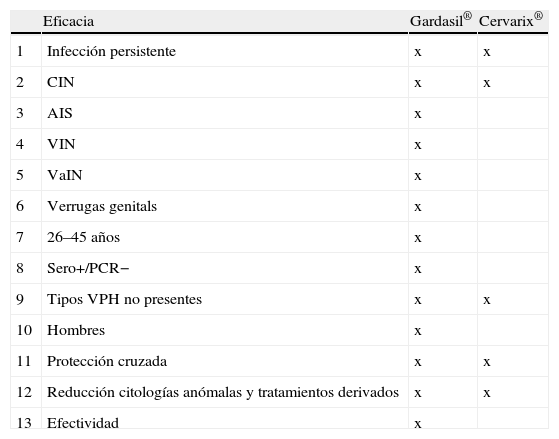
La tabla siguiente resume las evidencias disponibles de ambas vacunas relativas a eficacia (tabla 10).
- 1.
Ambas vacunas presentaron en fase II un 100% de eficacia frente a infección persistente por los tipos vacunales con lo que el primer objetivo de eficacia preventiva exigido por la OMS4 quedó perfectamente cubierto.
- 2.
Alta eficacia de ambas vacunas para la prevención del CIN, con independencia de los títulos de anticuerpos, tal como se discutió antes.
- 3.
Gardasil® protege en el rango del 100% frente al AIS, lesión previa del adenocarcinoma invasor de cuello de útero. La posibilidad de hacer prevención primaria de este tipo de cáncer constituye una muy buena noticia, dado que la capacidad preventiva secundaria que tenemos frente a estas lesiones basada en citología y colposcopia es muy pobre. Los registros poblacionales recogidos en la última edición del Cancer in Five Continents51 recogen que los impactos decrecientes obtenidos mediante el cribado en las tasas de incidencia y mortalidad por cáncer de cuello de útero afectan exclusivamente a la variedad escamosa.
- 4.
Ampliación de la protección de Gardasil® a todas las neoplasias intraepiteliales de tracto genital inferior y a las VG, recogida ya en su ficha técnica. La protección frente a verrugas es muy importante. Esta es una patología muy prevalente, de tratamiento frecuentemente problemático y que produce costes elevados, además de gravar muy sensiblemente la calidad de vida de quien la sufre. Datos españoles al respecto de todos estos apartados están ya disponibles o están pendientes de publicación52,53.
- 5.
Las mujeres con relaciones sexuales permanecen a riesgo de infectarse por VPH a lo largo de su vida en función de cambios de pareja sexual o de esta con otras parejas (redes sexuales). Un estudio de cohortes de mujeres colombianas54 demostró que este riesgo disminuye con la edad, pero que en mujeres que inician sus relaciones sexuales entre los 30 y los 44 años alrededor del 22% son positivas a VPH a los 5 años. En consecuencia, es muy relevante que Gardasil® haya demostrado ofrecer una alta protección a las mujeres en este segmento de edad, lo cual amplia la perspectiva de su aplicación clínica a medio plazo.
Cervarix® ha documentado11, como ya se citó, en seguimiento a 5,5 años en mujeres entre 15 y 55 años títulos altos y persistentes de anticuerpos para ambos tipos vacunales 16 y 18, pero la eficacia frente a lesiones resta por demostrar.
- 6.
La respuesta inmunogénica a la infección natural por VPH es pobre y desaparece a medio plazo. Solo la mitad de las mujeres que contactan con el VPH desarrollan anticuerpos y una proporción mayoritaria de ellas son seronegativas a los 2 años55. Por otro lado, informaciones recientes56 aportan datos novedosos sobre riesgo muy elevado de segundas infecciones en mujeres que han aclarado una infección previa (58% RR 2.a infección) o que presentan infección persistente (93% RR 2.a infección). Es por lo tanto muy importante saber que Gardasil® haya demostrado36 un 100% de eficacia frente a CIN en cualquier grado o AIS y otro 100% frente a lesiones genitales externas en mujeres seropositivas sin DNA viral detectable, mujeres, como se ha dicho, a muy alto riesgo de reinfección.
- 7.
De informaciones obtenidas en el reclutamiento de las mujeres que participaron en los ensayos de Gardasil®57 sabemos que la posibilidad de que una mujer europea sea positiva para los cuatro tipos vacunales es del 0,2% (solo una mujer entre 21.000 lo fue), para 3 tipos del 1,2%, para 2 tipos del 5,5% y para un tipo del 17,8%.
En consecuencia, hay siempre un amplísimo margen de negatividad para VPH, lo que sustenta la actual recomendación de vacunar frente a VPH sin necesidad de practicar un test de VPH como paso previo a la vacunación58.
Ambas vacunas han documentado27,37 que protegen a la mujer vacunada frente a los tipos vacunales no presentes en el momento de recibir la vacuna.
Cervarix® menciona esta protección en un trabajo que demuestra básicamente que la tasa de aclaramiento del VPH es la misma en las dos cohortes, vacunada y control27.
Esta documentación es más precisa para Gardasil®, que la fija en 100% para CIN 2+ y AIS y en 94% para lesiones vulvovaginales37.
- 8.
Los excelentes datos de inmunogenicidad en varones publicados por ambas vacunas13,20 se han visto confirmados para Gardasil® con los primeros datos de eficacia59,60 que abren la puerta de la aplicación de esta vacuna a hombres homo y heterosexuales con consistentes indicios de alta eficacia. La importancia de esta primera confirmación de eficacia en hombres debe medirse en términos de protección individual, que parece clara, de modificación de la transmisibilidad hombre–mujer, en estudio, y de su repercusión en los programas de vacunación de salud pública, aspecto que se discute en el capítulo de eficiencia de este artículo.
- 9.
Un tipo de VPH se diferencia de otro en que hay una diferencia de alrededor del 10% o más en la secuencia de aminoácidos constitutiva de la proteína L1 inmunógena mayor de su cápside. Los α papilomavirus se organizan en especies, 15 en total. A la especie 7 pertenecen el 18 y el 45, homólogos en un 88% de su L1; a la especie 9 pertenecen el 16 y el 31, que comparten un 84% de la secuencia L1; y en la especie 10 están el 6 y el 11, con una L1 similar en un 92%61. La protección cruzada parcial entre pares muy relacionados es posible, porque cada par comparte al menos un epítope de neutralización cruzada, aunque sea uno menor.
Es por lo tanto razonable que se produzca un cierto grado de protección principalmente frente a los tipos no vacunales filogenéticamente más próximos a los vacunales.
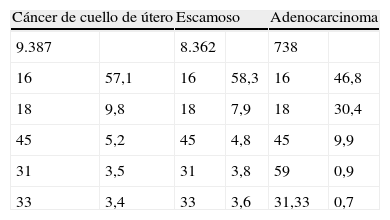
La importancia de esta protección cruzada puede medirse al observar en la tabla siguiente la distribución de tipos de VPH más recientemente establecida para cáncer de cuello de útero en su conjunto y, particularmente para las variedades escamosa y glandular, este último quizá un tumor «de tres tipos»: 16, 18 y 45 (tabla 11).
Tabla 11.Distribución de los diferentes tipos del virus del papiloma humano
Cáncer de cuello de útero Escamoso Adenocarcinoma 9.387 8.362 738 16 57,1 16 58,3 16 46,8 18 9,8 18 7,9 18 30,4 45 5,2 45 4,8 45 9,9 31 3,5 31 3,8 59 0,9 33 3,4 33 3,6 31,33 0,7 Fuente: de Sanjosé, Institut Català d,Oncologìa, en preparación.
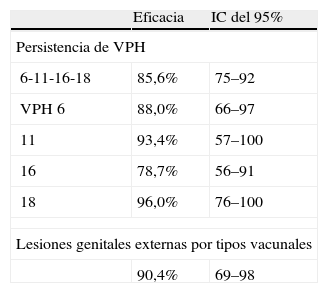
Cervarix® presenta datos de protección cruzada25 significativa frente a VPH 31, 92% y frente a VPH 58, 64,5%. Las protecciones frente a los VPH 33, 45 y 52 son remarcables pero, por el momento, no significativas. Sí lo es la protección cruzada para los 5 tipos citados, 53%.
Gardasil® tiene ya incorporados a su ficha técnica sus resultados de protección cruzada38,39. El 56% para el VPH 31 y el 23% para el análisis conjunto de los 10 tipos oncogénicos más prevalentes después del 16 y del 18, ambos hallazgos significativos.
- 10.
Ambas vacunas han publicado datos de reducción de citologías anómalas y de los tratamientos derivados de la evaluación de estas citologías.
Comparación de la eficacia entre ambas vacunas
| Eficacia | Gardasil® | Cervarix® | |
| 1 | Infección persistente | x | x |
| 2 | CIN | x | x |
| 3 | AIS | x | |
| 4 | VIN | x | |
| 5 | VaIN | x | |
| 6 | Verrugas genitals | x | |
| 7 | 26–45 años | x | |
| 8 | Sero+/PCR− | x | |
| 9 | Tipos VPH no presentes | x | x |
| 10 | Hombres | x | |
| 11 | Protección cruzada | x | x |
| 12 | Reducción citologías anómalas y tratamientos derivados | x | x |
| 13 | Efectividad | x |
Cervarix® ha publicado estimaciones globales del impacto25, y de su repercusión en España a lo largo del seguimiento de por vida de una cohorte de niñas de 12 años26.
Gardasil® ha comunicado la precisión de su impacto reductor para cada uno de los tipos de resultados citológicos anormales40,41 y la proyección de este impacto en España ha sido ya publicado42 y comunicado43.
Este es un valor añadido importante en el corto plazo de la eficacia vacunal frente al VPH. Los protocolos de valoración, seguimiento, diagnóstico y eventual tratamiento de esta patología son muy complejos62 y requieren frecuentación alta del sistema sanitario y un uso reiterado de exploraciones y tecnologías. La mujer sometida a este proceso ve penalizada sin duda su tranquilidad. Es por lo tanto muy interesante que la vacuna VPH tenga este potencial precoz reductor de patología muy prevalente y que genera un coste alto, social y económico. Este último ha sido identificado para España: controlar el CIN cuesta en nuestro país 147.284.811 €63.
- 11.
Siempre existe el interrogante que plantea si la eficacia (ensayo clínico) va a traducirse en efectividad (aplicación en práctica diaria). Gardasil® ha comunicado los primeros datos de efectividad procedentes de Australia. Esta demostración de efectividad de Gardasil® en el pionero programa australiano tiene por lo tanto un valor muy alto, porque además introduce la evidencia de la aparición de inmunidad de grupo, mediante la cual sujetos no vacunados (hombres heterosexuales) se benefician de la protección recibida por los vacunados (mujeres<28 años).
Una lectura asociada a estos resultados indica la enorme importancia de las fases IV en el continuo control de la vacunación. Las fases IV deben ser diseñadas y ejecutadas sin excusa ni dilación para obtener toda la información derivada de la vigilancia de la aplicación clínica de la vacuna, toda ella muy importante: coberturas, efectividad, control de seguridad y de duración de la protección y de la probable fluctuación epidemiológica de los tipos de VPH, interacción con el cribado y algunas otras de menor calado. Australia, Estados Unidos y Canadá, el Reino Unido y los países nórdicos y quizá ya algún otro país (Francia e Italia) mantienen ya en acción estas estructuras, en ámbito nacional o local64. En España, lamentablemente, únicamente en Cataluña se están poniendo en marcha las estructuras necesarias para una fase IV65.
F. EficienciaLa OMS ha determinado que una intervención con coste por año de vida salvado inferior al producto interior bruto (PIB) de la comunidad se considera eficiente; alrededor del PIB, probablemente eficiente y muy por encima del PIB, ineficiente66.
En un trabajo relativo a Gardasil®67 se adoptó al contexto español un modelo de Markov de la historia natural de la infección por VPH que incluía vacunación con Gardasil® y cribado. Esta estrategia (vacunación+cribado) se comparó administrada a una cohorte de niñas de 11 años con cobertura del 80% con los sistemas de cribado actuales. Los resultados aportaron que el coste incremental por año de vida ganado y por año de vida ganado ajustado por calidad fue en España de 8.657 € y de 6.493 €, respectivamente. Los análisis de sensibilidad demostraron que este coste/efectividad es estable.
El PIB español medio para el año 2008 fue de 24.020 €, con grandes diferencias territoriales68. La comunidad autónoma menos favorecida fue Extremadura con un PIB de 16.828 €. En consecuencia y siguiendo el criterio de la OMS de eficiencia, la vacunación con Gardasil® es altamente coste/beneficio incluso en el peor escenario económico español.
La clave de la alta eficiencia de Gardasil® se encuentra en el alto potencial preventivo a corto plazo demostrado sobre las VG y la patología vinculada a los tipos 6 y 11 en general. Dentro de los primeros 5 años posvacunación, el 90% de la eficacia preventiva se concentra en esta patología69. Esta estimación ha sido corroborada para el contexto general y para cualquier país. La prevención de los eventos relacionados con los VPH 6 y 11 es precoz y produce el mismo efecto de reducción de costes comparado con la protección frente a la patología VPH 16 /18 dependiente, que se produce más tardíamente70.
Cervarix® ha comunicado recientemente sus datos de eficiencia para España71. La vacunación con cobertura vacunal alta (≈80%) con Cervarix® de chicas adolescentes combinada con un cribado organizado y rediseñado iniciado a los 30 años y con intervalos de control de 3–5 años, asumiendo protección vacunal de por vida, sería la estrategia más coste/beneficio, con un coste por año de vida salvado de 27,700 €.
Este coste situaría en España a la vacunación con Cervarix® en el rango de «probablemente eficiente» para el conjunto del Estado según el criterio de la OMS antes expuesto (PIB medio 2008: 24.020 €). Por comunidades autónomas, País Vasco, Madrid, Navarra y Cataluña serían las únicas con PIB por encima del coste por año de vida documentado por Cervarix® y, en consecuencia, las únicas comunidades de aplicación eficiente en su población. El resto estarían por debajo, algunas muy alejadas, como Murcia (PIB 19.692 €), Andalucía (PIB 18.507 €), Castilla La Mancha (PIB 18.471 €) y Extremadura (PIB 16.828 €).
G. SeguridadLa vacuna VPH ha pasado niveles máximos de exigencia en fases I y II, desarrolladas de acuerdo a normas dictadas por la OMS47.
Hasta el momento han sido distribuidas a nivel mundial unas 50 millones de dosis de vacunas, 45 de Gardasil® y 5 de Cervarix®. Esta distribución y la subsiguiente aplicación clínica está siendo sometida a una estrecha farmacovigilancia compartida de forma muy transparente por las agencias reguladoras nacionales [autoridades sanitarias de cada país, por ejemplo Ministerio de Sanidad y Política Social en España, Food and Drug Administration (FDA) en USA] y supranacionales [Agencia Europea del Medicamento (EMEA), OMS] y la industria farmacéutica. En esta fase IV del desarrollo vacunal se documentan rigurosamente y de forma exhaustiva todos los casos de sospecha de acontecimientos adversos en sujetos vacunados. Dos registros constituyen la referencia internacional:
- •
GACVS: Global Committee on Vaccine Safety, dependiente de la OMS.
- •
VAERS: Vaccine Adverse Event Registry System; sistema abierto de información y comunicación controlado por la FDA y el Center for Disease Control and Prevention (CDC) con sede en Atlanta, USA.
Se ha publicado72 que en un estudio de cohortes de más de 30.000 mujeres de 10 a 25 años vacunadas con Cervarix® no se ha detectado ningún aumento significativo en la cohorte vacunada ni de eventos adversos serios ni de patología relacionada con el embarazo ni de nuevos diagnósticos de enfermedades crónicas, incluyendo enfermedades autoinmunes. Este es un dato muy importante, dada la histórica asociación insinuada de la vacunación de cualquier tipo con un aumento del riesgo de sufrir enfermedades autoinmunes. Para sentar las bases para la exploración en términos adecuados de esta posibilidad, se han publicado las tasas esperadas de enfermedades autoinmunes en adolescentes sanos73, por lo que un exceso de diagnósticos en las cohortes vacunadas podría, en caso de producirse, ser detectado precozmente y con precisión.
Una información adicional muy relevante desde el punto de vista de seguridad y de aplicación clínica ha surgido de la fase IV australiana74. Se recoge que el síncope posvacunación puede aparecer hasta en 10–15% de casos, especialmente condicionada a vacunaciones de adolescentes en grupo, por lo que se recomienda no vacunar con este sistema, consejo especialmente importante y que debe ser necesariamente atendido cuando se acude a vacunar a centros escolares, sistema seguido en España por 8 comunidades autónomas (Extremadura, País Vasco, Navarra, La Rioja, Cataluña, Valencia, Murcia y Baleares) y una ciudad autónoma (Melilla)75.
En esta publicación se recoge también un aumento ligero de la anafilaxia (2,6 x100,00), lo que hace necesario un control presencial posvacunación por 15–20min.
A raíz de los casos de accidentes convulsivos sufridos en Valencia y Baleares en el inicio del 2009 por adolescentes con el antecedente de vacunación con Gardasil® registrados e investigados, la Agencia Española de Medicamentos y Productos Sanitarios emitió un comunicado76 en el que constaba que:
- •
Los casos notificados hasta ahora al Sistema Español de Farmacovigilancia forman parte de lo esperado para un medicamento al que se han expuesto decenas de miles de personas desde su comercialización.
- •
Se ha realizado una nueva revisión de los datos de producción y control del lote NH52670 de Gardasil® al que pertenecían las dosis administradas a las adolescentes de Valencia y Baleares sin que se haya encontrado ninguna anomalía desde el punto de vista de la calidad.
- •
A la vista de los datos disponibles se concluye que no existe suficiente evidencia científica para establecer la relación de causalidad entre la administración de Gardasil® y la aparición de convulsiones severas no sincopales.
- •
Los programas de vacunación en las diferentes comunidades autónomas deben proseguir con normalidad.
- •
Esta recomendación de normalidad en el proceso de vacunación fue refrendada por el Consejo Interterritorial en su reunión ejecutiva de 25 de marzo de 2009.
Cerró este asunto una nota de 23 de abril de 200977 de la Subdirección General de Medicamentos de Uso Humano dependiente del Ministerio de Sanidad y Política Social refrendando totalmente las conclusiones previas ya emitidas por la Agencia española del medicamento.
Por su parte la EMEA emitió una información78 en la que afirmaba que a partir de los datos disponibles, el Comité para Productos Médicos de Uso Humano (CHMP) había concluido que los casos comunicados en España de convulsión no sincopal no estaban relacionados con la vacunación con Gardasil® y que los beneficios de Gardasil® seguían superando a los riesgos. En consecuencia, el Comité siguió recomendando que la vacunación con Gardasil® debiera continuar de acuerdo con los programas establecidos en los estados miembros.
El último informe de la OMS referente al tema de la seguridad de las vacunas VPH ha sido publicado en enero 200979 y está disponible on line en la revista de referencia80. En él se especifica que:
- •
El alto perfil de seguridad de la vacunación debe ser reafirmado.
- •
Pueden registrarse dolor local y cefalea, nausea, fiebre y erupción en<10% casos
- •
Se confirma que no aumentan ni el riesgo fetal ni las anormalidades congénitas.
- •
Sigue no recomendándose la vacunación VPH en el embarazo. Un embarazo imprevisto durante la vacunación no es indicación de interrupción.
- •
Ningún acontecimiento adverso grave ha podido ser relacionado causalmente con la vacunación. Las tasas registradas son las esperadas en una población sana de adolescentes y adultos jóvenes. Las asociaciones son temporales.
Consecuente con este informe, la OMS ha fijado en los siguientes términos su posición en relación a la vacunación VPH en su boletín de 10 de abril de 200981 reafirmada por una de sus responsables en la reciente reunión de Malmö82:
La OMS reconoce la importancia del cáncer de cuello de útero y de las otras enfermedades relacionadas con el VPH como un problema global de salud pública y recomienda que la vacunación rutinaria frente al VPH debiera ser incluida en los programas nacionales de inmunización. La prevención del cáncer de cuello de útero y de las otras enfermedades relacionadas con el VPH constituye una prioridad de salud pública. La introducción de la vacuna VPH es programáticamente factible y su financiación estable debería ser asegurada.
ConclusiónLa disponibilidad de vacunas preventivas seguras y eficaces frente al VPH supone una oportunidad única en la prevención de toda la patología relacionada, con el cáncer de cuello de útero como objetivo principal. Desde que en 1981 se aprobó la vacuna frente al virus de la hepatitis B hasta que, en 1991, se recomendó la vacunación universal de todos los lactantes, se desaprovecharon diez años de unos beneficios que hoy ya nadie discute. Confiemos que a pesar de las similitudes entre ambas enfermedades (virales, de transmisión sexual y causantes de cáncer), el proceso de introducción de la vacuna del VPH, tanto en nuestro país como en el mundo en general, no sufra un retraso paralelo al que en su día tuvo esta vacuna. Con la lección aprendida83, no dejemos escapar esta oportunidad histórica, de modo que todos los profesionales de la salud que jugamos un papel clave en la información, formación y puesta en práctica correctas de la vacuna frente a VPH, aseguremos, en la medida de lo posible, que la oportunidad que supone esta vacunación llegue a todos los que pueden beneficiarse de ella.
Conflicto de interesesLos firmantes han mantenido y/o mantienen relaciones profesionales con alguna de las siguientes compañías: GlaxoSmithKline, Meda, Merck, Qiagen, Roche y Sanofi Pasteur MSD.