La preeclampsia (PE) es un desorden multisistémico que se produce durante el embarazo. Implica alteraciones que conllevan una elevada morbimortalidad en la madre y el neonato. Se ha demostrado que la etiología de la PE está vinculada a factores angiogénicos y antiangiogénicos, específicamente los niveles séricos de la tirosincinasa 1 soluble similar a fms (sFlt-1) se encuentran elevados en embarazadas con PE, mientras los niveles libres circulantes del factor de crecimiento placentario disminuyen.
En este trabajo se ha realizado una revisión sistemática de la literatura para evaluar la validez del ratio sFlt-1/factor de crecimiento placentario para el diagnóstico de PE.
Se han seleccionado 7 estudios: un metaanálisis, 4 estudios prospectivos, 2 de casos y controles y 2 de cohortes; y 2 estudios retrospectivos.
La conclusión de esta revisión es que el ratio sFlt-1/factor de crecimiento placentario tiene una precisión diagnóstica moderada y es útil como técnica de apoyo en el diagnóstico y seguimiento de gestantes con sospecha de PE, especialmente para poder descartar el desarrollo de esta.
Pre-eclampsia (PE) is a multisystem disorder that occurs during pregnancy. It involves alterations that lead to high morbidity and mortality in mother and newborn. It has been shown that the aetiology of PE is linked to angiogenic and anti-angiogenic factors, specifically the serum levels of soluble tyrosine kinase 1 similar to fms (s-Flt1) are elevated in pregnant women with PE, while the circulating levels of the free placental growth factor decrease.
In this work, a systematic review of the literature has been carried out to evaluate the validity of the s-Flt1 / placental growth factor ratio for the diagnosis of PE.
Seven studies have been selected: one meta-analysis, 4 prospective studies, 2 case-control studies and 2 cohort studies; and 2 retrospective studies.
The conclusion of this review is that the sFlt-1 / placental growth factor ratio has a moderate diagnostic accuracy, and is useful as a support technique in the diagnosis and follow-up of pregnant women with suspected PE, especially to rule it out.
La preeclampsia (PE) es un desorden multisistémico que se produce durante el embarazo. En España tiene una prevalencia entre el 1 y 2%1. Implica alteraciones que conllevan una elevada morbimortalidad en la madre y el neonato. En la madre la PE provoca cuadros hipertensivos que pueden derivar en síndrome HELLP (del inglés Hemolysis, Elevated Liver enzymes and Low Platelet count) o eclampsia, además el riesgo de edemas pulmonares y fracaso renal es hasta 30 veces superior2. Es responsable del 13% de la mortalidad materna3. Entre las complicaciones neonatales se encuentran el parto pretérmino, retraso del crecimiento intrauterino y bajo peso al nacer. Entre el 50 y el 70% de los recién nacidos en estas circunstancias son ingresados en UCI neonatal y entre un 30 y un 40% sufre morbilidad grave neonatal.
El diagnóstico de la PE se realiza según el acuerdo de la National High Blood Pressure in Pregnancy cuando existen tanto hipertensión como proteinuria. Se considera cuando aparece un estado hipertensivo de novo con cifras de tensión arterial por encima de 140 /90mmHg, al menos 2 veces en un periodo de 6h; y definiendo proteinuria a partir de 300mg/24h4.
Estos parámetros son demasiado simples para una manifestación tan compleja como la PE y carecen de una relación específica con la fisiopatología de la enfermedad. Por ello, diabetes mellitus, obesidad o lupus, que pueden cursar también con proteinuria e hipertensión, pueden ser causa de falsos positivos5.
La fisiopatología de la PE sigue sin ser completamente conocida. La PE precoz, que se manifiesta antes de la semana 34 de gestación, está relacionada con la implantación anormal de la placenta, el remodelado insuficiente de la arteria espiral y la expresión alterada de proteínas placentarias6. La PE tardía no parece tener relación con la implantación placentaria, pero sigue estando vinculada con la alteración de la síntesis de las proteínas angiogénicas y antiangiogénicas.
Específicamente, se ha demostrado que los niveles séricos de la tirosincinasa 1 soluble similar a fms (sFlt-1), proteína antiangiogénica, se encuentran elevados en embarazadas con PE. A su vez, los niveles circulantes de factor de crecimiento placentario (PlGF) están reducidos5. Se ha hallado una relación entre el cociente de estas 2 proteínas, sFlt-1/PlGF y la PE y los eventos adversos provocados o relacionados con la misma7,8.
En los últimos años, especialmente desde la aparición de la determinación del ratio sFlt-1/PlGF de Elecsys® se han venido publicando trabajos que analizaban su utilidad en el diagnóstico de la PE, acumulándose evidencia al respecto. El objetivo de este trabajo es analizar la validez diagnóstica del ratio sFlt-1/PlGF como biomarcador de la PE mediante una revisión sistemática de la literatura científica.
Material y métodosPara la realización de este trabajo hemos llevado a cabo una revisión sistemática de la literatura, seleccionando tanto los estudios primarios como otras revisiones sistemáticas y metaanálisis.
La pregunta de investigación planteada fue: «¿Es eficaz la determinación del cociente sFlt-1/PlGF a partir de la 20.a semana de gestación para predecir la evolución en mujeres con signos clínicos de preeclampsia?».
En formato PICO: POBLACIÓN: Mujeres gestantes a partir de la 20.a semana de gestación (SG), con signos clínicos de PE; INTERVENCIÓN: Determinación del cociente sFlt-1/PlGF; COMPARADOR: Diagnóstico de la PE basado en la aparición de hipertensión arterial y proteinuria; RESULTADOS: Sensibilidad (S), especificidad (E), valores predictivos positivo y negativo (VPP y VPN) y área bajo la curva ROC.
Se han explorado exhaustivamente las bases referenciales Medline (interfaz Ovid®), Embase (interfaz Embase.com) y Web of Knowledge. Además se ha consultado la base de datos a texto completo Cochrane Library.
Las estrategias de búsqueda se han construido encaminadas a obtener cualquier estudio que evaluara la validez diagnóstica del cociente sFlt-1/PlGF para el diagnóstico de la PE, y que, por lo tanto, incluyeran los términos: preeclampsia, sFlt-1/PlGF, S, E, valor predictivo y área bajo la curva.
En el proceso de búsqueda se halló una guía de recomendación para el empleo del cociente sFlt-1/PlGF como ayuda al diagnóstico de PE en pacientes con sospecha, realizada por el National Institute for Health and Care Excellence (NICE)9 y publicada en mayo de 2016. Debido a la relevancia y calidad de este estudio, se ha planteado esta revisión como actualización de la guía NICE ya publicada, que revisó literatura publicada hasta julio de 2015. Por lo tanto, entre los parámetros empleados de búsqueda de estudios se añadió el de haber sido publicados a partir de julio de 2015.
Las referencias obtenidas fueron sometidas a un primer cribado mediante la revisión de los abstracts. Los artículos seleccionados en esta primera revisión fueron obtenidos a texto completo y analizados críticamente.
La calidad de los estudios fue valorada a través de los formularios elaborados por CASPe10 y los criterios de clasificación de SIGN 5011. Para evaluar la calidad del metaanálisis se hizo uso del formulario AMSTAR12.
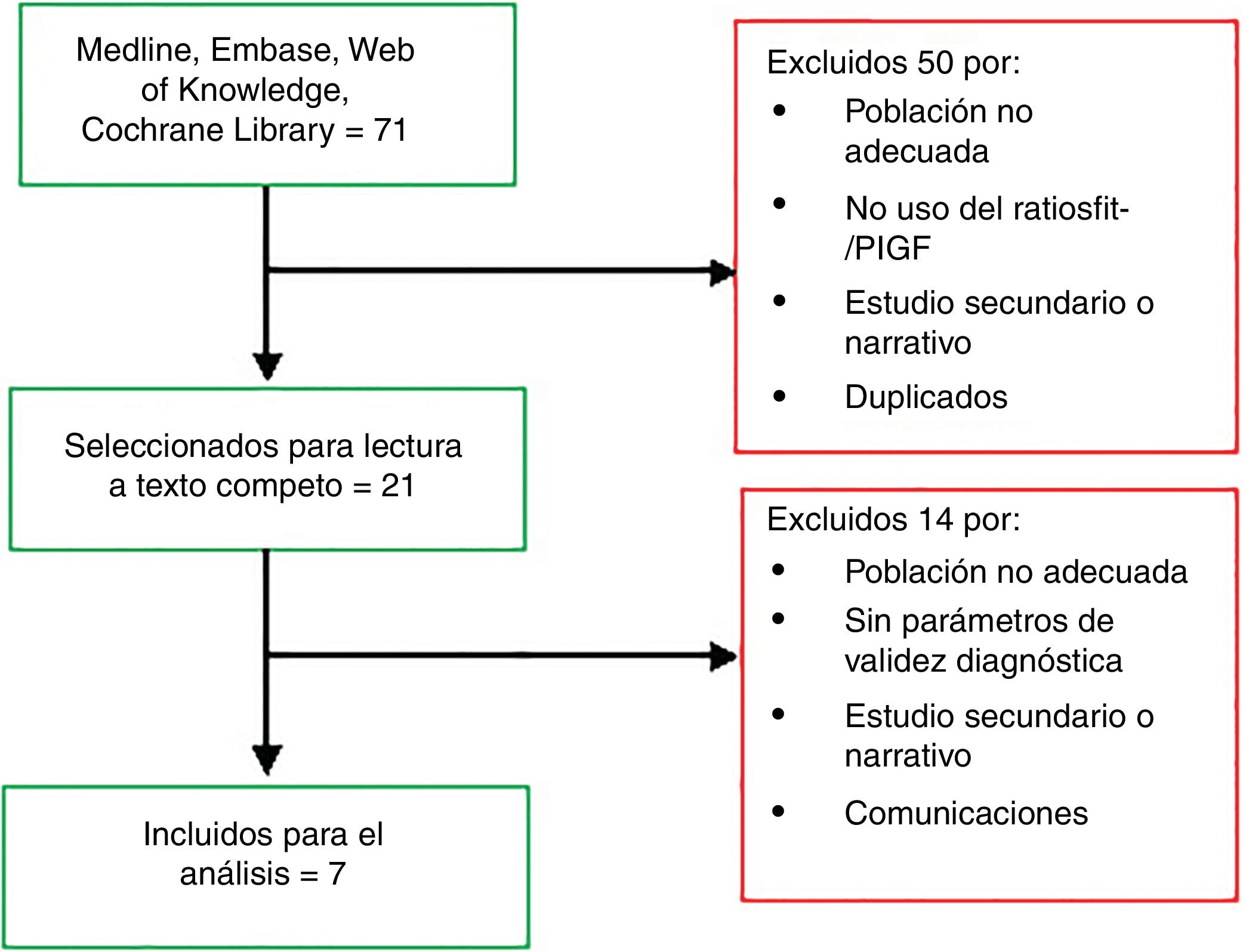
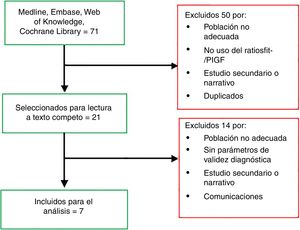
ResultadosDe la búsqueda de la literatura se obtuvieron 71 registros. Tras la lectura de títulos y abstracts se eligieron 21 artículos para ser leídos a texto completo, de los que, finalmente, han sido analizados 7 (tabla 1). El proceso de selección documental queda esquematizado en el diagrama de la figura 1. Las tablas 1 y 2 recogen las características de los estudios analizados.
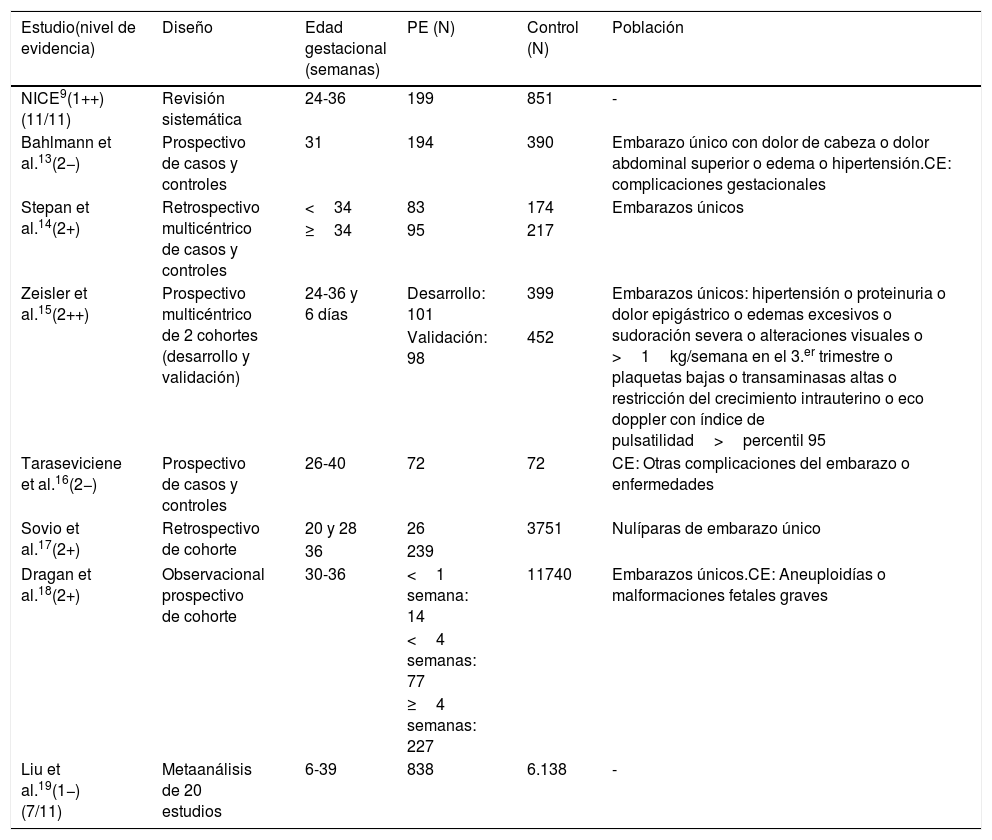
Características de los estudios incluidos en la revisión
| Estudio(nivel de evidencia) | Diseño | Edad gestacional (semanas) | PE (N) | Control (N) | Población |
|---|---|---|---|---|---|
| NICE9(1++)(11/11) | Revisión sistemática | 24-36 | 199 | 851 | - |
| Bahlmann et al.13(2−) | Prospectivo de casos y controles | 31 | 194 | 390 | Embarazo único con dolor de cabeza o dolor abdominal superior o edema o hipertensión.CE: complicaciones gestacionales |
| Stepan et al.14(2+) | Retrospectivo multicéntrico de casos y controles | <34 | 83 | 174 | Embarazos únicos |
| ≥34 | 95 | 217 | |||
| Zeisler et al.15(2++) | Prospectivo multicéntrico de 2 cohortes (desarrollo y validación) | 24-36 y 6 días | Desarrollo: 101 | 399 | Embarazos únicos: hipertensión o proteinuria o dolor epigástrico o edemas excesivos o sudoración severa o alteraciones visuales o >1kg/semana en el 3.er trimestre o plaquetas bajas o transaminasas altas o restricción del crecimiento intrauterino o eco doppler con índice de pulsatilidad>percentil 95 |
| Validación: 98 | 452 | ||||
| Taraseviciene et al.16(2−) | Prospectivo de casos y controles | 26-40 | 72 | 72 | CE: Otras complicaciones del embarazo o enfermedades |
| Sovio et al.17(2+) | Retrospectivo de cohorte | 20 y 28 | 26 | 3751 | Nulíparas de embarazo único |
| 36 | 239 | ||||
| Dragan et al.18(2+) | Observacional prospectivo de cohorte | 30-36 | <1 semana: 14 | 11740 | Embarazos únicos.CE: Aneuploidías o malformaciones fetales graves |
| <4 semanas: 77 | |||||
| ≥4 semanas: 227 | |||||
| Liu et al.19(1−)(7/11) | Metaanálisis de 20 estudios | 6-39 | 838 | 6.138 | - |
En esta tabla se describen los estudios incluidos en el análisis final de esta revisión, incluyendo la revisión sistemática que publicó NICE en 2016 y de la que se ha partido para actualizar la evidencia publicada, además de la calidad de la evidencia que aporta cada trabajo tras el análisis efectuado según los criterios de SIGN 5011. Se incluye el diseño de los estudios, la edad gestacional y tamaño de la población analizada, dividida en grupo de análisis (PE) y de control, así como los criterios de inclusión (población).
Los resultados que se extraen de la guía NICE9 se pueden resumir en las recomendaciones hechas en la propia guía:
- 1)
Se recomienda la razón sFlt-1/PlGF de Elecsys® para ayudar a descartar PE en embarazadas entre 20 y 34 semanas y 6 días de gestación con sospecha de PE.
- 2)
No hay suficiente evidencia para recomendar la razón sFlt-1/PlGF de Elecsys® en la ayuda al diagnóstico de PE en embarazadas entre 20 y 34 semanas y 6 días de gestación con sospecha de PE.
El estudio de Bahlmann et al.13 selecciona una población de gestantes con sospecha de PE (presentan uno o más de los síntomas expresados en la tabla 1), no especifica el rango de edades gestacionales admitidos, sino el promedio (31 semanas).
El trabajo de Stepan et al.14 utiliza las muestras de una población de gestantes seleccionadas para un estudio previo6 de las que escoge 178 embarazadas con PE confirmada y 391 controles con embarazos normales. Para establecer los resultados las divide en 2 grupos de acuerdo a sus edades gestacionales (<34 y ≥34 semanas).
En el trabajo de Zeisler et al.15 se reclutaron 2 cohortes, una para desarrollar el estudio (N=500) y otra para validarlo (N=550), en ambos casos eran embarazadas de entre 24 y 36 semanas y 6 días de gestación con sospecha de PE, de acuerdo con los criterios expuestos en la tabla 1.
Taraseviciene et al.16 reclutaron 144 gestantes, 72 en el grupo de estudio y 72 como grupo de control, todas ellas entre 26 y 44 semanas de gestación, no incluyendo en el estudio gestantes que tuvieran otras complicaciones del embarazo o enfermedades graves que pudieran alterar el resultado (tabla 1).
Sovio et al.17 trabajaron con una cohorte de 4.099 gestantes, realizando determinaciones del ratio sFlt-1/PlGF en las semanas 20, 28 y 36 de gestación (tabla 1).
En el estudio de Dragan et al.18 los autores analizaron una cohorte de 12.305 gestantes de entre 30 y 36,9 SG, excluyendo aquellas que presentaban malformaciones fetales o aneuplodías graves. De ellas, 318 desarrollaron PE (tabla 1).
De los 20 estudios incluidos en el metaanálisis de Liu et al.19, 12 fueron realizados en poblaciones de embarazadas sin determinar previamente el riesgo de PE y 8 en grupos de gestantes en riesgo de PE. Presentaron una gran heterogeneidad en las edades gestacionales que oscilan entre las 6 y las 39 semanas.
El criterio diagnóstico de PE en todos los estudios seleccionados es la aparición de hipertensión y proteinuria, derivado de las recomendaciones del grupo de trabajo de High Blood Pressure in Pregnancy4. Liu et al.19 no especifican los criterios utilizados por los estudios incluidos en su análisis.
En los 6 estudios primarios analizados, se evaluó el cociente sFlt-1/PlGF de Elecsys®. Los autores del metaanálisis Liu et al.19 seleccionaron 20 estudios que emplearon el cociente sFlt-1/PlGF, sin especificar la tecnología específica utilizada por ninguno de ellos.
El nivel de evidencia de cada uno de estos estudios, evaluado con los cuestionarios de CASPe10 y según los criterios de SIGN 5011, queda recogido en la tabla 1.
Los parámetros de rendimiento diagnóstico calculados en los estudios incluidos en el análisis, así como el o los valores de decisión propuestos para el ratio sFlt-1/PlGF han sido recogidos en la tabla 2.
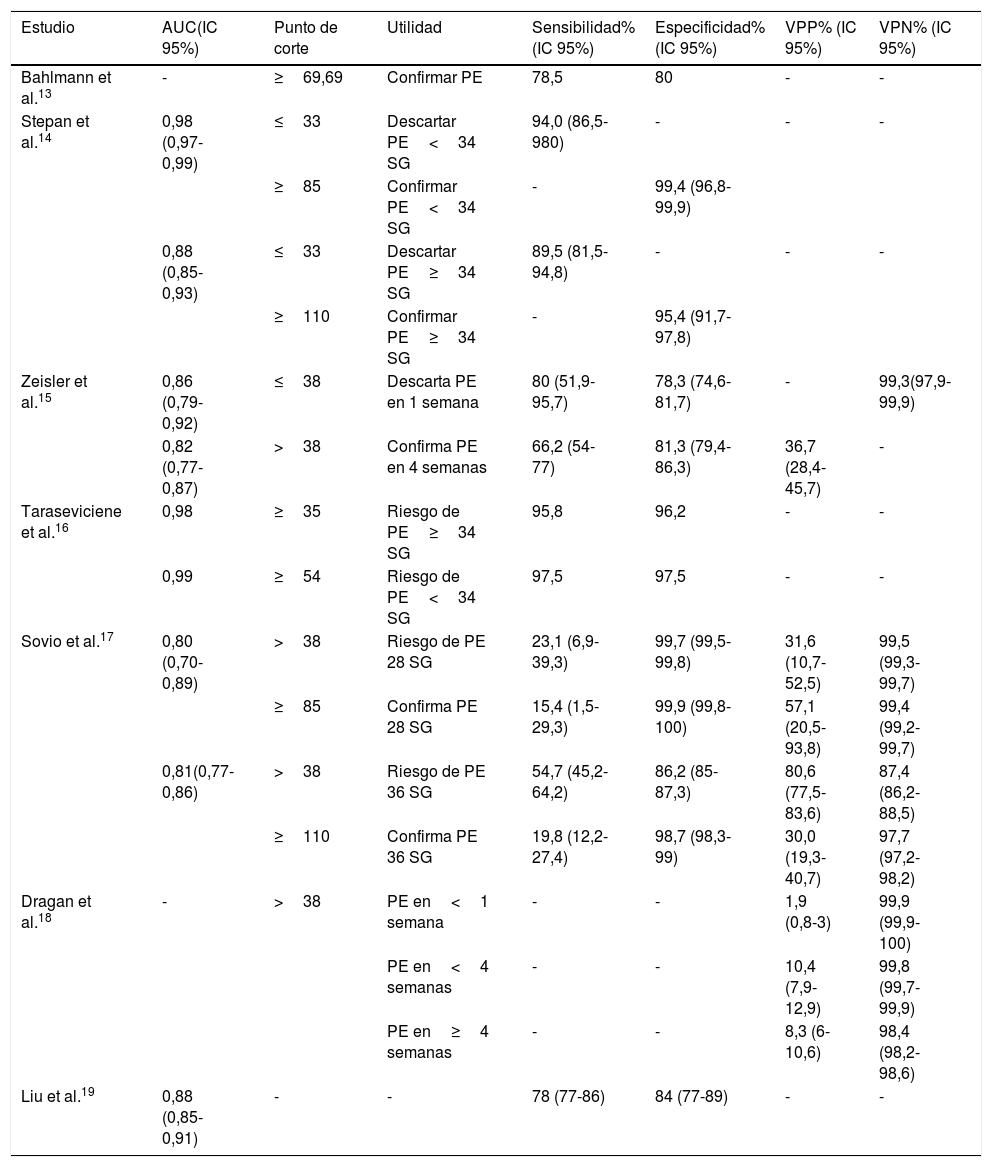
Rendimiento diagnóstico de los estudios analizados
| Estudio | AUC(IC 95%) | Punto de corte | Utilidad | Sensibilidad% (IC 95%) | Especificidad% (IC 95%) | VPP% (IC 95%) | VPN% (IC 95%) |
|---|---|---|---|---|---|---|---|
| Bahlmann et al.13 | - | ≥69,69 | Confirmar PE | 78,5 | 80 | - | - |
| Stepan et al.14 | 0,98 (0,97-0,99) | ≤33 | Descartar PE<34 SG | 94,0 (86,5-980) | - | - | - |
| ≥85 | Confirmar PE<34 SG | - | 99,4 (96,8-99,9) | ||||
| 0,88 (0,85-0,93) | ≤33 | Descartar PE≥34 SG | 89,5 (81,5-94,8) | - | - | - | |
| ≥110 | Confirmar PE≥34 SG | - | 95,4 (91,7-97,8) | ||||
| Zeisler et al.15 | 0,86 (0,79-0,92) | ≤38 | Descarta PE en 1 semana | 80 (51,9-95,7) | 78,3 (74,6-81,7) | - | 99,3(97,9-99,9) |
| 0,82 (0,77-0,87) | >38 | Confirma PE en 4 semanas | 66,2 (54-77) | 81,3 (79,4-86,3) | 36,7 (28,4-45,7) | - | |
| Taraseviciene et al.16 | 0,98 | ≥35 | Riesgo de PE≥34 SG | 95,8 | 96,2 | - | - |
| 0,99 | ≥54 | Riesgo de PE<34 SG | 97,5 | 97,5 | - | - | |
| Sovio et al.17 | 0,80 (0,70-0,89) | >38 | Riesgo de PE 28 SG | 23,1 (6,9-39,3) | 99,7 (99,5-99,8) | 31,6 (10,7-52,5) | 99,5 (99,3-99,7) |
| ≥85 | Confirma PE 28 SG | 15,4 (1,5-29,3) | 99,9 (99,8-100) | 57,1 (20,5-93,8) | 99,4 (99,2-99,7) | ||
| 0,81(0,77-0,86) | >38 | Riesgo de PE 36 SG | 54,7 (45,2-64,2) | 86,2 (85-87,3) | 80,6 (77,5-83,6) | 87,4 (86,2-88,5) | |
| ≥110 | Confirma PE 36 SG | 19,8 (12,2-27,4) | 98,7 (98,3-99) | 30,0 (19,3-40,7) | 97,7 (97,2-98,2) | ||
| Dragan et al.18 | - | >38 | PE en<1 semana | - | - | 1,9 (0,8-3) | 99,9 (99,9-100) |
| PE en<4 semanas | - | - | 10,4 (7,9-12,9) | 99,8 (99,7-99,9) | |||
| PE en≥4 semanas | - | - | 8,3 (6-10,6) | 98,4 (98,2-98,6) | |||
| Liu et al.19 | 0,88 (0,85-0,91) | - | - | 78 (77-86) | 84 (77-89) | - | - |
En esta tabla se detallan los parámetros de rendimiento diagnóstico publicado en los estudios incluidos en el análisis final de esta revisión. Se incluye el área bajo la curva ROC (AUC) con el 95% de intervalo de confianza (IC) en los casos en que haya sido publicado, el punto de corte óptimo propuesto en cada trabajo, la utilidad propuesta para el mismo y los valores de sensibilidad (S), especificidad (E), y valores predictivos positivo y negativo (VPP y VPN) en los casos en que estén disponibles, además de sus IC.
Bahlamann et al.13 plantean como punto de corte del ratio sFlt-1/PlGF≥69,69, para clasificar las gestantes en riesgo de PE, estableciendo su S y E.
Stepan et al.14 proponen 2 rangos de decisión, uno para PE precoz (antes de la 34.a SG) y otro para la PE tardía (a partir de la 34.a SG) (tabla 2). En cada rango el valor bajo maximiza la S (descarta PE para valores inferiores) y el valor alto maximiza la E (diagnostica PE para valores superiores), con una zona de incertidumbre intermedia.
Zeisler et al.15 establecen como punto de corte del ratio sFt1/PLGF≤38 para descartar la PE en una semana, y confirmando PE en 4 semanas si>38, sin tener en cuenta la edad gestacional.
Taraseviciene et al.16 determinan 2 puntos de corte, con sus respectivos valores de S y E (tabla 2): ≥35, para el riesgo de PE tardía (tras la 34.a SG), y ≥54 para la PE precoz (antes de la 34.a SG).
El estudio de Sovio et al.17 analiza la validez del punto de corte propuesto por Zeisler et al.15 para su aplicación en las 20.a, 28.a y 36.a SG, y los puntos de corte altos de Stepan et al.14, aplicando el primero (>85) a la 28.a SG y el segundo (>110) a la 36.a SG (tabla 2). En todos los casos evalúan la validez diagnóstica de los puntos de corte para un grupo general, otro de alto riesgo y otro de bajo riesgo, clasificados en base a parámetros clínicos.
Dragan et al.18 analizan la validez de las recomendaciones derivadas del estudio publicado por Zeisler et al.15 en una amplia cohorte de gestantes durante varios años (tabla 2).
En el metaanálisis evaluado, de Liu et al.19, se analizan 20 estudios diferentes, todos con parámetros de validez diagnóstica calculada, pero alguno de ellos sin punto de corte. Debido a la heterogeneidad de los estudios incluidos en el metaanálisis, este no calcula un punto de corte global, sino que se limita a obtener una curva ROC para estimar la S, E y razones de verosimilitud, así como el área bajo la curva de los 20 estudios agrupados (tabla 2).
DiscusiónLa PE continúa siendo uno de las principales causas del aumento de la morbimortalidad en gestantes y neonatos. Debido a su complejidad y a poseer una fisiopatología aún no del todo conocida, los criterios de diagnósticos habituales basados en proteinuria e hipertensión4 no son suficientes y ofrecen tan solo un 20% de VPP de eventos adversos relacionados con la PE20. La valoración de los niveles séricos de factores angiogénicos y antiangiogénicos está mucho más próxima a lo que parece ser la etiología de este complejo desorden sistémico5,6. Se conoce la relación de los niveles elevados de sFlt-1 y bajos de PlGF con la etiología de la PE21 y en los últimos años se vienen publicando estudios con diferentes propuestas para el empleo del cociente sFlt-1/PlGF en la estrategia diagnóstica de la PE.
El interés del presente trabajo radica en aportar novedades que actualizan la evidencia existente hasta julio de 2015, recogidas y analizadas en una guía NICE publicada en mayo de 20169, en la que se recomienda el ratio sFlt-1/PlGF de Elecsys® para ayudar a descartar PE en embarazadas entre 20 y 34 semanas y 6 días de gestación que ya tuvieran sospecha de PE.
En este lapso de poco más de 2 años, debido en parte al impacto de la mencionada guía NICE y a los resultados del estudio PROGNOSIS publicados por Zeisler et al.15, y también incluido en esta revisión, se han realizado importantes esfuerzos, especialmente en Reino Unido, por evaluar la validez diagnóstica del ratio sFlt-1/PlGF, fundamentalmente en sendos y amplios estudios de cohorte17,18. Por otro lado se han publicado interesantes corolarios a trabajos previos, como los de Bahlmann et al.13 o Stepan et al.14, que avanzan un poco más en el camino ya marcado previamente6. Además de la aparición de nuevos estudios16 y metaanálisis19 que inciden en la validez diagnóstica del biomarcador analizado.
En general existe una considerable heterogeneidad en los 7 estudios seleccionados para esta revisión, no solo en el diseño (un metaanálisis19, 4 prospectivos, 3 de cohorte y uno de casos y controles, y 2 retrospectivos, uno de casos y controles y otro de cohorte), sino que existe variabilidad en las edades gestacionales incluidas (tabla 1) o la exclusión o no de embarazos múltiples (que no se excluyen en 6 de los 20 estudios del metaanálisis de Liu et al.19).
Esta variabilidad es un reflejo de las lagunas que aún existen en el conocimiento de la fisiopatología de la PE y, sobre todo, la falta de consenso en el empleo del ratio sFlt-1/PlGF como biomarcador de la PE. Como consecuencia, los resultados ofrecidos por estos estudios presentan una considerable dispersión.
El estudio de Liu et al.19 incluye 20 estudios diferentes y sus resultados y conclusiones están también fuertemente marcados por la heterogeneidad de los trabajos seleccionados, que impide la obtención de un punto de corte. El análisis fue realizado agrupando estudios con poblaciones de gestantes de características diferentes: distintas edades gestacionales, criterios de inclusión y exclusión, población general y población con riesgo de PE o clasificación de la PE (precoz-tardía o severa-moderada). Los autores declaran la existencia de sesgo en las publicaciones empleadas. A pesar de tratarse de un metaánalisis que ha sido bien diseñado y llevado a cabo, estas debilidades señaladas bajan la calidad de la evidencia que ofrece (1−).
Bahlmann et al.13 proponen el valor 69,69 en el cociente sFlt-1/PlGF como cut-off óptimo para confirmar la PE, con un 80% de E. Sin embargo, sugieren que este punto de corte debería estar sujeto a la edad gestacional, y además proponen su combinación con parámetros ecográficos doppler para optimizar su rendimiento diagnóstico. Como grave limitación del estudio está la imposibilidad de conocer la precisión del cálculo porque los autores no incluyen los intervalos de confianza de los parámetros de validez diagnóstica. Tampoco se incluye el valor del área bajo la curva, ni se indica si se realizó una evaluación ciega de los resultados, todo lo que disminuye la calidad de la evidencia de este estudio (2−).
Stepan et al.14, basándose en la estrategia propuesta en un trabajo previo6, evalúan la validez diagnóstica del ratio usando 2 puntos de corte dobles (tabla 2), uno para PE precoz (antes de la semana 34) y otro para la PE tardía (tras la semana 34). De esta manera maximizan la S con el punto de corte bajo, y la E con el alto, a costa de dejar entre ambos una zona de incertidumbre en la cual habría que recurrir a un estrecho seguimiento de la gestante. En esta propuesta el mejor rendimiento lo ofrece la confirmación de PE para valores del ratio≥85, para PE precoz (E=99,4%), y ≥110 para PE tardía (E=95,4%). La calidad de la evidencia de este estudio se ve comprometida por su diseño retrospectivo y por no aportar los valores predictivos (2+).
Los autores del estudio de Zeisler et al.15 proponen un único punto de corte (38), sin tener en cuenta la edad gestacional, para descartar la PE en mujeres con el ratio sFlt-1/PlGF por debajo de ese punto con un VPN del 99,3%, pero añadiendo el factor tiempo, pues solo descartan la PE en la siguiente semana. En cambio, para aquellas gestantes cuyo ratio se sitúe por encima de este valor, la probabilidad de desarrollar PE en las siguientes 4 semanas es del 36,7%, valor que presentan como una mejora con respecto al VPP del 20% calculado para la hipertensión y proteinuria (calidad de la evidencia 2++).
Taraseviciene et al.16, con la limitación inherente a una población bastante reducida de solo 144 gestantes (77 diagnosticadas de PE y 77 en el grupo control), y con la debilidad añadida de la variabilidad de la edad gestacional de sus participantes, el no publicar valores predictivos ni intervalos de confianza (calidad 2−) proponen 2 puntos de corte del ratio sFlt-1/PlGF, >35 y >54. Estos valores son presentados como cribado de PE o PE precoz (después o antes de la 34.a SG), respectivamente. Su postulado de base es la obtención de un valor del ratio sFlt-1/PlGF que sea independiente de la edad gestacional, para diagnosticar una posible PE que debería ser confirmada o descartada posteriormente por otros métodos.
Sovio et al.17 utilizan el punto de corte propuesto por Zeisler et al. (38) para clasificar a las gestantes en riesgo de PE, y los puntos de corte de confirmación 85 y 110 para PE precoz y tardía, aplicándolos, respectivamente, a las semanas 28 y 36 de gestación. Para el punto de corte bajo confirman los resultados obtenidos por Zeisler et al., tanto de VPN próximos al 100%, como VPN por encima del 30%, en el caso de la semana 28 de gestación. En la semana 36, aunque el VPN se mantiene, el VPP baja hasta el 10,2%. En el caso de los puntos de corte altos, para la PE precoz (28 semanas, ≥85) el VPP aumenta hasta el 60%, mientras que en la PE tardía (36 semanas, ≥110) el VPP alcanza el 30% (calidad de la evidencia 2+). La estrategia adicional que siguen es el empleo de otros parámetros de riesgo (características clínicas, parámetros ecográficos, etc.) para definir grupos de alto riesgo que, en conjunción con el ratio sFlt-1/PlGF, optimicen el diagnóstico de PE.
El trabajo de Dragan et al.18 realiza un análisis de los resultados de la implementación del ratio sFlt-1/PlGF en varios hospitales ingleses durante 2 años, siguiendo las recomendaciones derivadas, tanto de la guía NICE como de Zeisler et al.15, con un total de 12.305 gestantes atendidas. Aunque vuelven a reproducirse los resultados obtenidos en Zeisler et al. en cuanto al VPN, que son próximos al 100%, los VPP obtenidos son mucho más bajos, con un 8,3% para la detección de PE en las siguientes 4 semanas, frente al 38% publicado por Zeisler et al. No publican área bajo la curva ROC ni valores de S y E. Además, Dragan et al. inciden en el hecho de que, aun a pesar de los elevados VPN, se produjeron 3 falsos negativos de gestantes que desarrollaron PE en menos de una semana, a pesar de tener un valor del ratio<38, y hasta 18 falsos negativos que tuvieron PE en menos de 4 semanas después de haber tenido un ratio<38 (evidencia 2+). Este número considerable de falsos negativos se halla también en los resultados de Sovio et al.17, y se puede asumir que en todos los demás estudios, a pesar de obtenerse VPN próximos al 100%, debido a la baja incidencia de la enfermedad.
A modo de conclusión se puede extraer de esta revisión que el ratio sFlt-1/PlGF es una herramienta útil en la estrategia diagnóstica de la PE, pero su rendimiento diagnóstico no lo avala como biomarcador único, sino más bien como apoyo a la decisión diagnóstica en el marco de una estrategia global que incluya otros parámetros y factores de riesgo. Sin embargo, aún no está claro cómo llevar a cabo el ensamblaje definitivo del biomarcador en un algoritmo diagnóstico, y existe una gran heterogeneidad en las propuestas halladas en los diferentes estudios analizados para la optimización de las posibilidades diagnósticas del biomarcador: punto de corte dobles que definen una zona de incertidumbre, vinculación poco clara de los valores de decisión a la edad gestacional o combinación no del todo definida de los mismos con parámetros ecográficos o clínicos.
El respaldo de un estudio como PROGNOSIS15, refrendado con los resultados de Sovio et al.17, y acompañados en líneas generales por todos resultados analizados, siguen la línea de las conclusiones de la guía NICE9, de la que este estudio es actualización. Los resultados extraídos de esta revisión, de manera aislada, o en conjunto con los de la mencionada guía, apoyan el uso del ratio sFlt-1/PlGF para ayudar a descartar PE en gestantes con signos clínicos, aunque su capacidad en la identificación de PE es limitada sin formar parte de una estrategia diagnóstica que incluya otros parámetros.
Sin embargo, aún debería trabajarse en la obtención de un consenso. Probablemente análisis multivariables que incluyeran diversos parámetros clínicos, ecográficos y bioquímicos, que simplificaran y optimizaran la utilización del ratio sFlt-1/PlGF mediante el cálculo de sencillos índices de riesgo que pudieran facilitar su utilización.
Conflicto de interesesNo existen conflictos de intereses a declarar.