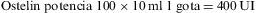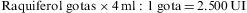El grupo de metabolismo óseo y mineral de la Sociedad Argentina de Nefrología (www.san.org) ha elaborado un consenso para ayudar al nefrólogo en el manejo del metabolismo mineral del paciente con enfermedad renal crónica, adaptándolo a la realidad de Argentina. Hemos tenido en cuenta las nuevas definiciones y el sistema de clasificación más integrado que recientemente propuso la Fundación Kidney Disease Improving Global Outcomes (KDIGO). En este manuscrito se desarrolla el capítulo tercero sobre el valor de la 25 hidroxi-vitamina D y tratamiento del hiperparatiroidismo secundario en la enfermedad renal crónica estadio 3–5.
The bone and mineral metabolism group of the Argentine Society of Nephrology (www.san.org) have drawn up a consensus to help nephrologists in the management of mineral metabolism in patients with chronic kidney disease in the Argentine context. The new definitions and the more integrated system recently proposed by the Kidney Disease - Improving Global Outcomes Foundation have been taken into account. This article discusses the value of 25-hydroxy-vitamin D and the treatment of secondary hyperparathyroidism in chronic kidney disease stages 3–5.
- 1.1
En los pacientes con enfermedad renal crónica estadios 3 y 4, es recomendable efectuar al menos una determinación basal de 25(OH) D3. Obligatoriamente en los casos en que los valores de PTH sean mayores que los deseables para ese estadio de ERC.
- 1.2
Los niveles adecuados de 25(OH)D3 en cualquier estadio de la ERC deben ser superiores a 30ng/ml.
- 1.3
Debe iniciarse tratamiento de reposición con vitamina D nativa si los valores séricos son inferiores a 30ng/ml (insuficiencia).
- 1.4
Podría iniciarse tratamiento aún sin conocer las concentraciones séricas de 25(OH) D3 en grupos seleccionados de pacientes: añosos, diabéticos, mal nutridos, baja exposición al sol.
- 1.5
Cuando los niveles de PTHi se encuentran por encima del límite superior del ensayo, en forma persistente o con un incremento progresivo, o luego de haber corregido los factores que lo eleven (hiperfosfatemia, hipocalcemia o deficiencia de 25(OH)D3 debe iniciarse tratamiento con calcitriol o análogos. La dosis de inicio recomendada del activador del receptor de vitamina D es:
Estadio 3
Estadio 4
Racional (Discusión)Los niveles séricos de 25(OH) D3 son un marcador muy bueno de los depósitos corporales de 25(OH)D3. Del 20 al 90% de la población «sana» de EE.UU. y Europa tiene deficiencia (<10–15ng/ml) o insuficiencia (<20–30ng/ml)1–2. En Argentina el problema no es menor: el valor promedio de 25(OH)D3 en toda la geografía del país, en invierno, en adultos mayores ambulatorios sanos es 17,4ng/ml3.
Dicho problema es mayor en regiones de Argentina con menor exposición al sol (Sur), pero ninguna región está exenta, existiendo grupos sociales (personas mayores con dificultad para salir del hogar, clases sociales bajas con alimentación insuficiente) y niños, que son más vulnerables4.
En síntesis: hay una alta incidencia (del 52 al 82%) de personas con niveles de insuficiencia (<30ng/ml) y solamente de un 2 al 17% de la población con niveles deseables (>30ng/ml).
En la ERC se añaden otras causas de déficit:
- a)
menor exposición solar;
- b)
menor ingesta de alimentos ricos en vitamina D5;
- c)
menor síntesis endógena de vitamina D en la piel6;
- d)
diabetes.
Esto se pone de manifiesto ya con tasa de filtrado glomerular estimada de 50–59ml/min7. Existe déficit o insuficiencia de vitamina D en el 70% de los pacientes ERC estadios 3 y 4, en el 90% de los pacientes en HD y en DP y en el 70% de los pacientes con trasplante renal funcionante8–12.
Además, incluso en personas sanas, los niveles reducidos de 25(OH)D3 se asocian a un aumento de los valores de PTH, a menor densidad ósea y mayor riesgo de fracturas13.
Lo mismo ocurre precozmente en la ERC, siendo ya detectable en estadio 3. La 25(OH)D3 es el sustrato para la producción de calcitriol y su déficit se asocia a la progresión y a la severidad del hiperparatiroidismo secundario14.
Pero también se ha visto que los niveles plasmáticos de 25(OH) D3 podrían ser un factor predictivo independiente de progresión en la ERC y de mortalidad, tanto en estadios precoces de la ERC, como en pacientes incidentes en hemodiálisis15,16.
En cuanto a los efectos pleiotrópicos de la vitamina D, hay que considerar aquellos relacionados con la fibrosis intersticial, su rol en los procesos inflamatorios y en el control de factores de riesgo para la albuminuria (SRAA, efecto antiproliferativo, etc.)17. Todos ellos factores implicados en la progresión de la enfermedad renal crónica y la enfermedad cardiovascular18. Por lo tanto, debería conocerse el nivel sérico de 25(OH)D3 e iniciar el tratamiento adecuado, no solo para lograr niveles óptimos, sino también para obtener los efectos pleiotrópicos de la vitamina D.
Ahora bien, si no se cuenta con los medios para hacerlo, y en vista de la altísima incidencia de valores en niveles de insuficiencia y/o déficit en esta población, también documentado en Argentina, podría prescindirse del mismo en caso de decidirse a comenzar un tratamiento, especialmente en pacientes añosos, niños, diabéticos, mal nutridos, baja exposición al sol, etc., es decir, el perfil de gran número de los pacientes con ERC.
Debe estarse alerta sobre la posibilidad, muy poco frecuente, de desarrollar hipercalcemia, monitorizando la calcemia cada 3 meses en pacientes en tratamiento con vitamina D7.
Es importante la prevención de la deficiencia o insuficiencia de vitamina D en todos los pacientes con IRC, con una dosis de 800UI/día para los mayores de 60 años y de 400UI/ día en adultos jóvenes.
En casos de niveles bajos documentados de vitamina D, las dosis indicadas varían según los niveles séricos de 25(0H)D3, desde los 50.000UI/semana de «carga» durante 1 mes en los casos de déficit severo (5–15pg/ml) hasta los 50.000UI/mes en los casos de deficiencia (16–30pg/ml), con continuación de dicha dosis mensualmente en ambos casos por un período nunca menor a 6 meses.
De constatarse la repleción de los niveles de vitamina D, puede continuarse el tratamiento en forma continuada con un preparado multivitamínico que contenga vitamina D, con monitoreos anuales de 25(OH)D3 sérico.
El efecto del tratamiento con Vitamina D sobre los valores elevados de PTH en la ERC parece alcanzar solamente a aquellos que se hallan en estadio 3, no logrando dicho efecto en pacientes con estadio 4, en los cuales no se constata disminución de la misma19–20. Hay razones para pensar que esta falta de efecto en este estadio se debe a la administración intermitente del mismo y que podría ser adecuado la administración más frecuente y en dosis más pequeñas para conseguir este efecto21.
Para facilitar los esquemas y dosis de tratamiento, en nuestro país existen varios preparados comerciales de ergocalciferol, todos en forma de gotas:
Como decíamos, en el estadio 4 de ERC puede ser necesario administrar concomitantemente calcitriol o análogos de la vitamina D, al no disminuir los valores de PTH cuando se administra solamente vitamina D19,20.
Los datos sobre los beneficios del tratamiento con ARVD en estadio 3–5 incluyen mejoría del hiperparatiroidismo en la histología ósea, aumento en la densidad mineral ósea y descenso en los valores de PTH23–25. El tratamiento con calcitriol en pacientes con estadio 3 de ERC mostró luego de 2 años una mejoría significativa en la biopsia ósea y un enlentecimiento de la pérdida de masa ósea, con una reducción de los niveles de PTH al año del 35% y 42% a los 2 años22. Además, el calcitriol controla su propio metabolismo y evita que se pierdan sus receptores ARVD, por lo que la respuesta de la glándula paratiroides a calcitriol se mantiene intacta. También mantiene la densidad del receptor de megalina localizado en las células tubulares renales, que se encarga de internalizar la 25(OH) D3 dentro de dicha célula, materia prima para la generación renal de calcitriol22 Recientemente se ha publicado que los pacientes en estadio 3–4 de ERC que recibieron tratamiento con calcitriol presentaron un riesgo de muerte 26% más bajo que los que no recibieron tratamiento con calcitriol, y por lo tanto mayor sobrevida26. La dosis varia en estadio 3–4 entre 0,25 y 0,5mcg/d.
Otra alternativa de tratamiento son los análogos de la vitamina D: doxecalciferol y paricalcitol. La ventaja de los análogos es que poseen diferente afinidad sobre el receptor de vitamina D, a nivel de células paratiroideas, en los osteoblastos, células de pared intestinal y células musculares lisas vasculares. La consecuencia es que producen menos hipercalcemia e hiperfosfatemia que el calcitriol.
El doxercalciferol es seguro y efectivo en controlar el hiperparatiroidismo secundario en pacientes con enfermedad renal crónica estadio 3–4. Así se observo que a una dosis de mantenimiento 1,62±0,2ug/d, el doxercalciferol administrado durante 24 meses redujo un 46% los niveles de PTH y no hubo diferencias en el calcio sérico, fósforo, calcio urinario o incidencia de hipercalcemia o cambios en el FG comparado con el grupo placebo. La dosis recomendada de doxercalciferol en estadio 3–4 es de 0,5 a 1mcg/d27,28.
El paricalcitol administrado por vía oral, ya sea en forma trisemanal o en forma diaria, también es seguro y efectivo en pacientes con ERC estadio 3 y 4. La dosis semanal promedio utilizada en las dos frecuencias de administración (trisemanal y diaria) fue 9,5±3,8ug. En 3 estudios llevados a cabo en pacientes con estas características, se observó una disminución del 30% en los valores de PTH en el 91% de los pacientes tratados. No hubo diferencias con el grupo placebo en cuanto a incidencia de hipercalcemia, hiperfosfatemia y producto fosfocálcico. Tampoco se observaron diferencias en la excreción urinaria de calcio y fósforo o deterioro de función renal entre ambos grupos29. El paricalcitol oral actualmente se encuentra disponible en nuestro país.
Por lo tanto, se observó que el paricalcitol cápsulas y el doxercalciferol fueron bien tolerados y disminuyeron los niveles de PTH con mínimo impacto sobre el calcio, fósforo y la función renal en pacientes con ERC estadio 3 y 4.
La combinación de PTH elevada y el descenso de 1,25 (OH) vitamina D3 en los pacientes en prediálisis da como resultado un alto recambio y pérdida ósea, y el tratamiento con vitamina D no solo desciende los niveles de PTH, sino que promueve el retorno a la normalidad del recambio óseo30–32. Además, la activación del receptor de vitamina D puede mejorar o detener la enfermedad cardiovascular a través de disminuir los niveles de renina plasmática, descenso del péptido natriurético atrial disminuyendo la hipertrofia de miocardio, las calcificaciones vasculares y mejorando la disfunción del ventrículo izquierdo33–38.
Por lo tanto, es de vital importancia el tratamiento temprano del hiperparatiroidismo secundario en la ERC para disminuir el crecimiento de la glándula paratiroidea y mantener los niveles de PTH cercano a lo normal, en un esfuerzo no solo de prevenir la pérdida ósea y la progresión de la hiperplasia paratifoidea, si no también, para disminuir los efectos deletéreos del hiperparatiroidismo sobre la función cardiovascular.
Preguntas de importancia clínicas- 1)
¿Es conveniente monitorizar los niveles de 25(0H)D3 sérico en los pacientes con ERC?
- 2)
¿En qué pacientes con ERC debe suplementarse con vitamina D?
- 3)
¿Cómo hacer el tratamiento de los aumentos de PTH en estadio 3 y 4 de ERC?
Los autores declaran no tener ningún conflicto de intereses.
A todos los socios de la Sociedad Argentina de Nefrología que participaron con sus opiniones a través de la encuesta.
A las autoridades de la Sociedad Argentina de Nefrología*, siendo Presidente: Dr Walter Douthat.
Al Dr. Julen Ocharan-Corcuera, por su publicación en esta revista.