Presentamos el caso de un paciente masculino, de 52 años, referido a nuestro centro con síndrome nefrótico, con una proteinuria de 5,2g/g, que al momento de realizarle el rastreo sonográfico nos percatamos de una silueta anatómica renal atípica, con sospecha de fusión, por lo que se solicita tomografía computarizada en la que se documenta riñón en herradura, lo que nos planteó un reto diagnóstico de la glomerulopatía subyacente. Debido a la dificultad técnica, se opta por realizar una biopsia renal por técnica laparoscópica, sin complicaciones para el paciente. El resultado histopatológico, reportó una nefropatía membranosa, por lo que se inicia tratamiento con prednisona a 1mg/kg/d y mofetil micofenolato, con el que se obtiene remisión del síndrome nefrótico a los 3 meses de seguimiento.
The case is presented of a 52 year-old male patient, who was referred to our center with nephrotic syndrome. He had a urine protein level of 5.2g/g creatinine. An atypical anatomical outline of the kidney, with suspicion of fusion, was observed while performing the ultrasound scan. A computed tomography scan was requested, which showed a horseshoe kidney, suggestive of an underlying glomerular disease. Due to technical difficulties, a laparoscopic technique was used to perform the renal biopsy, with no complications for the patient. The histopathology reported membranous nephropathy. Treatment was started with prednisone at 1mg/kg/d and mycophenolate mofetil, with remission of the nephrotic syndrome at 3 months follow-up.
El desarrollo embriológico normal del riñón se produce en 3 etapas: pronefros, mesonefros y metanefros. La última etapa se detecta por primera vez a las 5 semanas de gestación y no es completamente funcional hasta el inicio de la vida fetal, hacia el final de la octava semana de gestación. Su origen es doble, por un lado una región especializada de la cresta urogenital, el mesénquima metanéfrico del que derivan las nefronas, y otra, la yema ureteral (porción caudal del conducto mesonéfrico o de Wolf) que da lugar al uréter, pelvis renal, cálices y túbulos colectores. En su evolución el metanefros y la yema ureteral maduran migrando desde su posición pélvica, rotando hasta ocupar la región lumbar hacia la novena semana de gestación. Una vez situado en su localización definitiva, se desarrolla la red de vasos sanguíneos del riñón. Las anomalías renales congénitas en la posición y en la fusión son el resultado de la interrupción de la migración embriológica normal de los riñones1,2.
El riñón en herradura (RH) es la anomalía de fusión más frecuente y en el 90% de los casos la fusión se produce en el polo inferior. El puente de fusión o istmo puede estar compuesto de parénquima renal o de banda de tejido fibroso, que suele estar a la altura de la 4.ª o 5.ª vértebra lumbar. La pelvis y los uréteres están, habitualmente, en posición anterior y pueden estar duplicados, favoreciendo el reflujo vesicoureteral. Se ha descrito asociado a más de 30 síndromes polimalformativos y a alteraciones cromosómicas, como la trisomía 18 y el síndrome de Turner. El RH, a pesar de que suele ser asintomático, algunos desarrollan complicaciones como la hidronefrosis (secundarias a obstrucción por litiasis o estenosis pieloureteral) e infecciones del tracto urinario2,3. Se han descrito otras complicaciones, como las neoplasias en el parénquima renal, pero es muy raro una glomerulopatía asociada, existiendo a la fecha escasas publicaciones al respecto.
Presentamos el caso de un paciente con RH asociado a una glomerulopatía de tipo membranosa, la cual nos representó un reto diagnóstico por la dificultad técnica en la obtención de tejido renal.
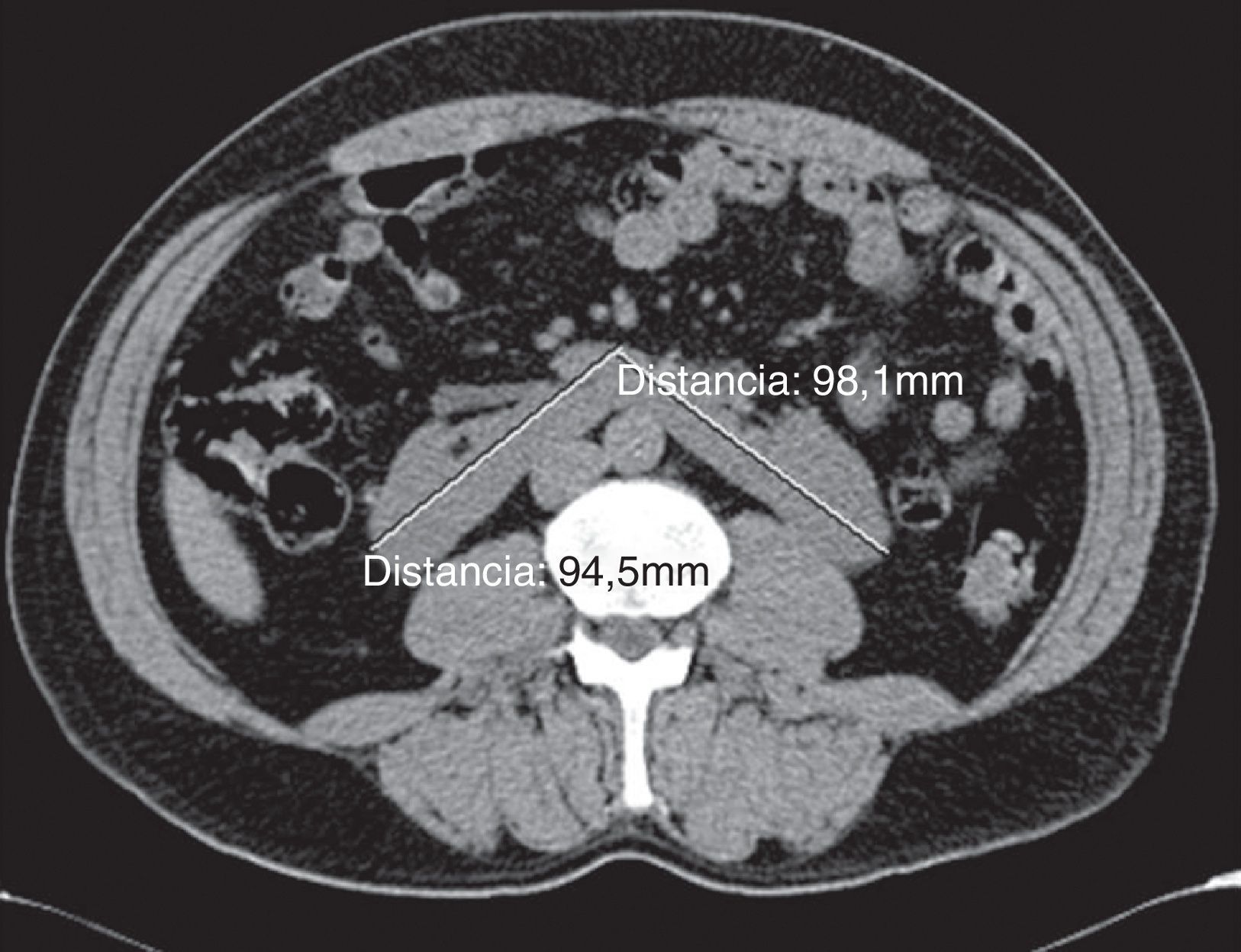
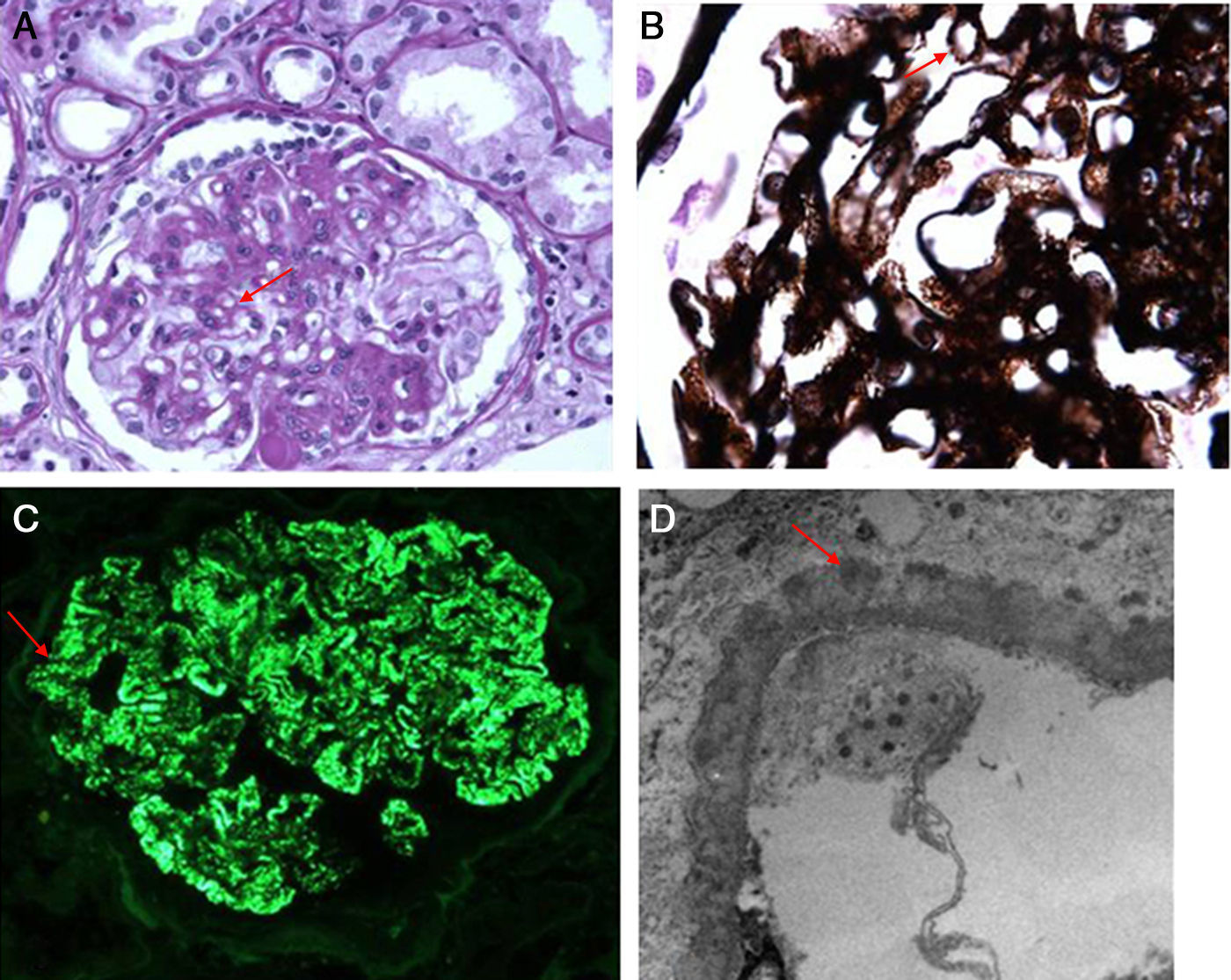
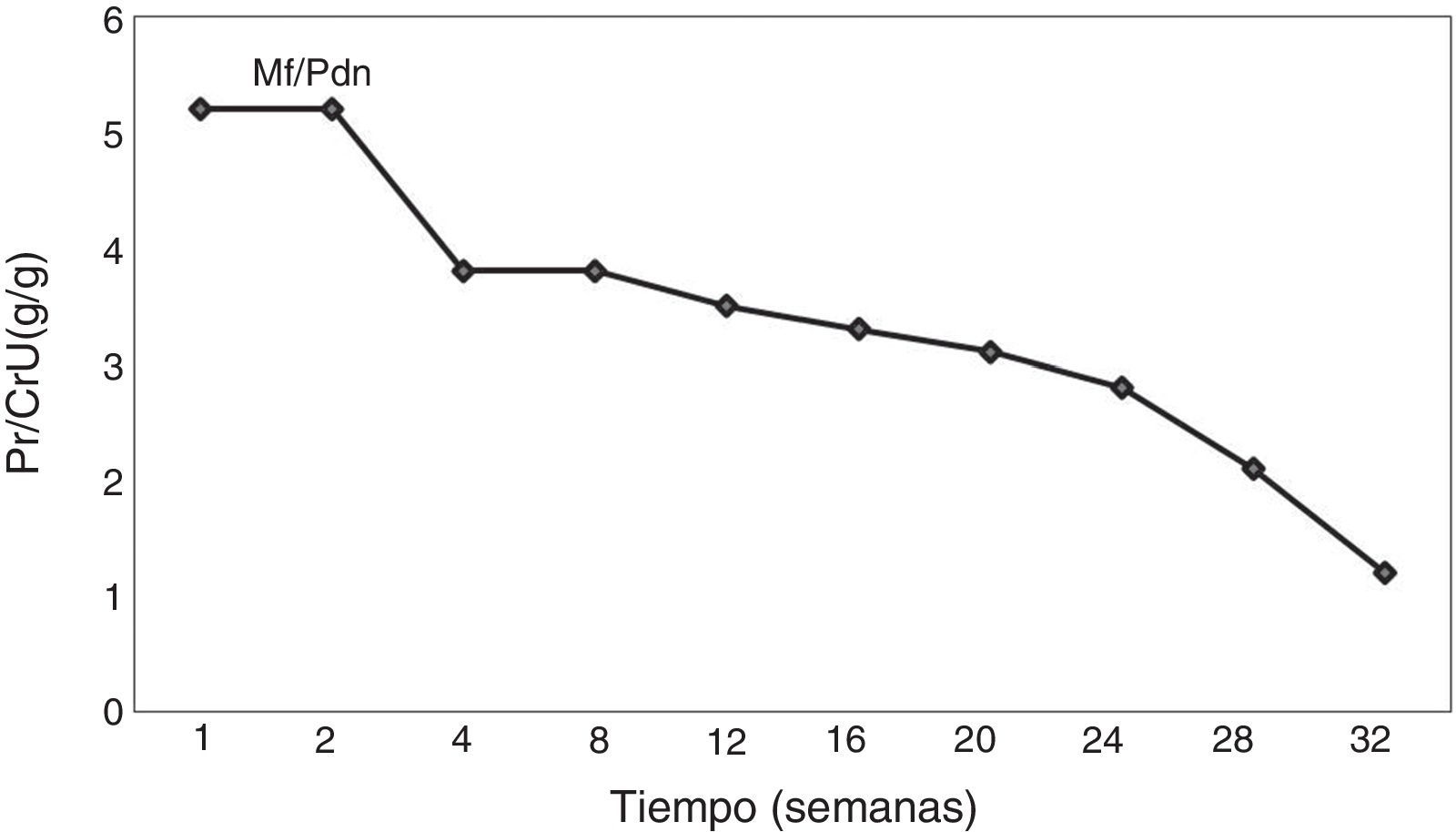
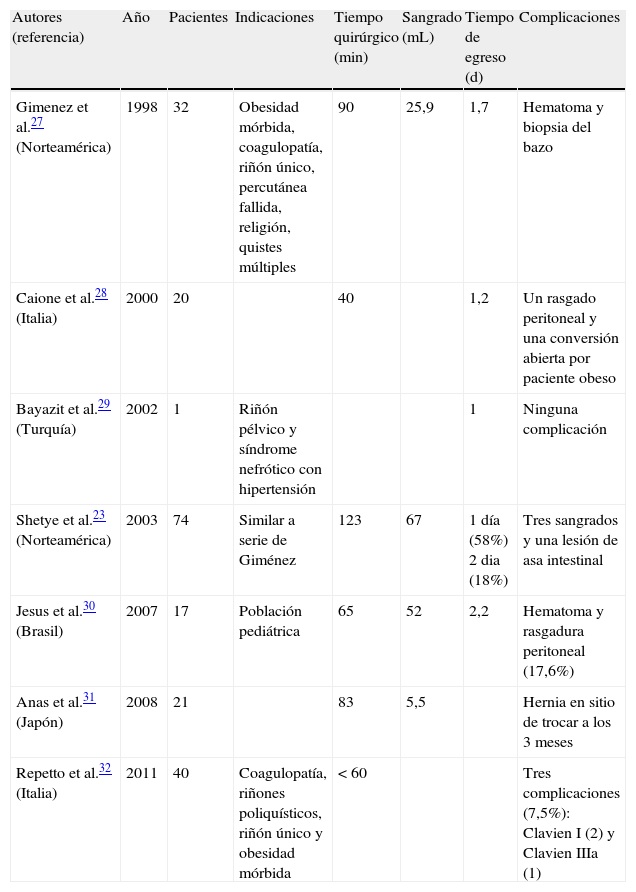
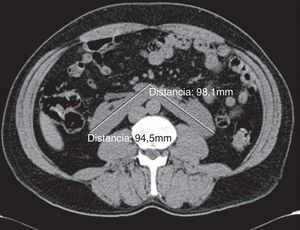
Caso clínicoSe trata de un paciente masculino, de 52 años de edad, procedente del estado de Hidalgo, México, referido de un centro hospitalario regional, por edema progresivo de extremidades, con patrón ascendente, asociado a orina espumosa y pérdida de peso de 12kg, de 5 meses de evolución. Además, refería cefalea holocraneana, palpitaciones, sensación de fatiga y adinamia de un mes de evolución, con dificultad respiratoria en la última semana previa a la consulta; había sido valorado por médico externo, quien le había prescrito prednisona 25mg/día, enalapril 20mg/día por hipertensión y furosemida 40mg/día por oliguria y edemas, sin notar mejoría alguna en los 10 días del tratamiento. A su ingreso, lo encontramos con anasarca, ligeramente pálido, con presión arterial de 145/91mmHg, frecuencia cardíaca de 100 latidos/minuto, frecuencia respiratoria de 22 ciclos/minuto, saturación de oxígeno de 97%, temperatura de 36°C, peso de 69kg y talla de 1,58m, al examinarle no se encontró algún otro hallazgo anormal, incluso con murmullo vesicular pulmonar presente bilateralmente. Sus laboratorios (tabla 1) mostraban hipoalbuminemia moderada, dislipidemia mixta, anemia leve normocítica normocrómica, ligera elevación de la creatinina y el nitrógeno ureico sanguíneo, proteinuria de 5,2g/g, un sedimento urinario con cilindros hialinos y hematuria microscópica reportando dismorfismo del 30%, con el resto de estudios en límites normales. Durante su hospitalización, se realizó un rastreo sonográfico de rutina, el cual evidenció riñón fusionado por ambos polos inferiores, con segmento derecho de 9,4×4,5×4,5cm y el izquierdo de 9,8×4,6×5,8cm. Se confirmó dicha alteración por tomografía computarizada como RH (fig. 1). Debido a la necesidad de establecer un diagnóstico etiológico de la glomerulopatía que evidentemente deterioraba el estado general del paciente y la dificultad técnica que implicaba obtener una muestra de tejido renal, se decidió solicitar apoyo de urólogo, quien con mucha destreza toma biopsia renal por técnica laparoscópica, sin ninguna complicación inmediata ni posterior, asociada al procedimiento. El reporte histopatológico (fig. 2) describía un engrosamiento de la membrana basal glomerular, con depósitos subepiteliales granulares que seguían un patrón espicular característico con tinción metenamina plata y depósitos de IgG en inmunofluorescencia, fibrosis intersticial grado II y arteriolonefroesclerosis leve, concluyendo en una nefropatía membranosa. Ante tal diagnóstico, se decide incrementar dosis de prednisona a 1mg/kg/día y adicionar micofenolato de mofetilo a 1g 2 veces al día, además del tratamiento inespecífico que ya recibía. En las siguientes 2 semanas de hospitalización (fig. 3) se realizó un rastreo corporal total, tratando de identificar algún hallazgo anormal asociado al RH y una causa secundaria de la nefropatía membranosa, resultando todo negativo. Se egresó como nefropatía membranosa primaria y se dio seguimiento en consulta externa, donde a las 4 semanas de iniciado el tratamiento fue evidente su mejoría en la remisión de los hallazgos característicos del síndrome nefrótico a su ingreso, permitiendo suspender los hipolipemiantes a las 12 semanas. A 8 meses de su seguimiento, con proteinuria de 1,2g/g, creatinina de 0,95mg/dL, albúmina sérica de 3,8g/dL y lípidos en límites normales.
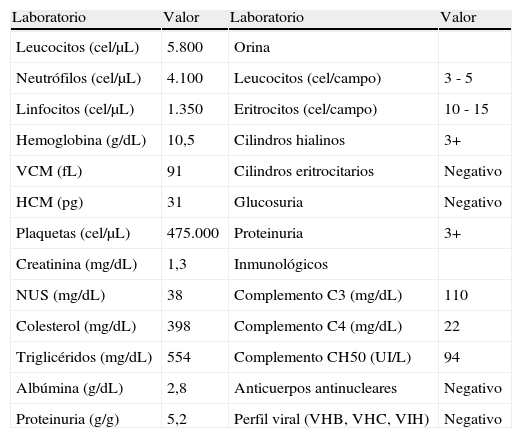
Laboratorios del paciente a su ingreso
| Laboratorio | Valor | Laboratorio | Valor |
| Leucocitos (cel/μL) | 5.800 | Orina | |
| Neutrófilos (cel/μL) | 4.100 | Leucocitos (cel/campo) | 3 - 5 |
| Linfocitos (cel/μL) | 1.350 | Eritrocitos (cel/campo) | 10 - 15 |
| Hemoglobina (g/dL) | 10,5 | Cilindros hialinos | 3+ |
| VCM (fL) | 91 | Cilindros eritrocitarios | Negativo |
| HCM (pg) | 31 | Glucosuria | Negativo |
| Plaquetas (cel/μL) | 475.000 | Proteinuria | 3+ |
| Creatinina (mg/dL) | 1,3 | Inmunológicos | |
| NUS (mg/dL) | 38 | Complemento C3 (mg/dL) | 110 |
| Colesterol (mg/dL) | 398 | Complemento C4 (mg/dL) | 22 |
| Triglicéridos (mg/dL) | 554 | Complemento CH50 (UI/L) | 94 |
| Albúmina (g/dL) | 2,8 | Anticuerpos antinucleares | Negativo |
| Proteinuria (g/g) | 5,2 | Perfil viral (VHB, VHC, VIH) | Negativo |
HCM: hemoglobina corpuscular media; NUS: nitrógeno ureico sanguíneo; VCM: volumen corpuscular medio.
El RH fue descrito inicialmente por Berengario da Carpi en 1552. En un tercio de los casos son asintomáticos y en el resto pueden presentar complicaciones como displasia renal multiquística, uropatías obstructivas, hidronefrosis, litiasis, infecciones o neoplasias como carcinoma renal, tumor de Wilms o de urotelio, constituyendo la glomerulopatía asociada un muy bajo porcentaje, no descrito en las escasas publicaciones al respecto4. En nuestro caso, el paciente no refería otras molestias ni había otros hallazgos a la exploración física diferentes a los explicados por síndrome nefrótico, tampoco síntomas extrarrenales que nos hicieran integrar algún síndrome congénito.
El RH constituye la anomalía más frecuente de la fusión renal. Aparece en 1/400 nacimientos, con una incidencia superior en hombres (2:1). La localización del istmo suele ser anterior a los grandes vasos abdominales, siendo irrigado por una arteria renal en un tercio de los casos, encontrándose en el resto arterias renales duplicadas o incluso triplicadas5. La estenosis de la unión pieloureteral (EPU) es la alteración congénita más frecuente del tracto urinario superior, y la que más se asocia con el RH. La hidronefrosis por obstrucción en la unión pieloureteral se observa en un tercio de los RH, siendo factores que contribuyen: la inserción alta del uréter en la pelvis renal, las anomalías en el istmo o el aporte sanguíneo6. Nosotros buscamos intencionadamente anormalidades genitourinarias sin encontrarlas.
En cuanto a las glomerulopatías y su asociación con el RH, existen 9 publicaciones de casos a la fecha, en los que coexisten otras condiciones que han jugado un papel importante en su desarrollo, al menos en 6 de ellos, lo que hace suponer la inexistencia de un vínculo directo de la anomalía de fusión y las glomerulopatías7. Sin embargo, ha predominado un contexto autoinmune en algunas de ellas, por lo que se ha propuesto que el RH predispone al depósito de inmunocomplejos, lo que resulta una explicación atractiva y fácil para el caso de las nefropatías membranosas en las que no se han encontrado otros hallazgos que sugieran su etiología secundaria8–10. Sin embargo, esto es difícil de explicar, sobre todo si tomamos en cuenta que muchas nefropatías membranosas anteceden en varios años al descubrimiento de una neoplasia subyacente, y que por otro lado, si consideramos que 1 de 400 niños nacen con un RH, para el caso de México, que nacen 19 niñosx1.000 habitantes/año (casi el doble de España), la cantidad de niños con esta anomalía de fusión no es despreciable, tampoco la cantidad de glomerulopatías que desarrollarían de forma primaria, lo que representaría en cierta medida un problema de salud que se reflejaría en mayores publicaciones de casos, lo que hasta la fecha no sucede.
Por tanto, establecer una asociación directa entre una glomerulopatía y la anomalía de fusión en la actualidad, no es algo sostenible, hacen falta mayores estudios al respecto que demuestren su patogénesis. Nuestro paciente, lo catalogamos como nefropatía membranosa primaria, ante la ausencia de otra patología que lo explicara, o que haya aparecido a la fecha de su seguimiento actual. Aunque el micofenolato de mofetilo no es una droga inmunosupresora de elección para tratar esta glomerulopatía, se usó lo que se tenía disponible, ante la carencia de medios económicos para sostener su tratamiento.
Los pacientes con RH entran en el grupo de anomalías anatómicas que contraindican la realización de una biopsia renal percutánea para obtener muestra histológica que fundamente el diagnóstico en el caso de desarrollo de una glomerulopatía. La biopsia renal continúa siendo el procedimiento diagnóstico indispensable y el pivote central en la valoración clínica de los pacientes con proteinuria, hematuria con falla renal y con enfermedades renales desconocidas.
La biopsia renal percutánea actualmente es la técnica estándar ya que ha probado desde la década de los años 80 ser un procedimiento seguro al ser realizado por personal experimentado y en pacientes apropiadamente seleccionados11,12. La técnica de la biopsia renal se ha ido perfeccionando en las últimas 2 décadas, en que se introdujo el ultrasonido como un método para guiar dicho procedimiento de forma percutánea, así como el uso de un dispositivo automatizado en la pistola de biopsia.
La biopsia renal percutánea es un procedimiento relativamente seguro con complicaciones que amenazan la vida con una tasa menor al 0,1% en reportes recientes de biopsias. Sin embargo, no está exenta de riesgos. Las complicaciones manifiestas ocurren hasta en un 13% de los casos, y en un 6-7%, de los cuales son reportadas como mayores, llegando a requerir otra intervención como transfusión de hemoderivados o un procedimiento invasivo (radiológico o quirúrgico), estas suelen aparecer en menos de 24 horas en más del 90% de los casos13.
Con el tiempo, las contraindicaciones para una biopsia percutánea del riñón se han ido reduciendo, con el advenimiento de las técnicas de imagen no invasivas, el desarrollo de protocolos adecuados para la monitorización de pacientes, durante el período posbiopsia temprana y el desarrollo de agujas de pequeño calibre, se ha contribuido al incremento de la seguridad en esta técnica, desde hace más de una década14.
En la actualidad, varias condiciones clínicas que eran consideradas contraindicaciones absolutas para biopsia percutánea, como el riñón único y la obesidad mórbida, son ahora consideradas contraindicaciones relativas15.
Sin embargo, existen situaciones en las que la única opción de obtener una muestra de tejido renal viable, sin someter a mayores riesgos al paciente, es bajo visión directa (tales como anticoagulación crónica, diátesis hemorrágica, anormalidades anatómicas o posición muy alta en retroperitoneo, riñones pequeños o pobremente visibles, riñón ectópico). La biopsia renal, bajo visión directa, puede ser realizada por una incisión abierta o laparoscópicamente vía transperitoneal o retroperitoneal16–19.
En el caso de la vía laparoscópica ambas son igualmente efectivas en manos adiestradas, aunque la vía transperitoneal ha demostrado tener un tiempo quirúrgico significativamente mayor, así como una pérdida sanguínea estimada promedio mayor en comparación con la retroperitoneal20.
Las principales desventajas identificadas son el alto costo económico y ser un procedimiento invasivo que requiere anestesia general, las que tratando de establecer el beneficio obtenido y la seguridad en el paciente se terminan minimizando, sobre todo al considerar las enormes ventajas en comparación con la técnica abierta, como un tiempo quirúrgico más corto, menor tiempo anestésico, menor sangrado, menor tamaño de la incisión, pocas probabilidades de formación de hernias, menores molestias postoperatorias, más rápido egreso hospitalario, mejores resultados cosméticos y más rápida integración a sus labores21–23. Por otro lado, el asegurar una biopsia de tejido cortical bajo visión directa, permite minimizar el riesgo de lesionar vasos sanguíneos profundos o sistema colector, reduciendo por tanto, el riesgo de una fístula arteriovenosa intraparenquimatosa o fístula urinaria23.
En nuestro país, actualmente, la técnica abierta mediante mini lumbotomía es la forma usual de abordar estos pacientes en muchos hospitales de tercer nivel del país, cuando se requiere obtener tejido para estudio, a pesar que desde la década pasada ha cobrado mayor auge la laparoscopia en diversos procedimientos a nivel nacional e internacional. No existen reportes de pacientes abordados bajo esta técnica en México, en publicaciones médicas.
La primera vez que se utilizó esta técnica en urología fue en la década de los 70, cuando Cortesi, en el año 1976, la usó para la localización intraabdominal de los testículos no palpables y su diagnóstico diferencial. En los años siguientes existen algunos reportes de casos de utilización de esta técnica para la investigación de estados intersexuales mediante visualización y biopsia ocasional de las gónadas, la monitorización transperitoneal de la cirugía percutánea de los riñones en ectopias pelvianas y la corrección laparoscópica del varicocele24. Sin embargo, su uso para la toma de biopsias renales, destaca en publicaciones médicas en el área veterinaria, hacia 1983, para la obtención de especímenes renales de perros y gatos, luego en bovinos sometidos a estudios farmacocinéticos de drogas en 198525,26. En humanos, existen escasas publicaciones al respecto (tabla 2), reportándose la primera hacia agosto de 1991 en Norteamérica y publicada en 199827, acumulándose en el transcurso de estos 16 años poca, pero valiosa experiencia en el área, digna de ser imitada, sobre todo considerando la alta destreza de recurso humano en el área en nuestros países y la tecnología novedosa con la que se cuenta en los hospitales actualmente27–32.
Biopsia renal por técnica laparoscópica
| Autores (referencia) | Año | Pacientes | Indicaciones | Tiempo quirúrgico (min) | Sangrado (mL) | Tiempo de egreso (d) | Complicaciones |
| Gimenez et al.27 (Norteamérica) | 1998 | 32 | Obesidad mórbida, coagulopatía, riñón único, percutánea fallida, religión, quistes múltiples | 90 | 25,9 | 1,7 | Hematoma y biopsia del bazo |
| Caione et al.28 (Italia) | 2000 | 20 | 40 | 1,2 | Un rasgado peritoneal y una conversión abierta por paciente obeso | ||
| Bayazit et al.29 (Turquía) | 2002 | 1 | Riñón pélvico y síndrome nefrótico con hipertensión | 1 | Ninguna complicación | ||
| Shetye et al.23 (Norteamérica) | 2003 | 74 | Similar a serie de Giménez | 123 | 67 | 1 día (58%) 2 dia (18%) | Tres sangrados y una lesión de asa intestinal |
| Jesus et al.30 (Brasil) | 2007 | 17 | Población pediátrica | 65 | 52 | 2,2 | Hematoma y rasgadura peritoneal (17,6%) |
| Anas et al.31 (Japón) | 2008 | 21 | 83 | 5,5 | Hernia en sitio de trocar a los 3 meses | ||
| Repetto et al.32 (Italia) | 2011 | 40 | Coagulopatía, riñones poliquísticos, riñón único y obesidad mórbida | <60 | Tres complicaciones (7,5%): Clavien I (2) y Clavien IIIa (1) |
La biopsia renal laparoscópica es segura, efectiva y un procedimiento mínimamente invasivo en el que se puede tener un control directo de la hemostasia bajo visión directa, con un bajo riesgo de morbilidad postoperatoria, obteniendo adecuado tejido renal cortical, con una recuperación y convalecencia cortas para muchos pacientes comparada con la biopsia abierta, siendo la forma laparoscópica la primera alternativa de elección cuando la forma percutánea está contraindicada.