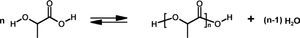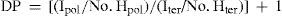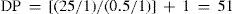An aliphatic polyester with degradable characteristics as poly(d,l-lactide) (PDLLA) was synthesized by ring-opening polymerization (ROP) of the d,l-lactide using tin (II) 2-ethyl-hexanoate as initiator and primary alcohols as coinitiators. PDLLA was characterized by proton nuclear magnetic resonance (1H NMR). The concepts and synthesis that are shown here are a contribution for courses of organic chemistry and polymers.
El interés de los alumnos de una licenciatura en química o ciencias químicas puede ser variado respecto de las áreas en las que potencialmente se podrán especializar en un futuro o trabajar en ellas en la vida profesional. Generar interés en las diversas áreas experimentales de la química es deber de todos los profesores universitarios. Al respecto, el campo de los polímeros o macromoléculas sintéticas representa un área de la Química Orgánica (y también Fisicoquímica) que proporciona una gran aplicación en la vida diaria. Diversidad de objetos con los que se convive tienen como componente principal a polímeros; ejemplo de ellos son: bolsas, envases, sillas, adhesivos, recubrimientos, suelas, zapatos, ropa, partes de automóviles, etc. La lista puede considerarse infinita en realidad.
Muchos de los polímeros desgraciadamente han sido “satanizados” como “no degradables” por algunas personas que, ya sea por ignorancia, manipulación (Gómez, 2009) o por protagonismo político (El Universal, 2009) hablan de ellos. Esto ha derivado en una percepción peyorativa de la propiedad química que en el pasado, presente y futuro, fue, es y será una de sus más grandes fortalezas: la estabilidad química o poca reactividad. Al respecto es necesario comentar que como propiedad sumamente importante, muchos de los polímeros resisten ácidos y bases fuertes.
Para ejemplificar al respecto, imagínese por un momento una tubería de drenaje del polímero llamado PVC (cloruro de polivinilo), la cual sirve para transportar los desechos fecales de una casa común y corriente como muchas en el mundo. Pregúntese: ¿es conveniente que este polímero se degrade de manera masiva en corto tiempo (1 o 2 años)? ¿Le gustaría que en su casa o edificio el excremento se infiltrara en las paredes, techos o pisos y aromatizara con peculiar olor su vivienda con la consecuente falta de higiene? La respuesta lógica en ambos casos es negativa. Afortunadamente muchos de los polímeros presentan la propiedad de resistencia química de manera que, para la alegría de la gente, la tubería de PVC puede resistir la oxidación (en comparación con los metales), la hidrólisis ácida y, consecuentemente, la alta concentración de ácido clorhídrico (comercialmente llamado ácido muriático) que se utiliza para limpiar la taza del baño o retrete.
Los químicos saben que, en principio, toda materia en este planeta puede ser modificada químicamente. Así pues, cuando se usa la palabra “polímeros no degradables” o “plásticos no degradables” se incurre en un error, debido a que todo polímero es materia y toda materia en principio es modificable o en su caso degradable (ya sea por oxidación, combustión, radiación, biodegradación, hidrólisis, pirólisis, etc.). La fortuna o el inconveniente es el tiempo y esto puede jugar a favor o en contra según la aplicación a que se destine el polímero: aquéllos cuyo periodo de uso es relativamente corto pueden reciclarse, almacenarse o también potencialmente ser reemplazados por otros que se puedan degradar rápidamente (2 años) y no representar una carga de espacio a corto tiempo para el basurero de la ciudad.
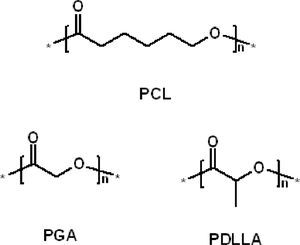
Respecto a esto último, una nueva familia de polímeros para aplicaciones de corta duración ha emergido, los llamados poliésteres alifáticos biodegradables; químicamente presentan la repetición de un grupo éster y un grupo alquilo a lo largo de la cadena polimérica. En esta familia se encuentran la poli(ε-caprolactona) (PCL) (Khatiwala, 2008), la poliglicolida (PGA) (Zou, 2005) y la poli(d,l-lactida)lactida) (PDLLA) (Tokiwa, 2006) (figura 1). Estos poliésteres se utilizan en el área de biomateriales como suturas biodegradables, material dental, bolsas, platos, etc. (Stevens, 2002) y presentan la propiedad de degradación y biodegradación debido a que el grupo funcional éster es susceptible de romperse mediante hidrólisis ácida, básica o enzimática; además, los oligómeros producidos (moléculas producto de la degradación del poliéster) pueden ser fuente de carbono para microorganismos como hongos y bacterias (Tokiwa, 2006).
2¿A quién va dirigido?Este escrito pretende contribuir a la formación del estudiante universitario mediante una práctica de laboratorio que lo acerque al área de los polímeros por medio de la síntesis de un poliéster con características degradables como la poli(d,l-lactida) (PDLLA). Esta práctica se recomienda para estudiantes que previamente hayan llevado uno o dos cursos de Química Orgánica, tengan habilidades básicas de laboratorio de esta materia para armar un equipo de reflujo y conozcan el fenómeno de recristalización. Es indispensable que el alumno tenga por conocido previamente en clase: 1) qué es un centro quiral, 2) la reactividad del grupo acilo, y 3) consecuentemente la del grupo funcional éster. La práctica puede ser hecha en el transcurso de un segundo o tercer curso de Química Orgánica o, preferentemente, en un curso de Polímeros. La duración de la práctica es de dos sesiones de cuatro horas.
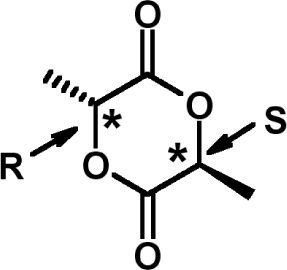
3El reactivo: d,l-lactidaEn este trabajo es de interés un polímero que en realidad es un poliéster llamado poli(d,l-lactida) (PDLLA), que tiene como unidad repetitiva un metino (CH), un metilo (CH3) y un grupo éster (O−C=O) como se indica en la figura 1. La molécula que se usará como reactivo —también llamado monómero— del cual se parte para la síntesis de la poli(d,l-lactida) es la d,l-lactida, un diéster cíclico (figura 2) o dilactona.
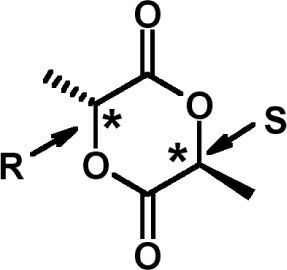
Esta molécula presenta dos centros quirales que se ubican en los dos metinos (CH) del anillo; gracias a esta característica es posible obtener dos enantiómeros. Para observar esto, hagamos una analogía con los alfa (α) aminoácidos: si utilizamos una proyección de Fisher con el grupo carbonilo arriba y el OR debajo con respecto al carbono α (metino, CH), podemos decir que si el metilo (CH3) se encuentra a la izquierda la molécula se llamará D-lactida y si se encuentra a la derecha se nombrará L-lactida (Yurkanis-Bruice, 2008). Es importante subrayar que los enantiómeros D-lactida y L-lactida tienen configuración R,R y S,S, respectivamente. Teniendo lo anterior en cuenta, al escribir d,l-lactida nos referimos estrictamente a una mezcla racémica de D-lactida y L-lactida. En los próximos experimentos sólo se utilizará d,l-lactida.
Otro estereoisómero de la lactida que también puede utilizarse para la síntesis de polilactida es la llamada meso-lactida (Ovitt, 1999), representada en la figura 3. La molécula meso-lactida, al igual que todos los compuestos meso, tiene carbonos quirales, aunque superpuestos a su imagen especular.
4ROP de la D,L-lactidaPara sintetizar la polilactida (PLA), se puede partir de cuatro diferentes reactivos: 1) D-lactida (d-LA), 2) L-lactida (l-LA), 3) la mezcla racémica d,l-lactida (d,l-LA) y 4) meso-lactida (meso-LA). Todas estas moléculas son susceptibles de polimerizarse mediante el mecanismo de polimerización por apertura de anillo ROP (por las siglas en inglés de Ring-Openig Polimerization). Así, se pueden obtener cuatro diferentes polímeros dependiendo del reactivo de que se parta: 1) poli(D-lactida) (PDLA), 2) poli(L-lactida) (PLLA), 3) poli(d,l-lactida) (PDLLA) y 4) poli(meso-lactida) (PmesoLA).
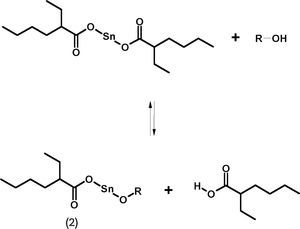
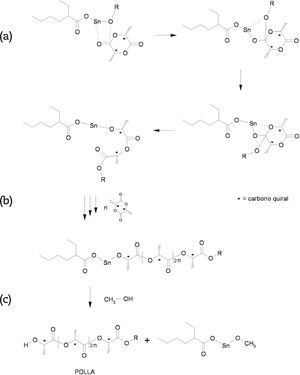
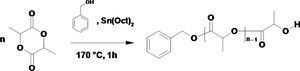
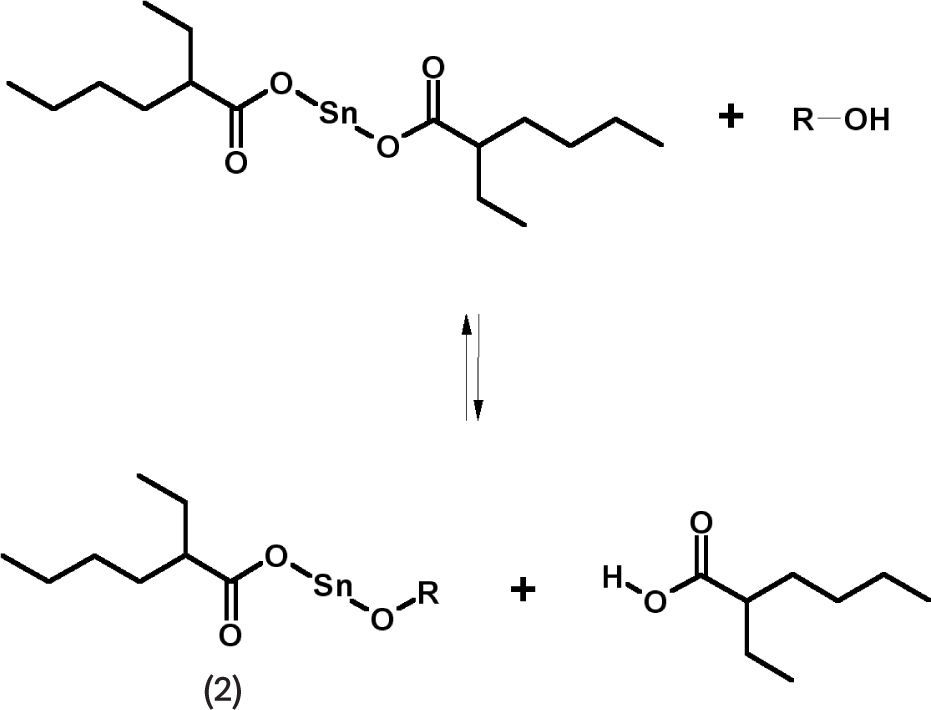
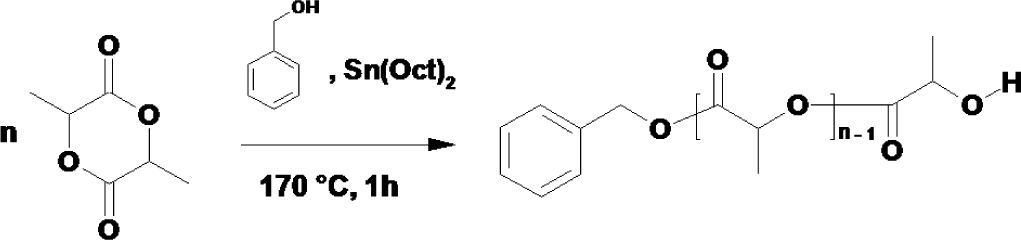
La polimerización por apertura de anillo (ROP) implica que el anillo del que se parte (d,l-lactida) sea susceptible para abrirse por una especie activa que lo ataque nucleofílicamente o electrofílicamente según sea el caso. Para tal fin es necesario contar con un iniciador, o molécula que favorezca la apertura del anillo; al respecto se sabe que una lactona puede interactuar con ácidos de Lewis (atractor de un par de electrones) (Evans, 1993). Debido a lo anterior se han estudiado una diversidad de compuestos metálicos que tienen la propiedad de polimerizar la d,l-lactida; el compuesto más usado es uno de estaño —Sn—, el 2-etilhexanoato de estaño (II) (1, en la figura 4) (Kaihara, 2007), comúnmente llamado octato de estaño —Sn(Oct)2—; éste ha sido avalado por la Administración de Alimentos y Drogas de Estados Unidos (FDA, por sus siglas en inglés de Food and Drug Administration) como iniciador en la polimerización para obtener poliésteres biodegradables. En presencia de un alcohol primario o secundario —que a partir de ahora llamaremos coiniciador—, este carboxilato de estaño tiene la característica de presentar una reacción de transferencia, en donde se produce una nueva especie de alcóxido de estaño (2, en figura 5), que experimentalmente se ha observado es la especie activa (Kowalski, 2000) en la reacción de iniciación y propagación en la polimerización de lactonas (figura 6). Se entiende por coiniciador todo aquel compuesto químico (generalmente alcohol) que tenga la propiedad de inducir una polimerización en presencia de un iniciador (Báez, 2006).
Reacción de transferencia para Sn(Oct)2 y formación del alcóxido de estaño (2).
(a) Iniciación, (b) propagación y (c) terminación de la polimerización de la d,l-lactida iniciada por el alcóxido de estaño (2). El Mn de los poliésteres coiniciados por 1-nonanol y alcohol bencílico son de 3 384 y 3 780 g/mol, respectivamente.
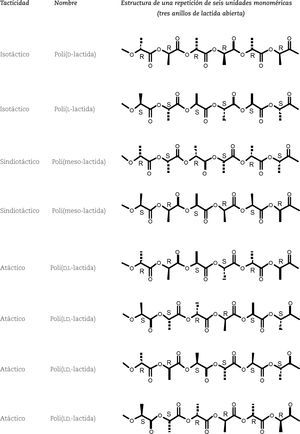
La polilactida (PLA) presenta el fenómeno de tacticidad, esto es, el arreglo estereoquímico de los centros quirales en una macromolécula o polímero. Al respecto, cabe señalar que la tacticidad generalmente depende del enantiómero, mezcla racémica o compuesto meso de la lactida utilizada como reactivo para la polimerización (apartado 3). En principio, la tacticidad puede ser de tres tipos: 1) isotacticidad, o una sola configuración de centro quiral en todo el polímero, como el caso de la poli(D-lactida) (PDLA) y poli(L-lactida) (PLLA); 2) sindiotacticidad, o configuración de centros quirales alternándose consecutivamente, como el caso de la poli(meso-lactida), y 3) atacticidad, o centros quirales R y S distribuidos aleatoriamente a lo largo de la cadena polimérica, como el caso de la poli(d,l-lactida);lactida); esta última se obtiene en la síntesis del presente trabajo. Para ejemplificar visualmente, en la figura 7 se ilustran las estructuras químicas utilizando como base seis unidades repetitivas de PLA.
5Una ruta alterna para sintetizar la poli(d,l-lactida): policondensación del ácido d,l-lácticoOtra ruta que también ha sido explorada para la síntesis de la poli(d,l-lactida) es la llamada ruta de policondensación (Zhou, 2003; Proikakis, 2006, y Pinzón, 2006). En términos generales se describe como una reacción en donde las moléculas de ácido d,l-láctico se unen y cada vez que sucede esto se libera una molécula de agua; la figura 8 ilustra la reacción de polimerización. Esta ruta tiene algunas características como:
- 1.
Para un mayor rendimiento de la reacción se necesita destilar el agua producida en el medio de reacción y con ello desplazar el equilibrio a la derecha; esto bajo el principio de Le Châtelier (Garritz, 2001).
- 2.
Debido a la funcionalidad (grupos funcionales: alcohol y ácido carboxílico) inherente que debe de tener el monómero (ácido d,L-láctico) para su policondensación, es difícil obtener polímeros con grupos funcionales terminales diferentes a los del monómero al finalizar la reacción.
- 3.
Presenta mayor aleatoriedad de reacciones, debido a que los diferentes oligómeros (HO-R-CO2H) reaccionan con ellos mismos y además con el monómero (ácido d,L-láctico); en consecuencia, el polímero resultante tiene una distribución de pesos moleculares más amplia (Mw /Mn > 2).
De acuerdo con los tres puntos anteriores, si bien esta ruta de polimerización es factible, se tienen que considerar las características del producto final para poder decidir si es conveniente. En este sentido, comparada con la policondensación, la polimerización por apertura de anillo (ROP) presenta mayores ventajas debido a que no tiene las “características” de los tres puntos antes señalados respecto a condiciones de reacción y al producto obtenido. En particular, en la ROP: 1) no se necesita destilar agua, 2) el polímero puede tener un grupo funcional terminal diferente al de partida y 3) usualmente la distribución de pesos moleculares de polímeros vía ROP es menor (Mw/ Mn < 2), debido a que las cadenas de oligómeros ya formados en el medio de reacción no tienden a reaccionar tanto entre sí y sólo lo hacen en su mayoría con el monómero en el paso de propagación (figura 6).
6ObjetivoEl objetivo de esta práctica de laboratorio es introducir a los alumnos a realizar la síntesis del poliéster poli(d,L-lactida) (PDLLA) mediante la ruta de polimerización por apertura de anillo (ROP) y caracterizar el poliéster por Resonancia Magnética Nuclear de Protón (RMN 1H).
7Reactivos y materialesReactivos. d,L-lactida grado reactivo (99%), 1-nonanol, alcohol bencílico, 2-etilhexanoato de estaño (II), xileno, agua destilada, hielo, cloroformo y metanol (PRECAUCIÓN: el metanol y el cloroformo son líquidos tóxicos y es conveniente se manejen en un área ventilada, preferentemente en una campana de extracción de gases para evitar inhalar sus vapores, además de evitar contacto con la piel e ingerirlo). Todos los desechos que se generen producto de la práctica tendrán que ser almacenados para su posterior tratamiento y no ser tirados en los lavabos o tarjas.
Material. Equipo de vidrio de reflujo (figura 9), parrilla de calentamiento con agitación magnética, baño de aceite de silicón (o en su caso mantilla de calentamiento eléctrica), y todo lo necesario para montar un sistema de reflujo y material de vidrio y cerámica necesario para llevar a cabo la técnica descrita.
8Técnica- 1.
Preparar 100 mL de una solución 0.123 M de 2-etilhexanoato de estaño (II) (Sn(Oct)2) en xileno.
- 2.
Precalentar el baño de aceite de silicón a 170 °C (preferentemente con un agitador magnético dentro del aceite).
- 3.
Pesar 4.32 g (30 mmol) de d,l-lactida y adicionarlo en un matraz balón (de 50 o 25 mL); adicionar al matraz 0.20 mL (2 mmol) de alcohol bencílico (coiniciador) (figura 10a), 1 mL de solución 0.123 M de Sn(Oct)2 (iniciador) y un agitador magnético. Nota: si se llega a utilizar una mantilla de calentamiento es necesario un matraz balón de dos bocas en donde se introduzca un termómetro en una boca para controlar la temperatura de reacción.
- 4.
Adaptar el matraz al sistema de reflujo y dejar reaccionar por 1 h (figura 9).
- 5.
Después de transcurrido el tiempo de reacción verter el crudo de reacción caliente sobre un vaso de precipitados (preferentemente dentro de una campana de extracción de gases) y dejar enfriar; el resto del polímero que se encuentre en el matraz balón, dejarlo enfriar (solidifica), disolverlo en el mínimo de cloroformo y verterlo en el vaso de precipitados mencionado anteriormente, disolver por agitación magnética la totalidad del polímero en el mínimo de cloroformo, dejar disolver por una noche tapando el vaso de precipitados con un vidrio de reloj.
- 6.
En la siguiente sesión de laboratorio, recristalizar el polímero con un exceso de metanol frío (mínimo 10 veces más volumen del que se utilizó de cloroformo al disolver) agitando vigorosamente con una varilla de vidrio hasta que todo el sólido recristalizado sea blanco.
- 7.
Filtrar por gravedad o al vacío y posteriormente dejar secar el filtrado en una campana de extracción de gases por una noche.
- 8.
Pesar el polímero y obtener el porcentaje de rendimiento con base en el peso inicial de monómero alimentado (d,l-lactida) y coiniciador (alcohol bencílico).
- 9.
Para caracterizar el poliéster por RMN 1H, pesar en un tubo de ensaye de 20 a 30 mg de muestra seca, disolverlo en aproximadamente 0.75 mL de cloroformo deuterado (CDCL3); posteriormente verter la solución en un tubo para RMN utilizando una pipeta Pasteur de vidrio, tapar el tubo para RMN y llevarlo al equipo de RMN (200 MHz o superiores) para obtener el espectro de protón (1H).
Observaciones. Análogamente se puede realizar la polimerización de d,l-lactida utilizando 1-nonanol como coiniciador y otro experimento sin presencia de coiniciador en el paso 3 de la técnica; esto es, las condiciones experimentales pueden variar con tres equipos diferentes de alumnos en la misma sesión de laboratorio. Cabe mencionar que tres requisitos para utilizar un alcohol como coiniciador en esta reacción son: 1) el alcohol (ROH) debe de ser primario o, en su caso, secundario, para favorecer la reacción de transferencia (figura 5) y evitar impedimento estérico con el iniciador (Sn(Oct)2); 2) alcohol con punto de ebullición mayor a los 170 °C (figura 10), y 3) el alcohol debe de ser miscible con la d,l-lactida fundida (p.f. = 116-119 °C) para que se lleve la reacción homogéneamente (en una sola fase). La reacción efectuada es sin presencia de disolventes para la d,l-lactida (monómero); a esto se le llama reacción en masa (bulk, en inglés).
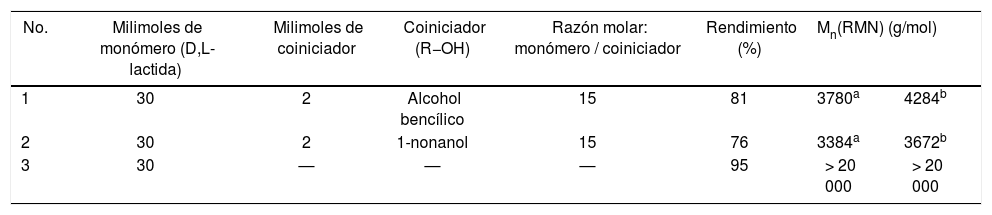
9Resultados9.1SíntesisEn la tabla 1 se observa que por la ruta de polimerización por apertura de anillo (ROP) de la d,l-lactida obtenemos muy buenos rendimientos (76-95%). Cuando se utiliza un coiniciador como 1-nonanol o alcohol bencílico (figura 11) el polímero tiene la apariencia física de un polvo blanco (figura 12a); sin embargo, al no utilizar coiniciador el producto se observa como un material con capacidad de formar hilos y películas delgadas (figura 12b).
Diferentes muestras de poli(d,l-lactida) sintetizadas utilizado 2-etilhexanoato de estaño (II) Sn(Oct)2 como iniciador en presencia (Nos. 1-2) y ausencia (No. 3) de coiniciadores.
Lo anterior se debe en principio a que la muestra sin coiniciador presenta mayor peso molecular: al adicionar un alcohol como coiniciador formamos más sitios reactivos tipo alcóxido de estaño (figura 5) que reaccionarán con más monómero y habrá más pasos de iniciación; consecuentemente, las cadenas serán más cortas y decrecerá el peso molecular del poliéster. Cuando no adicionamos coiniciador al medio (muestra 3, tabla 1), la iniciación puede proceder por reacción del Sn(Oct)2 con trazas de humedad (H2O, como coiniciador) y formar hidróxido de estaño como especie activa, existiendo más pasos de propagación respecto a las reacciones con adición de coiniciador.
El mayor rendimiento de la muestra 3 se debe a su alto peso molecular (Mn > 20 000); por ello, en el proceso de recristalización no se pierden tantos oligómeros (especies poliméricas de bajo peso molecular < 1 000 g/mol) en las aguas madres de cloroformo/metanol (cuando se filtra), como sucede con las muestras 1 y 2 con peso molecular bajo (Mn = 3 780-3 384).
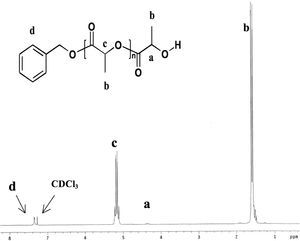
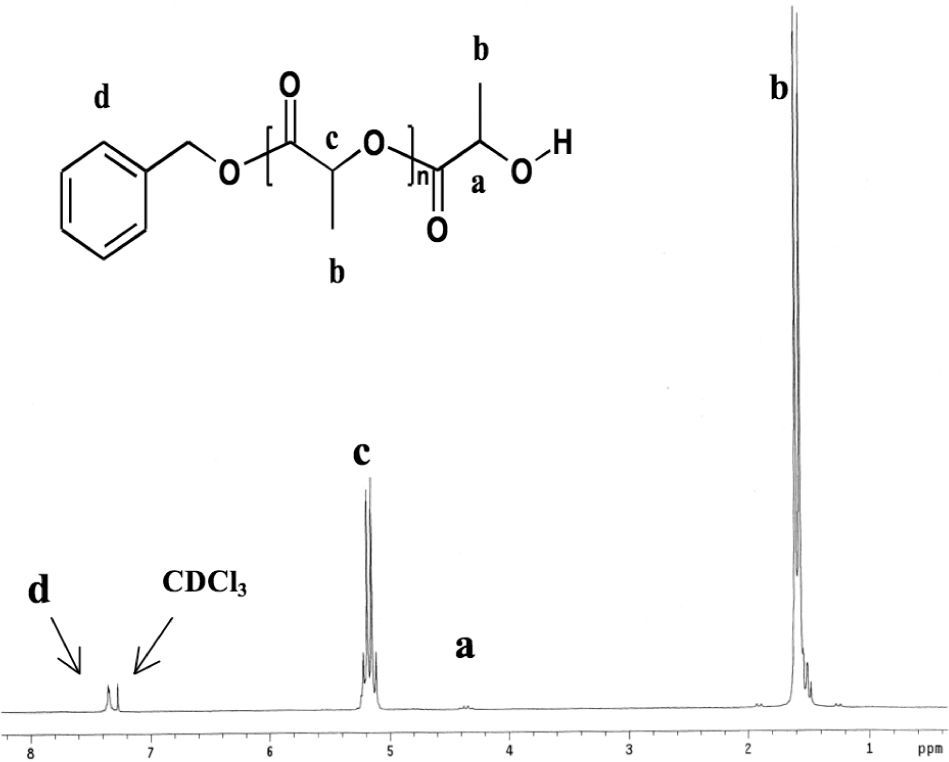
9.2Caracterización por RMN 1HSe llama caracterización al trabajo de evidenciar si el producto que se espera teóricamente —poliéster—puede ser observado experimentalmente mediante una técnica analítica. En este caso, la poli(d,l-lactida) purificada por recristalización y seca puede ser analizada por una técnica analítica de caracterización de moléculas y macromoléculas orgánicas —polímeros— llamada resonancia magnética nuclear de protón (RMN 1H). Mediante esta técnica se obtiene el espectro mostrado en la figura 13, donde se observa la asignación de las señales correspondientes a los protones que forman el poliéster, así como los dos grupos terminales que conforman la cadena polimérica: un hidroxilo (−OH) y un bencilo (C6H5−CH2−). La asignación del grupo terminal hidroxilo (−CO–CH(CH3)−OH, (a) fue hecha de acuerdo con el desdoblamiento del metino (cuarteto) y desplazamiento químico δ (Silverstien, 2005); este resultado fue corroborado en referencias del área (Lemmouchi, 2007 y Trimaille, 2004).
Espectro de resonancia magnética nuclear de protón (RMN 1H) de 200 MHz para la poli(d,l-lactida), reacción coiniciada con alcohol bencílico (No. 1, tabla 1), disolvente: CDCl3. Desplazamiento químico (δ, ppm) = 7.35 (d), 7.27(CDCl3), 5.16 (c), 4.35 (a), 1.58 (b). Nota: En la señal c se encuentra traslapado el pico singulete correspondiente al metileno del grupo bencilo (−CH2−C6H5).
El metileno del grupo bencilo (–CH2–C5H6, e) con desdoblamiento singulete no se observa en el espectro porque se encuentra traslapado (Trimaille, 2004) con el pico de la cadena repetitiva del polímero (c, cuarteto), teniendo una contribución mínima al valor de la integral de la unidad repetitiva.
Por otra parte, la RMN 1H nos permite calcular el grado de polimerización (DP, del inglés Degree of Polymerization), que se corresponde con el valor de n de las estructuras anteriores (figura 1). Para obtener el DP se necesita el valor de la integral (área bajo la curva) de un protón que se repita a lo largo de la cadena (que esté dentro de los corchetes []n); en este caso utilizamos el metino CH (c) y lo relacionamos mediante una división con el valor de la integral del grupo terminal de la cadena (utilizamos el metino adyacente al grupo funcional hidroxilo CH-OH (a)); el valor de cada integral se divide entre el número de protones integrados por esa señal, obteniendo la siguiente ecuación:
Ipol = Valor de la integral del área bajo la curva para la señal del polímero.
No. Hpol = Número de protones que contribuyen a la señal del polímero.
Iter = Valor de la integral del área bajo la curva para la señal del grupo terminal.
No. Hter = Número de protones que contribuyen a la señal del grupo terminal.
El número 1 que se adiciona al final de la ecuación 1 se debe a la contribución de un grupo terminal (el extremo hidroxilo). Para el caso particular del poliéster PDLLA y tomando en cuenta el valor de las integrales para las señales a (Ia = Iter = 0.5) y c (Ic = Ipol = 25) de la figura 13, tenemos:
El peso molecular promedio numeral (Mn) puede ser obtenido a partir del DP calculado por RMN 1H y se escribe Mn(RMN). Lo anterior se conjunta en la siguiente ecuación:
donde PMmon es el peso molecular de la unidad repetitiva o monomérica de la poli(d,l-lactida) [−CO−CH(CH3)−O−] (72 g/mol), y PMalc es el peso molecular del coiniciador que está presente en el otro extremo de la cadena, siendo para el caso particular del alcohol bencílico 108 g/mol.Es necesario señalar que la obtención del DP también puede llevarse a cabo a partir de la señal d correspondiente del grupo fenil (C6H5) dentro del bencil; en este caso el valor de la integral fue de 2.12 y el número de protones que contribuyen para esta señal son 5. De lo anterior y utilizando las ecuaciones (1) y (2) se obtiene:
A partir de lo anterior se puede afirmar que existe una diferencia entre los valores de Mn calculados con ambos extremos; sin embargo, el valor obtenido utilizando el grupo fenil también está dentro de lo esperado debido a que se tiene un oligómero de PDLLA.
Para el experimento en el que no se adicionó un alcohol como iniciador (No. 3, tabla 1), el peso molecular promedio numeral (Mn) no puede determinarse por RMN debido a que la señal (a) del grupo terminal es indistinguible y el límite de detección por RMN para polímeros es de 20 000 g/mol. En este caso, para determinar el Mn de la muestra No. 3 se recomienda preferentemente otra técnica analítica llamada Cromatografía de Permeación en Gel (GPC), mediante la cual, además, se puede obtener el valor de polidispersidad (Mw/Mn), medición que no puede ser obtenida por RMN 1H.
10ConclusiónMediante la ruta de polimerización por apertura de anillo (ROP) de la d,l-lactida iniciada por 2-etilhexanoato de estaño (II) se pudo sintetizar en el laboratorio un poliéster con características degradables, como lo es la poli(d,l-lactida), con la obtención de buenos rendimientos (76-95%). Diferentes grupos terminales en el poliéster se pueden obtener a partir del uso de distintos coiniciadores (alcohol bencílico y 1-nonanol) en la reacción de polimerización. La adición de coiniciador al sistema de reacción se ve reflejado en un mayor número de especies activas tipo alcóxido de estaño que tiene como consecuencia el decremento del peso molecular promedio numeral (Mn). Mediante la caracterización del poliéster por resonancia magnética nuclear de protón (RMN 1H) se puede observar y caracterizar: 1) la repetición de la cadena polimérica y sus grupos terminales y 2) calcular el grado de polimerización DP para oligómeros, y consecuentemente su peso molecular promedio numeral, Mn(RMN) < 20000 g/mol.
El autor agradece muy especialmente al Sistema Nacional de Investigadores (SNI). Se agradece el apoyo parcial del PROMEP. Debido al poco apoyo de la Universidad del Papaloapan (UNPA), el financiamiento de los reactivos, disolventes y material de vidrio de este trabajo fue hecho con recursos personales del autor.












![Enantiómeros D-lactida y L-lactida [R = −C(=O)−CH(CH3)−)]. Se señalan con asteriscos los carbonos quirales, donde R y S indican configuración del centro quiral. Enantiómeros D-lactida y L-lactida [R = −C(=O)−CH(CH3)−)]. Se señalan con asteriscos los carbonos quirales, donde R y S indican configuración del centro quiral.](https://static.elsevier.es/multimedia/0187893X/0000002100000002/v1_201802080150/S0187893X1830168X/v1_201802080150/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![2-etilhexanoato de estaño (II) [Sn(Oct)2]. 2-etilhexanoato de estaño (II) [Sn(Oct)2].](https://static.elsevier.es/multimedia/0187893X/0000002100000002/v1_201802080150/S0187893X1830168X/v1_201802080150/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)