Los nódulos tiroideos (NT) en la edad pediátrica requieren una evaluación diagnóstica completa porque el riesgo de malignidad es mayor con más frecuencia que en el adulto. La ecografía es la técnica de imagen clave para decidir la actitud a seguir.
ObjetivosEvaluar con carácter inédito la utilidad y precisión de los criterios ecográficos definidos por el «Thyroid Imaging Reporting and Data System (EU-TIRADS) 2017» en adultos para estratificar el riesgo de malignidad en pacientes pediátricos con NT y establecer la indicación de la práctica de una punción aspiración con aguja fina (PAAF).
Pacientes y métodosSe revisaron las historias clínicas de 24 pacientes con NT atendidos en los últimos 15 años en un único centro. Cumplieron los criterios de inclusión establecidos 24 pacientes (31 nódulos; edad: 15,2 ± 2,2 años; 18 mujeres): PAAF con clasificación de Bethesda y ecografía con clasificación EU-TIRADS reevaluadas de forma retrospectiva. A 14 de ellos se les realizó una cirugía y se obtuvo el diagnóstico histológico definitivo, esto permitió llevar a cabo los cálculos de sensibilidad, especificidad y valores predictivo positivo y negativo de la clasificación EU-TIRADS y Bethesda.
ResultadosDel global de 31 nódulos, la distribución por categoría EU-TIRADS (T) fue: T1 (3,2%), T2: 2 (6,4%), T3: 7 (22,6%), T4: 16 (51,6%) y T5: 5 (16,1%). Todos los nódulos malignos estaban incluidos en la categoría EU-TIRADS 4 o 5. En contraste, 13 de los 25 nódulos benignos fueron integrados también en la categoría EU-TIRADS 4, y uno de ellos, en la 5. La distribución por categorías de la clasificación de Bethesda (B): B I: 6 (19,4%), BII: 14 (45,2%), BIII: 5 (16,1%), BIV: 2 (6,5%), BV: 0 y BVI: 4 (12,9%). El diagnóstico anatomopatológico de los 14 pacientes en los que se realizó la cirugía fue: seis carcinomas papilares y ocho con lesiones benignas; seis hiperplasias nodulares y dos adenomas foliculares. El porcentaje de malignidad fue del 42%. La sensibilidad de la clasificación EU-TIRADS para detectar nódulos malignos fue del 100%, la especificidad del 25%, el valor predictivo positivo (VPP) del 44% y el valor predictivo negativo (VPN) del 100%. La sensibilidad de la clasificación Bethesda para identificar nódulos malignos fue del 86%, la especificidad del 75%, VPP 67% y VPN 90%. El análisis del diámetro mayor de los nódulos no demostró diferencias estadísticamente significativas entre lesiones benignas y malignas.
ConclusionesLos criterios ecográficos en combinación con la historia clínica representan un método adecuado y reproducible para identificar nódulos malignos en la edad pediátrica. La ecografía es una prueba diagnóstica fiable para decidir qué nódulos serán candidatos a PAAF.
Thyroid nodule (TN) harboring a thyroid carcinoma are more common in pediatric than adult patients. In pediatric population, the evaluation of a TN should require specific pediatric tools for its diagnostic and therapeutic management. High-resolution ultrasonography and cytological evaluation after fine-needle aspiration biopsy (FNAB) remain the cornerstones of evaluation of TN.
ObjectivesTo evaluate in pediatric TN for the first time the usefulness and precision of the ultrasound criteria defined by the”Thyroid Imaging Reporting and Data System (EU-TIRADS) 2017 in adults” to establish the ultrasound indication for the practice of FNAB and stratify the risk of malignancy.
Patients and methods24 pediatric patients under age 18 years with thyroid nodules were attended in the last 15 years, 24 of them (31 nodules; age: 15.2 ± 2.2 years; 18 women) met the inclusion criteria: FNAB with Bethesda classification and ultrasound with EU-TIRADS score. EU-TIRADS score were evaluated retrospectively. Fourteen patients underwent surgery and the definitive histological diagnosis was obtained, this allowed the calculations of sensitivity, specificity and positive and negative predictive values of the EU-TIRADS and Bethesda classification. Data on the largest diameters of the nodules were collected.
ResultsOf the overall 31 nodules, the distribution by EU-TIRADS (T) category was: T1 (3.2%), T2: 2 (6.4%), T3: 7 (22.6%), T4: 16 (51.6%) and T5: 5 (16.1%). All malignant nodules were included in EU-TIRADS category 4 or 5. By the other hand, 13 of the 25 benign nodules were also included in the EU-TIRADS 4 category, and one in the 5. The distribution by categories of Bethesda's classification (B): BI: 6 (19.4%), BII: 14 (45.2%), BIII: 5 (16.1%), BIV: 2 (6.5%), BV: 0 and BVI: 4 (12.9%). The pathological diagnosis of the 14 patients who underwent surgery was: 6 papillary carcinomas and 8 with benign lesions: 6 nodular hyperplasia and 2 follicular adenoma. The percentage of malignancy was 42%. The sensitivity of the EU-TIRADS classification to detect malignant nodules was 100%, the specificity was 25%, PPV 44% and NPV 100%. The sensitivity of the Bethesda classification to detect malignant nodules was 86%, the specificity was 75%, PPV 67% and NPV 90%. The analysis of the largest diameter of the nodules did not show statistically significant differences between benign and malignant lesions.
ConclusionsEU-TIRADS for ultrasonographic criteria classification in combination with the clinical history is an adequate and reproducible method to estimate suspicion of malignancy of pediatric TN. It is also a reliable diagnostic tool to decide which nodules will be candidates for FNAB.
El hallazgo de un nódulo tiroideo (NT) en el paciente pediátrico obliga a un estudio minucioso, ya que con mayor frecuencia que en el adulto puede albergar un carcinoma diferenciado de tiroides (CDT)1.
La incidencia de NT en la edad pediátrica se sitúa entre el 1 al 1,5% y su frecuencia se incrementa con la edad, la historia familiar o el personal de patología tiroidea, antecedente de radioterapia y en portadores de ciertas mutaciones genéticas (RET, BRAF y DICER), entre otros2. La tasa de malignidad en las series pediátricas publicadas varía entre el 18 al 25% y llega a ser del 40% en pacientes expuestos a radioterapia3.
El CDT se considera un tumor raro en la infancia, aunque debe destacarse que, en los últimos años, su incidencia en la población pediátrica está aumentando un 1,1% anual4. Los carcinomas derivados de la célula folicular son los más frecuentes e incluyen el CDT, el carcinoma pobremente diferenciado y el anaplásico, aunque estos dos últimos son de presentación excepcional en pediatría. La suma de los tres supone más del 85 al 90% de los carcinomas tiroideos. A su vez, el CDT incluye el carcinoma papilar (75 a 80%) y el folicular (10%).
La ecografía y la evaluación citológica de las muestras obtenidas mediante punción aspiración con aguja fina (PAAF) son las piedras angulares del manejo diagnóstico y terapéutico del NT, junto con la presentación clínica y los antecedentes patológicos, particularmente, los relacionados con el desarrollo de otros tumores y tratamientos radioterápicos.
El reto de la ecografía es diferenciar los nódulos sospechosos de malignidad que van a requerir estudio citológico de los que solo van a necesitar un seguimiento clínico. Diversas sociedades científicas han intentado agrupar y estratificar el riesgo de malignidad del NT en una única clasificación para recomendar la punción y el análisis citológico. Una de las más conocidas es la Thyroid Imaging Reporting and Data System (TIRADS), en su versión americana (ACR-TIRADS) y la europea (EU-TIRADS), pero aún no existe una escala única para la población adulta5 y tampoco ha sido validada para la población pediátrica, aunque se han publicado algunos trabajos6,7. La escala TIRADS5, evalúa algunas características del nódulo como su estructura (sólida, quística o mixta) y ecogenicidad, además de los signos «clásicos» de malignidad (hipoecogenicidad, presencia de microcalcificaciones, forma más alta que ancha y regularidad de los márgenes), otorgando una puntuación que permite clasificar el NT en cinco categorías y les concede un riesgo esperado de malignidad 1: normal, 2: benigno, 3: riesgo bajo de malignidad, 4: riesgo intermedio de malignidad y 5: riesgo elevado de malignidad. En ambas versiones, la americana y la europea, la estratificación del riesgo por características ecográficas está puntuada y detallada, por lo que es fácilmente reproducible. La diferencia entre ambas radica en los diámetros de los nódulos susceptibles de punción, siendo la versión europea ligeramente más agresiva solamente en la categoría 3. EU-TIRADS recomienda la punción a partir de la categoría 3 cuando el nódulo tiene 20 mm de diámetro o más (ACR-TIRADS la sugiere a partir de 25 mm de diámetro), en la categoría 4 cuando es mayor de 15 mm y en la categoría 5 cuando es mayor de 10 mm. La PAAF no está indicada para las categorías 1 y 2, excepto cuando se realiza con fines terapéuticos. En nuestra práctica clínica, al tratarse de pacientes pediátricos que, con mayor frecuencia que en el adulto presentan CDT, utilizamos la clasificación EU-TIRADS y analizamos todos los nódulos tiroideos que son iguales o mayores de 20 mm y cumplen con los criterios de la categoría 3.
El sistema Bethesda para el diagnóstico citológico del NT es el más extendido y su objetivo es estandarizar el diagnóstico, adjudicando a cada una de las categorías un porcentaje esperado de malignidad, así como sugerencias en el manejo clínico y/o quirúrgico. Clasifica el material obtenido en la PAAF del NT en seis categorías diagnósticas; I: no diagnóstico, II: benigno, III: atipia de significado indeterminado, IV: neoplasia folicular, V: sospecha de malignidad y VI: maligno. No incluye recomendaciones específicas para la valoración de los nódulos pediátricos, así como tampoco porcentajes de malignidad esperada corregidos específicamente para niños6.
El objetivo de este trabajo ha sido evaluar, por primera vez en una muestra de pacientes pediátricos, la utilidad y la precisión de los criterios ecográficos definidos EU-TIRADS en el 2017 para pacientes adultos5 para: 1. Clasificar los nódulos en pacientes pediátricos por riesgo de malignidad. 2. Valorar dichos criterios EU-TIRADS como guía para la indicación de la evaluación citológica mediante PAAF en infantes con NT.
Pacientes y métodosEstudio retrospectivo de 24 pacientes pediátricos con NT atendidos en un hospital pediátrico universitario de tercer nivel en los últimos 15 años (2005 a 2020). Los criterios de inclusión fueron disponer de un estudio ecográfico y de un examen citológico obtenido por PAAF. Las ecografías tiroideas fueron reevaluadas de forma retrospectiva e independiente por dos radiólogos pediátricos y puntuadas según la clasificación EU-TIRADS, sin conocimiento del resultado del examen citológico. Las diferentes puntuaciones de cada radiólogo no variaron la categoria TIRADS de los nódulos y, por lo tanto, no influyeron en el manejo. Se recogieron los datos de los diámetros mayores de los nódulos medidos por ecografía para poder calcular su mediana y sus límites superior e inferior. Dado que la clasificación de Bethesda se implementó en nuestro centro en el 2012, las PAAF realizadas anteriormente se revisaron retrospectivamente y se les adjudicó una categoría diagnóstica. En los casos en los que se hubiera indicado la exéresis quirúrgica del NT, se recogió también el tipo de cirugía efectuada y el resultado anatomopatológico definitivo. La muestra final fue de 24 pacientes y 31 nódulos. Los nódulos no sometidos a cirugía (17/31) no se incluyeron en el análisis estadístico al no poder obtener la confirmación histológica, actualmente permanecen en seguimiento.
Todos los pacientes firmaron un consentimiento para poder participar en el estudio.
Los análisis estadísticos han sido realizados con el programa IBM SPSS Statistic v.20. Las variables categóricas se expresan como frecuencias absolutas y relativas; y las cuantitativas, mediante medias y desviación estándar o mediana y rango intercuartílico, según corresponda. Por otra parte, se evaluó el rendimiento diagnóstico del Bethesda y TIRADS vs. intervención quirúrgica para detectar la malignidad de los nódulos, mediante la estimación de los valores predictivos de sensibilidad, especificidad y de los valores predictivos positivo (VPP) y negativo (VPN). Para estos cálculos se analizaron únicamente los 14 casos sometidos a cirugía y de los que disponíamos de confirmación histológica, al considerarse esta la prueba definitiva. En total, se examinaron 19 ecografías y 19 PAAF (cinco pacientes tuvieron dos ecografías y dos PAAF). Se consideraron «sospechosos de malignidad o malignos» los nódulos con categorías EU-TIRADS 4 y 5 y aquellos con categorías Bethesda III y IV por ser consideradas indeterminadas y, por ello, subsidiarias a repetición de PAAF o cirugía y las categorías V y VI de Bethesda.
ResultadosEn los 24 pacientes analizados, la edad media fue de 15,3 ± 2,2 años. Fueron mujeres 18 casos (75%) y 19 pacientes (80%) eran postpuberales. Los motivos para indicar el estudio del NT fueron: hallazgo casual en el examen físico (10 pacientes, 42%), estudio de bocio (siete pacientes, 30%), antecedentes de radioterapia (cuatro pacientes, 16%), síndrome genético con predisposición a cáncer de tiroides (dos pacientes, 8%) y hallazgo ecográfico en el seguimiento de cirugía tiroidea previa (un paciente, 4%). En 14 casos se realizó exéresis del NT (10 tiroidectomías totales y cuatro hemitiroidectomías con istmectomía).
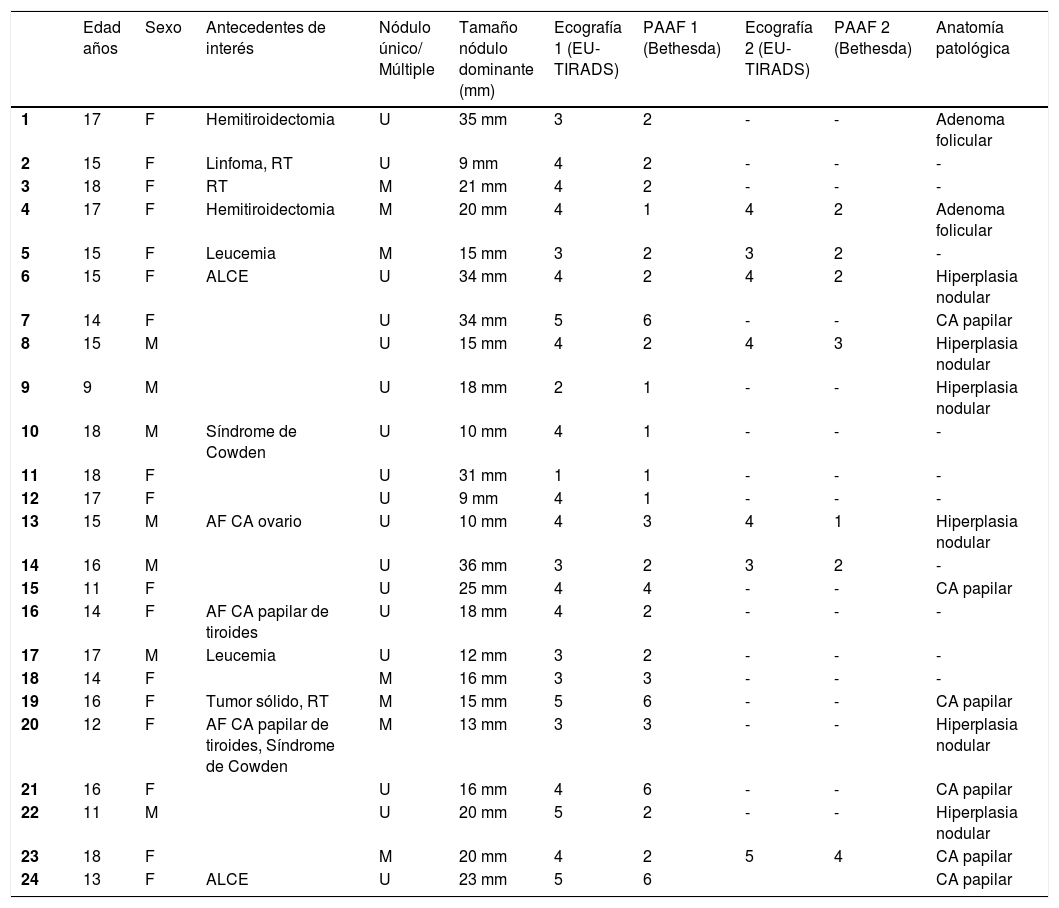
En la tabla 1 se describen las características clínicas de los 24 pacientes analizados (31 nódulos), la puntuación EU-TIRADS, la categoría Bethesda y el diagnóstico anatomopatológico de la pieza operatoria de 14 nódulos: seis carcinomas papilares y ocho con lesiones benignas (seis hiperplasias nodulares y dos adenomas foliculares).
Descripción de las características clínicas de los pacientes, puntuación EU-TIRADS, categoría Bethesda y del diagnóstico histológico definitivo
| Edad años | Sexo | Antecedentes de interés | Nódulo único/ Múltiple | Tamaño nódulo dominante (mm) | Ecografía 1 (EU-TIRADS) | PAAF 1 (Bethesda) | Ecografía 2 (EU-TIRADS) | PAAF 2 (Bethesda) | Anatomía patológica | |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 17 | F | Hemitiroidectomia | U | 35 mm | 3 | 2 | - | - | Adenoma folicular |
| 2 | 15 | F | Linfoma, RT | U | 9 mm | 4 | 2 | - | - | - |
| 3 | 18 | F | RT | M | 21 mm | 4 | 2 | - | - | - |
| 4 | 17 | F | Hemitiroidectomia | M | 20 mm | 4 | 1 | 4 | 2 | Adenoma folicular |
| 5 | 15 | F | Leucemia | M | 15 mm | 3 | 2 | 3 | 2 | - |
| 6 | 15 | F | ALCE | U | 34 mm | 4 | 2 | 4 | 2 | Hiperplasia nodular |
| 7 | 14 | F | U | 34 mm | 5 | 6 | - | - | CA papilar | |
| 8 | 15 | M | U | 15 mm | 4 | 2 | 4 | 3 | Hiperplasia nodular | |
| 9 | 9 | M | U | 18 mm | 2 | 1 | - | - | Hiperplasia nodular | |
| 10 | 18 | M | Síndrome de Cowden | U | 10 mm | 4 | 1 | - | - | - |
| 11 | 18 | F | U | 31 mm | 1 | 1 | - | - | - | |
| 12 | 17 | F | U | 9 mm | 4 | 1 | - | - | - | |
| 13 | 15 | M | AF CA ovario | U | 10 mm | 4 | 3 | 4 | 1 | Hiperplasia nodular |
| 14 | 16 | M | U | 36 mm | 3 | 2 | 3 | 2 | - | |
| 15 | 11 | F | U | 25 mm | 4 | 4 | - | - | CA papilar | |
| 16 | 14 | F | AF CA papilar de tiroides | U | 18 mm | 4 | 2 | - | - | - |
| 17 | 17 | M | Leucemia | U | 12 mm | 3 | 2 | - | - | - |
| 18 | 14 | F | M | 16 mm | 3 | 3 | - | - | - | |
| 19 | 16 | F | Tumor sólido, RT | M | 15 mm | 5 | 6 | - | - | CA papilar |
| 20 | 12 | F | AF CA papilar de tiroides, Síndrome de Cowden | M | 13 mm | 3 | 3 | - | - | Hiperplasia nodular |
| 21 | 16 | F | U | 16 mm | 4 | 6 | - | - | CA papilar | |
| 22 | 11 | M | U | 20 mm | 5 | 2 | - | - | Hiperplasia nodular | |
| 23 | 18 | F | M | 20 mm | 4 | 2 | 5 | 4 | CA papilar | |
| 24 | 13 | F | ALCE | U | 23 mm | 5 | 6 | CA papilar |
RT: radioterapia; AF: antecedentes familiares; CA: carcinoma; ALCE: presencia de adenopatías laterocervicales en la ecografía; M: masculino; F: femenino; U: nódulo único; M: nódulo múltiple.
Del global de 31 nódulos, la distribución por categoría EU-TIRADS (T) fue: T1 (3,2%), T2: 2 (6,4%), T3: 7 (22,6%), T4: 16 (51,6%) y T5: 5 (16,1%). Todos los nódulos malignos estaban incluidos en la categoría EU-TIRADS 4 o 5. Por contra, 13 de los 25 nódulos benignos fueron incluidos también en la categoría EU-TIRADS 4, y uno de ellos, en la 5. La distribución por categorías de la clasificación de Bethesda fue: B I: 6 (19,4%), BII: 14 (45,2%), BIII: 5 (16,1%), BIV: 2 (6,5%), BV: 0 y BVI: 4 (12,9%).
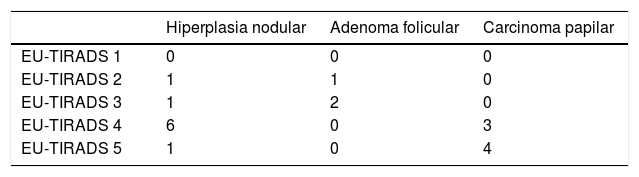
En las tablas 2a y 2b se describe la distribución por categorías EU-TIRADS y Bethesda y su correlación con el diagnóstico histológico de las 19 muestras (correspondientes a 14 nódulos) con diagnóstico histológico definitivo. El porcentaje de malignidad fue del 42% (se encontraron seis carcinomas papilares en 14 nódulos con resultado histológico definitivo).
La sensibilidad de la clasificación EU-TIRADS para detectar nódulos malignos fue del 100%, la especificidad del 25%, VPP 44% y VPN 100%. Los resultados se muestran en la tabla 3a. Todos los carcinomas papilares obtuvieron una puntuación en la clasificación EU-TIRADS de 4 o 5. Por el contrario, nueve ecografías de lesiones benignas también obtuvieron una puntuación en la clasificación EU-TIRADS de 4 y 5. Según los lineamientos EU-TIRADS, dos pacientes no cumplían criterios para PAAF, aunque se realizó igualmente por antecedentes de síndrome de Cowden (paciente 10) y radioterapia (paciente 19), ninguno de ellos fue un carcinoma.
Resultados de la clasificación EU-TIRADS versus diagnóstico histológico definitivo
| EU-TIRADS vs. diagnóstico definitivo | Maligno | Benigno |
|---|---|---|
| EU-TIRADS 4 y 5 | 7 | 9 |
| EU-TIRADS 1-3 | 0 | 3 |
Sensibilidad (S) = 100%, Especificidad (E) = 25%, Valor Predictivo Positivo (VPP) = 44% y Valor Predictivo Negativo (VPN) = 100%.
La sensibilidad de la clasificación Bethesda para detectar nódulos malignos fue del 86%, la especificidad del 75%, VPP 67% y VPN 90%. Los resultados se muestran en la tabla 3b. La tasa de malignidad para las categorías indeterminadas de Bethesda (III y IV) fue del 10,5% (2/19). Hubo un carcinoma papilar (paciente 23) que en la primera PAAF obtuvo una puntuación en la clasificación Bethesda de II, pero en la segunda PAAF ya alcanzó una valoración de Bethesda IV, por lo que también fue candidato a cirugía.
Resultados la clasificación de Bethesda versus diagnóstico histológico definitivo
| Bethesda vs diagnóstico definitivo | Maligno | Benigno |
|---|---|---|
| Bethesda III-VI | 6 (2 BIII-IV; 4 BVI) | 3 |
| Bethesda I-II | 1 | 9 |
Sensibilidad (S) = 86%, Especificidad (E) = 75%, Valor Predictivo Positivo (VPP) = 67% y Valor Predictivo Negativo (VPN) = 90%.
En cuanto al diámetro mayor medido por ecografía de los nódulos, los límites superior e inferior fueron 9 y 36 mm, respectivamente y la mediana 18 mm. Los límites superior e inferior de los seis carcinomas papilares fueron 15 y 34 mm y la mediana 21,5 mm. Los límites superior e inferior de las ocho lesiones benignas fueron 10 y 35 mm y la mediana 20 mm. El análisis del diámetro mayor de los nódulos no demostró diferencias estadísticamente significativas entre lesiones benignas y malignas.
DiscusiónLa evaluación inicial de un NT clínicamente evidente o descubierto de forma incidental incluye una ecografía cervical y la evaluación de los factores de riesgo clínicos. En función de los resultados, se indicará el uso de otros instrumentos de diagnóstico, como la PAAF, para la obtención de citología y, eventualmente, el estudio molecular de las muestras con citologías indeterminadas mediante paneles moleculares de secuenciación masiva que incluyen la mayoría de variantes genéticas implicadas en el cáncer de tiroides.
El reto de la ecografía es identificar los nódulos sospechosos de malignidad que van a requerir estudio citológico de los que solo van a necesitar un seguimiento exclusivamente clínico. Hasta la publicación de las últimas guías pediátricas7 el manejo del CDT en niños se hacía extrapolando las guías para adultos, como las de la American Thyroid Association (ATA)8. No obstante, la presentación clínica y el comportamiento del CDT del niño difieren del CDT del adulto, con presencia de nódulos de mayor volumen, invasión más temprana de la cápsula, mayor extensión y afectación de ganglios linfáticos y metástasis pulmonares. Los pacientes pediátricos presentan mejor respuesta al tratamiento y mejor tasa de supervivencia a medio y largo plazo, por lo cual, las secuelas a largo plazo de los tratamientos cobran mayor importancia9,10.
En nuestra serie de pacientes pediátricos con NT, aunque se trata de una muestra reducida con solo 31 nódulos, se puede inferir que el uso de los criterios ecográficos de EU-TIRADS identificó con una alta sensibilidad los nódulos malignos, pero fue menos eficaz para discriminar los benignos. En nuestra muestra, dichos criterios nos hubieran permitido diagnosticar a los seis pacientes con carcinoma papilar, ya que cuatro de ellos se clasificaron como T5 y los otros dos como T4. Todos ellos hubieran sido subsidiarios de PAAF y ninguno hubiera quedado sin diagnosticar. [0]
Nuestros resultados son similares a los comunicados por Lim-Dunham et al.7 en el que solo un nódulo maligno obtuvo una puntuación TIRADS inferior a 4. Por el contrario, el estudio de Richman et al.11 en una amplia serie de pacientes pediátricos estima que el 22% de los nódulos malignos (17 de 77) hubieran quedado sin diagnosticar. Ambos estudios7,11 siguieron la versión americana ACR-TIRADS. En relación con los nódulos benignos, 3/8 (37,5%) obtuvieron una puntuación EU-TIRADS inferior o igual a 3, el resto obtuvieron una puntuación EU-TIRADS entre 4 y 5, lo que hubiera llevado a realizar una PAAF y se habría obtenido un resultado histológico benigno, haciendo innecesaria la punción. Los resultados son similares a los de Lim-Dunham et al.7 (35%) y Martínez-Rios et al.12 (82%). En cuanto al tamaño de los nódulos, nuestro estudio no aporta datos para un cambio en el manejo de los nódulos pediátricos.
A diferencia de los estudios de Richman et al.11 y Dinauer13, donde nódulos de gran tamaño (40 mm) y categorías TIRADS bajas (escala ACR-TIRADS) obtuvieron resultados falsos-negativos en la citología, ninguno de nuestros nódulos benigno ni maligno mostró un resultado falso negativo, tan solo hubo un carcinoma papilar que en la primera PAAF obtuvo una puntuación en la clasificación Bethesda de II, pero en la segunda PAAF ya alcanzó una puntuación de Bethesda IV, por lo que también fue candidato a cirugía. Sin embargo y en concordancia con los demás estudios11,14 consideramos que en la estratificación del nivel del riesgo del nódulo pediátrico debe realizarse un seguimiento estrecho de todos los nódulos, incluso los más pequeños (10 mm) e individualizar en cada paciente.
Hemos considerado no evaluables los nódulos a los que solo se les realizó seguimiento clínico sin cirugía, al no disponer de dictamen anatomopatológico. Esta particularidad puede justificar las diferencias observadas en relación con otros estudios15,16, en los que se consideran benignos si no se observan cambios significativos en su seguimiento a medio plazo (dos años). Somos conscientes de que esta decisión puede introducir un sesgo en nuestro estudio, ya que los criterios quirúrgicos pueden recoger otros signos de alarma, pero consideramos que se trata de la opción más académica al poder comparar las pruebas diagnósticas evaluadas con un examen histológico definitivo.
Nuestro estudio pone de manifiesto que la clasificación de Bethesda es altamente confiable en las categorías V-VI y en sus categorías indeterminadas (BIII-IV) debe considerarse el abordaje quirúrgico o la repetición de la PAAF, ya que la tasa de malignidad esperada en la población pediátrica es superior a la del adulto9. En nuestra muestra los seis carcinomas papilares hubieran sido subsidiarios de cirugía, pues cuatro obtuvieron un Bethesda VI y 2 un Bethesda IV. El porcentaje de citologías con dictamen indeterminado en nuestra serie es del 22,6% (del global de 31 nódulos) y similar a la reportada en otras series pediátricas o de adultos17,18. El problema radica en diferenciar cuáles de esos nódulos son benignos y pueden seguirse en el tiempo, y cuáles de ellos son malignos y requieren cirugía. El uso complementario de paneles moleculares junto con la citología ha sido, de momento, la única herramienta que parece ayudar en este difícil escenario19. Faltan, a día de hoy, nuevos estudios, especialmente en la edad pediátrica20, que calibren definitivamente su utilidad real en la práctica clínica, en los costes y en la calidad de vida de los pacientes, así como recomendaciones acerca del seguimiento a largo plazo o la necesidad de reevaluación citológica/molecular de estos pacientes19.
Un 20% de nuestras muestras obtuvieron una clasificación de Bethesda I que por definición es no diagnóstica, el porcentaje es similar al de otras series publicadas21. El porcentaje de Bethesda I es muy variable en las series pediátricas publicadas (5,5-20%)21. Una de las razones de este elevado porcentaje podría ser que no se realiza la evaluación «in situ», conocida por Rapid On Site Evaluation (ROSE). En nuestra serie, en los casos más antiguos no se realizó este procedimiento y esta podría ser la razón de este elevado porcentaje de muestras no diagnósticas.
En conclusión, nuestro trabajo pone de relieve que los criterios ecográficos de la escala EU-TIRADS representan un método adecuado y reproducible para estimar el nivel de sospecha de malignidad de los nódulos tiroideos pediátricos. En nuestro estudio ha demostrado ser una buena herramienta para discriminar los nódulos malignos, pero no tan eficaz para discriminar los benignos. Entre las limitaciones de nuestro trabajo, hacemos referencia a que se trata de un estudio retrospectivo, aunque las otras investigaciones mencionadas también lo son, y el reducido número de nódulos evaluados en la muestra. No obstante, creemos que la valoración de un NT en pacientes pediátricos debería contar con herramientas pediátricas más específicas para su manejo diagnóstico y terapéutico.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.