El radioyodo (131I) constituye una modalidad establecida de tratamiento definitivo del hipertiroidismo. A pesar de la vasta experiencia existente, persisten varios aspectos por clarificar, como qué tipo de dosis emplear, ¿fijas o calculadas? El objetivo del estudio fue determinar si se podría mejorar la eficacia de este tratamiento implementando un método simple de cálculo dosimétrico que incluyera la estimación ecográfica del volumen tiroideo y una medida única de captación de 131I (24h).
MétodosDiseñamos un estudio prospectivo de no inferioridad comparando entre dos modalidades de cálculo de la actividad de radioyodo: el método de dosis «semifijas» (A) y el de dosis «calculadas» (B). El primero consistió en escaladas de actividad (peldaños de 185MBq) teniendo en cuenta: etiología del hipertiroidismo, captación de 131I y objetivo terapéutico. El segundo se basó en el concepto de «compromiso dosimétrico», considerando como únicos factores la captación y el volumen tiroideos, empleando una vida media estándar de 5,5días. La dosis absorbida diana fue 150Gy, aunque tras un análisis preliminar (100 primeros casos) se aumentó a 200Gy en los bocios difusos tóxicos (BDT).
ResultadosSe incluyeron 212 pacientes. El métodoB resultó al menos igual de eficaz en cuanto al resultado final y funcional, con tendencia a más éxitos y menos hipotiroidismo. Además, las actividades administradas fueron significativamente menores.
ConclusiónEn la terapia con radioyodo del hipertiroidismo se pudo implementar un método dosimétrico sencillo que proporcionó resultados al menos iguales a los de un método basado en dosis fijas, con actividades administradas inferiores.
Radioiodine (131I) is an established modality of definitive treatment of hyperthyroidism. In spite of the vast experience available, there are still several aspects to be clarified, such as whether fixed or calculated doses should be used. The aim of this study was to assess whether efficacy of this treatment could be improved by implementing a simple dosimetric calculation method including ultrasonographic estimation of thyroid volume and a single measurement of 24-hour 131I thyroid uptake.
MethodsA prospective non-inferiority study was designed to compare two procedures to calculate radioiodine activity: the «semi-fixed» dose method (A), and the «calculated» dose method (B). The first consisted of activity escalation (185MBq steps) based on etiology of hyperthyroidism, 131I uptake, and treatment objective. The second method was based on the «dosimetric compromise» concept, considering 24-hour uptake and thyroid volume as the only factors and using a standard half-life of 5.5 days. The target absorbed dose was 150Gy, but after a preliminary analysis (first 100 cases) it was increased to 200Gy in diffuse toxic goiters (DTGs).
ResultsA total of 212 patients were included. MethodB was at least as effective in terms of final and functional outcome, with a trend to more success and less hypothyroidism. In addition, activities administered were significantly lower.
ConclusionIn radioiodine therapy of hyperthyroidism, a simple dosimetric method that provided results at least equal to those of a fixed dose-based method, with lower administered activities, could be implemented.
El hipertiroidismo es un trastorno endocrino cuya manifestación más peligrosa es la taquiarritmia en forma de fibrilación auricular. Es importante mejorar rápidamente sus síntomas y disminuir la sobreproducción de hormonas tiroideas. Además de la habitual aproximación inicial en base a fármacos antitiroideos, es muy frecuente el requerimiento de una solución definitiva.
El radioyodo, o yodo-131 (131I), se viene utilizando desde los años cuarenta en el tratamiento de patología tiroidea tanto benigna como maligna1-4, y es considerado, junto con la cirugía, una modalidad de tratamiento definitivo en las principales patologías causantes de hipertiroidismo: enfermedad de Graves-Basedow (EGB) y bocios nodulares tóxicos5,6. Su eficacia es muy alta y depende básicamente del tipo de trastorno, del tamaño tiroideo y de la actividad de 131I administrada.
El principal problema inherente al tratamiento es que una tasa máxima de curación conlleva inevitablemente una mayor tasa de hipotiroidismo. El objetivo ideal sería restaurar el eutiroidismo, con la posible excepción del tratamiento «definitivo» de la EGB (la mayor tendencia a la recaída del hipertiroidismo autoinmune podría hacer aconsejable la «ablación»).
A pesar de la vasta experiencia existente, persisten varios aspectos por clarificar: ¿debe primar la remisión del hipertiroidismo con un solo tratamiento, aun a costa de ocasionar/precipitar hipotiroidismo? ¿Deben emplearse actividades bajas o altas? ¿Qué factores influyen en el resultado? ¿Es posible contemplarlos todos al planificar la terapia con radioyodo? La cuestión más en boga hoy día es qué tipo de dosis deben emplearse: ¿fijas o calculadas?
La forma clásica, y todavía más frecuente, de administrar el tratamiento es en base a las llamadas «dosis fijas»: rango de actividades que la experiencia de años ha llevado a considerar como las idóneas. Las guías británicas todavía defienden esta estrategia sencilla7. Sin embargo, en los últimos años, y de la mano de normativas más estrictas en cuanto a la exposición a la radiación8 y de los principios básicos de radioprotección (como el principio ALARA [As Low As Reasonably Achievable]), la mayoría de guías actuales recomiendan el empleo de «dosis calculadas». Las variables que deben introducirse para el cálculo de las actividades necesarias para una terapia «personalizada» son fundamentalmente la medida de la/s captación/es tiroidea/s y el tamaño del tejido diana. Una mayor precisión en la dosis absorbida real implica una cantidad importante de medidas preterapéuticas y posterapéuticas de captación de radioyodo, lo que resta sencillez y funcionalidad al tratamiento.
Nuestra hipótesis de trabajo fue que se podría mejorar la eficacia del tratamiento con radioyodo del hipertiroidismo implementando un método simple de cálculo dosimétrico que incluyera la estimación ecográfica del volumen tiroideo y una medida única de captación tiroidea de 131I a las 24h. El objetivo final era implementar un método de cálculo individual de la actividad de 131I al menos igual de eficaz que el que veníamos utilizando, una variante ponderada de los de dosis fijas (que llamamos de dosis «semifijas»).
Pretendíamos comparar de forma prospectiva ambos métodos en cuanto a tasa de éxitos (estado no hipertiroideo) y resultados funcionales (proporción de hipotiroidismos); valorar si se lograba con actividades de 131I inferiores (menos irradiación total al paciente), y estudiar la dependencia del tipo de patología hipertiroidea en los resultados.
Material y métodoEn marzo de 2010 iniciamos un estudio prospectivo comparativo entre dos modalidades de estimación de la actividad del radioyodo en el tratamiento del hipertiroidismo. Diseñamos un estudio prospectivo de no inferioridad según el cual a los 50 primeros pacientes hipertiroideos consecutivos remitidos para terapia con 131I se les aplicaría el primer método, de dosis «semifijas» —a partir de ahora, métodoA—, y a los 50 siguientes el método dosimétrico o de dosis «calculadas» —método B—. La idea era realizar un análisis preliminar de los primeros 100 pacientes para comprobar la no inferioridad y calibrar la necesidad de hacer ajustes en el métodoB.
PacientesSe incluyeron todos los pacientes recibidos entre marzo de 2010 y mayo de 2014. Debían poder completar el estudio inicial y no cumplir ningún criterio de exclusión.
No contemplamos pacientes eutiroideos referidos para terapia con radioyodo para disminuir el volumen glandular. También constituyeron criterios de exclusión las contraindicaciones absolutas recogidas en las guías de la European Association of Nuclear Medicine (EANM): embarazo y lactancia.
Sin embargo, sí consideramos candidatos a los enfermos con oftalmopatía tiroidea consensuados con su médico de referencia, siempre con profilaxis corticoidea.
Se instaba a suspender la medicación antitiroidea 5días antes de la prueba de captación, y se aconsejaba restringir la toma de otros fármacos que pudieran interferir en la incorporación del radioyodo al tiroides y seguir una dieta baja en yodo.
El primer día el paciente era visto en consulta y, tras firmar el consentimiento informado, procedíamos con las pruebas complementarias necesarias. El segundo día se completaba el procedimiento de medición de la captación de 131I, se citaba al paciente para el tratamiento, recomendando seguir sin medicación antitiroidea (y con la dieta), si este iba a ser cercano, o reiniciar la misma y discontinuarla después al menos 5días, si no pudiera tratarse al paciente la semana siguiente. También se procedía a la asignación de actividades y/o al cálculo de las mismas.
Pruebas complementariasGammagrafía de tiroidesSe inyectaban 185MBq (5mCi) de 99mTc-pertecnetato y se adquiría imagen centrada en región cervicotorácica en proyección anterior a los 10-15min. Solo utilizamos la gammagrafía para su análisis visual, pero no para hacer cálculos de captación ni estimaciones del tamaño glandular o del tejido tiroideo funcionante.
Los resultados de la misma podían modificar la actitud terapéutica en dos casos:
- –
Imagen de nódulo «caliente» de comportamiento autónomo en pacientes remitidos como bocio multinodular. Pasaban a catalogarse como «nódulo autónomo tóxico» (NAT).
- –
Nódulos «fríos» no estudiados previamente. Eran remitidos al médico de referencia para su valoración ecográfica y posible punción aspiración con aguja fina (PAAF) ecoguiada, si existiera componente sólido o imagen sospechosa9.
El día 1 se administraba una dosis oral de 3,7MBq (100μCi) de 131I, disuelta en agua. El día2 se procedía a su cálculo. Utilizamos la sonda CAPTUS 2000 (Capintec®) para realizar las mediciones necesarias, habiendo prefijado como parámetros principales: radioisótopo 131I, en forma líquida, contajes de 300segundos y distancia de 30cm.
Ecografía de tiroidesSe adquiría colocando al paciente en decúbito supino con hiperextensión del cuello. Se utilizaba un ecógrafo con una sonda lineal de alta frecuencia, 7-15MHz, acompañada de gel transductor soluble. Se determinaba el volumen de cada uno de los lóbulos y el total tiroideo en mililitros, haciendo barridos longitudinales y trasversales, empleando la fórmula de Brunn10, que considera el volumen del istmo despreciable. Se asume que cada uno de los lóbulos es un elipsoide, de tal modo que:
Volumen del lóbulo (ml)=diámetro transverso×longitudinal×anteroposterior (cm)×π/6
Volumen total=volumen derecho + volumen izquierdo
Asignación de actividadesMétodo ABasado en escaladas de actividad en peldaños de 185MBq (5mCi). Sus características principales eran las siguientes:
- •
Criterios de dosificación (actividades):
- ∘
Bocio difuso tóxico (BDT): 185/370/550MBq (5/10/15mCi).
- ∘
NAT: 370/550/740MBq (10/15/20mCi).
- ∘
Bocio multinodular tóxico (BMT): 550/740/925MBq (15/20/25mCi).
- •
Estos niveles de actividad dentro de cada patología se asignaban en función de la captación tiroidea calculada:
- ∘
>50%: primer nivel (la actividad menor).
- ∘
25-50%: segundo nivel (actividad intermedia).
- ∘
<25%: tercer nivel (la actividad mayor).
- •
Además se consideraba el objetivo terapéutico: se ascendía un nivel del anterior esquema (+185MBq), siempre que por criterios clínicos prevaleciera la eficacia en una dosis única frente al efecto secundario del hipotiroidismo.
- •
Por tanto, la actividad mínima que administrábamos era de 185MBq (5mCi) y la máxima, de 1,11GBq (30mCi).
Asumimos el concepto de «compromiso dosimétrico»11; el volumen diana no es el tejido autónomo (difícil de determinar con precisión), sino toda la glándula. En un intento de que prevaleciera la sencillez, adoptamos como únicos factores la captación de 131I a las 24h y el volumen tiroideo. La actividad a administrar se calculaba a través del algoritmo de Marinelli12,13:
Actividad de 131I (MBq)=(dosis diana×volumen tiroideo) / (0,04×capt 24h 131I×T1/2)
- •
La dosis diana fue de 150Gy para al menos los 50 primeros pacientes, con la posibilidad de tener que cambiarla en la segunda fase del estudio en función de la patología causante del hipertiroidismo.
- •
El volumen tiroideo lo medimos con ecografía, pues es la prueba, sencilla y económica, con mejor correlación con la resonancia magnética, el gold standard.
- •
Además, al hacer una única determinación de la captación de 131I era necesario utilizar una vida media estándar para el radioyodo (5,5días).
Se decidió, con fines comparativos y por temas de protección radiológica, adoptar los mismos límites de actividad que en el métodoA: actividad mínima 185MBq y máxima 1,11GBq. Esto quiere decir que si la actividad calculada era <185MBq, asignábamos 185MBq, y si era >1,11GBq, asignábamos 1,11GBq.
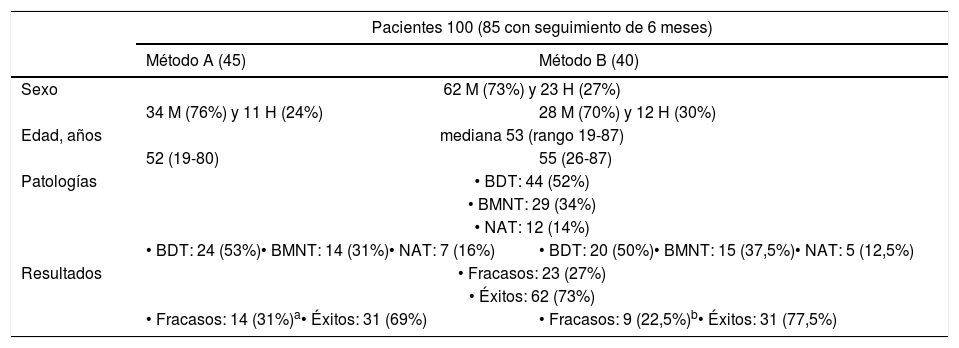
A raíz del análisis preliminar de los 100 primeros pacientes tratados (50 por cada método) (tabla 1) se decidió aumentar la dosis diana a 200Gy en el BDT14.
Características de la población del análisis preliminar
| Pacientes 100 (85 con seguimiento de 6 meses) | ||
|---|---|---|
| Método A (45) | Método B (40) | |
| Sexo | 62 M (73%) y 23 H (27%) | |
| 34 M (76%) y 11 H (24%) | 28 M (70%) y 12 H (30%) | |
| Edad, años | mediana 53 (rango 19-87) | |
| 52 (19-80) | 55 (26-87) | |
| Patologías | • BDT: 44 (52%) | |
| • BMNT: 29 (34%) | ||
| • NAT: 12 (14%) | ||
| • BDT: 24 (53%)• BMNT: 14 (31%)• NAT: 7 (16%) | • BDT: 20 (50%)• BMNT: 15 (37,5%)• NAT: 5 (12,5%) | |
| Resultados | • Fracasos: 23 (27%) | |
| • Éxitos: 62 (73%) | ||
| • Fracasos: 14 (31%)a• Éxitos: 31 (69%) | • Fracasos: 9 (22,5%)b• Éxitos: 31 (77,5%) | |
El día del tratamiento el paciente debía acudir en ayunas (al menos 4h). En mujeres en edad fértil se obtenía un test de gestación. El paciente permanecía ingresado 24h, pues así se concertó con el servicio de protección radiológica.
Al alta, era instruido en cuanto a medicación y seguimiento. Se recomendaba reintroducir la medicación antitiroidea a los 5días y seguir una pauta descendente de la misma durante 3semanas (disminuyendo la dosis semanalmente).
El seguimiento se basó en los resultados de las analíticas de perfil tiroideo a los 3, 6 y 12meses del tratamiento con radioyodo. En caso de aparecer clínica de hipotiroidismo o hipertiroidismo antes de las fechas fijadas para los análisis y consulta, se recomendaba adelantarlas.
Se consideró «éxito» la ausencia de hipertiroidismo y «fracaso» al hipertiroidismo persistente (incluido el subclínico).
Análisis estadísticoUtilizamos el software RStudio versión 0.98.1091, realizándose análisis de comparación de medias. La variable principal (éxito o fracaso) es una variable dicotómica que no se distribuye normalmente, con lo que fue necesario aplicar el test de Wilcoxon-Man-Whitney.
Para estudiar si el tipo de dosificación suministraba una cantidad de medicamento menor en el caso del métodoB frente alA, la variable estudiada (actividad administrada) es una variable cuantitativa continua, por lo que se utilizó otro test estadístico para la comparación de medias. Se realizó previamente un test de comparación de varianzas y normalidad de la variable (test de Kolmogorov-Smirnov), a fin de posteriormente aplicar el test de Student (si las varianzas fueran iguales) o el test de Welch (si fueran distintas).
Los valores de p<0,05 se consideraron estadísticamente significativos.
ResultadosEntre el 3 de marzo de 2010 y el 26 de mayo de 2014 tratamos a un total de 221 pacientes hipertiroideos con radioyodo en nuestro servicio. Se excluyeron 9 pacientes, en los que usamos dosis fijas al no poder realizarse la medida de captación (por falta de disponibilidad del paciente). Por tanto, la población de estudio estaba constituida por 212 enfermos. En cuanto al resultado final y funcional, solo se pudo valorar en 179 pacientes (en 33 casos no se pudo establecer por seguimiento insuficiente o pérdida del mismo).
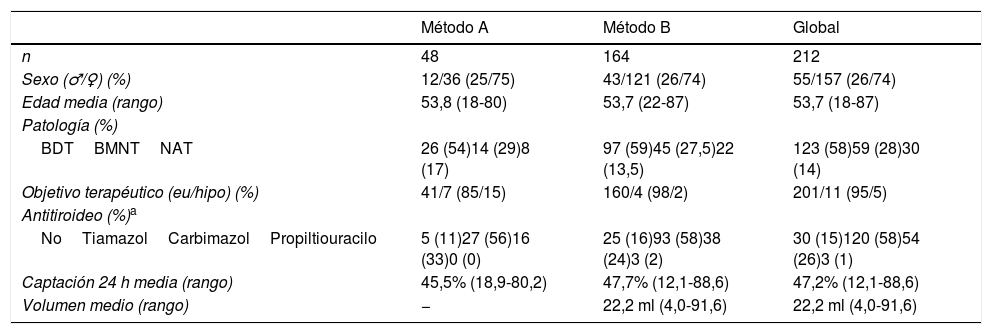
Las principales características de la población se muestran en la tabla 2, y no se aprecian grandes diferencias entre los tratados por uno u otro método.
Principales características de los pacientes
| Método A | Método B | Global | |
|---|---|---|---|
| n | 48 | 164 | 212 |
| Sexo (♂/♀) (%) | 12/36 (25/75) | 43/121 (26/74) | 55/157 (26/74) |
| Edad media (rango) | 53,8 (18-80) | 53,7 (22-87) | 53,7 (18-87) |
| Patología (%) | |||
| BDTBMNTNAT | 26 (54)14 (29)8 (17) | 97 (59)45 (27,5)22 (13,5) | 123 (58)59 (28)30 (14) |
| Objetivo terapéutico (eu/hipo) (%) | 41/7 (85/15) | 160/4 (98/2) | 201/11 (95/5) |
| Antitiroideo (%)a | |||
| NoTiamazolCarbimazolPropiltiouracilo | 5 (11)27 (56)16 (33)0 (0) | 25 (16)93 (58)38 (24)3 (2) | 30 (15)120 (58)54 (26)3 (1) |
| Captación 24 h media (rango) | 45,5% (18,9-80,2) | 47,7% (12,1-88,6) | 47,2% (12,1-88,6) |
| Volumen medio (rango) | − | 22,2 ml (4,0-91,6) | 22,2 ml (4,0-91,6) |
BDT: bocio difuso tóxico; BMNT: bocio multinodular tóxico; NAT: adenoma tóxico.
Las mujeres representaron casi 3/4 del total; la edad media fue de 53,7años (rango: 18-87). La patología más frecuente fue la EGB, mientras que entre la patología nodular el bocio multinodular era predominante. Solo en 11 enfermos (5%) el objetivo terapéutico fue el hipotiroidismo.
La captación de 131I a las 24h y el volumen tiroideo estimado ecográficamente eran dos variables necesarias para el cálculo de la actividad en el método dosimétrico. Además, la captación también se requería para la asignación de actividades en el métodoA. Así, dispusimos de datos de la primera para el total de pacientes (212), pero de la segunda solo en los del métodoB (163). Respecto al tamaño del tiroides, a pesar de algunos valores extremos (4-91,6ml), en nuestra población las glándulas tiroideas por lo general no eran grandes (22,25±15,92ml) (tabla 2).
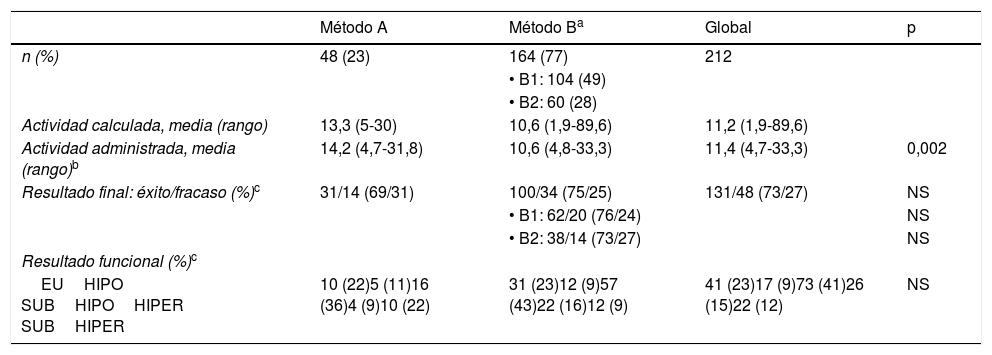
Resultados según el método de cálculoDe los 212 pacientes, 48 recibieron su tratamiento según el métodoA y el resto (164) por elB, de los cuales 104 (49% del total) tenían como dosis absorbida tiroidea objetivo 150Gy (B1) y 60 (28%; todos con EGB) 200Gy (B2). En la tabla 3 se recogen las actividades calculadas y realmente administradas y los resultados obtenidos con cada método.
Resultados en función del método de cálculo
| Método A | Método Ba | Global | p | |
|---|---|---|---|---|
| n (%) | 48 (23) | 164 (77) | 212 | |
| • B1: 104 (49) | ||||
| • B2: 60 (28) | ||||
| Actividad calculada, media (rango) | 13,3 (5-30) | 10,6 (1,9-89,6) | 11,2 (1,9-89,6) | |
| Actividad administrada, media (rango)b | 14,2 (4,7-31,8) | 10,6 (4,8-33,3) | 11,4 (4,7-33,3) | 0,002 |
| Resultado final: éxito/fracaso (%)c | 31/14 (69/31) | 100/34 (75/25) | 131/48 (73/27) | NS |
| • B1: 62/20 (76/24) | NS | |||
| • B2: 38/14 (73/27) | NS | |||
| Resultado funcional (%)c | ||||
| EUHIPO SUBHIPOHIPER SUBHIPER | 10 (22)5 (11)16 (36)4 (9)10 (22) | 31 (23)12 (9)57 (43)22 (16)12 (9) | 41 (23)17 (9)73 (41)26 (15)22 (12) | NS |
La actividad calculada fue 11,21±9,17mCi (rango: 1,9-89,6mCi). La actividad media administrada con el métodoA fue de 14,16mCi, vs. 10,55mCi con elB. Tras comprobar, con el test de Kolmogorov-Smirnov, que la variable «actividad administrada» satisfacía la hipótesis de normalidad, se aplicó el test de igualdad de medias de Student, obteniendo una p=0,002; por tanto, la actividad administrada con el métodoB fue significativamente menor a la delA.
El resultado fue exitoso en 131 de los 179 pacientes evaluados (73%) y fracasó (hipertiroidismo persistente) en 48 (27%). En la tabla 3 se puede apreciar el mayor porcentaje de éxitos con el métodoB que con elA, aunque sin una p significativa.
La tabla 3 también muestra la destacada proporción de hipotiroidismos resultantes, independientemente del método de asignación de dosis: superior al número de eutiroidismos, incluso aunque sumáramos los hipotiroidismos subclínicos. Dentro del grupo de fracasos al tratamiento, en los pacientes tratados con el métodoA predominaron los hipertiroidismos francos, mientras que con el métodoB, los subclínicos. Desde el punto de vista funcional tampoco se hallaron diferencias significativas.
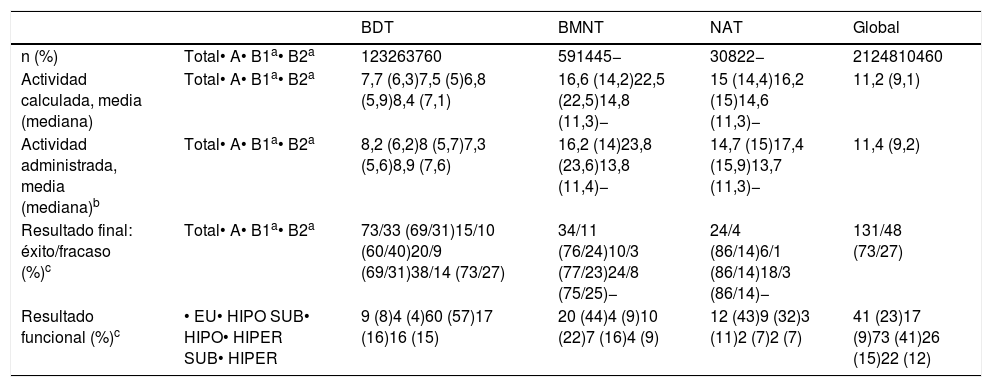
Resultados en función de la patología causalDel total de pacientes incluidos, el 58% tenían BDT, el 28% BMT y el 14% NAT. La tabla 4 recoge las actividades de 131I y los resultados del tratamiento en cada tipo de patología.
Resultados por patologías
| BDT | BMNT | NAT | Global | ||
|---|---|---|---|---|---|
| n (%) | Total• A• B1a• B2a | 123263760 | 591445− | 30822− | 2124810460 |
| Actividad calculada, media (mediana) | Total• A• B1a• B2a | 7,7 (6,3)7,5 (5)6,8 (5,9)8,4 (7,1) | 16,6 (14,2)22,5 (22,5)14,8 (11,3)− | 15 (14,4)16,2 (15)14,6 (11,3)− | 11,2 (9,1) |
| Actividad administrada, media (mediana)b | Total• A• B1a• B2a | 8,2 (6,2)8 (5,7)7,3 (5,6)8,9 (7,6) | 16,2 (14)23,8 (23,6)13,8 (11,4)− | 14,7 (15)17,4 (15,9)13,7 (11,3)− | 11,4 (9,2) |
| Resultado final: éxito/fracaso (%)c | Total• A• B1a• B2a | 73/33 (69/31)15/10 (60/40)20/9 (69/31)38/14 (73/27) | 34/11 (76/24)10/3 (77/23)24/8 (75/25)− | 24/4 (86/14)6/1 (86/14)18/3 (86/14)− | 131/48 (73/27) |
| Resultado funcional (%)c | • EU• HIPO SUB• HIPO• HIPER SUB• HIPER | 9 (8)4 (4)60 (57)17 (16)16 (15) | 20 (44)4 (9)10 (22)7 (16)4 (9) | 12 (43)9 (32)3 (11)2 (7)2 (7) | 41 (23)17 (9)73 (41)26 (15)22 (12) |
El resultado final y funcional se aplica a los 179 pacientes con seguimiento suficiente. BDT: bocio difuso tóxico; BMNT: bocio multinodular tóxico; EU: eutiroidismo; HIPO SUB: hipotiroidismo subclínico; HIPO: hipotiroidismo; HIPER SUB: hipertiroidismo subclínico; HIPER: hipertiroidismo; NAT: adenoma tóxico.
Las actividades medias administradas fueron 8,2, 16,2 y 14,7mCi en BDT, BMT y NAT, respectivamente. Las mayores diferencias entre las actividades administradas según el métodoA oB se dieron en los bocios nodulares, en especial en el BMT (media 23,8 versus 13,8mCi, A vs.B).
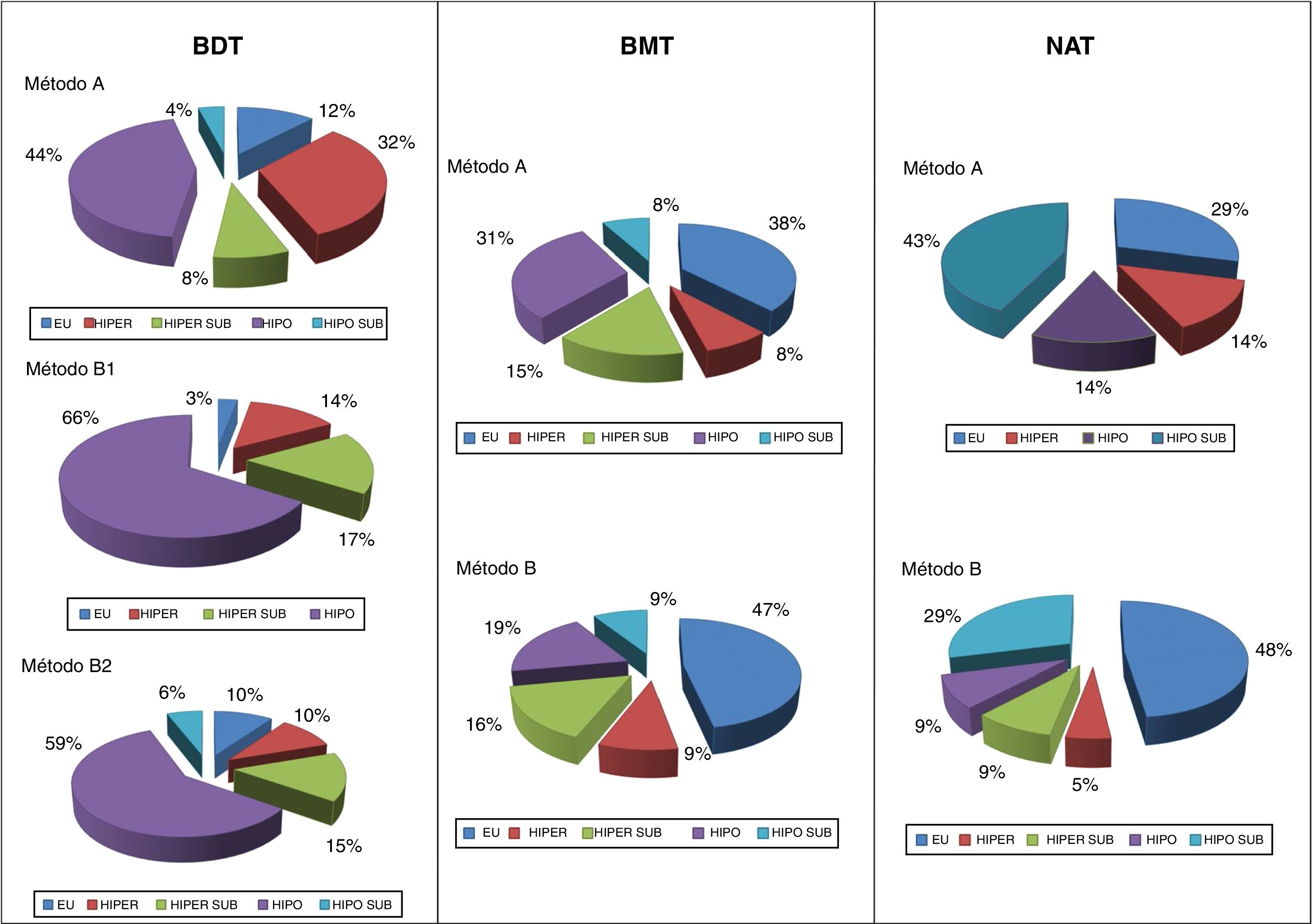
El mayor porcentaje de éxitos se produjo en el grupo de pacientes con NAT (86%), mientras que en los BDT era más frecuente el fracaso que en el resto (31% vs. 24% en BMT y 14% en NAT).
Fue también entre los enfermos con EGB donde hubo mayor proporción de hipotiroidismos resultantes: 57% frente al 8% de eutiroidismos «puros» (sin requerimiento farmacológico). El estatus eutiroideo fue claramente más habitual en los bocios nodulares (44% en BMT y 43% en NAT). La patología con menor proporción de hipotiroidismos que requirió medicación hormonal sustitutiva fue el NAT (11%).
En BDT, el porcentaje de fracasos con el métodoA alcanzó el 40%, mientras que con elB, con dosis absorbida diana de 150Gy (B1), fue del 31%, y con 200Gy (B2), del 27%. En BMT, la tasa de éxitos con uno y otro método fue muy similar (77 y 75%, A vs.B), siendo aún todavía mejor en los NAT (86% en ambos casos).
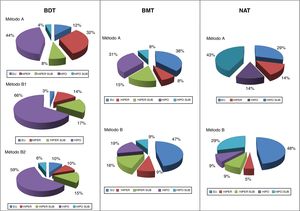
En cuanto al resultado funcional, se pudo observar que el mayor porcentaje de éxitos con el métodoB en BDT fue a expensas de un aumento paralelo en los hipotiroidismos resultantes. No obstante, al afinar la dosis objetivo a 200Gy se consiguió frenar esa tendencia. En cambio, en los bocios nodulares la balanza hipo/eutiroidismo se invertía, siendo notable la mejora en los resultados funcionales con el método de dosis calculadas, rozando, tanto en BMT como en NAT, el 50% de eutiroidismos. Incluso en los NAT (con idéntico porcentaje de éxitos por ambos métodos) se apreció un claro incremento del porcentaje final de eutiroidismo (48 vs. 29%) (fig. 1).
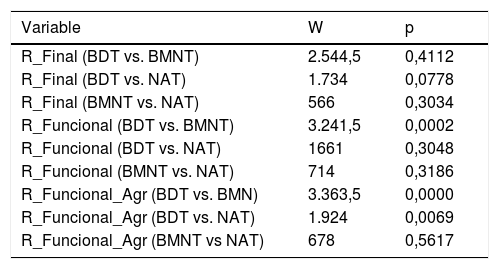
Al comparar los resultados según la patología causal, los datos no presentaron evidencias suficientes como para suponer que el éxito dependiera del tipo de patología. En el caso de BDT vs NAT el valor de p estuvo muy próximo a rechazarse, aunque fue >0,05. Al comparar los resultados funcionales, si nos fijamos en la variable agrupada (R_Fxl_agr), apreciamos que se presentaban diferencias del nivel BDT con el resto (tabla 5).
Test de W-M-W para la comparación de medias de R_Final, R_Funcional y R_Funcional_Agr separadas por patologías
| Variable | W | p |
|---|---|---|
| R_Final (BDT vs. BMNT) | 2.544,5 | 0,4112 |
| R_Final (BDT vs. NAT) | 1.734 | 0,0778 |
| R_Final (BMNT vs. NAT) | 566 | 0,3034 |
| R_Funcional (BDT vs. BMNT) | 3.241,5 | 0,0002 |
| R_Funcional (BDT vs. NAT) | 1661 | 0,3048 |
| R_Funcional (BMNT vs. NAT) | 714 | 0,3186 |
| R_Funcional_Agr (BDT vs. BMN) | 3.363,5 | 0,0000 |
| R_Funcional_Agr (BDT vs. NAT) | 1.924 | 0,0069 |
| R_Funcional_Agr (BMNT vs NAT) | 678 | 0,5617 |
R_Final: resultado final (éxito/fracaso); R_Funcional: resultado funcional (eutiroidismo/hipotiroidismo/hipotiroidismo subclínico/hipertiroidismo/hipertiroidismo subclínico). R_Funcional_Agr: resultado funcional agrupado (los subclínicos se integran en su correspondiente categoría).
BDT: bocio difuso tóxico; BMNT: bocio multinodular tóxico; NAT: adenoma tóxico.
En el global de los 179 pacientes tratados con seguimiento suficiente, la tasa de curación del hipertiroidismo fue del 73%. Al comparar los resultados obtenidos por uno y otro método, encontramos una tendencia favorable al método dosimétrico frente alA (75 vs. 69%) (tabla 3), aunque sin diferencias significativas. Esos porcentajes de éxito están dentro de lo esperable según la literatura. Bonnema y Hegedüs15 describían unas tasas de curación al año que oscilaban entre el 50 y el 90%.
Bernard et al.16 publicaron los resultados de una encuesta nacional en Francia sobre las prácticas de la medicina nuclear respecto al tratamiento con radioyodo del hipertiroidismo. Aunque no recogieron datos sobre las tasas de curación, sí mencionaban que estas varían considerablemente entre estudios y son dependientes tanto de la propia definición del resultado como del conocimiento y la integración de varios factores que influyen en el mismo, muchos de los cuales no son tenidos en cuenta en las fórmulas dosimétricas. Es interesante también el dato respecto a la aproximación terapéutica más habitual en ese momento en Francia, donde las dosis fijas son las más frecuentemente utilizadas (en el 60% de los EGB y en el 72,5% de los bocios nodulares).
En nuestro estudio, aproximadamente el 50% de los pacientes desarrollaron hipotiroidismo (tabla 3), aunque tampoco se apreciaron diferencias significativas entre ambos métodos. Nuestros resultados coinciden con lo publicado en la literatura, aunque el hipotiroidismo derivado de la terapia con 131I está sujeto a una aún mayor variabilidad y su significado es motivo de controversia. Así, las guías de la EANM9 dicen que «el principal efecto adverso del tratamiento con radioyodo es el hipotiroidismo, y su incidencia continúa creciendo a lo largo del tiempo de seguimiento». Puntualizan que la predicción pretratamiento no es posible usando las variables actuales y que, no obstante, su incidencia es mayor en EGB que en BMT, siendo rara en NAT. De hecho, con seguimientos más largos el hipotiroidismo permanente parece inevitable en la EGB post-radioyodo15.
Bernard et al.16 recogieron que el 33% de los médicos remitentes consideraban resultado exitoso el eutiroidismo, frente al 26% cuyo objetivo sería el hipotiroidismo. También hacían alusión a si el hipotiroidismo es una complicación o un resultado negativo, aunque, como Shapiro17, opinaban que es más bien un punto final post-radioyodo, fácilmente detectable y solucionable.
Se sabe que una tasa máxima de curación se asocia de forma invariable a una mayor tasa de hipotiroidismo18. En el debate editorial planteado en 2007 entre Van Isselt et al.19 y Sisson et al.20 sobre dosis fijas o calculadas, uno de los temas de discrepancia era el objetivo terapéutico (eutiroidismo o hipotiroidismo). Así, Van Isselt no era partidario de buscar el hipotiroidismo como resultado inicial. Ambos grupos coincidían en que el empleo de dosis calculadas permitiría cumplir mejor con el principio ALARA.
Unos magníficos resultados en cuanto a curación del hipertiroidismo con una sola dosis, como los obtenidos con la prescripción de endocrinólogos en el trabajo de Leow et al.21, no deberían conseguirse a costa de aumentar la dosis de radiación.
Las actividades administradas en base a dosis calculadas fueron inferiores a las de las dosis semifijas (tabla 3), siendo la diferencia estadísticamente significativa. Es decir, con tasas de curación e hipotiroidismo estadísticamente no peores (incluso tendencia a mayor tasa de éxitos) las actividades administradas al paciente, y por ende la exposición a la radiación, fueron menores con el métodoB. Estos resultados apoyan, por tanto, la utilización del método dosimétrico, ya que se adecúa mejor al principio ALARA y a la Directiva del Consejo de la Unión Europea 2013/59/EURATOM8.
En 2004 Jönsson y Mattsson22 realizaron un estudio comparativo en 187 enfermos con EGB tratados mediante diversos protocolos, comprobando que en aquellos en que no se utilizaba ninguna medida de captación de 131I pretratamiento, la mayoría recibieron una actividad innecesariamente alta (siendo el exceso promedio de 2,5 y, en algunos casos, de hasta 8 veces).
Dos son las revisiones sistemáticas y metaanálisis disponibles en la literatura que comparan actividad estimada (dosis fija) versus calculada en el tratamiento del hipertiroidismo23,24 —la segunda de ellas, solo en el ámbito del bocio nodular tóxico24—. De Rooij et al.23 incluyeron 8 estudios (3aleatorizados y 5no aleatorizados) y Rokni et al.24, 7 estudios (2 y 5, respectivamente); coincidiendo en 4 de los estudios seleccionados. En ambos trabajos el principal factor limitante era la enorme heterogeneidad: diferentes fórmulas para el cálculo de la actividad de 131I, diferentes formas de asignar las actividades estimadas (fijas), distintas maneras de determinar el volumen tiroideo (en algunos casos, por palpación), definiciones dispares de «baja» y «alta» dosis, etc.
Al igual que en nuestro estudio, ambos métodos de tratamiento resultaron igualmente exitosos para De Rooij et al.23, mientras que en el metaanálisis de Rokni et al.24 la tasa de respuesta fue mayor con las dosis calculadas, sin que se incrementaran de forma reseñable los hipotiroidismos, por lo que concluían que estas eran preferibles. En ninguna de las revisiones se hallaron diferencias significativas en la cantidad de 131I administrada en ambos grupos.
Por patologías, las tasas de éxito fueron del 69, del 76 y del 86% (BDT, BMT y NAT) (tabla 4). Es algo conocido que los resultados varían según el tipo de etiología responsable, siendo más amplio el rango de tasas de curación publicadas en BDT que en patologías nodulares, y habitualmente menor el porcentaje de éxitos de una sola dosis. A este respecto, es determinante el objetivo del tratamiento en la EGB (concepto que tuvimos en cuenta en el métodoA). Estamos ante dos conceptos contrapuestos10: tratamiento «orientado a la función»25 versus «dosis ablativa»26. Sin embargo, desde los inicios del tratamiento con radioyodo en la EGB se vio que la mayoría de estos pacientes acaban hipotiroideos a largo plazo, a diferencia de los bocios nodulares tóxicos27.
El rango publicado de tasas de curación del hipertiroidismo debido a EGB es más amplio que en los bocios nodulares (50-90% vs 75-95%), siendo también más frecuente el hipotiroidismo permanente en los primeros15. Muchos factores que explican por qué son menos predecibles los resultados de la terapia con radioyodo en BDT son inherentes a la propia enfermedad28: se trata de un trastorno autoinmune en el que el hipertiroidismo es causado por anticuerpos que actúan contra los tirocitos29 y en el que el recambio de radioyodo está habitualmente acelerado (por un aumento de la vascularización y una mayor actividad metabólica de los tirocitos)30. Por contra, la menor frecuencia de hipotiroidismo en BMT y NAT se debe, al menos en parte, a una captación de 131I reducida en el tejido tiroideo paranodular, parcialmente suprimido.
Como queda reflejado en la tabla 5, aunque no hubo diferencias estadísticamente significativas en cuanto al resultado final (éxito/fracaso) entre BDT y los bocios nodulares, sí las hubo en el resultado funcional: la tasa de hipotiroidismo fue significativamente mayor en el BDT, en consonancia con lo descrito en la literatura.
ConclusiónPara el tratamiento del hipertiroidismo con radioyodo, el método sencillo de cálculo de actividades que proponemos fue, al menos, igual de exitoso que el que utilizábamos previamente, basado en un rango de actividades fijas. Aunque no significativa, se observó una tendencia favorable, con mayor porcentaje de curaciones.
Igualmente sucedió con el resultado funcional, sin diferencias significativas pero con una tendencia en favor del métodoB, al menos en los bocios nodulares (menor proporción de hipotiroidismos).
Estos resultados se consiguieron administrando a los pacientes actividades significativamente más bajas, lo que redunda en una menor exposición a la radiación.
Los resultados obtenidos no mostraron de forma global dependencia significativa en función de la patología causal. No obstante, tanto en BMT como en NAT se apreció una tendencia a mejores resultados funcionales finales.
AutoríaFrancisco José Pena Pardo es el autor principal, responsable de la concepción y el diseño del estudio, la adquisición, el análisis y la interpretación de los datos, así como de la redacción del manuscrito. El Sr. López Serrano contribuyó con el análisis estadístico de los datos, el Dr. García Cases colaboró en el diseño del estudio y en los sistemas de registro informático de los datos, las Dras. Redal Peña y Crespo-Jara en la adquisición de los datos y los Dres. García Vicente y Martínez-Almagro Andreo en la revisión crítica del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El trabajo se desarrolló en el Hospital Quironsalud Torrevieja, y no hubiera sido posible sin los enfermeros del Servicio de Medicina Nuclear (Mónica Berná Campos, Encarnación Salinas Sánchez, Pedro Jorge Contreras Sánchez, Stefano Bonetti, M. Carmen Ortuño Meseguer, M. Carmen Balboa Almira, Nuria Armengol Hernández, Noelia García Amat y Santos Maciá Berna) por su gran profesionalidad y su labor desinteresada en la recogida de datos.