Existe cierta controversia sobre la indicación quirúrgica del hiperparatiroidismo primario, sobre todo en pacientes asintomáticos. El objetivo de este estudio es valorar la evolución de la densidad mineral ósea (DMO) y la aparición de fracturas en pacientes operados vs. pacientes seguidos sin cirugía.
MétodosSe trata de un estudio retrospectivo de cohortes en el que se incluyó a 170 pacientes (112 tratados con cirugía y 58 seguidos sin cirugía) entre los años 1991 y 2014. Se analizó la evolución de la DMO en columna lumbar, cuello femoral, cadera total y radio en 2-6 años de seguimiento, así como la aparición de fracturas.
ResultadosLos pacientes tratados con cirugía experimentaron una ganancia de DMO a los 2 años en columna lumbar del 4,37% vs. el 1,59% en no operados (p < 0,05); en cuello femoral del 3,90% vs. el 0,19% (p < 0,05) y en cadera total del 2,70% vs. el 0,14% (p < 0,05). La ganancia de DMO continuó siendo significativa en pacientes operados a los 4 y 6 años, en columna lumbar y cuello femoral. No se observó mejoría en radio distal en los pacientes tratados quirúrgicamente. La aparición de fracturas durante el tiempo de seguimiento no mostró diferencia significativa entre ambos grupos.
ConclusionesLos pacientes con hiperparatiroidismo primario tratados con cirugía experimentan una ganancia de DMO superior a los pacientes no operados, tanto en columna lumbar como en cuello femoral. El riesgo de fractura no desciende en el grupo de pacientes tratados con cirugía.
The need for parathyroidectomy to treat asymptomatic patients with primary hyperparathyroidism is controversial. The aim of this study was to assess the impact of parathyroidectomy vs. surveillance on skeletal outcomes such as bone mineral density (BMD) and incident fractures.
MethodsThis was a retrospective cohort study including 170 patients (112 treated with surgery and 58 subject to active surveillance) between 1991 and 2014. Changes in BMD in lumbar spine, femoral neck, total hip, and radius, and incidence of fractures, were monitored for 2-6 years.
ResultsPatients treated with surgery had BMD gains at 2years of 4.37%, as compared to 1.59% in non-operated patients (p<0.05) in the lumbar spine, 3.90% vs. 0.19% (p<0.05) in the femoral neck, and 2.70% vs. 0.14% (p<0.05) in total hip. Gain in BMD in the lumbar spine and femoral neck remained significant in operated patients at 4 and 6 years. No improvement was seen in the radius in operated patients. No significant difference was seen in fracture occurrence between operated and non-operated patients.
ConclusionPatients with primary hyperparathyroidism treated with surgery experience greater BMD gains than non-operated patients, especially in the lumbar spine and femoral neck. The risk of fracture does not decrease in the group of operated patients.
El hiperparatiroidismo primario (HPP) se define como una enfermedad endocrinológica causada por la producción excesiva o inadecuada de la PTH por una o más glándulas paratiroideas. El espectro clínico del HPP cambió drásticamente a principios de los años 70 con la introducción del calcio en el analizador bioquímico multicanal, con el cual se detectó un número importante de pacientes con enfermedad asintomática no sospechada previamente.
El hueso es un órgano diana clásico en el HPP y es bien conocido que el recambio óseo está reversiblemente incrementado en estos pacientes, lo que provoca un descenso en la densidad mineral ósea (DMO)1 y un potencial aumento del riesgo de fractura. El tratamiento quirúrgico del HPP se asocia con un incremento de la DMO, sobre todo en localizaciones ricas en hueso trabecular2,3, mientras que en el hueso de predominio cortical como es el tercio distal del radio las pérdidas son sustancialmente irreversibles4. Los datos sobre reducción del riesgo de fractura tras la cirugía son contradictorios. Hay estudios que describen descenso del riesgo de fractura de cadera y antebrazo, pero no descenso de fractura vertebral5. Otros estudios no encuentran un aumento del riesgo de fracturas respecto a controles tras la cirugía y algunos refieren un aumento del riesgo de fractura de radio distal congruente con la escasa ganancia de masa ósea a la que nos referíamos anteriormente6.
El tratamiento de las formas asintomáticas de HPP es objeto de un debate continuo. No tenemos estudios realizados en España sobre la evolución de esta enfermedad, por lo que analizar lo que está ocurriendo en la práctica clínica diaria en cuanto a evolución de DMO y riesgo de fracturas en pacientes tratados con cirugía y pacientes que se siguen de forma conservadora es de gran relevancia.
Material y métodosSe trata de un estudio retrospectivo de cohortes en el que se identificaron un total de 709 casos de HPP en el área sanitaria de Santander entre los años 1970 y 2014. Los casos de HPP se definieron como hipercalcemia junto con niveles altos o inapropiadamente normales de PTH en al menos 2ocasiones. Se excluyeron casos de HPP normocalcémico, hipercalcemia hipocalciúrica familiar, casos de HPP en el contexto de neoplasias endocrinas múltiples, así como elevaciones transitorias de calcio o PTH tras inicio de tratamientos farmacológicos tales como suplementos de vitamina D o bifosfonatos. También se excluyó hipercalcemia asociada a insuficiencia renal crónica avanzada o trasplante renal. Todos los pacientes tenían más de 18 años y eran de origen caucásico.
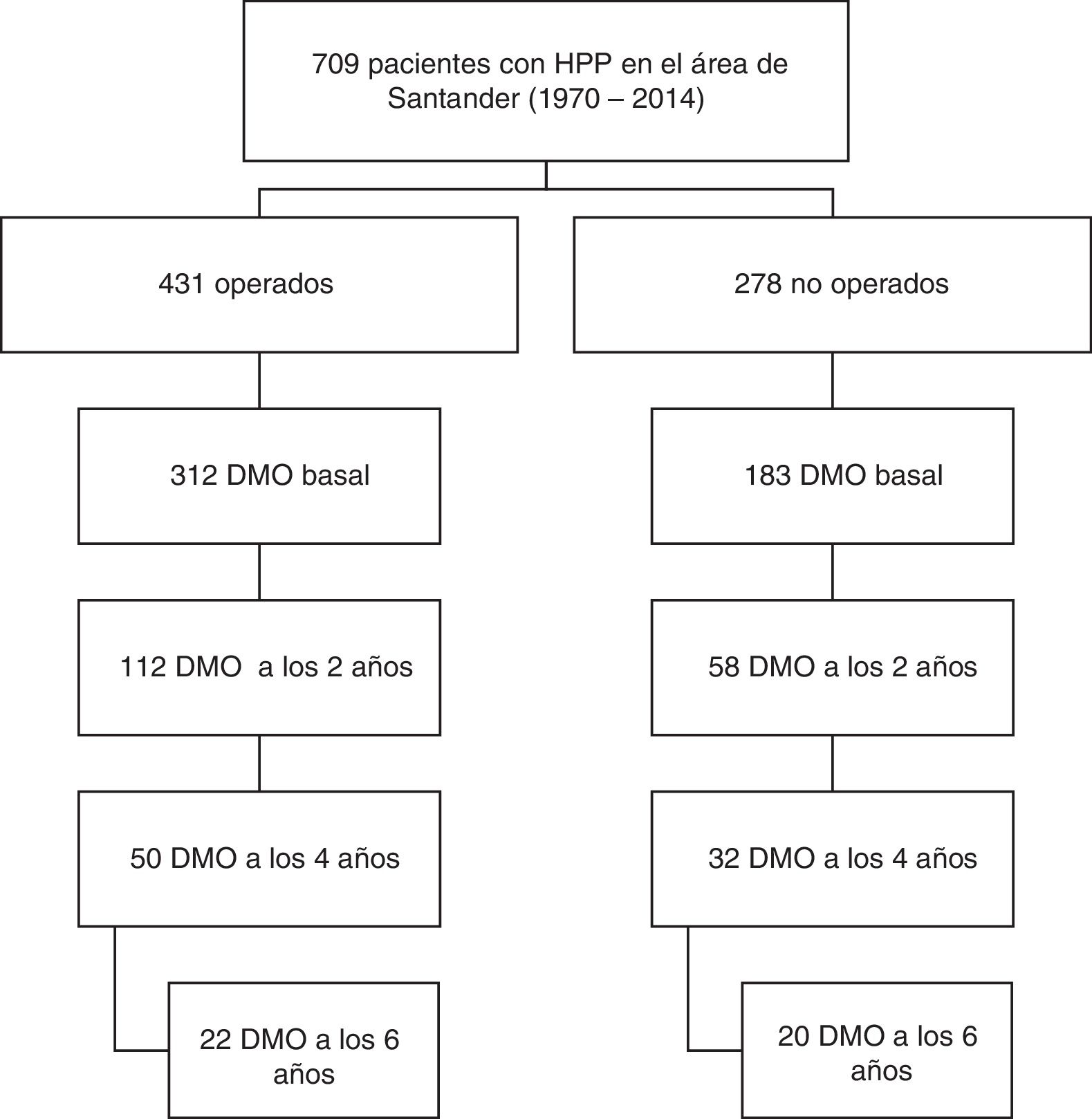
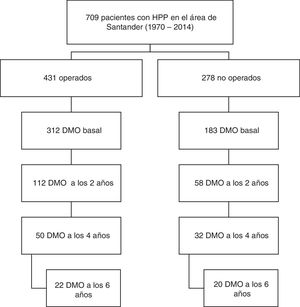
De este total de casos se seleccionaron 170 pacientes (92% mujeres) entre los años 1991 y 2014, que cumplían el requisito de tener una densitometría ósea basal y al menos otra a los 2años de seguimiento. Se consideraron pacientes sintomáticos aquellos con síntomas o complicaciones directamente atribuibles a la hipercalcemia o exceso de PTH: litiasis y osteítis fibrosa quística. Fueron tratados con cirugía 112 pacientes y otros 58 fueron seguidos de forma conservadora. En ambas ramas, se dispone de datos de evolución de la DMO de hasta 6 años en una parte de la muestra (fig. 1).
El análisis de incidencia de fracturas y modificación de la DMO se realizó sobre los 170 pacientes hasta finales de 2016, con períodos de seguimiento de 6 años (4-9) (expresado como mediana y rango intercuartílico), desde la cirugía paratiroidea, en pacientes operados, y de 8 años (6-11), desde el diagnóstico, en pacientes no operados. Se contabilizaron fracturas espontáneas o traumáticas de localización vertebral, cadera o radio. No se excluyó en el análisis de fracturas a los pacientes que recibían tratamiento para la osteoporosis. Para el análisis de los marcadores de remodelación ósea, hemos considerado un subgrupo de 56 pacientes que cumplían una serie de factores que hacen que estos marcadores tengan validez: ausencia de insuficiencia renal y de infecciones o procesos inflamatorios recientes, y no recibir tratamiento con medicamentos que puedan interferir, como bifosfonatos, ranelato de estroncio, corticoides, antiepilépticos, estrógenos o tiazidas. De las 56 muestras, 42 corresponden a pacientes operados y 14 a no operados.
Análisis bioquímicosEl calcio total (en suero y orina), el fósforo y la creatinina se midieron por métodos automatizados en ADVIA 2000 (Siemens Corp., Tarrytown, NY, EE. UU.). El calcio total en suero fue corregido con la albúmina. El calcio ionizado se midió mediante electrodos selectivos de calcio automatizados en un analizador de pH Ca++Ciba Corning 634 (Ciba Corning Diag. Corp., Medfield, Massachusetts, EE. UU.). La determinación de PTH intacta se ha ido modificando conforme avanzan los años: de 1991 a 2001 se determinó mediante IRMA (Nichols Institute, San Juan Capistrano, CA, EE. UU.), de 2002 a 2005 se utilizó Duo PTH IRMA (Scantibodies Laboratory, EE. UU.), de 2006 a 2012 se determinó mediante análisis quimioluminiscente automatizado Liason (DiaSorin, Stillwater, Minnesota, EE. UU.) y de 2012 a la actualidad con análisis quimioluminiscente automatizado Ysis (IDS-iSYS de Immunodiagnostic Systems Ltd, Gran Bretaña). Se midió la 25-OH-vitamina D3 (25-OH-vitamina D) de 1993 a 2005 por radioinmunoanálisis (DiaSorin, Stillwater, Minnesota, EE. UU.), de 2006 a 2010 con análisis quimioluminiscente Liaison (DiaSorin) y de 2011 a 2015 con análisis quimioluminiscente automatizado Ysis (IDS-iSYS). La fosfatasa alcalina ósea se determinó mediante inmunoanálisis (kit Alkphase B, Metra Biosystems, Mountain View, CA, EE. UU). La osteocalcina sérica se midió mediante análisis inmunorradiométrico (kit OSTEO-RIACT, CIS Bio international, Gif-sur-Yvette, Francia). Los niveles de propéptido N-terminal de colágeno tipo I (P1NP) se midieron mediante RIA (Orion Diagnostica, Espoo, Finlandia). Los crosslaps se midieron mediante ELISA (Nordic Bioscience Diagnostics, Herlev Hovedgade, Dinamarca).
Valoración de la densidad mineral óseaLa evaluación de la masa ósea se realizó mediante absorciometría de rayos X a 3niveles (columna lumbar L2-L4), cadera (proyección cuello femoral y total) y radio distal. Los cambios en los valores de la DMO se expresan como porcentajes de cambio respecto de la basal. Se utilizó en más de un 80% de los pacientes un densitómetro Hologic QDR 4500 (DXA, Hologic, Walthan, MA, EE. UU.), con un error de precisión en columna lumbar de un 1,08% y en cuello femoral de un 1,50%. En el resto de los casos, el densitómetro utilizado fue de tipo Lunar DPX-L (Lunar Corporation, Madison, WI, EE. UU.), con un error de precisión en columna lumbar de un 1,22% y en cuello femoral de un 1,97%. El seguimiento de cada paciente se realizó siempre con el mismo equipo de la primera exploración.
MedicaciónNo se consideró un criterio de exclusión el tratamiento con suplementos de vitamina D o con fármacos para la osteoporosis, pero se tuvo en cuenta a la hora del análisis de los datos.
Análisis estadísticoLos datos se incluyeron en el paquete estadístico SPSS 15.0. Al analizar los datos se hizo en primer lugar un estudio de la distribución normal o no de las variables analizadas mediante el test de Kolmogorov-Smirnov. Las variables continuas se expresaron como media ± desviación estándar si seguían una distribución normal o como mediana y rango intercuartil si no la seguían. Las variables categóricas se expresaron como porcentajes. La comparación de variables entre los grupos operados y no operados se realizó con el test de la T de Student en las variables que seguían una distribución normal y el test de la U de Mann Whitney en las que no la seguían. El análisis de los datos categóricos se realizó con la prueba del chi cuadrado. Se utilizó un modelo de regresión logística para identificar factores de riesgo de la fractura de cadera, incluyendo en él factores considerados como tales en la literatura previa disponible hasta la fecha: edad, sexo, antecedentes de fracturas previas, tratamiento de la osteoporosis, además del propio tratamiento quirúrgico del HPP. El coeficiente de correlación de Spearman (rs) se aplicó para establecer correlaciones entre parámetros de distribución no normal. Se consideró estadísticamente significativa una p <0,05.
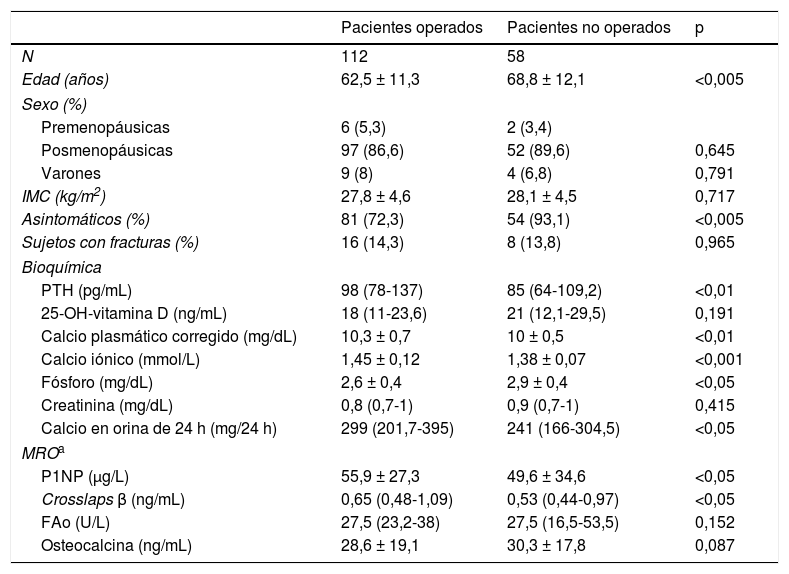
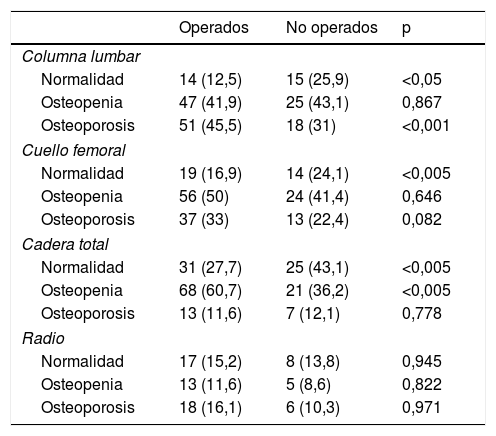
ResultadosBasalmente encontramos que los pacientes que se operaron eran más jóvenes y tenían síntomas tales como litiasis en un porcentaje superior a los que no se operaron (21,4% frente a 6,9%; p <0,05). Así mismo, tenían cifras más elevadas de calcio en sangre y en orina, y de PTH. Presentaban también mayor porcentaje de osteoporosis en la columna lumbar y valores de los marcadores de remodelado óseo más elevados (tablas 1 y 2).
Características basales de la población
| Pacientes operados | Pacientes no operados | p | |
|---|---|---|---|
| N | 112 | 58 | |
| Edad (años) | 62,5 ± 11,3 | 68,8 ± 12,1 | <0,005 |
| Sexo (%) | |||
| Premenopáusicas | 6 (5,3) | 2 (3,4) | |
| Posmenopáusicas | 97 (86,6) | 52 (89,6) | 0,645 |
| Varones | 9 (8) | 4 (6,8) | 0,791 |
| IMC (kg/m2) | 27,8 ± 4,6 | 28,1 ± 4,5 | 0,717 |
| Asintomáticos (%) | 81 (72,3) | 54 (93,1) | <0,005 |
| Sujetos con fracturas (%) | 16 (14,3) | 8 (13,8) | 0,965 |
| Bioquímica | |||
| PTH (pg/mL) | 98 (78-137) | 85 (64-109,2) | <0,01 |
| 25-OH-vitamina D (ng/mL) | 18 (11-23,6) | 21 (12,1-29,5) | 0,191 |
| Calcio plasmático corregido (mg/dL) | 10,3 ± 0,7 | 10 ± 0,5 | <0,01 |
| Calcio iónico (mmol/L) | 1,45 ± 0,12 | 1,38 ± 0,07 | <0,001 |
| Fósforo (mg/dL) | 2,6 ± 0,4 | 2,9 ± 0,4 | <0,05 |
| Creatinina (mg/dL) | 0,8 (0,7-1) | 0,9 (0,7-1) | 0,415 |
| Calcio en orina de 24 h (mg/24 h) | 299 (201,7-395) | 241 (166-304,5) | <0,05 |
| MROa | |||
| P1NP (μg/L) | 55,9 ± 27,3 | 49,6 ± 34,6 | <0,05 |
| Crosslaps β (ng/mL) | 0,65 (0,48-1,09) | 0,53 (0,44-0,97) | <0,05 |
| FAo (U/L) | 27,5 (23,2-38) | 27,5 (16,5-53,5) | 0,152 |
| Osteocalcina (ng/mL) | 28,6 ± 19,1 | 30,3 ± 17,8 | 0,087 |
Las variables con distribución normal se expresan como media ± desviación estándar y las variables con distribución no normal como mediana y rango intercuartílico.
IMC: índice de masa corporal; MRO: marcadores de remodelado óseo.
Valores de referencia:
PTH: 10-45 pg/mL; 25-OH-vitamina D: insuficiencia <20 ng/mL; calcio plasmático: 8,1-10,4mg/dL; calcio iónico: 1,16-1,30 mmol/L; calcio en orina de 24 horas: varones <300mg/24 h, mujeres <250mg/24 h.
Densidad mineral ósea: estado basal
| Operados | No operados | p | |
|---|---|---|---|
| Columna lumbar | |||
| Normalidad | 14 (12,5) | 15 (25,9) | <0,05 |
| Osteopenia | 47 (41,9) | 25 (43,1) | 0,867 |
| Osteoporosis | 51 (45,5) | 18 (31) | <0,001 |
| Cuello femoral | |||
| Normalidad | 19 (16,9) | 14 (24,1) | <0,005 |
| Osteopenia | 56 (50) | 24 (41,4) | 0,646 |
| Osteoporosis | 37 (33) | 13 (22,4) | 0,082 |
| Cadera total | |||
| Normalidad | 31 (27,7) | 25 (43,1) | <0,005 |
| Osteopenia | 68 (60,7) | 21 (36,2) | <0,005 |
| Osteoporosis | 13 (11,6) | 7 (12,1) | 0,778 |
| Radio | |||
| Normalidad | 17 (15,2) | 8 (13,8) | 0,945 |
| Osteopenia | 13 (11,6) | 5 (8,6) | 0,822 |
| Osteoporosis | 18 (16,1) | 6 (10,3) | 0,971 |
Los datos se expresan como número de pacientes y porcentaje respecto al total de pacientes de cada grupo. Se consideró normalidad: T score superior a –1 DE; osteopenia: T score entre –1 y –2,5 DE; osteoporosis: T score igual o inferior a –2,5 DE.
Recibieron suplementos de vitamina D 33 de los pacientes no operados (57%) y 65 de los pacientes operados (58%). En lo relativo al tratamiento para la osteoporosis, un 58% de los pacientes operados y un 63,8% de los pacientes no operados recibieron algún tipo de tratamiento, mayoritariamente bifosfonatos (51,8% de los operados y 56,9% de los no operados) en algún momento del seguimiento.
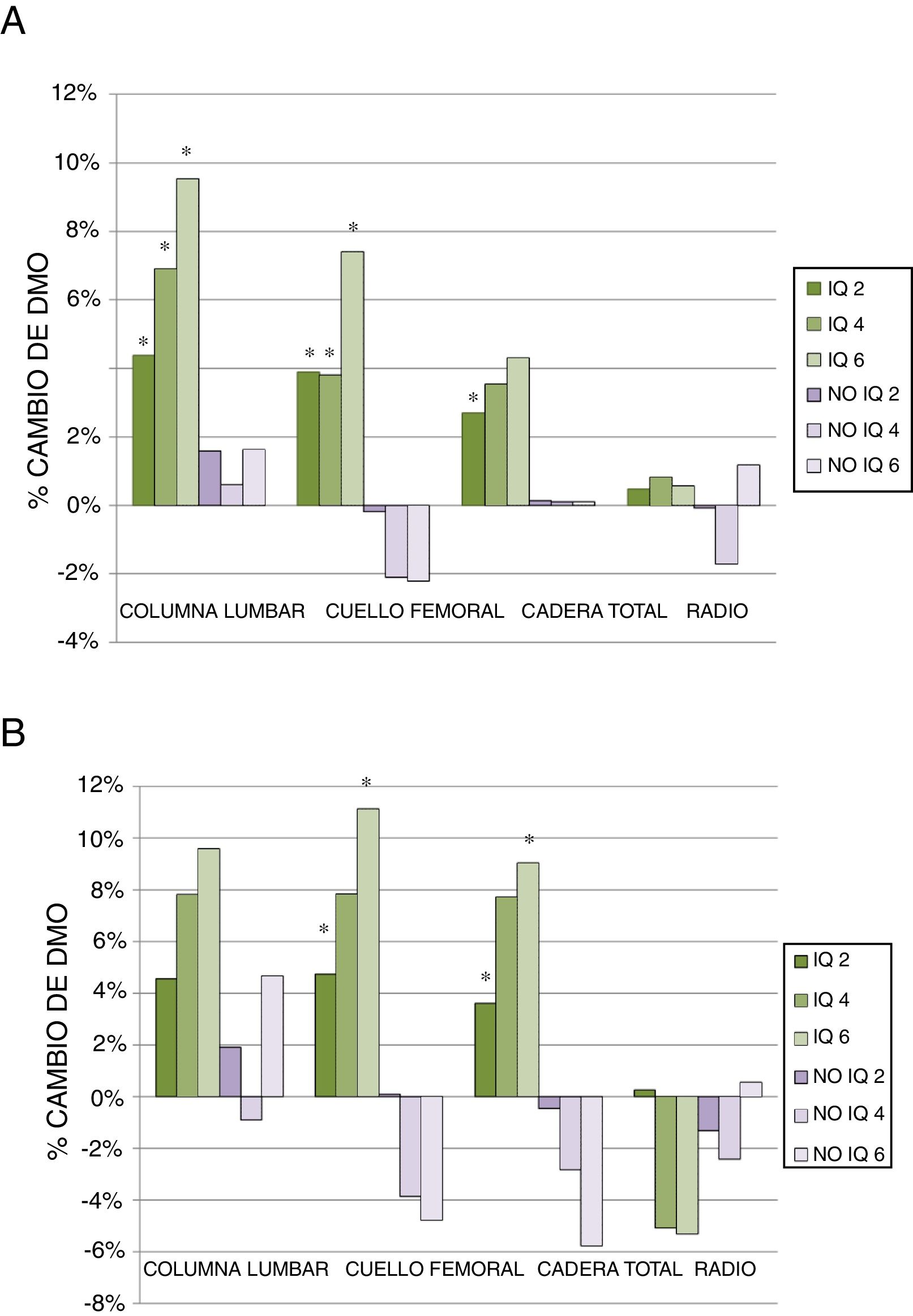
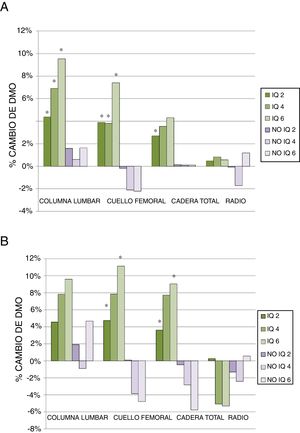
A los 2 años de la intervención quirúrgica los pacientes operados presentaron una ganancia de DMO del 4,37% (0,25-10,27) (expresado como mediana y rango intercuartílico) en columna lumbar, frente al 1,59% (−1,94-5,04) en no operados (p <0,005), de 3,90% (0,79-8,28) en cuello femoral frente a un descenso del −0,19% (−2,84-1,79) en no operados (p <0,001) y del 2,70% (−0,17-5,77) en cadera total vs. 0,14% (−3,11-2,83) en el otro grupo (p <0,005). No es así en el tercio distal del radio, en el que no se observó mejoría en pacientes operados (fig. 2A).
Porcentaje de cambio de DMO en el total de pacientes (A) y en el grupo de pacientes que no han recibido tratamiento para la osteoporosis (B) a los 2, 4 y 6 años de evolución. Los datos se presentan como la mediana del porcentaje de cambio.
A) IQ 2: CL (112), CF (98), CT (103), Radio (38); IQ 4: CL (50), CF (43), CT (45), Radio (17); IQ 6: CL (22), CF (21), CT (21), Radio (9).
No IQ 2: CL (58), CF (50), CT (51), Radio (17); No IQ 4: CL (32), CF (28), CT (31), Radio (8); No IQ 6: CL (20), CF (20), CT (21), Radio (6).
B) IQ 2: CL (38), CF (37), CT (38), Radio (17); IQ 4: CL (6), CF (7), CT (7), Radio (3); IQ 6: CL (6), CF (5), CT (5), Radio (2).
No IQ 2: CL (21), CF (18), CT (18), Radio (7); No IQ 4: CL (4), CF (4), CT (4), Radio (2); No IQ 6: CL (8), CF (8), CT (8), Radio (1).
* p < 0,05.
CF: cuello femoral; CL: columna lumbar; CT: cadera total; IQ 2: operados a los 2 años; IQ 4: operados a los 4 años; IQ 6: operados a los 6 años; No IQ 2: no operados a los 2 años; No IQ 4: no operados a los 4 años; No IQ 6: no operados a los 6 años; Radio: tercio distal del radio.
Si analizamos los datos a los 4 años, observamos que el porcentaje de cambio continuó siendo superior en los pacientes operados tanto en columna lumbar (6,89% [0,66-16,68] vs. 0,62% [−3,88-7,74]), como en cuello femoral (3,84% [−4,01-10,97] vs. −2,09% [−6,07-2,46]; p <0,005). En cadera y tercio distal del radio se observaron modificaciones más discretas de la DMO, sin diferencias significativas entre los 2grupos (fig. 2A).
A los 6 años se mantuvieron las tendencias observadas anteriormente, con mayor magnitud de cambio. Mejoró la DMO en columna lumbar (9,54% [2,64-18,59] vs. 1,63% [−4,22-10,54]) y en cuello femoral (7,42% [−2,20-11,13] vs. −2,20% [−6,52-5,73]) en los pacientes operados, con ambas diferencias estadísticamente significativas. En cadera total se incrementó la DMO, pero no de forma significativa, al igual que en el radio (fig. 2A).
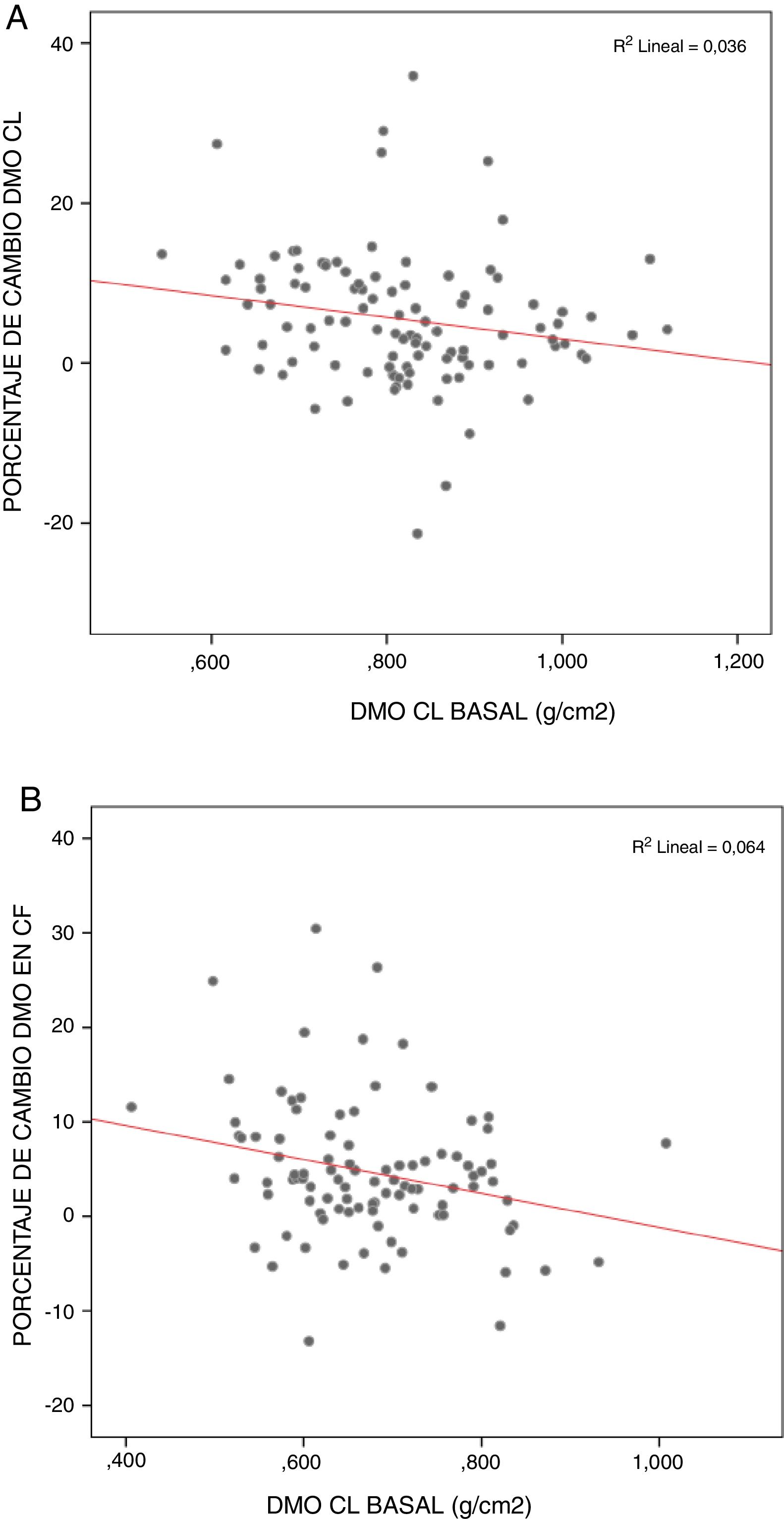
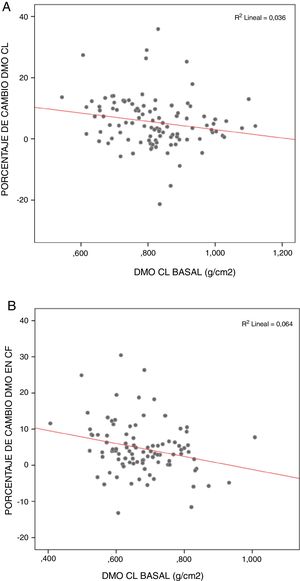
Los pacientes operados que partían de DMO más baja fueron los que más recuperaron, sobre todo en columna lumbar (rs = −0,249; p <0,05) y cuello femoral (rs = −0,250; p <0,05) (fig. 3).
Al excluir a los pacientes que habían recibido tratamiento para la osteoporosis, los resultados presentaron tendencias similares, aunque con una población muestral más pequeña. En la densitometría a los 2 años se observó un porcentaje de cambio superior en los pacientes operados en todas las localizaciones, con diferencia estadísticamente significativa en cuello femoral y cadera total. A los 4 años, la DMO empeoró en los pacientes no operados en todas las localizaciones, salvo en columna lumbar, en la que se mantuvo, pero las diferencias con los operados no eran estadísticamente significativas. A los 6 años se observó un importante descenso de la DMO en cuello femoral y cadera total en los no operados, mientras que en los operados mejoró la DMO en esas localizaciones de forma significativa. Al igual que hemos comentado anteriormente, no se observaron modificaciones importantes de la DMO en columna lumbar en los no operados y no hubo diferencia estadísticamente significativa en el tercio distal del radio (fig. 2B).
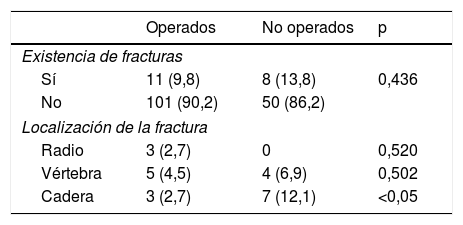
No se encontraron diferencias estadísticamente significativas en el porcentaje de fracturas totales entre el grupo de operados y el de no operados. Sí hubo diferencia en el porcentaje de fracturas de cadera, más frecuente en los no operados, diferencia esta estadísticamente significativa (p <0,05) (tabla 3). En el análisis de regresión logística se identificó únicamente la edad como factor de riesgo de fractura de cadera con una odds ratio de 1,12 (1,02-1,24).
Fracturas en la evolución
| Operados | No operados | p | |
|---|---|---|---|
| Existencia de fracturas | |||
| Sí | 11 (9,8) | 8 (13,8) | 0,436 |
| No | 101 (90,2) | 50 (86,2) | |
| Localización de la fractura | |||
| Radio | 3 (2,7) | 0 | 0,520 |
| Vértebra | 5 (4,5) | 4 (6,9) | 0,502 |
| Cadera | 3 (2,7) | 7 (12,1) | <0,05 |
Los datos se expresan como número de casos y porcentaje respecto del total de pacientes en cada grupo.
La cirugía es el único tratamiento curativo del HPP y debería ser recomendado para todos los pacientes sintomáticos. En los pacientes asintomáticos existe cierta controversia sobre la indicación de cirugía. En este trabajo se analiza de forma retrospectiva la evolución de la DMO, así como la aparición de fracturas en pacientes operados y no operados en la práctica clínica habitual, donde más del 80% de los pacientes con HPP se encuentran asintomáticos7. Es el primer trabajo de estas características realizado en España en pacientes con HPP.
En nuestra serie el incremento de la DMO en columna lumbar tras la cirugía es estadísticamente significativo tanto a los 2 años, como a los 4 y a los 6 años. La ganancia de DMO tras la cirugía es mayor en áreas ricas en hueso trabecular y se produce de forma temprana en los primeros meses tras la intervención quirúrgica. Este rápido incremento tras la cirugía es debido a la reducción en la resorción ósea y a un efecto de relleno del espacio de remodelado óseo ampliado8. Esta ganancia de DMO en columna lumbar también aparece descrito en los estudios llevados a cabo en población nórdica3,9,10. En el estudio de Ambrogini, donde se comparan pacientes con HPP asintomáticos aleatorizados a cirugía o seguimiento, la DMO en columna lumbar mejora al año de la cirugía (4,16 vs. −1,12%)11. Si comparamos la mejoría en DMO lumbar encontrada en nuestra serie a los 4 años de la cirugía (6,89%), esta es claramente inferior a la publicada por Silverberg en el mismo periodo de tiempo (12,8%)12. Aunque se espera una pérdida de DMO en columna lumbar asociada a la edad, esto no se observa en los pacientes no operados de esta serie, con ganancia de DMO a los 2 años, tanto si se incluye a los pacientes que reciben tratamiento para la osteoporosis como si se los excluye del análisis. Estos resultados son consistentes con anteriores observaciones en las que la DMO de columna lumbar está relativamente preservada de la pérdida de masa ósea en el HPP13.
Los porcentajes de cambio en cuello femoral y cadera total son superiores a los publicados por Rao et al.14 e inferiores a los de Ambrogini eta al.11 y Silverberg et al.12. La mejoría de la DMO en cuello femoral se mantiene de forma significativa a los 4 y 6 años, por lo que la pérdida de hueso cortical puede ser parcialmente reversible a largo plazo tras la intervención quirúrgica. Se espera una caída anual de la DMO en cuello femoral de un 0,6% en población general femenina15. Los pacientes no operados presentan una pérdida menor a los 2 años, tanto si consideramos el grupo completo de no operados como si consideramos exclusivamente a los que no reciben tratamiento para la osteoporosis. Sin embargo, a los 4 y 6 años, los pacientes no operados que no reciben otros tratamientos tienen una pérdida de DMO en cuello femoral de un −3,85 y −4,77%, respectivamente, superior a la que les correspondería por la edad.
La intervención quirúrgica tiene menos efecto sobre el hueso cortical comparado con el hueso trabecular. En este estudio la DMO no mejora en localizaciones con hueso de predominio cortical como el tercio distal del radio: esto es acorde con lo observado en otros estudios11,16-19.
Los pacientes que partían de DMO más bajas se correlacionaron con un mayor porcentaje de cambio en la densitometría a los 2 años en las localizaciones de columna lumbar y cuello femoral. De acuerdo con lo expuesto por otros autores, los pacientes que más recuperan son los que parten de cifras peores20.
En nuestra serie, en el grupo de pacientes no operados no se observan diferencias estadísticamente significativas entre los valores de la DMO basal y la DMO a los 2, 4 y 6 años de seguimiento en ninguna de las localizaciones. Estos resultados están en consonancia con las conclusiones publicadas en el metaanálisis de Sankaran: los pacientes no tratados no experimentan una rápida pérdida de DMO21. Sí hay un empeoramiento de los valores de DMO en las localizaciones de hueso más cortical, cuello femoral y radio a los 2 y 4 años, pero no alcanza significación estadística. Estos datos son acordes con lo publicado por Rubin, en los que se observa descenso de DMO en cuello femoral y radio antes de los 10 años de seguimiento, pero no se afecta la columna lumbar en los 15 años de seguimiento13. Otros estudios también observan un descenso de DMO en cuello femoral y radio en no operados10,16. El descenso de DMO en radio no se confirma en los estudios de Rao ni en el de Ambrogini, que miden DMO en 1-2 años de evolución, lo que indica que puede ser poco tiempo para observar diferencias11,14.
Es importante tener en cuenta que una de las limitaciones de nuestro estudio es el uso de fármacos con actividad ósea, hecho que también ocurre en otros trabajos publicados9,10. Un 58% de los pacientes operados y un 63,8% de los pacientes no operados recibieron tratamiento para la osteoporosis. Al tratarse de un estudio retrospectivo de práctica clínica habitual, existe un sesgo, pues los pacientes que se siguen varios años en la consulta con densitometrías periódicas cada 2 años suelen ser aquellos que presentaban inicialmente un descenso de DMO, mientras que el resto o son dados de alta o siguen controles bioquímicos con alguna densitometría ocasional. Si bien este es un dato que tener en cuenta, minimizaría las diferencias entre ambos grupos y no explicaría un aumento. De hecho, si excluimos a los pacientes que han recibido tratamiento para la osteoporosis, continuamos observando una ganancia importante de DMO en cuello femoral y cadera total a los 2 años de la cirugía que persiste a los 4 y 6 años.
A pesar de las diferencias en la evolución de la DMO tras la intervención quirúrgica frente a observación, no queda claro si la mejoría de la DMO reduce el riesgo de fracturas. En este estudio, el bajo número de fracturas en la evolución no nos permite extraer conclusiones definitivas; aun así, observamos un porcentaje de fracturas superior en el grupo de no operados, pero que no alcanza significación estadística. Sí hay diferencias significativas en las fracturas de cadera, pero, ajustando por otros factores, solo la edad resulta significativa como factor de riesgo, como también ocurre en otros trabajos22. La disminución del riesgo de fractura en operados aparece descrita en algunos estudios23, pero, al igual que en nuestra serie, en el metaanálisis publicado por Singh Ospina no se observan diferencias en la disminución de riesgo de fracturas entre operados y no operados24. En lo relativo a la localización de las fracturas, observamos un mayor número de fracturas de radio en el grupo de operados, sin que llegue a alcanzar significación estadística: esto también aparece descrito por otros autores6 e iría en consonancia con lo ya reflejado de no mejoría de la DMO en el radio tras la intervención quirúrgica. Diversos estudios ponen de manifiesto que factores como la microarquitectura ósea podrían tener cierta relevancia en la resistencia del hueso frente a la fractura. Una herramienta que podría ser útil para valorar este hecho es el trabecular bone score que está fuertemente correlacionado con el número de trabéculas y su conectividad25. Otra herramienta de gran utilidad en la práctica clínica diaria para estimar el riesgo de fractura es el FRAX, que tiene en cuenta otros factores de riesgo, algunos dependientes de la DMO (sexo femenino, menopausia precoz, inmovilización prolongada) y otros independientes de la DMO (edad, bajo peso corporal, hábito tabáquico)26.
La mayoría de los estudios no tienen en cuenta la baja ingesta de calcio y el déficit de vitamina D asociados al HPP27 y sería de interés evaluar la influencia de la suplementación con calcio y vitamina D sobre la evolución de la DMO en el postoperatorio.
La principal limitación de nuestro trabajo es su diseño retrospectivo, que impide controlar múltiples sesgos potenciales que tener en cuenta. Se recogen datos de pacientes con HPP durante 23 años, pero durante estos años no solo han ido cambiando los métodos analíticos sino también los criterios quirúrgicos. La indicación quirúrgica fue decidida por el médico responsable del paciente en cada caso, lo que explica que los pacientes intervenidos sean aquellos con síntomas clínicos (litiasis y osteítis fibrosa quística), más jóvenes, con menor comorbilidad, DMO más bajas y un remodelado óseo incrementado. Todo ello justifica las diferencias basales encontradas entre los grupos. A pesar de ello, consideramos que los datos son relevantes como análisis de lo realizado en la práctica clínica diaria habitual.
Podemos concluir que en nuestra serie los pacientes con HPP tratados quirúrgicamente experimentan una mayor ganancia de DMO en columna lumbar en relación con los no intervenidos, lo que confirma lo descrito en estudios previos. Así mismo, se observa una ganancia significativa de DMO en cuello femoral, sin encontrar alteraciones significativas en la DMO del tercio distal del radio. En todo caso, no hemos logrado demostrar un descenso del riesgo de fracturas en los pacientes operados, con la edad como el factor de riesgo determinante en su aparición.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en relación con este artículo.