Los tratamientos insulínicos actuales para diabetes tipo 1 (DM1) no siempre consiguen los objetivos de control metabólico debido, entre otros aspectos, a la aparición de episodios de hipoglucemia asociados al uso de insulina.
Material y métodosEstudio descriptivo en la vida real con 247 pacientes DM1, el 55,5% varones, de 46,53 ± 16,23 años, con un tiempo de evolución de 21,89 ± 11,99 años, a los que se sustituyó su insulina basal, glargina U100, por glargina U300. Los objetivos primarios fueron los cambios en la HbA1c y en el número de hipoglucemias y los secundarios fueron los cambios en el peso y en la dosis de insulina trascurridos 6 y 12 meses.
ResultadosTras un año, no se observaron cambios en la HbA1c en el total de los pacientes, si bien se comprobó un descenso significativo en los pacientes mal controlados. Sin embargo, aumentó el porcentaje de pacientes con HbA1c < 7,5% a los 6 meses (33,5 vs. 40,5%; p < 0,05), que se mantuvo al año. El número de hipoglucemias leves se redujo tras los 12 meses de tratamiento en aquellos pacientes con antecedentes de hipoglucemias leves. En cuanto al peso, no observamos cambios.
La dosis total de insulina/kg se incrementó significativamente en un 7,24% a los 6 meses y en un 8,69% al año por el aumento de la insulina basal. Las diferencias en las dosis a los 6 meses y al año no fueron significativas. Este aumento fue similar entre los grupos según el control metabólico, la presencia de hipoglucemias y no se relacionó con la insulina basal inicial, la HbA1c inicial, el número de hipoglucemias leves ni con el peso inicial.
DiscusiónEn la vida real glargina U300 muestra un mejor control glucémico en pacientes mal controlados, al reducir las hipoglucemias en pacientes con antecedentes de hipoglucemias sin incrementar el peso corporal.
Current treatment of type 1 diabetes mellitus (T1DM) does not always achieve metabolic control because, among other things, the ocurrence of hypoglycemic events associated to insulin use.
Material and methodsA descriptive real life study of 247 T1DM patients, 55.5% male, aged 46.53 ± 16.23 years, and with a mean diabetes duration of 21.89 ± 11.99 years, who were switched from basal insulin glargine U100 to glargine U300. The primary endpoints were changes in Hba1c and number of hypoglycemic events, while secondary endpoints included changes in weight and insulin dose after 6 and 12 months.
ResultsAfter one year, no changes were seen in HbA1c, but the proportion of patients with HbA1c values <7.5% increased at 6 months (33.5 vs. 40.5%; P<0.05) and remained stable during one year of follow-up. Hypoglycemic events significantly decreased after one year of treatment in patients with previous hypoglycemic events. No changes were seen in body weight.
Total insulin dose (U/kg) increased 7.24% at 6 months of treatment and by 8.69% at one year, mainly due to basal insulin. No changes were seen between the doses given at 6 and 12 months. These changes were similar in the different metabolic control groups and in patients with or without hypoglycemia. This increase was not related with prior basal insulin dose, baseline HbA1c level, number of hypoglycemic events or baseline weight.
DiscussionGlargine U300 is a good basal insulin alternative to treat T1DM, improving metabolic control in patients with HbA1c levels >7,5 and decreasing hypoglycemic events in patients with history of hypoglycemia without increasing body weight.
La diabetes mellitus tipo 1 (DM1) representa el 10-15% de los casos de diabetes mellitus en todo el mundo y su incidencia aumenta de un 3 a un 5% anualmente1. En España se ha estimado una prevalencia de DM1 del 0,08 al 0,2% de la población2 y estudios recientes han puesto de manifiesto el aumento de la incidencia principalmente en el rango de edad de 0 a 4 años3,4.
Para reducir la aparición de las complicaciones asociadas a la diabetes es fundamental conseguir un buen control glucémico. El buen control glucémico medido por cifras de hemoglobina glicosilada (HbA1c) ha demostrado reducir la aparición de complicaciones cardiovasculares, cerebrales, de daño neuropático y de pérdida de visión5,6.
Sin embargo, con los tratamientos insulínicos actuales no siempre se consiguen los objetivos de control metabólico. Unos de los mayores obstáculos es la aparición de episodios de hipoglucemia asociados al uso de insulina. Se estima que cada paciente con DM1 presenta 1,8 episodios de hipoglucemia leve por semana y entre 0,2 y 3,2 episodios anuales de hipoglucemias graves, que precisarán de la ayuda de una tercera persona7,8.
Es conocida la asociación entre los eventos de hipoglucemia sintomática y el aumento del riesgo de episodios cardiovasculares y de la mortalidad, por lo que debemos seleccionar el tratamiento con menor riesgo de hipoglucemias, principalmente en los pacientes con mayor riesgo de presentar eventos cardiovasculares9,10.
Este riesgo de presentar eventos hipoglucémicos se puede reducir mediante una adecuada educación diabetológica de los pacientes y con el uso de los nuevos esquemas terapéuticos basados en análogos de la insulina11.
A principios de 2016, fue aprobada en Europa la insulina glargina U300 (Gla-300) para su uso en pacientes con DM1 y DM2 adultos. Este nuevo análogo de insulina Gla-300 presenta unas características farmacológicas que le proporcionan una liberación más sostenida con un efecto más plano y duradero que el de la glargina U100 (Gla-100). En la práctica clínica esto se traduce en un control glucémico más estable más allá de las 24 h, una menor variabilidad glucémica y un menor riesgo de hipoglucemia, comparada con la Gla-10012,13.
En este estudio incluimos a pacientes con DM1 en tratamiento con Gla-100 a los que se cambió a Gla-300 y hemos evaluado su efectividad y seguridad en vida real.
Material y métodosSe diseñó un estudio descriptivo retrospectivo que incluyó a los pacientes en seguimiento en las consultas externas de endocrinología y nutrición de nuestro hospital con el diagnóstico de DM1, en tratamiento con insulina al menos durante un año. Se excluyó a las mujeres embarazadas, a los pacientes con diabetes secundaria, a los que presentaran cualquiera otra enfermedad y a los que tomaran cualquier medicación intercurrente que pudiera alterar el control glucémico.
Se selecciónó a 247 pacientes con DM1, el 55,5% varones, con una edad de 46,53 ± 16,23 años (13-84) y un tiempo de evolución de la enfermedad de 21,89 ± 11,99 años (1-58) en tratamiento con pauta de insulina bolo-basal, que usaban como basal Gla-100. A todos ellos se les sustituyó su análogo de insulina basal, Gla-100, por Gla-U300 entre marzo de 2016 y febrero de 2017. Los motivos fundamentales para el cambio fueron la variabilidad glucémica, la presencia de hipoglucemia, el efecto fin de acción de Gla-100 antes de las 24 h o la comodidad del dispositivo.
El momento de administración de Gla-300 fue el mismo que el de su anterior análogo basal (11,8% por la mañana; 48,8% a medio día; 39% por la noche y 0,4, equivalente a un paciente, en 2 dosis) y la dosis tampoco fue modificada en el momento del cambio. Los ajustes de dosis de insulina basal fueron realizados por el paciente ambulatoriamente según el control de la glucemia capilar para conseguir un objetivo entre 80 y 130mg/dl, siguiendo la misma escala que venía haciendo con anterioridad (aumentar la dosis basal en 2 unidades si la media de la glucemia basal durante 3 días consecutivos era superior a 130mg/dl). Los ajustes de insulina preprandial los hacía el paciente según su necesidad para conseguir cifras posprandiales menores de 180mg/dl a las 2 h poscomidas.
Los objetivos primarios fueron la valoración de los cambios en la HbA1c y en el número de hipoglucemias trascurridos 6 y 12 meses desde el cambio de tratamiento. Las hipoglucemias fueron definidas de acuerdo con las recomendaciones de la ADA14. Así, consideramos hipoglucemia leve cuando los valores de glucemia capilar son inferiores a 70mg/dl, con o sin sintomatología, e hipoglucemias graves, aquellas en las que el paciente requiera la ayuda de otra persona u hospitalización. El número de episodios de hipoglucemias leves fue reportado por los pacientes y se contabilizaron como episodios por semana y los de hipoglucemia grave fueron los reportados por el paciente y los registrados en la historia clínica informatizada.
Subdividimos nuestra muestra en 2 grupos de pacientes, según el control metabólico previo, buen control (HbA1c previa al cambio ≤7,5%) y mal control (HbA1c previa al cambio >7,5%) Además, analizamos la muestra en función de la presencia o ausencia de hipoglucemias leves (presencia de uno o más eventos de hipoglucemia por semana previamente al cambio versus ausencia de hipoglucemias en los 6 meses previos).
Los objetivos secundarios fueron evaluar los cambios en el peso y en la dosis de insulina por kilo, los cambios en las unidades de insulina basal y cambios en la cantidad de insulina prandial a los 6 y a los 12 meses.
Los datos fueron analizados con SPSS versión 15.0 para Windows (SPSS, Inc., Chicago, IL, EE. UU.). Se utilizó la prueba ANOVA para variables cuantitativas repetidas además de Bonferroni como análisis post hoc. Para variables cualitativas utilizamos la prueba de χ2 o exacta de Fisher cuando fue necesario y las correlaciones se realizaron con el test de Pearson. El nivel de significación se fijó en p < 0,05 a 2colas y los datos se expresaron en medias ± error estándar, a menos que se indique de otra manera.
ResultadosTras el cambio a Gla-300 de 247 pacientes, 6 suspendieron este tratamiento (2 por iniciar tratamiento con ISCI y 4 por empeoramiento en el control glucémico); 8 pacientes se perdieron en el seguimiento y 13 aún no han completado la revisión de los 12 meses. Presentamos los datos de 216 casos que completaron 2 revisiones a los 6 y a los 12 meses de seguimiento.
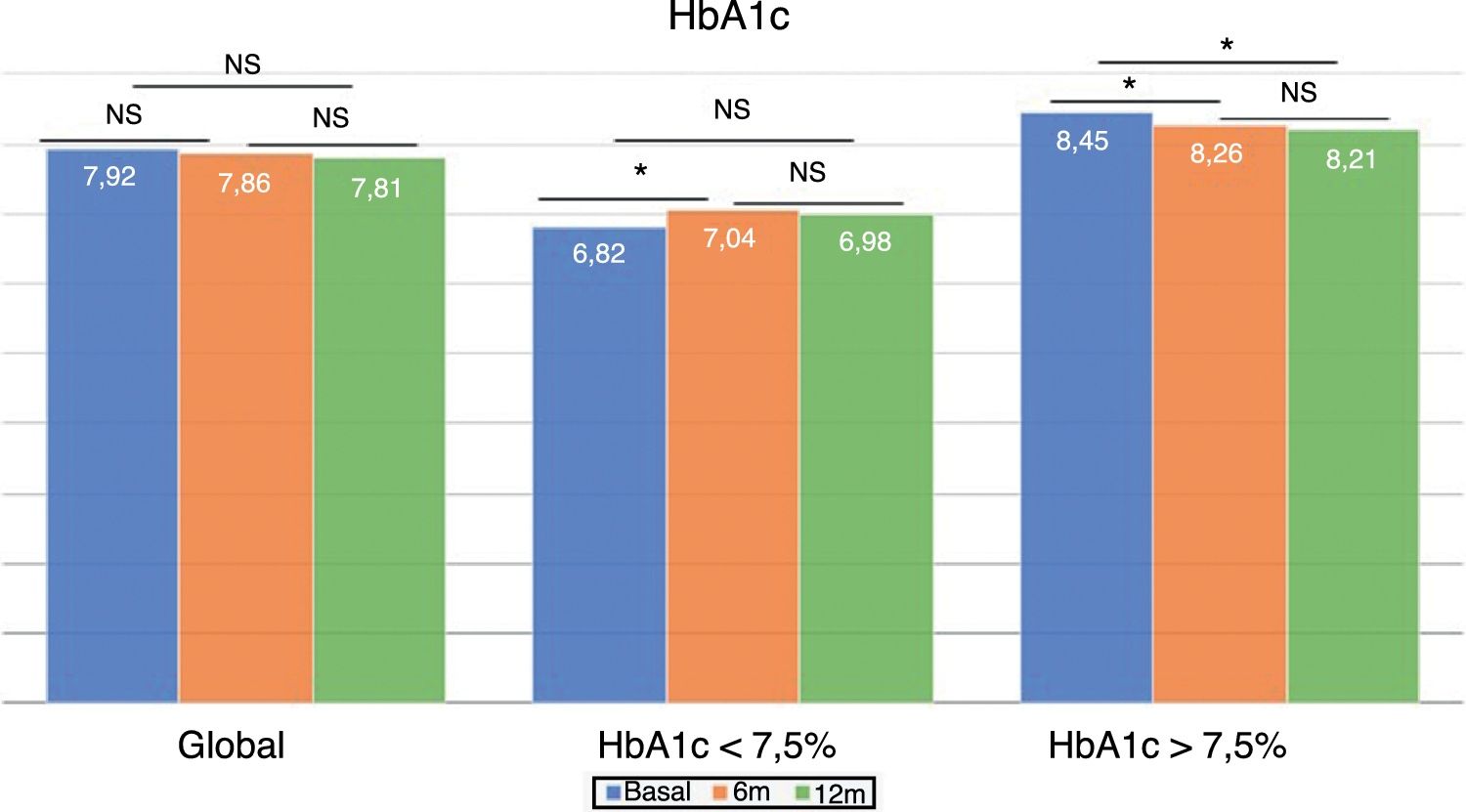
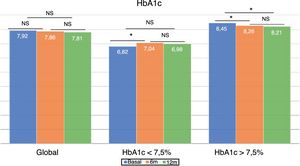
Cambios en el control glucémico e hipoglucemiasEn el global de los pacientes no se observaron diferencias en la cifra de HbA1c tras 6 meses del cambio de tratamiento, ni transcurrido un año (fig. 1). Sin embargo, el porcentaje de pacientes con HbA1c < 7,5% aumentó significativamente a los 6 meses (33,5 vs. 40,5%; p < 0,05) y al año (33,5 vs. 40,7%; p < 0,05). Lo mismo ocurrió con el porcentaje de pacientes con HbA1c < 8%, que aumentó significativamente a los 6 meses (52,7 vs. 61,0%; p < 0,05) y a los 12 meses de seguimiento (52,7 vs. 64,4%; p < 0,05).
El grupo con buen control glucémico previo experimentó un aumento significativo en la HbA1c a los 6 meses (6,82 ± 0,52 vs. 7,04 ± 0,74%; p < 0,05), que no se observó a los 12 meses (6,82 ± 0,52 vs. 6,98 ± 0,73%; p = NS). Sin embargo, los pacientes con mal control previo mostraron una mejora del control glucémico a los 6 meses (8,45 ± 0,68 vs. 8,26 ± 0,96%; p < 0,05), que persistió tras un año de seguimiento (8,45 ± 0,68 vs. 8,21 ± 0,92%; p < 0,05) (fig. 1).
En los 6 meses previos al cambio de la insulina, 6 pacientes presentaron hipoglucemias graves (7 episodios). A los 6 meses del cambio de tratamiento se registraron solamente 4 episodios de hipoglucemia grave en 4 pacientes y, al año, 2 episodios de hipoglucemia grave en 2 pacientes (uno de ellos presentaba previamente antecedentes de hipoglucemia grave a los 6 meses).
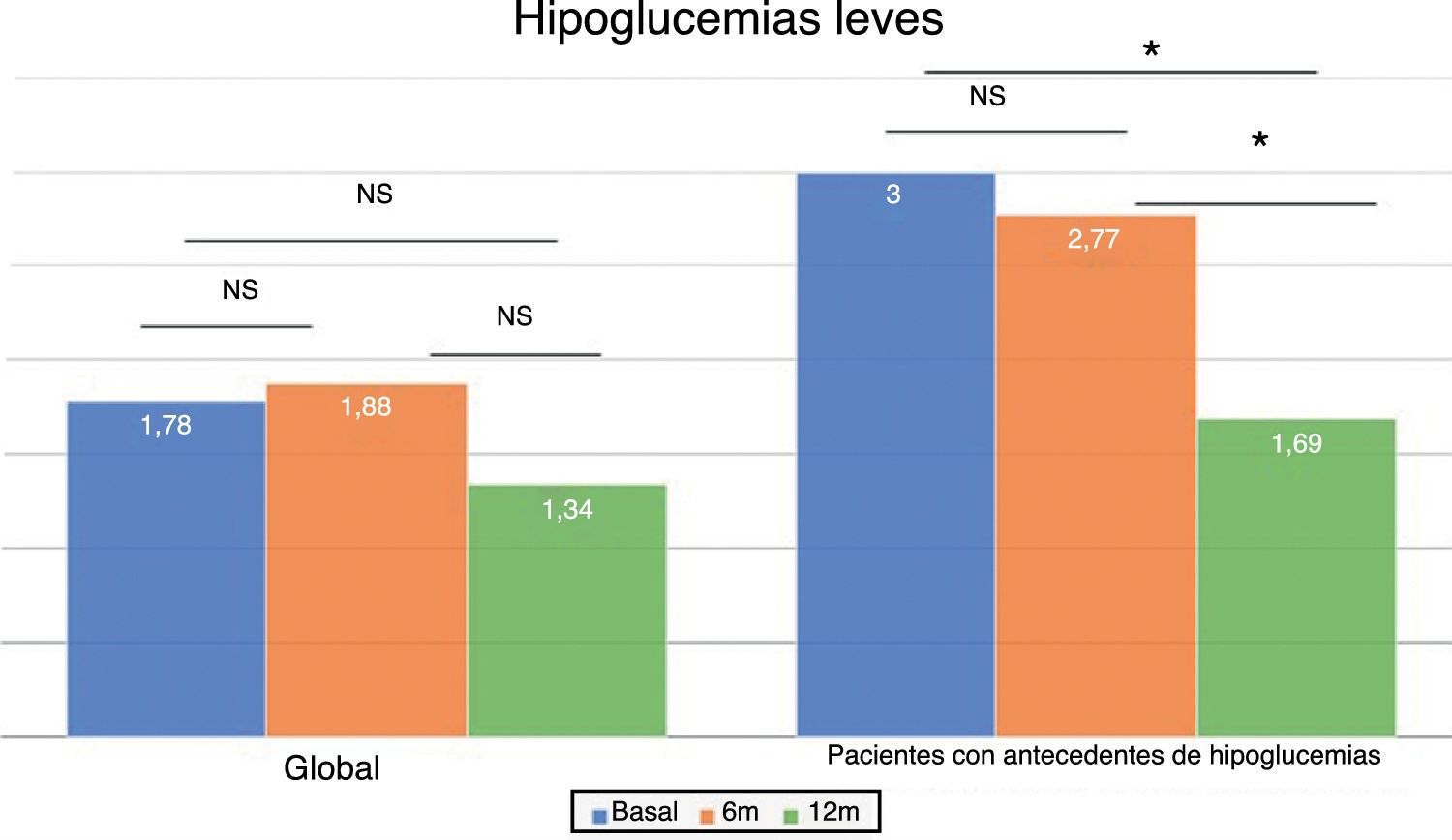
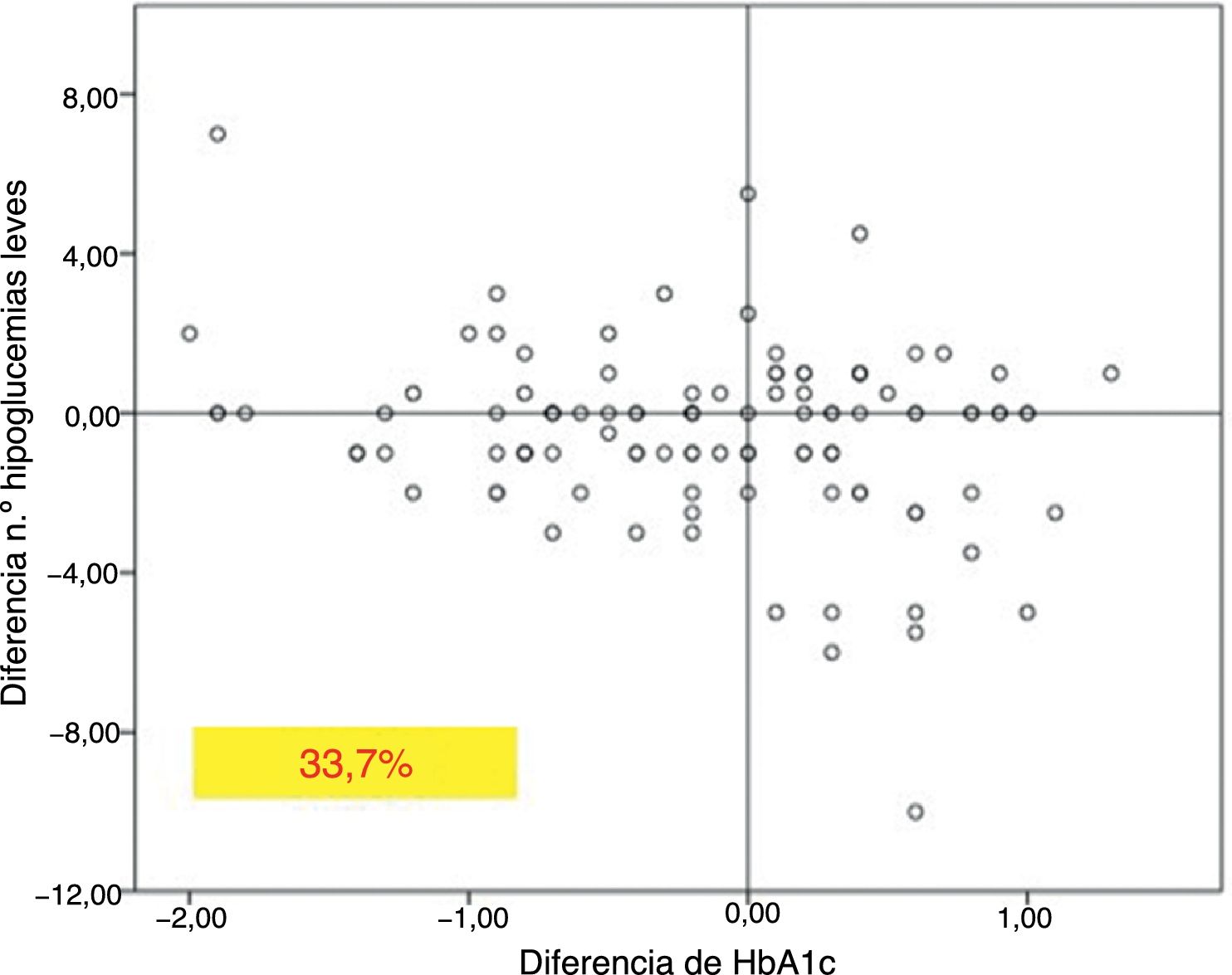
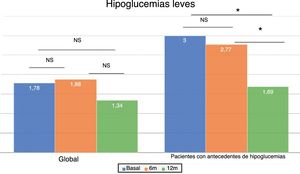
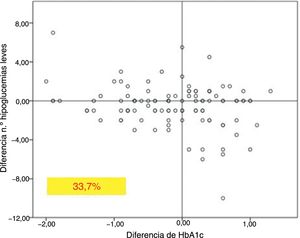
En el total de los pacientes, el número medio de hipoglucemias leves por semana previas al cambio de insulina fue de 1,64 ± 2,20 episodios/semana y no se modificó a lo largo del tiempo del estudio (fig. 2). Sin embargo, en los 101 pacientes con antecedentes de alguna hipoglucemia leve (40,5%), se produjo un descenso significativo tras los 12 meses de tratamiento: pasaron de 3,06 ± 2,72 a 1,70 ± 2,17 episodios/semana (p < 0,05) (fig. 2). No se observaron diferencias significativas a los 6 meses. El 83,8% de estos pacientes con antecedentes de hipoglucemias leves redujeron el número de eventos por semana tras un año de tratamiento con Gla-300 y un 33,7% disminuyeron a la vez la HbA1c y los eventos de hipoglucemia (fig. 3).
En función del control glucémico, los pacientes con HbA1c inicial < 7,5%, (n = 82) redujeron de manera no significativa los eventos de hipoglucemia pasados 12 meses del cambio de tratamiento (2,11 ± 2,64 vs. 1,89 ± 2,86 episodios/semana a los 6 meses y 1,24 ± 1,75 episodios/semana al año; p = NS). Este efecto no se observó en aquellos con mal control previo. La reducción en las hipoglucemias fue especialmente significativa a los 12 meses del cambio en aquellos pacientes con HbA1c < 7,5% y con antecedentes de hipoglucemias (n = 43) (basal 3,47 ± 3,04 vs. a los 12 meses 1,55 ± 2,11 episodios/semana al año; p < 0,05).
Cambios en el peso y la cantidad de insulinaEn cuanto al peso, observamos un descenso del peso a los 6 meses del cambio de tratamiento (74,16 ± 14,90 vs. 73,59 ± 14,99kg; p < 0,05). Sin embargo, al cabo de un año no se objetivaron cambios en el peso respecto al valor basal (74,16 ± 14,90 vs. 74,10 ± 15,10 kg; p = NS).
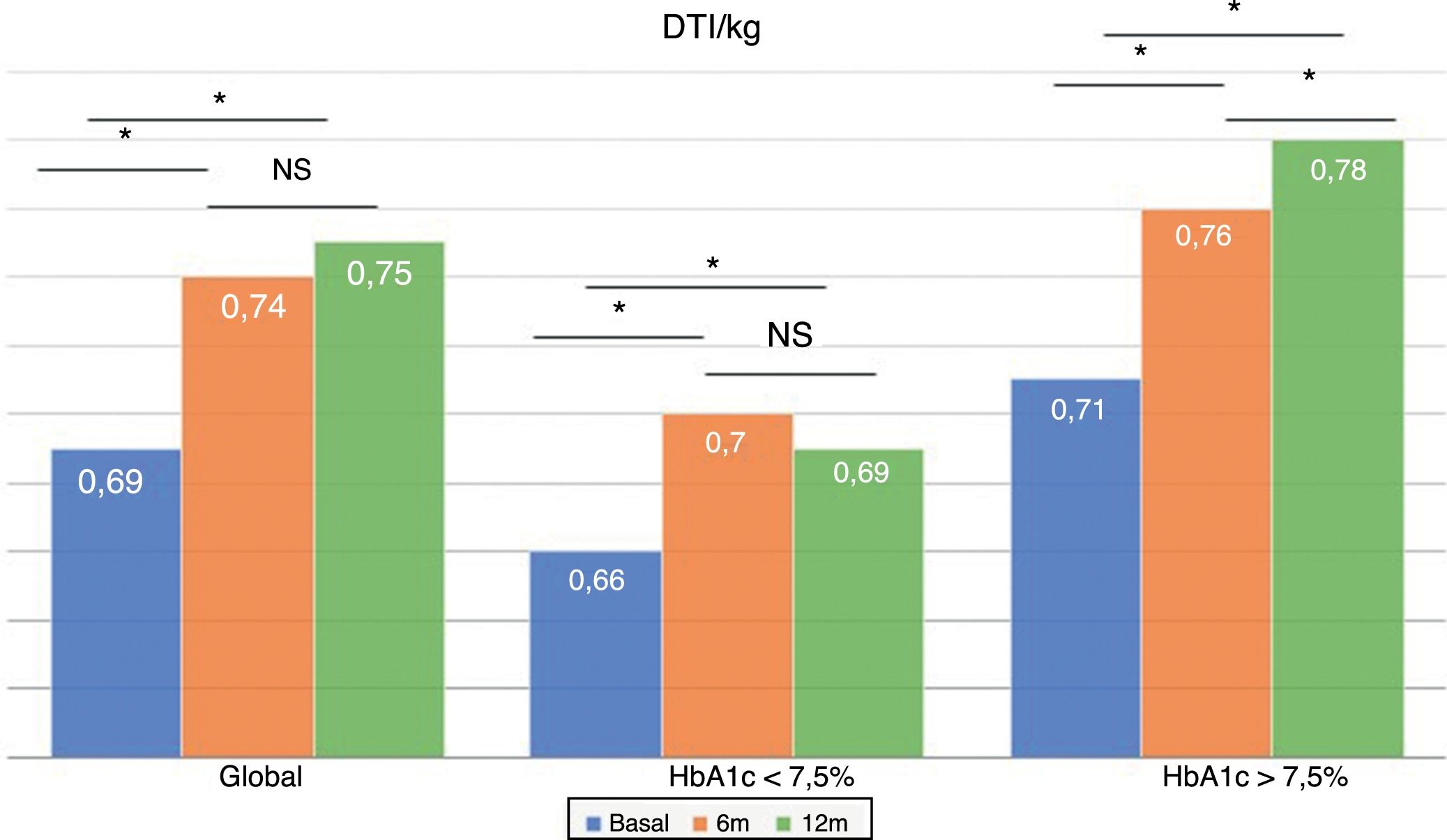
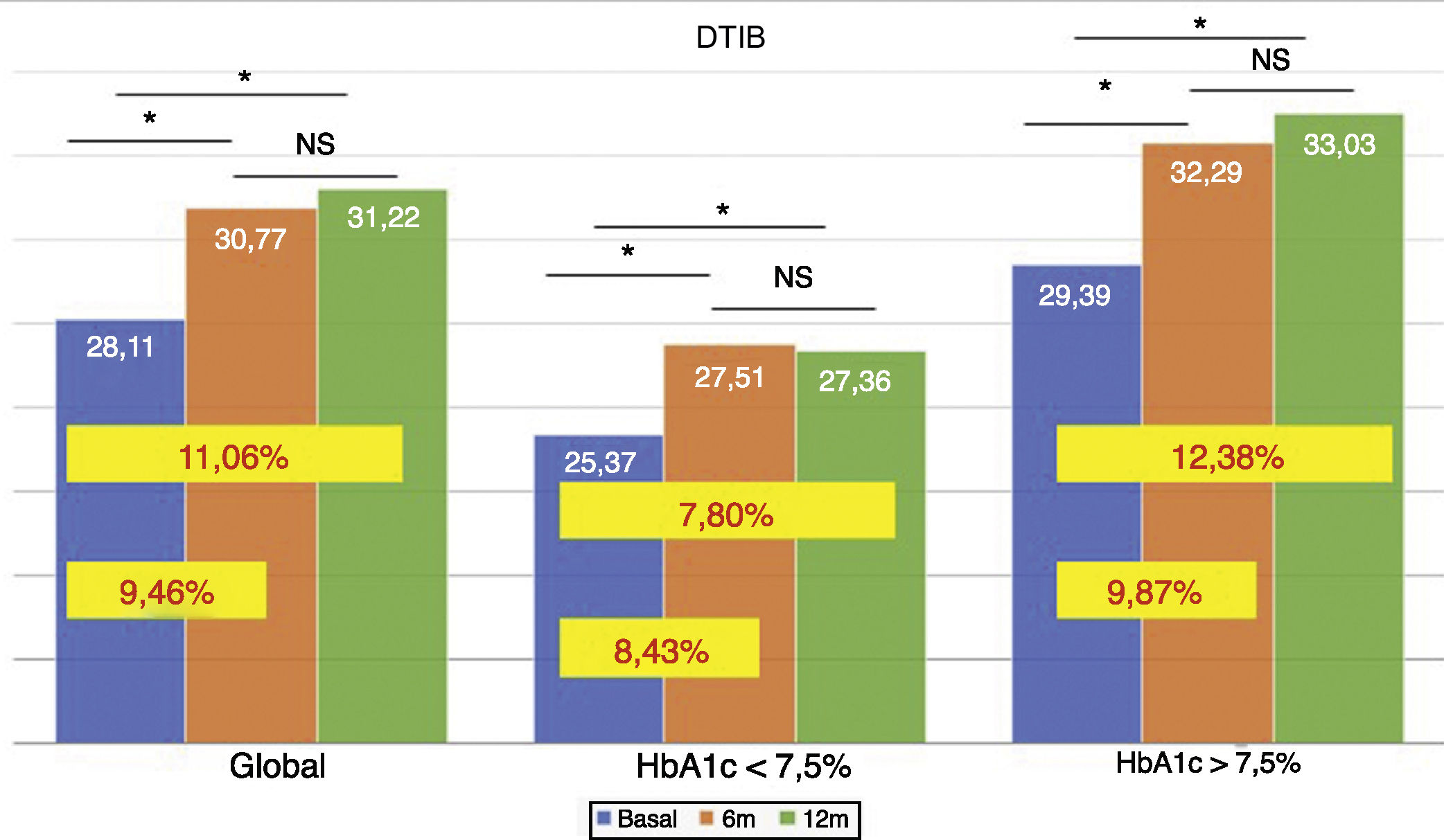
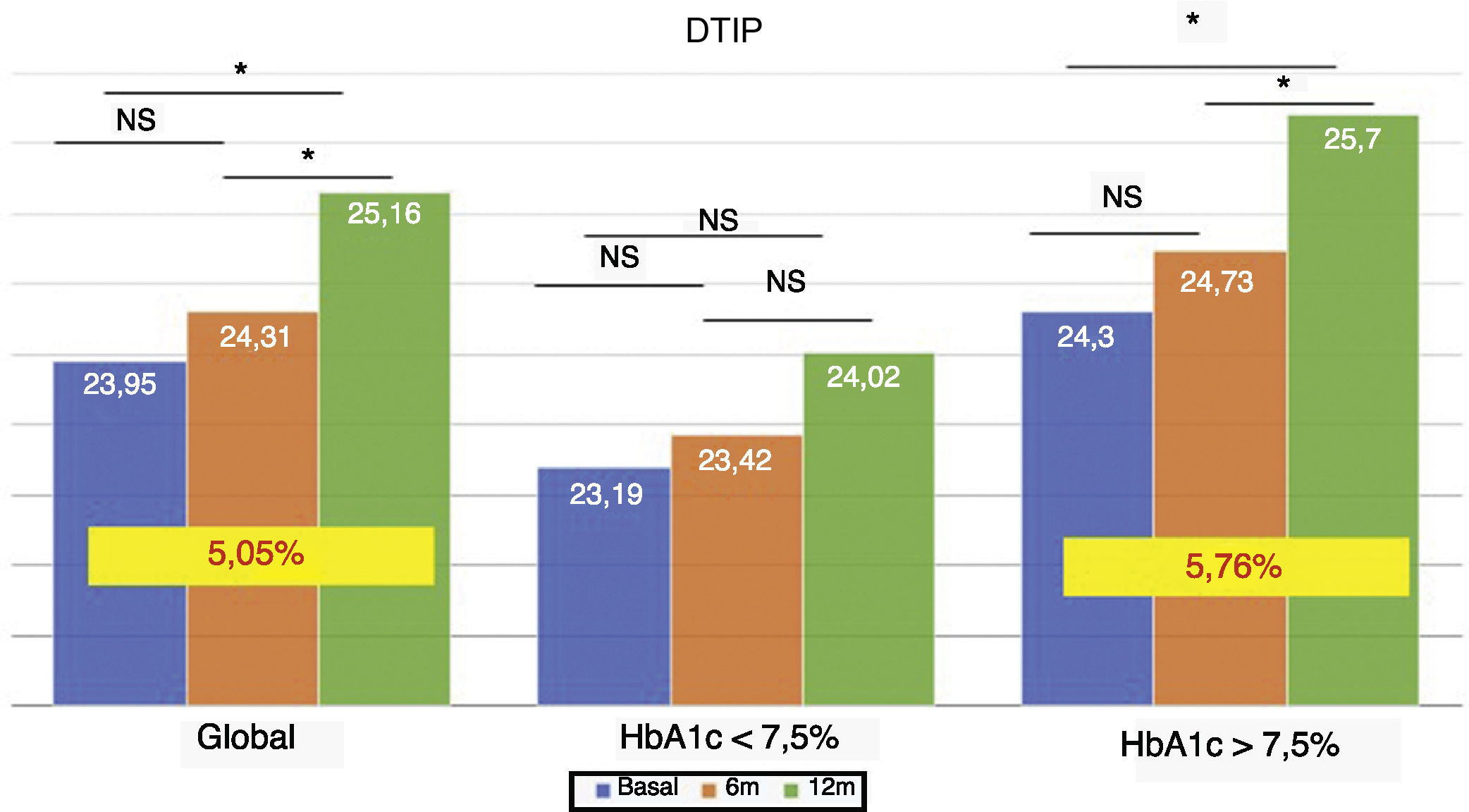
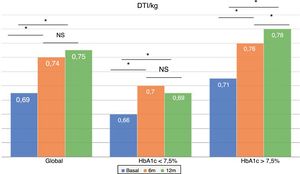
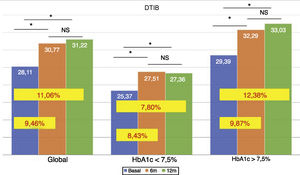
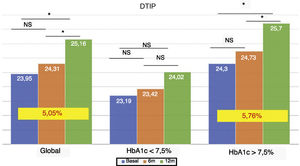
La dosis total de insulina/kg se incrementó significativamente en el global de los pacientes en un 7,25% a los 6 meses (0,69 ± 0,23 vs. 0,74 ± 0,23 UI/d/kg; p < 0,05) y al año en un 10,14% (0,69 ± 0,23 vs. 0,76 ± 0,24 UI/d/kg; p < 0,05) (fig. 4), aunque no se vieron diferencias entre los 6 meses y un año. Este aumento se produjo principalmente por el aumento de la insulina basal en los primeros 6 meses (el aumento medio de insulina basal fue de 9,46% a los 6 meses y de 11,06% al año de tratamiento) (fig. 5). El incremento de insulina basal transcurrido un año fue similar en los grupos de control metabólico y los grupos en función si presentaban o no hipoglucemias leves previas al cambio de insulina. Además, el cambio en la dosis de la insulina basal no se relacionó con la cantidad de insulina basal inicial, la HbA1c inicial, el número de hipoglucemias leves ni con el peso inicial de los pacientes. Los pacientes con buen control glucémico aumentaron de manera significativa su dosis de insulina basal en un 8,43% a los 6 meses y en un 7,80% al año (fig. 5), pero no experimentaron cambios significativos en la dosis de insulina prandial. Los pacientes con mal control glucémico previo aumentaron significativamente la dosis de insulina basal en un 9,87% a los 6 meses y en un 12,38% al año, sin diferencias significativas respecto a los pacientes con buen control (fig. 5). Sin embargo, incrementaron la cantidad de insulina rápida en un 5,76% al año de tratamiento (24,30 ± 12,73 vs. 25,70 ± 13,08 UI; p < 0,05) (fig. 6).
Nuestro estudio muestra la eficacia y seguridad de Gla-300 en pacientes con DM1 en vida real. Los estudios realizados en vida real con pacientes con DM2 a los que se les sustituyó su insulina basal por Gla-300 han demostrado un descenso similar de HbA1c al de otros análogos lentos, pero con un descenso significativo de las hipoglucemias y sus consecuencias asociadas15.
El programa EDITION, realizado en pacientes con DM1, ha demostrado que Gla-300 consigue un control glucémico similar y mantenido a los 12 meses frente a Gla-100, reduciendo el tiempo en hipoglucemia16. Sin embargo, en estudios en vida real, como el nuestro, sí se ha observado un descenso de la cifra de HbA1c. En este sentido, Gradiser et al.17 realizaron un estudio en 18 pacientes con DM1, con un control subóptimo, a los que cambiaron Gla-100 por Gla-300. Tras un seguimiento de 6 meses, observaron un descenso significativo de HbA1c, con reducción del número de episodios de hipoglucemia. Estos datos concuerdan con los de nuestro estudio, en el que los pacientes mal controlados reducen las cifras de HbA1c a los 6 meses y en el que aumenta de manera significativa el porcentaje de pacientes con cifras de HbA1c < 7,5%. Además, nosotros hemos podido comprobar que este efecto agudo se mantiene en el tiempo, al menos durante un año. En el estudio de Gradiser et al.17 no fueron incluidos pacientes con HbA1c < 7,5%. En nuestro estudio este subgrupo de pacientes aumenta ligeramente su cifra de HbA1c en los primeros 6 meses, pero no muestra diferencias significativas respecto a los valores basales pasado un año. Por tanto, son necesarios más estudios con pacientes con DM1 con buen control y que incluyan otros aspectos (variabilidad glucémica, calidad de vida) para poder concluir que este subgrupo va a beneficiarse del cambio de Gla-100 por Gla-300.
En cuanto a las hipoglucemias, observamos que, aquellos pacientes con antecedentes de hipoglucemias leves, mostraban un descenso significativo del número de dichas hipoglucemias al año del cambio del tratamiento. Cabe destacar que el 33,7% de los pacientes con antecedentes de hipoglucemias leves conseguían reducir estos episodios, además de la cifra de HbA1c. Estos datos difieren de los presentados en otros estudios, donde se muestran descensos de hipoglucemias leves en las primeras semanas de tratamiento18,19 a expensas principalmente de las hipoglucemias nocturnas, pero sin observar diferencias entre Gla-100 y Gla-300 en los seguimientos a un año. Estas diferencias observadas en nuestra muestra podrían estar explicadas por el número bajo de hipoglucemias por semana de nuestros pacientes o por no contabilizarlas como otros estudios, que miden el número medio de hipoglucemias por paciente17. Un estudio diseñado específicamente para valorar este punto, utilizando medición continua de glucemia, podría ayudar a aclarar el beneficio agudo de Gla-300 sobre las hipoglucemias leves en DM1. Además, el descenso de los episodios de hipoglucemia podría estar relacionado con la mayor duración de efecto de Gla-300, con un perfil de liberación más plano y mantenido más allá de las 24 h12.
En cuanto al peso, no observamos variación tras el cambio a Gla-300 a lo largo del seguimiento de un año, a pesar de un aumento de la dosis total de insulina. Esto difiere de otros estudios reportados previamente, en los que se describen discretos aumentos de peso con Gla-30020, aunque menores que con Gla-10016.
La dosis total de insulina por kg de peso aumentó de forma significativa en el total de los pacientes a los 6 meses y al año, fundamentalmente a expensas de la insulina basal, sin demostrar diferencias significativas cuando comparamos los grupos en función del control glucémico o la presencia de hipoglucemias, lo que demuestra que el aumento de dosis se relaciona con las propiedades farmacocinéticas de Gla-300. En diferentes estudios se ha demostrado este mismo efecto16, en los que se atribuye esta necesidad de aumento de dosis a un mayor depósito subcutáneo21. De igual manera que lo observado en el estudio EDITION JP119, este aumento de insulina basal se produce en los primeros 6 meses y se mantiene durante el año de seguimiento. Por otro lado, el estudio en vida real realizado por Gradiser et al.17 no mostró cambios en la dosis de insulina basal tras un seguimiento de 6 meses. La selección de los pacientes, las cifras de HbA1c inicial o el hecho de que todos los pacientes seleccionados presentaran hipoglucemias son datos que podrían justificar estas diferencias.
En conclusión, este estudio, realizado en vida real con pacientes con DM1, muestra que la insulina Gla-300 es una alternativa segura y eficaz en el tratamiento de este tipo de pacientes. Este nuevo análogo de insulina basal puede proporcionar un mejor control glucémico a los pacientes mal controlados y reducir la aparición de hipoglucemias leves en aquellos pacientes con antecedentes de hipoglucemias leves, sin incrementar el peso corporal. Queda por aclarar qué beneficios podría proporcionar a pacientes con buen control metabólico y sin antecedentes de hipoglucemias leves.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.