La prevalencia de la obesidad se ha incrementado mundialmente en las últimas décadas. La obesidad se asocia a múltiples comorbilidades, como la diabetes tipo 2, que generan un gran impacto en la salud y en la economía. La pérdida de peso en este colectivo favorece el control glucémico, por lo que es uno objetivo a lograr. Los cambios en el estilo de vida son poco efectivos por sí solos, y en los últimos años se han desarrollado otras opciones terapéuticas como la cirugía bariátrica/metabólica, así como fármacos para la diabetes tipo 2 y fármacos para reducir peso en la obesidad. El objetivo de la revisión es la comparación de los resultados en reducción de peso y control glucémico de los distintos tipos de fármacos con los resultados de la cirugía bariátrica/metabólica en diabetes tipo 2.
The prevalence of obesity has increased worldwide over the past decades. Obesity is associated with multiple comorbidities, such as type 2 diabetes, that generates a great impact on health and economy. Weight loss in these patients leads to glycemic control so it is a target to achieve. Lifestyle changes are not effective enough and recently other treatments have been developed such as bariatric/metabolic surgery, as well as drugs for type 2 diabetes and antiobesity drugs. The aim of this review is to compare the results in weight reduction and glycemic control of the different kinds of drugs with bariatric / metabolic surgery's results in type 2 diabetes.
Habitualmente el exceso de peso se clasifica atendiendo al índice de masa corporal (IMC), pero es importante considerar además la presencia o no de comorbilidades como factor pronóstico1. En algunas personas el sobrepeso (IMC≥25kg/m2) y la obesidad (IMC≥30kg/m2) tienen un impacto negativo por su asociación con alteraciones psicológicas, limitación funcional, comorbilidades como diabetes mellitus tipo 2 (DM2), enfermedades cardiovasculares2 y mayor mortalidad1,3. Incluso, las personas en las que aparentemente producen pocos efectos («metabólicamente sanos») tienen a largo plazo mayor riesgo de eventos cardiovasculares y más mortalidad al comparar con población con IMC normal4.
Según la OMS en 2016 más de 1,9 billones de adultos presentaban sobrepeso y, de ellos, 650 millones eran obesos5. El aumento de incidencia de la obesidad y la gravedad de la misma conlleva mayor prevalencia de DM2 y favorece el desarrollo de complicaciones en este colectivo. Los pacientes con DM2 alcanzan una reducción menor de pérdida de peso que las personas sin diabetes, en parte favorecido por algunos tipos de tratamientos hipoglucemiantes, como el tratamiento con insulina. El tratamiento dietético y los cambios en el estilo de vida son pilares fundamentales en el manejo de la obesidad y la DM2 (pérdidas de peso ≥3% en pacientes con DM2 mejoran el control glucémico)6, pero con frecuencia los resultados son pobres y difíciles de mantener en el tiempo7.
Recientemente se ha aprobado el uso de diferentes fármacos8 para el tratamiento de la obesidad que contribuyen a mejorar el control de la DM2 favoreciendo la pérdida ponderal. Así mismo, existen fármacos para el tratamiento de la DM2 que tienen efecto beneficioso sobre el peso como los ISGLT-2 y los análogos de GLP1. La cirugía bariátrica ha mostrado ser eficaz en la pérdida de peso y en la resolución de las comorbilidades, especialmente la DM29–13.
El objetivo de esta revisión es analizar el efecto sobre el control metabólico en DM2 del tratamiento farmacológico de la obesidad y el de algunos fármacos utilizados para el tratamiento de la DM2 sobre la pérdida de peso. Además se compararán los resultados con los obtenidos con la cirugía bariátrica/metabólica.
Fármacos para el tratamiento de la diabetes tipo 2 que favorecen la pérdida de pesoLa metformina se mantiene como primera opción terapéutica en pacientes obesos con DM2, no solo por el control de la hiperglucemia, sino porque su empleo se ha asociado a disminución de la ingesta y pequeñas pérdidas ponderales en pacientes con DM214, en adultos con prediabetes15 y en niños con sobrepeso e hiperinsulinemia16.
Recientemente se ha producido una profunda trasformación en el tratamiento de la DM2 con la incorporación de nuevos fármacos hipoglucemiantes que presentan efecto favorable sobre el control metabólico y promueven importantes pérdidas ponderales.
Inhibidores selectivos de los cotransportadores de sodio-glucosaActúan inhibiendo los cotransportadores sodio-glucosa tipo 2 en el riñón y bloqueando la reabsorción de glucosa en el túbulo proximal, mecanismos independientes de la insulina. Inducen una pérdida renal de aproximadamente 75g de glucosa (∼300kcal)17, favoreciendo un balance energético negativo. En un metaanálisis de 2013 se publicó un descenso de HbA1C en torno al 0,66%18 con estos fármacos. Estudios más recientes refieren un descenso de HbA1C entre 0,45% y 1,03% y una pérdida ponderal entre 2,2 y 3,6kg respecto al peso inicial del individuo19.
Pueden emplearse en cualquier estadio de la DM2, en combinación con la mayoría de fármacos antidiabéticos, e incluso pueden preservar la función beta del páncreas. Los efectos adversos más relevantes descritos con su empleo son: infecciones genitourinarias, depleción de volumen y cetoacidosis diabética, siendo esta última menos frecuente pero más relevante por su gravedad.
Los estudios EMPA-REG20 y CANVAS21 han demostrado en los pacientes con DM2 tratados con empagliflozina y canagliflozina, respectivamente, disminución en los eventos cardiovasculares y renales.
Análogos del péptido similar al glucagón tipo 1Los análogos del péptido similar al glucagón tipo 1 (AGLP-1) potencian la secreción de insulina mediada por glucosa, estimulan de secreción de insulina por las células beta, suprimen la de glucagón por las células alfa pancreáticas y enlentecen el vaciado gástrico. De esta forma disminuyen a largo plazo la HbA1C entre 0,4% y 1,7% según estudios22. Los AGLP-1 producen además saciedad, disminución del apetito y de la ingesta alimentaria y actúan en el sistema nervioso central, lo que lleva a una pérdida ponderal entre 0,9 y 5,3kg23,24. También presentan efecto sobre el gasto energético y la termogénesis25. En una revisión sistemática reciente, en la que se comparan diferentes AGLP-1 (albiglutide, dulaglutide, exenatide 2 veces al día y semanal y liraglutide) no se observaron diferencias importantes en la pérdida de peso, aunque dulaglutide y liraglutide fueron superiores en el control glucémico comparado con exenatide 2 veces al día26. Semaglutide, comparado con exenatide semanal, ha demostrado superioridad en el control glucémico y en la reducción de peso (–1,5% vs. –0,9% de HbA1C y –5,6 vs. –1,9kg de peso)27.
Los efectos adversos asociados con su empleo se recogen en la tabla 1.
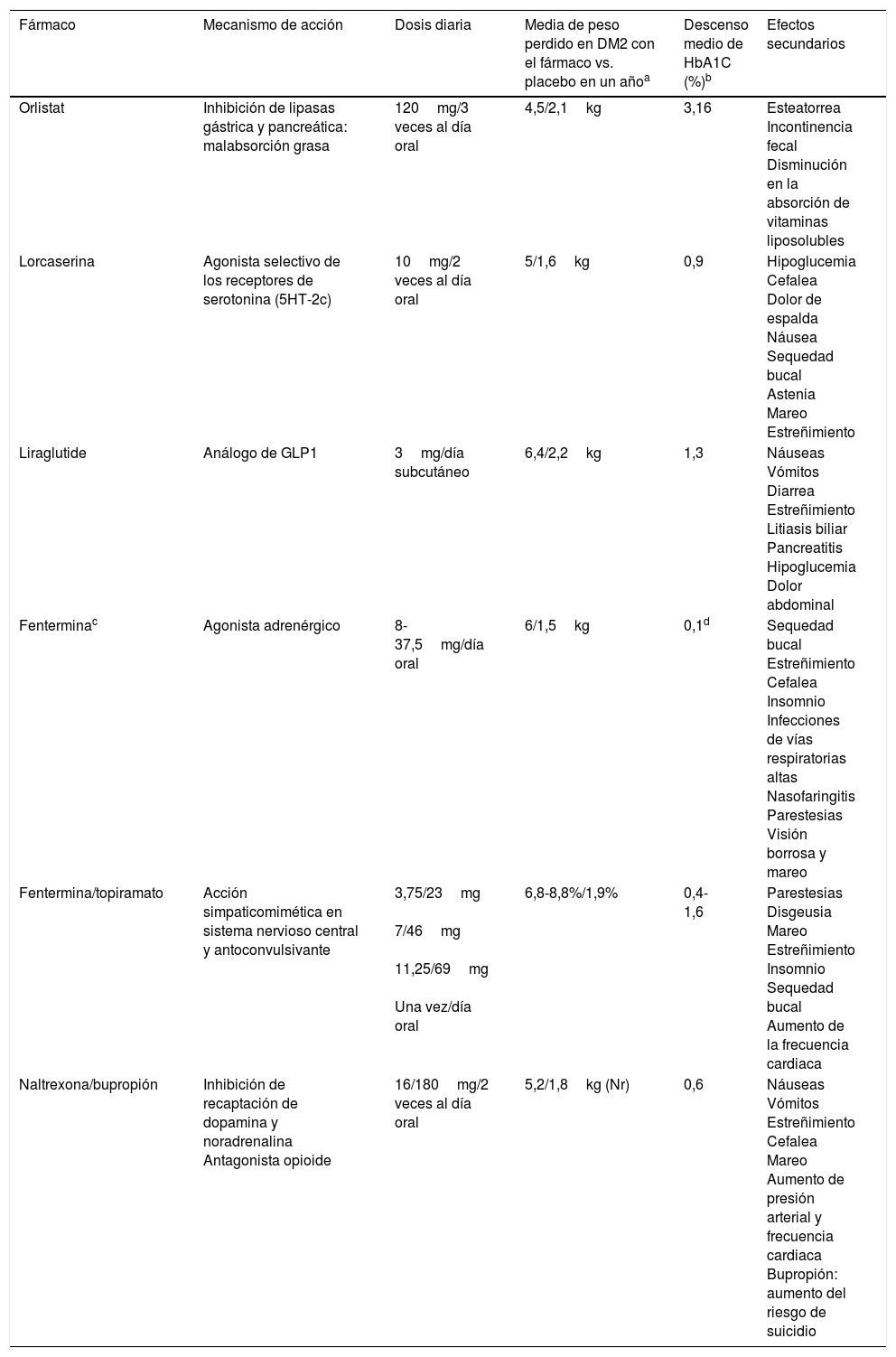
Fármacos para la pérdida de peso en obesidad. Mecanismo de acción, dosis diaria y efectos secundarios
| Fármaco | Mecanismo de acción | Dosis diaria | Media de peso perdido en DM2 con el fármaco vs. placebo en un añoa | Descenso medio de HbA1C (%)b | Efectos secundarios |
|---|---|---|---|---|---|
| Orlistat | Inhibición de lipasas gástrica y pancreática: malabsorción grasa | 120mg/3 veces al día oral | 4,5/2,1kg | 3,16 | Esteatorrea Incontinencia fecal Disminución en la absorción de vitaminas liposolubles |
| Lorcaserina | Agonista selectivo de los receptores de serotonina (5HT-2c) | 10mg/2 veces al día oral | 5/1,6kg | 0,9 | Hipoglucemia Cefalea Dolor de espalda Náusea Sequedad bucal Astenia Mareo Estreñimiento |
| Liraglutide | Análogo de GLP1 | 3mg/día subcutáneo | 6,4/2,2kg | 1,3 | Náuseas Vómitos Diarrea Estreñimiento Litiasis biliar Pancreatitis Hipoglucemia Dolor abdominal |
| Fenterminac | Agonista adrenérgico | 8-37,5mg/día oral | 6/1,5kg | 0,1d | Sequedad bucal Estreñimiento Cefalea Insomnio Infecciones de vías respiratorias altas Nasofaringitis Parestesias Visión borrosa y mareo |
| Fentermina/topiramato | Acción simpaticomimética en sistema nervioso central y antoconvulsivante | 3,75/23mg 7/46mg 11,25/69mg Una vez/día oral | 6,8-8,8%/1,9% | 0,4-1,6 | Parestesias Disgeusia Mareo Estreñimiento Insomnio Sequedad bucal Aumento de la frecuencia cardiaca |
| Naltrexona/bupropión | Inhibición de recaptación de dopamina y noradrenalina Antagonista opioide | 16/180mg/2 veces al día oral | 5,2/1,8kg (Nr) | 0,6 | Náuseas Vómitos Estreñimiento Cefalea Mareo Aumento de presión arterial y frecuencia cardiaca Bupropión: aumento del riesgo de suicidio |
Nr: No reportado.
Los beneficios cardiovasculares observados son atribuidos a los efectos pleiotrópicos extrapancreáticos de los AGLP-1 sobre el sistema cardiovascular y el impacto favorable sobre otros factores de riesgo cardiovascular no glucémicos, como el peso, la presión arterial y los lípidos. Los receptores de GLP-1 se encuentran distribuidos en diferentes lugares del organismo, como las células endoteliales, las células cardiacas y las células musculares lisas de los vasos. El mecanismo de acción se basa en la activación de la enzima óxido nítrico sintetasa y la inhibición de otros factores endoteliales, disminuyendo la disfunción endotelial y la arteriosclerosis. El tratamiento con liraglutide o exenatide se ha asociado con disminución de la presión arterial y biomarcadores de riesgo cardiovascular, como el inhibidor del activador del plasminógeno-1 y la proteína C reactiva. Otros efectos beneficiosos de los AGLP-1 se han observado sobre el perfil lipídico, disminuyendo los niveles de ácidos grasos libres, triglicéridos y colesterol LDL28.
Los estudios LEADER29 y SUSTAIN 630 han demostrado en los pacientes con DM2 tratados con liraglutide y semaglutide, respectivamente, disminución en los eventos cardiovasculares y renales. Liraglutide además produce disminución de la grasa visceral, en concreto la esteatosis hepática31.
Combinación de fármacosLa combinación de inhibidores selectivos de los cotransportadores de sodio-glucosa y AGLP-1 es una opción terapéutica atractiva para pacientes con DM2 y obesidad, ya que los mecanismos de acción de estos fármacos son complementarios. El estudio DURATION 8 mostró que la combinación de dapagliflozina una vez al día y exenatide semanal conseguía una reducción de 3,4kg de peso y del 2% de HbA1C tras 28 semanas de tratamiento32. El estudio AWARD-10, recientemente publicado online, muestra descenso de 1,34% de HbA1C en pacientes con DM2 no controlados con inhibidores selectivos de los cotransportadores de sodio-glucosa, cuando se asocia dulaglutide 1,5mg semanal tras 24 semanas de tratamiento33. Otras combinaciones farmacológicas son posibles: en un análisis post-hoc del estudio CANVAS el tratamiento con canagliflozina 300mg al día junto a AGLP-1 (exenatide o liraglutide) produjo un descenso adicional de peso y presión arterial sistólica34.
Fármacos para la pérdida de peso en obesidad y su uso en pacientes con diabetes tipo 2A la vez que se han ido retirando algunos fármacos aprobados para la pérdida de peso por presentar importantes efectos adversos35, se han ido aprobando otros nuevos. En Europa lorcaserina, fentermina/topiramato y fentermina en monoterapia aún no están disponibles. Los fármacos están indicados cuando el IMC es ≥30kg/m2 o ≥27kg/m2 con comorbilidades como dislipidemia, hipertensión, apnea obstructiva del sueño o DM236. Siempre deben ofertarse junto con cambios del estilo de vida. En la tabla 1 se describen los fármacos aprobados para la obesidad en Estados Unidos, el mecanismo de acción, la dosis diaria, los efectos en el peso y el control glucémico y los principales efectos secundarios.
OrlistatEn un metaanálisis que incluye 12 ensayos clínicos aleatorizados en pacientes obesos con DM2, la administración de orlistat produce una pérdida de 4,25kg de peso y una disminución de la HbA1C de 3,16%. En el grupo tratado con placebo solo se consigue pérdida de 2,1kg y descenso de 2,52% en la HbA1C37.
El tratamiento con orlistat ha demostrado disminuir en aproximadamente un 50% el riesgo de progresión a DM2 en pacientes con prediabetes, aunque no altera el grado de progresión a DM2 cuando la glucemia basal es normal. Orlistat también tiene efecto positivo sobre factores de riesgo cardiovascular y disminuye la tensión arterial, la circunferencia de cintura y el colesterol LDL significativamente más que el placebo38. En pacientes con síndrome metabólico ha demostrado reducir el riesgo coronario39.
La prescripción de orlistat sería más apropiada en pacientes con estreñimiento y/o hipercolesterolemia que limiten la ingesta de grasa alimentaria, y se debería evitar su uso en pacientes con enfermedad gastrointestinal con episodios de diarrea y en gestantes40.
LorcaserinaEl estudio BLOOM-DM muestra que, con respecto al placebo, los pacientes tratados con lorcaserina logran más pérdida ponderal (5kg vs. 1,6kg) y mayor descenso de la HbA1C (0,9% vs. 0,4%). Tras 52 semanas de tratamiento el 37% de pacientes consigue una pérdida de peso ≥5% (pacientes respondedores)41. En un análisis posterior se observaron beneficios en el control glucémico, tanto en pacientes respondedores como en no respondedores42.
La glucemia basal puede disminuir en las primeras semanas de tratamiento con lorcaserina, por lo que se debería considerar ajustar la dosis de hipoglucemiantes en pacientes con DM2 controlada43. En el estudio BLOOM-DM se produjo hipoglucemia sintomática en el 7,4% de pacientes con DM2 tratados con lorcaserina a dosis de 10mg 2 veces al día, en el 10,5% de los tratados con una dosis diaria única de lorcaserina y en el 6,3% de los del grupo placebo41. En un metaanálisis en el que se evalúa la adición de lorcaserina a metformina, comparado con la adición de otros hipoglucemiantes, se observó no inferioridad en la disminución de HbA1C, y sin embargo el riesgo de hipoglucemia no era diferente al resto de hipoglucemiantes, excepto las sulfonilureas, cuyo riesgo de hipoglucemia era mayor cuando se añadía a metformina44.
En función de su mecanismo de acción la prescripción de lorcaserina sería adecuada en pacientes con gran apetito y en diabetes, y contraindicada en pacientes con enfermedad valvular cardiaca o en tratamiento con otros fármacos cuya vía de acción sea la serotonina o en gestantes40.
Liraglutida 3mgEl estudio SCALE Diabetes demostró una pérdida de peso de 6,4kg empleando dosis de liraglutida de 3mg, 5kg con dosis de 1,8mg y 2,2kg para placebo. El 54,3% de los pacientes presentaron pérdida ≥5% del peso con la dosis de 3mg. Considerando el control glucémico, se obtuvo un descenso de 1,3% en la HbA1C empleando 3mg, 1,1% con 1,8mg y 0,3% con placebo45. Un análisis posterior demostró disminución del riesgo de DM2 en pacientes con obesidad y prediabetes con la dosis de 3mg46.
La prescripción de liraglutida sería más adecuada en pacientes que refieren no presentar saciedad con los alimentos, con alteración del metabolismo hidrocarbonado o enfermedad cardiovascular. Sin embargo, liraglutide debería evitarse en pacientes con antecedente de carcinoma medular de tiroides, pancreatitis o en gestantes40.
FerterminaUn estudio aleatorizado en el que se comparaban fentermina, topiramato y la combinación de los 2 fármacos durante 28 semanas, demostró que fentermina a dosis de 15mg al día producía un media de 6kg de pérdida de peso comparado con 1,5kg con placebo47. Otro estudio no demostró diferencias en la pérdida de peso con el tratamiento continuo o alternado de fentermina frente a placebo48.
La prescripción de fentermina en monoterapia sería más adecuada en pacientes jóvenes, con el objetivo de disminuir el apetito. Su prescripción está aprobada para periodos cortos de tiempo (3 meses). Este fármaco no es adecuado en pacientes con enfermedad cardiovascular (hipertensión, afección cardiaca) hipertiroidismo, ansiedad, insomnio, glaucoma, historia personal de drogadicción o uso reciente de fármacos IMAO o en gestantes40.
Fentermina/topiramatoEl estudio CONQUER incluyó 2487 pacientes con sobrepeso, obesidad y comorbilidades (15,6% con DM2) y demostró, en pacientes tratados con esta asociación de fármacos frente a los tratados con placebo, más pérdida ponderal (8,8% vs. 1,9%) y mayor descenso de la HbA1C (0,4% vs. 0,1%) tras 56 semanas de tratamiento49. En el estudio de extensión (SEQUEL),en el grupo de pacientes con diabetes se observó un descenso de hasta 0,4% de HbA1C a las 52 semanas de tratamiento.
Resultados similares se obtuvieron en el estudio OB-202/DM-230, donde el 65% de los pacientes tratados durante 56 semanas con fentermina/topiramato perdieron ≥5% del peso (24% con placebo). Además, el grupo tratado con esta asociación farmacológica presentó mayor reducción de peso (9,4kg vs. 2,7kg con placebo) y de HbA1C (1,6% vs. 1,2% con placebo)50. Empleando dosis de 15mg/92mg durante 108 semanas disminuye la progresión hacia DM2 en pacientes con prediabetes y/o síndrome metabólico51.
Fentermina/topiramato presenta las mismas indicaciones y contraindicaciones que fentermina en monoterapia, y además se debe evitar este tratamiento en pacientes con nefrolitiasis40.
Naltrexona/bupropiónEl estudio COR-Diabetes, realizado en 505 pacientes con DM2, mostró que en los tratados con esta asociación durante 56 semanas frente a los tratados con placebo se lograba más pérdida de peso (5% vs. 1,8%) y mayor descenso de la HbA1C (0,6% vs. 0,1%). El 44,5% de los pacientes consiguió una pérdida de peso ≥5% en el grupo con tratamiento farmacológico frente al 18,9% con placebo52.
La prescripción de naltrexona/bupropión sería más adecuada en pacientes que presenten comportamientos de ansiedad o adicción a los alimentos, y que manifiesten otras conductas adictivas como el consumo de alcohol o tabaco y/o presenten depresión. No estaría indicado en pacientes con riesgo de convulsión o en tratamiento con IMAO, hipertensión, dolor no controlado, discontinuación brusca de benzodiacepinas, alcohol, fármacos antiepilépticos o barbitúricos o en gestantes40. Bupropión puede aumentar el riesgo de suicidio y se debería evitar en los pacientes con estas características.
Terapias farmacológicas futurasExisten nuevas combinaciones farmacológicas en estudio para la pérdida de peso. La combinación de fentermina/lorcaserina fue evaluada en un ensayo clínico aleatorizado, doble ciego, en una muestra de 238 pacientes sin diabetes, con obesidad o sobrepeso con al menos una comorbilidad. Se demostró una mejora en la pérdida de peso a corto plazo sin un aumento en los efectos secundarios serotorinérgicos53. Otra combinación farmacológica posible en el futuro es canagliflozina/fentermina. Este tratamiento demostró mayor pérdida de peso y una reducción ≥5% de la presión arterial sistólica comparado con placebo en un ensayo clínico en fase 2, con una muestra de 335 pacientes sin diabetes con obesidad o sobrepeso con hipertensión o dislipidemia54. Existen otros tratamientos que se encuentran en estudio, como los agonistas de los receptores de melanocortina 4 (con un papel importante en la regulación de la ingesta alimentaria), inhibidores de la enzima metionil aminopeptidasa 2 y péptidos intestinales (péptido YY [3-36], agonistas de los receptores de PYY y antagonistas de la grelina). También se están desarrollando fármacos híbridos (actúan doblemente sobre los receptores de GLP-1 y GIP, o receptores de GLP-1 y GLP-2 o en receptores de GLP-1 y glucagón) y fármacos agonistas de triple acción55.
Cirugía bariátrica/metabólicaEn las guías más recientes se recomienda como objetivo en el tratamiento de la obesidad la pérdida de 5-10% del peso basal a lo largo de 6 meses36, lo que resulta difícil de conseguir con modificaciones dietéticas y cambios en el estilo de vida, incluso si se asocian fármacos7. La cirugía es más efectiva en la pérdida de peso (15-30%)56 y en reducir, a largo plazo, la mortalidad y las comorbilidades. Esto ha producido un incremento significativo en el número de cirugías bariátricas/metabólicas realizadas en los últimos años.
Las técnicas quirúrgicas más utilizadas son el bypass gástrico en Y de Roux (RYGB) (48% de las intervenciones mundiales) y la gastrectomía vertical o en manga (VSG), (42%) seguidas de la banda gástrica ajustable laparoscópica (LAGB) (8%) y la derivación biliopancreática (BPD) (2%)57. En un metaanálisis que incluye 136 estudios, en el que se analizan los resultados de 22.000 intervenciones quirúrgicas (la mayoría a corto plazo), el porcentaje de exceso de peso perdido medio es de 61,6% empleando RYGB, 68,2% con VSG, 70,1% con BPD y 47,5% con LAGB58.
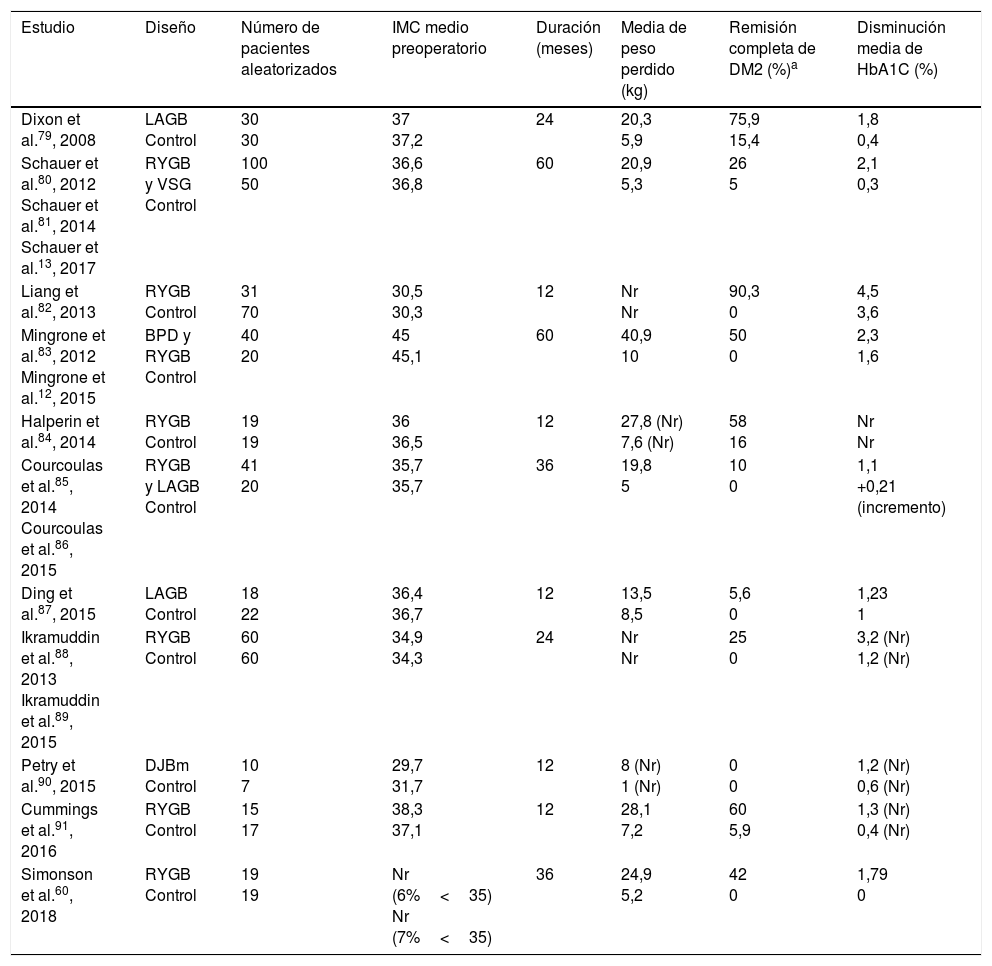
Además de la pérdida de peso, la cirugía bariátrica/metabólica ha mostrado resolución de comorbilidades como DM2 y otros factores de riesgo cardiovascular (hipertensión y dislipidemia) en estudios observacionales, como el Swedish Obese Study9, y en ensayos clínicos (tabla 2). Aunque se aprecia remisión de DM2 en el 30-63% de casos, esta puede aparecer de nuevo en el 35-50% de pacientes. La HbA1C experimenta una reducción media del 2% tras la cirugía frente a una reducción del 0,5% para el tratamiento médico habitual59. Simonson et al.60 publican en un estudio aleatorizado reciente en el que la HbA1C desciende 1,9% en pacientes con DM2 tratados con cirugía bariátrica, sin apreciarse cambios en el grupo con tratamiento médico intensivo. A pesar de estos efectos beneficiosos, en la actualidad, pocos pacientes con DM2 (<1%) acceden a la cirugía36.
Ensayos clínicos aleatorizados controlados en cirugía bariátrica/metabólica en pacientes con DM2
| Estudio | Diseño | Número de pacientes aleatorizados | IMC medio preoperatorio | Duración (meses) | Media de peso perdido (kg) | Remisión completa de DM2 (%)a | Disminución media de HbA1C (%) |
|---|---|---|---|---|---|---|---|
| Dixon et al.79, 2008 | LAGB Control | 30 30 | 37 37,2 | 24 | 20,3 5,9 | 75,9 15,4 | 1,8 0,4 |
| Schauer et al.80, 2012 Schauer et al.81, 2014 Schauer et al.13, 2017 | RYGB y VSG Control | 100 50 | 36,6 36,8 | 60 | 20,9 5,3 | 26 5 | 2,1 0,3 |
| Liang et al.82, 2013 | RYGB Control | 31 70 | 30,5 30,3 | 12 | Nr Nr | 90,3 0 | 4,5 3,6 |
| Mingrone et al.83, 2012 Mingrone et al.12, 2015 | BPD y RYGB Control | 40 20 | 45 45,1 | 60 | 40,9 10 | 50 0 | 2,3 1,6 |
| Halperin et al.84, 2014 | RYGB Control | 19 19 | 36 36,5 | 12 | 27,8 (Nr) 7,6 (Nr) | 58 16 | Nr Nr |
| Courcoulas et al.85, 2014 Courcoulas et al.86, 2015 | RYGB y LAGB Control | 41 20 | 35,7 35,7 | 36 | 19,8 5 | 10 0 | 1,1 +0,21 (incremento) |
| Ding et al.87, 2015 | LAGB Control | 18 22 | 36,4 36,7 | 12 | 13,5 8,5 | 5,6 0 | 1,23 1 |
| Ikramuddin et al.88, 2013 Ikramuddin et al.89, 2015 | RYGB Control | 60 60 | 34,9 34,3 | 24 | Nr Nr | 25 0 | 3,2 (Nr) 1,2 (Nr) |
| Petry et al.90, 2015 | DJBm Control | 10 7 | 29,7 31,7 | 12 | 8 (Nr) 1 (Nr) | 0 0 | 1,2 (Nr) 0,6 (Nr) |
| Cummings et al.91, 2016 | RYGB Control | 15 17 | 38,3 37,1 | 12 | 28,1 7,2 | 60 5,9 | 1,3 (Nr) 0,4 (Nr) |
| Simonson et al.60, 2018 | RYGB Control | 19 19 | Nr (6%<35) Nr (7%<35) | 36 | 24,9 5,2 | 42 0 | 1,79 0 |
BPD: biliopancreatic diversion; DJBm: duodenal-jejunal bypass surgery with minimal gastric resertion; LAGB: laparoscopic adjustable gastric band; Nr: no reportado; RYGB: roux-en-Y gastric bypass; VSG: vertical sleeve gastrectomy.
El orden de elección de la técnica en cuanto a su efectividad para la mejoría de DM2 y la pérdida de peso sería BPD>RYGB>VSG>LAGB. El orden inverso correspondería a la seguridad de la técnica57. Aunque la derivación biliopancreática es teóricamente la más efectiva, es la menos utilizada por sus efectos secundarios derivados de la malabsorción. Por tanto, la RYGB se considera de elección para los pacientes con DM2, aunque el uso de la VSG es superior en muchos países. En España, en general, se ha experimentado un incremento del uso de la VSG en los últimos 15 años61.
Todas las técnicas quirúrgicas mejoran el control glucémico por la pérdida de peso; sin embargo, los resultados son más pronunciados con RYGB y VSG y se producen antes de la pérdida ponderal62,63. Una posible explicación sería la recuperación de la función de las células beta pancreáticas tras estas técnicas quirúrgicas. En la mejoría o resolución de la DM2 se han implicado también otros mecanismos independientes de la pérdida de peso64–67: modificación en los ácidos biliares, cambios en el microbioma intestinal y en los mecanismos de detección de nutrientes en el tracto digestivo que modulan la sensibilidad a la insulina, aumento en la secreción posprandial de hormonas intestinales (GLP-1), exclusión de los nutrientes de la zona proximal del duodeno e intestino delgado y regulación a la baja de factores antiincretínicos aún no identificados. Todos ellos pueden contribuir al efecto «antidiabético» de la cirugía metabólica. Cualquier paciente con DM2, independientemente de su IMC, puede beneficiarse de los mecanismos antidiabéticos no relacionados con la pérdida de peso68. En esta línea, la Sociedad Americana de Diabetes en 2018 recomienda considerar la cirugía metabólica en pacientes con IMC a partir de 30kg/m2 (27,5kg/m2 en asiáticos) con DM2 no controlada69, además de las indicaciones clásicas en pacientes con IMC≥35kg/m2 (32,5kg/m2 en asiáticos) con hiperglucemia no controlada o IMC≥40kg/m2 (37,5kg/m2 en asiáticos). Tras la cirugía bariátrica es necesario el ajuste del tratamiento hipoglucemiante de los pacientes con diabetes, ya que en la mayoría de los casos precisan reducción, o incluso discontinuación del tratamiento previo a la intervención por la mejoría del control glucémico70.
A pesar de sus buenos resultados metabólicos y ponderales, las diferentes técnicas quirúrgicas no están exentas de complicaciones71. La LAGB presenta altas tasas de reintervención por erosión, deslizamiento y obstrucción, y puede provocar dilatación esofágica progresiva. La VSG presenta, comparando con RYGB, mayor riesgo de aparición de reflujo gastroesofágico en el postoperatorio y problemas obstructivos a largo plazo. Las complicaciones asociadas a RYGB son náuseas y vómitos (incluso deshidratación), síndrome de dumping y, menos frecuente, neumonía, infección de la herida quirúrgica, arritmias cardiacas y colelitiasis. A largo plazo puede aparecer obstrucción intestinal, úlceras marginales y hernias. Existen complicaciones potencialmente mortales como el shock secundario a hemorragia postoperatoria, la sepsis por dehiscencia anastomótica o la enfermedad cardiopulmonar. La enfermedad tromboembólica presenta una incidencia en torno al 0,34%56. Otro inconveniente de la cirugía es la recuperación ponderal a largo plazo (entre el 2% y 18% de los pacientes, dependiendo de la técnica, vuelven al peso de base)72 y secundariamente la aparición de nuevo de las comorbilidades asociadas a la obesidad, como la DM2.
Tras la cirugía bariátrica es necesario mantener un seguimiento nutricional, especialmente tras la realización de procedimientos malabsortivos. Durante el primer año tras la intervención se debe realizar análisis de sangre con parámetros nutricionales cada 3 meses, cada 6 meses durante el segundo año poscirugía y anual posteriormente. Se recomienda la suplementación crónica con vitaminas y minerales en mayor o menor dosis en función del tipo de cirugía realizado73. Para prevenir la deficiencia de micronutrientes es necesaria la suplementación en forma de polivitamínico o suplementando de forma separada con tiamina 12mg/día, vitamina B12 (350-500mcg/día), ácido fólico (400-800mcg/día) y hierro (al menos 18mg/día y entre 45-60mg/día en caso de mujeres en estado fértil y tras cirugías malabsortivas). Otros aportes necesarios son el calcio (1.200-1.500mg/día para RYGB, SG y LAGB y 1.800-2.400mg/día para BPD) y vitamina D3 (3.000U/día hasta alcanzar niveles en sangre de vitamina D>30ng/ml), vitamina A (5.000-10.000UI/día), vitamina K (90-120mcg/día), vitamina E (15mg/día), cinc (8-22mg/día) y cobre (1-2mg/día)74. De especial atención es la deficiencia grave de tiamina, ya que puede causar la encefalopatía de Wernicke.
Técnicas quirúrgicas futurasEn los últimos años se han desarrollado innovadoras técnicas quirúrgicas dirigidas a obtener el beneficio «antidiabético» de la cirugía no relacionado con la pérdida de peso. Se consigue el control metabólico y una pérdida discreta de peso. Dichas técnicas incluyen:
- 1.
La transposición ileal y sus variantes (transposición ileal aislada, combinada con sleeve gástrico o combinada con sleeve gástrico y exclusión duodenal)75: el mecanismo de la transposición ileal se basa en la interposición de un segmento de íleon en el yeyuno proximal favoreciendo el paso temprano de alimento por el íleon. Con ello se produce un aumento de GLP-1 que favorece la secreción de insulina y aumenta la sensación de saciedad.
- 2.
Bypass duodeno-yeyunal con o sin sleeve gástrico y Endobarrier: una de las teorías que explica su efecto es que el cambio de dirección de los alimentos tras las cirugía puede producir que los factores endocrinos presentes en el duodeno y en el yeyuno que favorecen la resistencia a la insulina disminuyan y lleven a una respuesta metabólica sostenida75. En el caso de la técnica de Endobarrier consiste en la implantación de un dispositivo, evitando el contacto de los alimentos con la pared del intestino proximal76. Disminuye la glucemia basal desde la primera semana de inserción y reduce 1,2-2,3% la HbA1C. La principal limitación de esta técnica es que el polímero debe ser necesariamente retirado a los 6-12 meses, o incluso antes si aparecen complicaciones (dolor abdominal, náuseas, vómitos, sangrado)77.
- 3.
Otras técnicas: Single Anastomosis Duodenal Ileostomy with sleeve gastrectomy y Single Anastomosis Duodenal Jenunostomy: son técnicas efectivas en la resolución de la diabetes, pero con frecuentes complicaciones nutricionales similares la derivación biliopancreática75.
La fisiopatología de la obesidad es compleja y es difícil elaborar un tratamiento efectivo. La cirugía bariátrica/metabólica se indicó inicialmente en obesidad grave, pero ha demostrado recientemente que es igualmente eficaz en la resolución de comorbilidades en obesidad más leve. Los fármacos tienen menor potencia en cuanto a la pérdida de peso y control glucémico, pero no presentan el riesgo de la cirugía y no precisan suplementos vitamínicos a largo plazo. La prescripción debe ser individualizada y, si no es efectiva o aparecen efectos adversos, debe ser discontinuada y cambiar a otros fármacos con otros mecanismos de acción.
La combinación de la cirugía y fármacos es una opción terapéutica atractiva. Los fármacos podrían utilizarse en pacientes que experimentan una pérdida inadecuada de peso tras la cirugía o nueva ganancia ponderal en el tiempo78, pero se necesitan más estudios para generalizar su uso en esta población.
En el futuro también podremos contar con nuevas técnicas y procedimientos quirúrgicos, así como nuevos fármacos para la pérdida de peso que en la actualidad se encuentran en investigación.
Conflicto de interesesLos autores Rosa Cámara Gómez y Juan Francisco Merino Torres han participado en ponencias sobre fármacos para la reducción de peso en la obesidad. Matilde Rubio-Almanza declara no tener ningún conflicto de intereses.