Tedizolid fosfato es un antibiótico del grupo de las oxazolidinonas que ha sido recientemente aprobado para el tratamiento de las infecciones bacterianas agudas de la piel y tejidos blandos, causadas por cocos gram-positivos1. Este fármaco, de segunda generación, tiene mayor actividad in vitro que su análogo linezolid2–4. Aunque los puntos de corte para la sensibilidad a tedizolid frente a Staphylococcus han sido establecidos recientemente5, su actividad frente a aislados resistentes a linezolid (RL) no ha sido bien estudiada. Nuestro objetivo es la evaluación in vitro de la sensibilidad a tedizolid de Staphylococcus coagulasa-negativos resistentes a meticilina y a linezolid (SCN-RL) y Staphylococcus aureus resistentes a la meticilina (SARM). Como objetivo secundario hemos comparado la sensibilidad de nuestros aislados a otros antibióticos utilizados como alternativa en las infecciones por SARM.
Se estudió la sensibilidad in vitro a tedizolid en 22 SCN-RL y 33 SARM aislados en el Servicio de Microbiología del Hospital Universitario San Cecilio de Granada a partir de 2007. Nueve de los SCN-RL fueron recuperados de un trabajo previo realizado por Sorlozano et al.6. La identificación fue realizada mediante MALDI-TOF (Bruker Daltonics®, Alemania) y a todos se les estudió la concentración mínima inhibitoria (CMI) frente a tedizolid, linezolid, vancomicina, ceftarolina y daptomicina mediante el método de difusión con tira de gradiente (Liofilchem®, Italia). Adicionalmente, se estudió la CMI frente a eritromicina, clindamicina, cloranfenicol y estreptogramina A en todos los aislados RL, y se evaluaron los diferentes perfiles de resistencia relacionados con diferentes mecanismos de resistencia a linezolid7: mutaciones puntuales en el dominio V del ARN ribosómico 23S (gen rrn), presencia del gen cfr o mutaciones en los genes que codifican las proteínas L3 y L4 de la subunidad ribosómica 50S. Todos los aislados fueron sembrados en agar de Mueller-Hinton con un inóculo 0,5 de McFarland, incubando 24h a 37°C. La resistencia a meticilina se comprobó utilizando cefoxitina de 5μg. La interpretación de la CMI a los diferentes antibióticos se realizó según las recomendaciones EUCAST (v 6.0). Todos los aislados redundantes con un periodo menor a 5 días para un mismo paciente fueron excluidos. Asimismo, se realizó un estudio de clonalidad mediante electroforesis en gel de campo pulsado (PFGE)6, en los aislados que presentaron indicios de brote epidemiológico: aislados que estuvieron agrupados en tiempo y espacio8.
Se analizaron 55 aislados de 30 varones (54,5%) y 25 mujeres (45,5%), de diferentes localizaciones; 29 muestras de hemocultivos (13 S. aureus, 7 S. epidermidis y 9 S. hominis), 15 muestras respiratorias (15 S. aureus) y 11 muestras procedentes de exudados (5 S. aureus y 6 S. epidermidis).
La relación epidemiológica de los pacientes infectados por SCN-LR fue la siguiente: 9 de los pacientes infectados por S. hominis entre 2007 y 2008 estuvieron ingresados en la unidad de cuidados intensivos (n=8) y urgencias (n=1). El resto de pacientes infectados por SCN-LR (S. epidermidis, n=13), estuvieron ingresados en diferentes servicios entre 2009 y 2015: cirugía general (n=2, 2009-2013), medicina interna (n=3, 2010-2015), digestivo (n=1, 2009), vascular (n=2, 2009-2014), nefrología (n=3, 2011-2015), anestesia (n=1, 2010) y urgencias (n=1, 2013). El estudio de clonalidad para los aislados de S .hominis que presentaron indicios de brote epidemiológico confirmó la presencia de 2 clones diferentes: clon A (n=8) y clon B (n=1)6, el resto de aislados no presentaron indicios de brote epidemiológico.
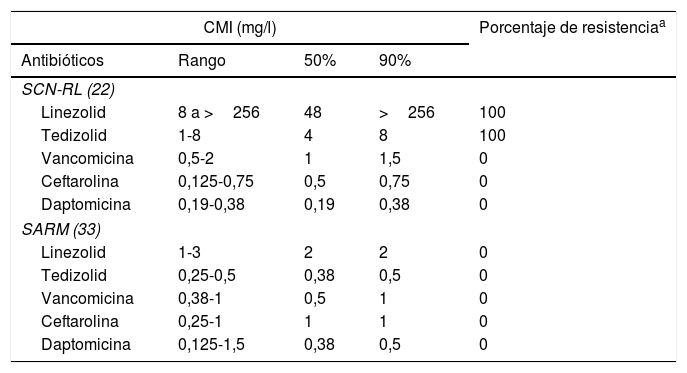
Todos los aislados fueron resistentes a meticilina. El perfil de sensibilidad para los aislados se presenta en la tabla 1. Tedizolid demostró tener mayor actividad in vitro en comparación con linezolid. La CMI90 para tedizolid frente a SCN-RL y SARM fue menor (8 y 0,5mg/l) en comparación a la observada para linezolid (>256mg/l y 2mg/l). Asimismo, se estimaron intervalos para la CMI de tedizolid frente a SCN-RL y SARM de 1 a 8mg/l y de 0,25 a 0,5mg/l, respectivamente, en comparación con linezolid (CMI de 8 a >256mg/l para SCN-RL y de 1 a 3mg/l para SARM). Encontramos resistencia a tedizolid en todos los SCN-RL (CMI>0,5mg/l, punto de corte de EUCAST para considerarlos resistentes). Asimismo 4 de los SARM tuvieron una CMI a tedizolid de 0,5mg/l. No se encontró resistencia a vancomicina, ceftarolina o daptomicina en ninguno de los aislados que hemos estudiado.
Resumen de la actividad in vitro de diferentes antibióticos en 22 aislados de SCN-RL y 33 SARM
| CMI (mg/l) | Porcentaje de resistenciaa | |||
|---|---|---|---|---|
| Antibióticos | Rango | 50% | 90% | |
| SCN-RL (22) | ||||
| Linezolid | 8 a >256 | 48 | >256 | 100 |
| Tedizolid | 1-8 | 4 | 8 | 100 |
| Vancomicina | 0,5-2 | 1 | 1,5 | 0 |
| Ceftarolina | 0,125-0,75 | 0,5 | 0,75 | 0 |
| Daptomicina | 0,19-0,38 | 0,19 | 0,38 | 0 |
| SARM (33) | ||||
| Linezolid | 1-3 | 2 | 2 | 0 |
| Tedizolid | 0,25-0,5 | 0,38 | 0,5 | 0 |
| Vancomicina | 0,38-1 | 0,5 | 1 | 0 |
| Ceftarolina | 0,25-1 | 1 | 1 | 0 |
| Daptomicina | 0,125-1,5 | 0,38 | 0,5 | 0 |
CMI: concentración mínima inhibitoria; SARM: Staphylococcus aureus resistentes a la meticilina; SCN-RL: Staphylococcus coagulasa-negativos resistentes a meticilina y a linezolid.
Los fenotipos de resistencia de los SCN-LR fueron compatibles con la presencia de una única cepa portadora del gen cfr (resistencia cruzada a linezolid, los fenicoles, las lincosamidas y a la estreptogramina A, así como sensibilidad a los macrólidos), con una CMI a linezolid mayor de 256mg/l y a tedizolid de 3mg/l. Asimismo, encontramos otra cepa compatible con la presencia de mutaciones en el dominio V del ARN ribosómico 23S (resistencia a linezolid y sensibilidad a los fenicoles, lincosamidas, estreptogramina A y a macrólidos), con una CMI para linezolid y tedizolid de 32 y 6mg/l, respectivamente. El resto de aislados presentaron fenotipos compatibles con la coexistencia de varios mecanismos de resistencia.
Tedizolid se presenta como un fármaco con una elevada potencia, y en consonancia con otras series, presentamos datos que muestran una CMI90 4 a 16 veces inferior en comparación con linezolid9. Aunque nuestros resultados sugieren una mayor actividad in vitro de este antibiótico, como en otros estudios realizados en Staphylococcus RL10,11, la CMI de tedizolid se presenta con frecuencia superior al punto de corte establecido por EUCAST. En nuestro estudio, la CMI50 y CMI90 frente a SCN-RL fue de 4 y 8mg/l, respectivamente, y todos fueron resistentes.
Aunque existen estudios que demuestran una mayor sensibilidad a tedizolid en aislados RL que son portadores del gen cfr12, no hemos podido demostrar este hecho. Sin embargo, presentamos resultados que demuestran una elevada resistencia a tedizolid en aislados que con frecuencia presentan perfiles fenotípicos de resistencia compatibles con la presencia de varios mecanismos de resistencia a linezolid. A la luz de estos hechos, ha sido recientemente descrita la existencia de un nuevo plásmido (optrA) que confiere resistencia a linezolid y a los fenicoles13. Por lo tanto, se hace necesaria la presencia de nuevos estudios que aporten datos definitivos sobre la eficacia de tedizolid en aislados RL, que con frecuencia poseen varios mecanismos de resistencia a este fármaco.