Los pacientes con virus de la inmunodeficiencia humana (VIH) coinfectados con virus de la hepatitis B (VHB) tienen mayor riesgo de desarrollo de hepatitis B crónica y de hepatotoxicidad con el tratamiento antirretrovírico (TAR). El desarrollo de hepatitis A en el paciente con VIH podría obligar a suspender el TAR y producir una viremia más prolongada. En este trabajo se pretende determinar la prevalencia de anticuerpos protectores.
MétodosSe realizó un estudio transversal para establecer la prevalencia de anticuerpos inmunoglobulina G frente al virus de la hepatitis A (VHA) y de anticuerpos frente al antígeno de superficie del VHB (AcHBs) en una cohorte de 121 niños y adolescentes de 1 a 19 años infectados por VIH, de 4 hospitales públicos de Madrid.
ResultadosEl 12,4% de los pacientes (IC [intervalo de confianza] del 95%: 7,1 al 9,6%) presentó serología positiva para VHA. Los niños de origen inmigrante tuvieron una mayor prevalencia (el 50 frente al 6,2% en los niños nacidos en España) (p<0,001). La proporción de niños con AcHBs positivos fue del 16,5% (IC del 95%: 10,4 al 4,3%). Hubo una mayor proporción de niños con anticuerpos protectores en el estadio A (20%) frente al B (16%) y al C (9,4%) (p = 0,19). Este porcentaje disminuía según el tiempo transcurrido desde la vacunación.
DiscusiónLa mayoría de los niños y adolescentes con VIH no presentan anticuerpos protectores frente a la infección natural por VHA y VHB. Es necesario plantear una estrategia de vacunación para conseguir una mayor proporción de pacientes protegidos frente a la hepatitis A y a la hepatitis B.
Patients coinfected with HIV and hepatitis B virus (HBV) have a higher risk of developing chronic HBV infection and a higher risk of hepatotoxicity. Hepatitis A virus (HAV) in HIV-infected patients may require antiretroviral treatment interruption, producing prolonged viremia. In this study, we assess the prevalence of protective antibodies in these patients.
MethodsA cross-sectional study was conducted to determine the prevalence of IgG antibodies against HAV and antibody against HBs (anti-HBs) in a cohort of 121 HIV-infected children and adolescents (1–19 years), followed-up in 4 public hospitals in Madrid (Spain).
ResultsAmong the total, 12.4% (95% CI: 7.1–19.6%) of children and adolescents had positive serology for HAV. Children of immigrant origin presented a higher percentage than children born in Spain: 50% vs. 6.2%, respectively (P<0.001). In addition, 16.5% (95% CI: 10.4–24.3) of the study population had protective anti-HBs. A higher percentage of children with anti-HBs antibodies was seen in CDC clinical category A: 20% vs. 16% of those in clinical category B vs. 9.4% of those in clinical category C (P=0.19). The percentage of positive-positive children progressively decreased according to the years elapsed since HBV vaccination.
DiscussionMost HIV-infected children and adolescents have no protective antibodies against natural infection by HBV and HAV. More studies are needed to define the best vaccination strategy to achieve a higher percentage of patients protected against these infections.
La coinfección por el virus de la inmunodeficiencia humana (VIH) y por el virus de la hepatitis B (VHB) ha sido ampliamente estudiada, y se estima que de un 6 a un 10% de los pacientes con VIH tiene infección crónica por VHB1–4. Por otro lado, la incidencia del VHB aguda en pacientes con VIH mayores de 12 años se estima en 12,2 casos/1.000 personas al año (370 veces mayor que en la población no infectada por VIH)3,4. En pacientes coinfectados, se ha observado un mayor riesgo de desarrollo de hepatitis B crónica y un mayor riesgo de hepatotoxicidad con el tratamiento antirretrovírico (TAR), que obliga, además, a usar combinaciones de fármacos activos para ambos virus en los casos indicados1,3,4.
En una encuesta seroepidemiológica realizada en Madrid en el año 2002 entre niños y adolescentes de 0 a 19 años, la prevalencia de anticuerpos inmunoglobulina G (IgG) protectores frente al virus de la hepatitis A (VHA) fue del 5,5%; mientras que alcanzó el 68% en adultos de 37 a 44 años y el 96% en personas de 45 a 65 años5. En una encuesta serológica realizada en Brasil, la prevalencia de anticuerpos frente al VHA en niños y adolescentes con VIH fue mayor (34%) que en el grupo no infectado por VIH (19,7%)6. El desarrollo de hepatitis A en el paciente con VIH se está estudiando, pero se ha observado que, si bien la enfermedad no parece cursar con una mayor gravedad, la hepatitis puede obligar a suspender el TAR y la duración de la viremia es más prolongada7–9. Por otro lado, la hepatitis A cursa habitualmente de manera asintomática o tiene manifestaciones muy escasas en la edad pediátrica, en contraste con la edad adulta6: el riesgo del desarrollo de ictericia aumenta según la edad. Sumada a las complicaciones mencionadas, la infección por VHA en el paciente con VIH coinfectado por VHB o por virus de la hepatitis C conlleva un riesgo mayor de hepatitis fulminante1–6.
Se ha planteado la necesidad de implementar la vacunación frente a hepatitis A y hepatitis B en los pacientes con VIH que no hayan tenido contacto con VHA o VHB. En el presente trabajo se desarrolla un análisis epidemiológico realizado en la Comunidad de Madrid que estudia la prevalencia de anticuerpos protectores frente al VHA y al VHB en una cohorte de niños y adolescentes de 1 a 19 años infectados por VIH.
Población y métodosSe estudió, con corte transversal, la prevalencia de anticuerpos IgG frente al VHA y de anticuerpos frente al antígeno de superficie del VHB (AcHBs) (anticuerpos marcadores de protección frente a VHB tras la vacunación) en una cohorte de 121 niños y adolescentes de 1 a 19 años infectados por VIH y seguidos en 4 hospitales de la Comunidad de Madrid (Hospital 12 de Octubre, Hospital Gregorio Marañón, Hospital Carlos III y Hospital de Getafe). La encuesta serológica se realizó entre los meses de agosto y diciembre de 2006. Todos los pacientes se habían vacunado frente al VHB según los calendarios de vacunación vigentes, pero sólo se pudo confirmar en las historias clínicas la fecha de la vacunación de 89 niños. Se consideró título protector una cifra de anti-HBs de ⩾10mU/mm.
Las variables categóricas se expresaron como frecuencias y porcentajes; las variables numéricas se presentaron como medias, medianas, desviación estándar y rango intercuartílico (RIC). Se usó el test de χ2 para comparar las variables categóricas de tendencia lineal y el test exacto de Fisher cuando fue apropiado. Los valores de p fueron bilaterales y se consideró estadísticamente significativo p<0,05. Los intervalos de confianza (IC) se fijaron en el 95%. Para el análisis estadístico se empleó el programa SPSS (Chicago, IL) para Windows, versión 13.0.
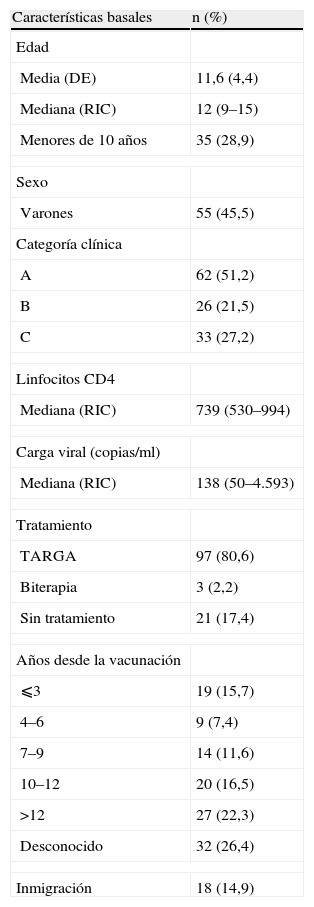
ResultadosLa media de edad fue de 11,60 años y la mediana fue de 12 años (RIC: 9 a 15). La distribución por estadios clínicos fue A: 51,2% (62 niños); B: 21,5% (26 niños), y C: 27,2% (33 niños). Un 15,7% de los niños eran inmigrantes (subsaharianos o latinoamericanos). Noventa y siete niños (80,6%) seguían tratamiento antirretrovírico de gran actividad (TARGA) en el momento de la encuesta serológica. La media de linfocitos CD4 fue de 862 (tabla 1) y la mediana de la CV fue de 138.
Características basales de los niños del estudio
| Características basales | n (%) |
| Edad | |
| Media (DE) | 11,6 (4,4) |
| Mediana (RIC) | 12 (9–15) |
| Menores de 10 años | 35 (28,9) |
| Sexo | |
| Varones | 55 (45,5) |
| Categoría clínica | |
| A | 62 (51,2) |
| B | 26 (21,5) |
| C | 33 (27,2) |
| Linfocitos CD4 | |
| Mediana (RIC) | 739 (530–994) |
| Carga viral (copias/ml) | |
| Mediana (RIC) | 138 (50–4.593) |
| Tratamiento | |
| TARGA | 97 (80,6) |
| Biterapia | 3 (2,2) |
| Sin tratamiento | 21 (17,4) |
| Años desde la vacunación | |
| ⩽3 | 19 (15,7) |
| 4–6 | 9 (7,4) |
| 7–9 | 14 (11,6) |
| 10–12 | 20 (16,5) |
| >12 | 27 (22,3) |
| Desconocido | 32 (26,4) |
| Inmigración | 18 (14,9) |
DE: desviación estándar; RIC: rango intercuartílico; TARGA: tratamiento antirretrovírico de gran actividad
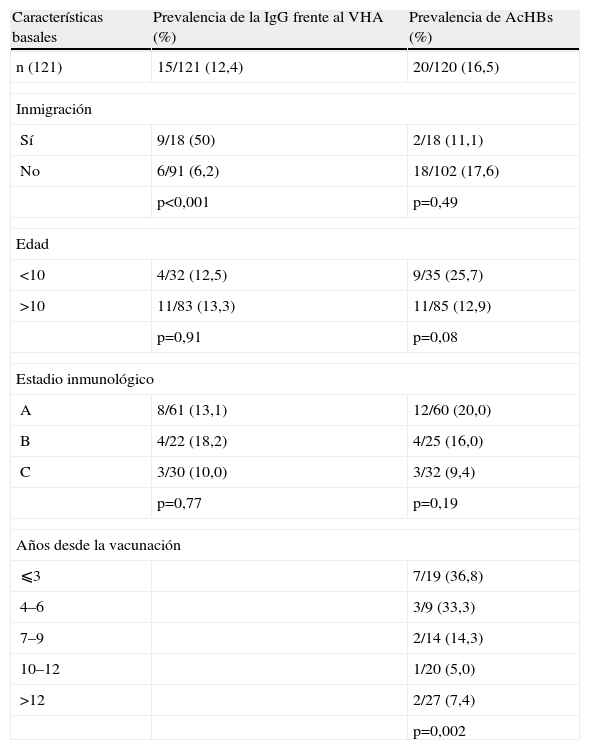
La proporción de niños y adolescentes con serología positiva para VHA fue del 12,4% (IC del 95%: 7,1 al 19,6%) (15 niños). Los niños inmigrantes tuvieron una mayor prevalencia: 50 frente al 6,2% en los niños nacidos en España (p<0,001). No se encontraron diferencias al estratificar por edad: el 12,5% de los menores de 10 años y el 13,3% de los mayores de esa edad presentaron anticuerpos frente a VHA (p=0,9). Tampoco se encontraron diferencias según el estadio clínico: el 13,1% de los niños en estadio A frente al 18,2% de los niños en estadio B y al 13,3% de los niños en estadio C presentaban serología positiva para VHA (tabla 2).
Prevalencia de la inmunoglobulina G frente al virus de la hepatitis A y del anticuerpo frente al antígeno de superficie del virus de la hepatitis B según las características de los niños
| Características basales | Prevalencia de la IgG frente al VHA (%) | Prevalencia de AcHBs (%) |
| n (121) | 15/121 (12,4) | 20/120 (16,5) |
| Inmigración | ||
| Sí | 9/18 (50) | 2/18 (11,1) |
| No | 6/91 (6,2) | 18/102 (17,6) |
| p<0,001 | p=0,49 | |
| Edad | ||
| <10 | 4/32 (12,5) | 9/35 (25,7) |
| >10 | 11/83 (13,3) | 11/85 (12,9) |
| p=0,91 | p=0,08 | |
| Estadio inmunológico | ||
| A | 8/61 (13,1) | 12/60 (20,0) |
| B | 4/22 (18,2) | 4/25 (16,0) |
| C | 3/30 (10,0) | 3/32 (9,4) |
| p=0,77 | p=0,19 | |
| Años desde la vacunación | ||
| ⩽3 | 7/19 (36,8) | |
| 4–6 | 3/9 (33,3) | |
| 7–9 | 2/14 (14,3) | |
| 10–12 | 1/20 (5,0) | |
| >12 | 2/27 (7,4) | |
| p=0,002 | ||
AcHbs: anticuerpo frente al antígeno de superficie del virus de la hepatitis B; IgG: inmunoglobulina G; VHA: virus de la hepatitis A.
La proporción de niños con anticuerpos protectores AcHBs fue del 16,5% (20 niños) (IC del 95%: 10,4 al 24,3%). Una niña presentaba hepatitis B crónica. No se encontraron diferencias respecto al origen étnico de los niños. Se observó, sin embargo, más proporción de niños con anticuerpos protectores en los menores de 10 años: 25,7 frente al 12,9% en los mayores (p=0,09). También se observó una mayor proporción de niños con anticuerpos protectores en el estadio A (20%) frente al estadio B (16%) y al estadio C (9,4%), aunque las diferencias no fueron significativas (p=0,19). Se observó que entre los 89 niños en los que se obtuvo la fecha exacta de la vacunación frente al VHB, el porcentaje de pacientes positivos para AcHBs disminuía significativamente de manera inversamente proporcional al tiempo transcurrido desde la vacunación: en el grupo de los niños que se habían vacunado hacía menos de 3 años, la proporción de niños con anticuerpos protectores fue del 36,8%; en contraste con el 7,4% en el grupo que había recibido la vacunación hacía más de 12 años (p=0,002).
DiscusiónSe encontró una baja prevalencia de anticuerpos frente al VHA (12,4%). La baja prevalencia global en esta serie indicaría que la mayoría de los niños y adolescentes con VIH de España son susceptibles a la infección natural por VHA, con el consiguiente riesgo de enfermedad sintomática, ya que la probabilidad de que se desarrolle ictericia aumenta con la edad (el 7% en el grupo de 0 a 4 años comparado con el 70% en el grupo de 10 a 17 años y el 85% en los mayores de 18 años)6. Los autores del presente artículo no han encontrado en la literatura médica encuestas serológicas sobre la prevalencia de anticuerpos frente al VHA en niños con VIH en países europeos; solamente hay estudios epidemiológicos realizados en Brasil (país de alta endemia), donde se encontró una prevalencia mayor (34%) a la que se encontró en este estudio6. En esa serie, en contraste con ésta, se observó una mayor prevalencia de anticuerpos positivos en los pacientes en las categorías B y C. En otras series realizadas en adultos con VIH, las prevalencias han sido mayores (el 84% en una serie de Argentina10, el 72,7% en una serie de París11 y el 56,6% en una encuesta serológica de Estrasburgo12). En esas series no se vieron diferencias según el estadio inmunológico, y solamente fueron factores de riesgo la edad y el origen subsahariano. En el presente grupo, sólo el origen inmigrante influyó de manera significativa en la proporción de niños y adolescentes con anticuerpos frente al VHA.
La prevalencia de anticuerpos protectores frente al VHB en esta población fue del 16,5%. En otras series de niños o adolescentes infectados por VIH, la prevalencia oscila entre el 1 y el 16%13,14. En individuos inmunocompetentes, el aclaramiento de anticuerpos anti-HBs con el transcurso del tiempo no significa necesariamente una pérdida de inmunidad frente a la infección natural debido a la existencia de respuestas anamnésicas de tipo celular. Esto podría no ser aplicable a individuos inmunodeprimidos o a pacientes con VIH13,15 y significaría que un 84% de los adolescentes con VIH que se vacunaron frente al VHB no estaría protegido frente a la infección natural. Este hecho podría explicarse debido a la falta de seroconversión (fallo primario de la inmunización) o debido a una rápida pérdida de anticuerpos (fallo de vacunación secundario)13,15,16. En este estudio se observó que los pacientes de menor edad (menores de 10 años) presentaban una tendencia a producir mayor proporción de anticuerpos protectores (el 25,7 frente al 12,9% en los mayores), aunque no fue estadísticamente significativo. Esto podría deberse a 2 factores: por un lado, la inmunidad y por consiguiente, la respuesta de la vacunación estaría más conservada en los primeros años de vida; por otro lado, el hecho de que en los niños más pequeños había transcurrido menos tiempo desde la vacunación. Asimismo, se comprobó cómo influye de manera significativa el tiempo transcurrido desde la vacunación, ya que la proporción de niños que contaba con anticuerpos protectores anti-HBs disminuyó según el transcurso de los años desde la primovacunación; así, los niños que se habían vacunado hacía 3 o menos años presentaron más proporción de anti-HBs (36,8%) que el resto del grupo (véase tabla 1). El descenso de la concentración de anticuerpos puede deberse a la destrucción progresiva de los linfocitos CD4, necesarios para la producción de anticuerpos por parte de las células B contra antígenos dependientes de T (virus, proteínas) y también para la diferenciación de las células B memoria15.
Estos hallazgos justifican la necesidad de plantear una política de revacunación en los niños con VIH, especialmente en adolescentes, por ser este grupo más vulnerable al contagio del VHB y por presentar un riesgo aumentado de infección sintomática por VHA. La eficacia de la vacuna frente al VHB ha sido ampliamente estudiada en la época anterior al TARGA y se han obtenido pobres resultados (del 25 al 70% de seroconversión), especialmente en pacientes con VIH sintomáticos o con linfocitos CD4 inferiores a 20015–18; con lo que la práctica habitual consiste en doblar la dosis de HBsAg para obtener una mayor y más duradera respuesta15,18. Esta baja eficacia predispone a que en muchas ocasiones se posponga la vacunación frente al VHB a la espera de una mejoría clínica e inmunológica, hecho que por sí mismo reduce la cobertura de la vacunación en los pacientes susceptibles15,19. En la actualidad, si se tiene en cuenta que la inmunidad de los niños y adolescentes ha mejorado en la época del TARGA, la respuesta a esta vacuna podría ser mejor (llegó al 92% en un estudio reciente)20.
Por el contrario, los estudios de eficacia realizados en pacientes con VIH con la vacuna frente al VHA demostraron, ya en la época anterior al TARGA, una alta eficacia y duración de la respuesta de la vacunación, incluso en los pacientes inmunodeprimidos o sintomáticos21–24. También ha quedado establecida la seguridad de esta vacuna en la población con VIH25,26. Un estudio reciente, realizado en niños y en adolescentes con VIH en tratamiento con TARGA, demostró una seroconversión del 98%27. Queda aún por determinar si la investigación de anticuerpos frente al VHA sería de coste efectivo en la población inmigrante28.
Entre las limitaciones de este estudio figura el hecho de que no se ha contado con un grupo control de niños y adolescentes no infectados con VIH. Por otra parte, solamente se ha tenido en cuenta el estadio clínico global de los niños, sin tener en cuenta el estadio y las características inmunológicas que presentaban en el momento de la vacunación, dato que resultaría muy útil, pero que a menudo no figura en las historias clínicas.
En conclusión, se observó que la mayoría de los niños y de los adolescentes con VIH de España no están protegidos frente a la infección natural por VHA y por VHB. Por esto, son necesarios estudios más amplios que determinen la mejor estrategia de vacunación para conseguir una mayor proporción de pacientes protegidos frente a la hepatitis A y a la hepatitis B.