Analizar la relación entre el consumo de antimicrobianos y la sensibilidad en bacterias gramnegativas y grampositivas en un hospital general durante un período de 13 años.
MétodosSe obtuvieron las series de consumo normalizadas de 58 antibióticos (dosis diarias definidas por 100 estancias por día) en el período de 1993 a 2005, así como también se obtuvieron las series de porcentajes de sensibilidad para todas las combinaciones posibles entre antibiótico y bacteria en este período. Se consideraron tanto las relaciones simples como las relaciones múltiples mediante la separación de las series del servicio de medicina intensiva de las del resto de los servicios medicoquirúrgicos. Se relacionaron las series consumo-sensibilidad mediante regresión lineal simple para los retardos 0, 1 y 2 años y se seleccionaron aquellas relaciones con coeficiente de determinación superior o igual a 0,5 y coeficiente de correlación de Pearson negativo. Estas relaciones se reanalizaron tanto mediante modelos de regresión autorregresivos para incluir la autocorrelación temporal de los residuales como mediante modelos de regresión con retardos de distribución polinómica que permitieron distribuir en el tiempo el efecto del consumo sobre la sensibilidad.
ResultadosEl aumento de consumo de determinados antibióticos ha repercutido de forma negativa sobre la sensibilidad a otros antimicrobianos de manera inmediata (imipenem, cefalosporinas de tercera generación y piperacilina con tazobactam), mientras que otros antimicrobianos parecen tener una repercusión más lenta con demoras de 1 año (ciprofloxacino, amoxicilina con ácido clavulánico y aminoglucósidos) o de 2 años (macrólidos con lincosaminas sobre la sensibilidad a cloxacilina en Staphylococcus aureus).
ConclusiónEl incremento en el consumo de algunos antimicrobianos parece haber producido una disminución en la sensibilidad a otros antimicrobianos. Este efecto es inmediato para algunas de las relaciones y con demora de 1 o 2 años para otras relaciones.
To analyze the relationship between antimicrobial use and susceptibility in gram-negative and gram-positive bacteria in a general hospital during a 13-year period.
MethodsNormalized antimicrobial consumption (defined daily dose per 100 bed-days) was determined for 58 antibiotics for the period of 1993 to 2005, and susceptibility percentages were calculated for all possible antibiotic-microbial combinations for the same period. Both simple and multiple relationships were considered in 2 different settings: the intensive care unit and the remaining medical-surgical departments. Simple linear regression models for sensitivity-usage were employed, with delays of 0, 1, and 2 years; relationships with determination coefficients (r2) higher than 0.5 and negative correlation coefficients (r) were selected. These selected relationships were further analyzed using both autoregressive models to account for autocorrelation in the error term, and polynomial distributed lag regression models that allow distribution in time of the usage effect on sensitivity, considering all delays simultaneously.
ResultsThe increase in consumption of some antimicrobials has negatively influenced sensitivity to other antimicrobials, with an immediate influence in time for some of them (imipenem, 3rd generation cephalosporins, piperacillin-tazobactam), whereas for others a lag of 1 year (ciprofloxacin, amoxicillin-clavulanate, aminoglycosides) or even 2 years (consumption of macrolides-lincosamides on decreased susceptibility to cloxacillin in S. aureus) was observed.
ConclusionsThe significant increment of antimicrobial use observed for many agents seems to produce a negative effect on the sensitivity to other antimicrobials, which is immediate in some relationships, but shows a time lag of 1 or 2 years in others.
El uso de antimicrobianos es uno de los factores de riesgo que se asocia con mayor frecuencia al aumento de la resistencia bacteriana. Estudios recientes en el ámbito hospitalario por análisis multivariante muestran que el incremento del consumo de determinados antimicrobianos o de familias de antimicrobianos es un factor de riesgo independiente que se asocia al incremento en la incidencia de Staphylococcus aureus resistente a meticilina (SARM)1 o al mantenimiento de sus brotes2, así como a la adquisición de resistencia por aislados sensibles de bacilos gramnegativos (Enterobacter, Pseudomonas y Acinetobacter)3–5. Los estudios que evalúan la relación entre el consumo de antimicrobianos y la resistencia bacteriana requieren una cuidadosa recogida de datos para su posterior análisis.
En España, las bacterias intrahospitalarias exhiben tasas de resistencia elevadas pero no muy diferentes a las tasas encontradas en otros países europeos6. La utilización de antimicrobianos en los hospitales españoles se ha incrementado paulatina pero sostenidamente, sobre todo debido al consumo de combinaciones de betalactámicos con inhibidores de betalactamasas, quinolonas y carbapenémicos7. Según los últimos estudios de prevalencia, el Estudio de Prevalencia de las Infecciones Nosocomiales en España y el Estudio Nacional de Vigilancia de Infección Nosocomial en Unidades de Cuidados Intensivos, en 2006 el 39,5% de los pacientes hospitalizados tomaba antimicrobianos, cifra que se eleva al 57% en los pacientes críticos de los servicios de medicina intensiva (SMI)8,9.
Los programas de monitorización del uso de antibióticos y de la resistencia a éstos en microorganismos centinela son estrategias recomendadas para contener la resistencia bacteriana y permiten establecer medidas de intervención sobre el consumo. El objetivo de este estudio es analizar la influencia del consumo de antimicrobianos sobre la sensibilidad en bacterias gramnegativas y grampositivas de un hospital general durante un período de 13 años (1993–2005) mediante 2 modelos de análisis de regresión complementarios.
Material y métodosCaracterísticas del hospitalEl Hospital Santiago Apóstol de Vitoria es un hospital general público perteneciente a Osakidetza-Servicio Vasco de Salud y es el hospital de referencia para un área de 121.400 habitantes. En el período de 1993 a 2005 presentó una media de 260 camas instaladas y alrededor de 11.000 ingresos anuales. El SMI tiene 9 camas con una media anual de 600 ingresos y es una unidad de referencia de Álava para pacientes neurocríticos. En 2005, el SMI atendió a pacientes médicoquirúrgicos (66%), a pacientes coronarios (18%) y a pacientes neuroquirúrgicos (16%).
Consumo de antibióticosLos datos de consumo desde el año 1993 hasta el año 2005 se obtuvieron de las bases de datos del Servicio de Farmacia del hospital (AS/400 y SAP) y se transfirieron a una hoja de cálculo mediante la separación de consumos de los servicios medicoquirúrgicos (SMQ) y del SMI. Los principios activos se agruparon por familias. Los gramos y las unidades internacionales de los distintos antimicrobianos se convirtieron en número de dosis diarias definidas (DDD) y finalmente se expresaron, de acuerdo con la recomendación de la OMS para consumo hospitalario, como número de DDD por 100 estancias por día, es decir, el número de pacientes que se encuentra bajo tratamiento con determinado antibiótico por cada 100 estancias.
Se define estancia por día como el tiempo de permanencia medido en días de un paciente en régimen de hospitalización que ocupa una cama; este tiempo se calcula como la diferencia entre la fecha del alta y la fecha del ingreso. El número de estancias por día anuales asociado al hospital es la suma de las estancias por día asociadas a cada uno de los ingresos que han tenido lugar cada año. Los ingresos del hospital de día quirúrgico no generaron estancias (homogeneización de indicadores del sistema de información de atención especializada disponible en: http://www.osakidetza.net/docs/osaki/publicaciones/Gestion). El total de estancias anuales se obtuvo del sistema informático de la Unidad de Gestión Sanitaria. Los valores de la DDD se tomaron de las guías ATC/WHO vigentes en el período de estudio10. En aquellos fármacos para los que no se definió la DDD se utilizó la dosis que recomienda habitualmente la bibliografía. Los valores de DDD por 100 estancias por día se obtienen mediante la fórmula: [peso del fármaco (g) × 100] / [DDD (g) × estancias anuales].
En total, se estudiaron 58 antibióticos pertenecientes a 6 grupos: penicilinas, cefalosporinas, carbapenémicos, aminoglucósidos, macrólidos con lincosaminas y quinolonas.
Sensibilidad a los antimicrobianosA partir del sistema informático del laboratorio de microbiología, se obtuvo la sensibilidad de los siguientes microorganismos: Escherichia coli (n=1.442), S. aureus (n=1.099), Pseudomonas aeruginosa (n=692), Enterococcus faecalis (n=451), Enterobacter (n=351), Bacteroides fragilis (n=345), Klebsiella spp. (n=278) y Proteus mirabilis (n=207). Sólo se incluyeron las cepas provenientes de muestras intrahospitalarias y se excluyeron las muestras provenientes de consultas externas y las correspondientes a hemocultivos, a urocultivos y a las de origen respiratorio de pacientes con menos de 48h de estancia en el hospital. Los datos de sensibilidad de los aislados hospitalarios se recogieron a partir de 1993, mientras que los datos del SMI se recogieron a partir de 1996.
Las pruebas de sensibilidad se realizaron por microdilución en placas de 96 pocillos a través del sistema automatizado Sensititre® (Trek Diagnostic Systems Ltd, Inglaterra). Los puntos de corte que utilizó este sistema están en concordancia con los puntos de corte que propuso el National Committee for Clinical Laboratory Standards y vigentes durante el período de estudio. Las cepas correspondientes a una categoría intermedia de sensibilidad se consideraron resistentes y el porcentaje de sensibilidad se calculó como el número de aislados sensibles dividido por el número total de aislados y multiplicado por 10011.
Para evitar duplicaciones se excluyó a los aislados obtenidos del mismo paciente con sensibilidad similar al aislado inicial (ausencia de diferencias mayores en el antibiograma) en el período posterior de 2 semanas11. Si el paciente permanece en el hospital, se excluyen los aislados sin diferencias mayores de sensibilidad. Se define diferencia mayor en el antibiograma en aislados consecutivos al cambio de fenotipo de sensibilidad a meticilina en S. aureus y a betalactámicos (combinaciones con inhibidores de betalactamasa, cefalosporinas de amplio espectro y carbapenémicos), quinolonas o aminoglucósidos en bacilos gramnegativos. Se realizaron los estudios de correlación sólo en aquellas series de sensibilidad para las que el porcentaje anual de sensibilidad fue mayor al 70% en alguno de los años durante el período de estudio (de acuerdo con los criterios que propusieron Friedrich et al)12 y que además eran candidatas a tener una tendencia significativa de acuerdo con su representación gráfica.
Análisis estadísticoLa evolución de las características del hospital así como la evolución de las series de consumo y de sensibilidad se analizaron mediante el test de tendencias no paramétrico de Spearman, que contrasta la existencia de tendencia significativa creciente o decreciente durante un período determinado, y su valor de p asociado se calculó mediante técnicas bootstrap. El análisis se acompañó del cálculo del porcentaje de crecimiento relativo global y del porcentaje de crecimiento medio anual obtenido mediante regresión lineal para estas variables.
Para analizar la influencia del consumo de antibióticos sobre la sensibilidad, se consideraron las series de consumo de antibióticos normalizadas (DDD por 100 estancias por día) y el porcentaje de sensibilidad para todas las posibles combinaciones de consumo y sensibilidades durante el período de 13 años. Para realizar los análisis, se utilizaron 2 métodos complementarios y en ambos casos se consideraron tanto las relaciones simples (RS) (consumo de un antibiótico y sensibilidad al mismo antibiótico) como las relaciones múltiples (RM) (consumo de un antibiótico y sensibilidad a otros antibióticos) para los diferentes microorganismos. El primer método consiste en calcular el coeficiente de correlación de Pearson (r) entre las series de los porcentajes de sensibilidad y las series de los porcentajes de consumo de antibióticos. De acuerdo con los criterios de Friedrich et al12, sólo aquellas relaciones en que el coeficiente de determinación (r2) fue superior o igual a 0,5 (r⩾0,7) y r negativo se seleccionaron para su posterior análisis. Además, aquellos modelos en los que los errores no estaban normalmente distribuidos debido a la presencia de autocorrelación serial se volvieron a reajustar, incluida la estructura de autocorrelación en los errores. Todos los modelos se ajustaron considerando que el consumo podía afectar a la sensibilidad con retardo 0 (lag=0), 1 año (lag=1) y 2 años (lag=2) de forma independiente. Se han considerado significativos los valores con p<0,05. Para el segundo método y sólo para aquellas relaciones seleccionadas se utilizaron los modelos de análisis de regresión PDL (polynomial distributed lag models ‘retardos de distribución polinómica’) (v. aplicación en Vlcek et al13) que permitieron distribuir en el tiempo el efecto de la variable de regresión (consumo de antibióticos) sobre la variable respuesta (sensibilidad). Además, se consideraron todos los retardos simultáneamente y se seleccionaron aquéllos en los que el efecto fue más significativo. Se consideraron significativos aquellos valores en los que p<0,2, dado que son más los parámetros por estimar cuando se incluyen varios retardos simultáneamente, por lo que la potencia disminuye respecto al modelo lineal. Los análisis estadísticos relativos al análisis de tendencias y las representaciones gráficas se realizaron en R versión 2.4.0., mientras que para el estudio de las relaciones entre el consumo y la sensibilidad se utilizaron los procedimientos GLM, AUTOREG y PDLREG del paquete estadístico SAS versión 9.1.
ResultadosTendencia de las características del hospital en el período de estudioEl número de ingresos, con media anual igual a 10.853 (desviación estándar [DE]: 1.092), ha aumentado en torno a un 33% (r=0,918; p<0,001), mientras que la estancia media, con una media anual de 6,7 días (DE: 0,82), ha presentado una reducción significativa (r=−0,885; p<0,001). El número de estancias, con media anual igual a 72.188 (DE: 2.238), no ha variado significativamente (r=0,05; p=0,9). Por el contrario, la estancia media del SMI, con una media anual de 5,26 días, ha aumentado en un 3,7% medio anual (r=0,806; p=0,003) y el número de ingresos, con media anual igual a 587 (DE: 72), no ha variado significativamente (r=−0,2; p=0,28). La actividad quirúrgica medida tanto mediante el número total de intervenciones, con una media anual de 7.761 (DE: 958), como mediante el número de intervenciones por cada 1.000 ingresos, con una media anual de 714,6 (DE: 37,6), ha aumentado de forma considerable (el incremento medio anual del número total de intervenciones quirúrgicas fue del 3,1% [r=0,951; p<0,001]). Se mantuvieron sin cambios considerables el índice del case-mix hospitalario (media de 1,434, DE: 0,08) y el porcentaje de pacientes que tomaban antimicrobianos (alrededor del 29% en los SMQ y alrededor del 54% en el SMI).
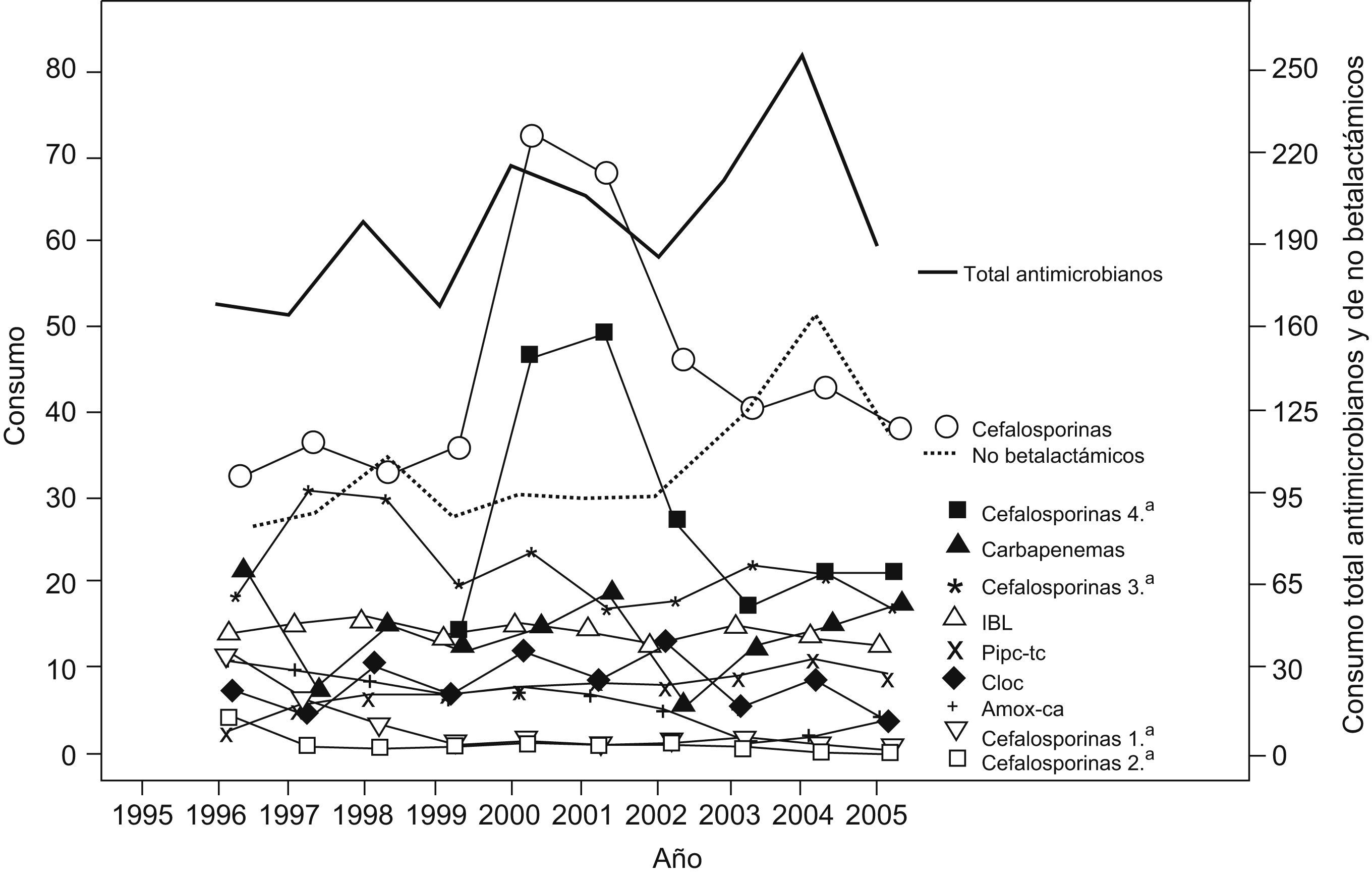
Descripción de las series de consumo de antimicrobianos y sensibilidades bacterianasLas series de consumos para antibióticos individuales y por grupos en los SMQ se representan en la figura 1 y los correspondientes al SMI se representan en la figura 2. En el SMQ, el total de antimicrobianos consumidos aumentó en un 51% en el período estudiado ya que pasó de 41,5 a 64,4 DDD cada 100 estancias por día, con un incremento medio anual del 4%. Los betalactámicos fueron el grupo más consumido (entre el 53,5 y el 64% del total de antibióticos durante el período de estudio). Aumentó de forma significativa el consumo de combinaciones de betalactámicos con inhibidores de betalactamasas (sobre todo piperacilina con tazobactam), cloxacilina, cefalosporinas de primera generación, cefalosporinas de tercera generación, cefepima, carbapenémicos, aminoglucósidos, glucopéptidos y quinolonas. Las quinolonas son las que presentaron la mayor pendiente (21,2 DDD/100 estancias por día en 2005 con un incremento medio anual del 185%) seguidas por piperacilina con tazobactam, cefepima, carbapenémicos, glucopéptidos, cefalosporinas de tercera generación y cloxacilina. Por el contrario, disminuyó de forma significativa el consumo de cefalosporinas de segunda generación, cotrimoxazol, macrólidos con lincosaminas, fosfomicina, tetraciclinas y penicilina G.
Por su parte, el incremento en el consumo total de antibióticos en SMI (189 DDD/100 estancias por día en 2005 y un incremento medio anual del 3,6%) no fue tan marcado como en los SMQ e incluso hubo cierta estabilidad en gran parte de los antibióticos analizados. La mayor pendiente de consumo correspondió a piperacilina con tazobactam, con un incremento medio anual del 17,6%.
Los resultados de los análisis de tendencias revelan las siguientes tendencias significativas según el test de tendencias no paramétrico de Spearman: a) disminución significativa de los porcentajes de sensibilidad, a un ritmo de alrededor de un 2% anual, a ciprofloxacino en S. aureus, P. aeruginosa (del 86 al 67%) y E. coli (del 94 al 78%); b) disminución de un 1% anual a cloxacilina en S. aureus (del 92 al 82%), amoxicilina con ácido clavulánico en E. coli (del 92 al 83%), ceftazidima e imipenem en P. aeruginosa (del 97 al 90% y del 94 al 88%, respectivamente), y c) disminución de un 0,5% anual a cefalosporinas de tercera generación en E. coli. En el SMI sólo se observó una reducción de un 2% anual de la sensibilidad a tobramicina en P. aeruginosa (del 100 al 68%) y a amoxicilina con ácido clavulánico en E. coli (del 90 al 82%).
Relación entre las series de consumos y las sensibilidades bacterianasSe analizaron 431 relaciones consumo-sensibilidad, de las que 264 (61%) se refirieron a series en los SMQ y las 167 (39%) restantes se refirieron al SMI. En los SMQ, se obtuvieron 11 RS y 64 RM que cumplieron los criterios de inclusión de acuerdo con los diferentes retardos de tiempo. En cambio, en el SMI se obtuvo una única RS y 14 RM.
Por tipo de relación, sólo el 4,4% de las RS estudiadas (12 de 273 relaciones) y el 49,3% de las RM estudiadas (78 de 158 relaciones) presentaban r2 mayor o igual que 0,5 (r⩾0,7) y r negativo.
Los resultados de los métodos de regresión lineal simple con errores autocorrelados que mostraron relación significativa entre consumo y sensibilidad, según localización (SMQ o SMI) y microorganismo, se muestran en la tabla 1. En esta tabla se recogen las estimaciones de la pendiente del modelo para los retardos lag=0 años, lag=1 año y lag=2 años. Se puede observar que para la mayoría de las relaciones hubo significación estadística en los 3 retardos analizados en los SMQ. Asimismo, se presentan en esta tabla las estimaciones y los valores p para el retardo que parece más significativo con los modelos PDL ajustados. Entre las RS cabe destacar que el aumento del consumo de ciprofloxacino en una DDD/100 estancias por día parece disminuir la sensibilidad al mismo antibiótico en un 2% para S. aureus, P. aeruginosa y E. coli en los 3 retardos. Asimismo, el consumo de cefalosporinas de tercera generación afecta de forma tardía a la sensibilidad de cefotaxima en E. coli y se asocia a la disminución del 4,5% a los 2 años. Entre las RM, en P. aeruginosa el consumo de imipenem y de cefalosporinas de tercera generación repercute de forma inmediata en la sensibilidad a ciprofloxacino, así como el consumo de esta quinolona incide en la sensibilidad a imipenem y a ceftazidima en los 3 retardos. En E. coli, el consumo de ciprofloxacino y de piperacilina con tazobactam se asocia a la disminución de sensibilidad a cefalosporinas de tercera generación y a amoxicilina con ácido clavulánico en los 3 retardos.
Modelos de regresión lineal con errores autocorrelados y modelos de retardos de distribución polinómica con errores autocorrelados
| Sensibilidad | Consumo | Estimaciones | P-valores | r2 | PDL con errores autocorrelados | |||||||||||
| Ámbito | β(lag=0) | β(lag=1) | β(lag=2) | p(lag=0) | p(lag=1) | p(lag=2) | r2(lag=0) | r2(lag=1) | r2(lag=2) | I | β | p | r2 | |||
| SMQ | ||||||||||||||||
| Staphylococcus aureus | CIP | CIP | −2,69 | −2,71 | −2,92 | 0,002 | 0,001 | 0,001 | 0,708 | 0,718 | 0,755 | 1 | −4,45 | 0,112 | 0,733 | |
| LEV | −1,45 | −2,02 | −3,75 | 0,015 | 0,041 | <0,001 | 0,726 | 0,688 | 0,999 | |||||||
| QUI | −1,48 | −1,71 | −2,10 | <0,001 | 0,001 | <0,001 | 0,804 | 0,790 | 0,807 | |||||||
| GEN | GEN | −8,04 | 0,001 | 0,701 | 1,2 | −2,45−6,65 | 0,055 0,003 | 0,733 | ||||||||
| Pseudomonas aeruginosa | CIP | CIP | −2,00 | −1,94 | −2,02 | 0,002 | 0,002 | 0,002 | 0,627 | 0,650 | 0,678 | |||||
| QUI | −1,05 | −1,22 | −1,42 | <0,001 | 0,001 | 0,001 | 0,720 | 0,706 | 0,692 | |||||||
| Cef 3.a | −7,41 | 0,001 | 0,687 | 0 | −7,26 | 0,015 | 0,687 | |||||||||
| IMIP | −16,45 | −18,61 | <0,001 | 0,001 | 0,829 | 0,671 | 0 | −13,27 | 0,012 | 0,843 | ||||||
| CTAZ | CIP | −1,79 | −1,64 | −1,55 | 0,001 | 0,003 | 0,01 | 0,652 | 0,606 | 0,539 | ||||||
| IMIP | CIP | −1,58 | −1,46 | −1,57 | 0,001 | 0,001 | 0,002 | 0,712 | 0,675 | 0,668 | ||||||
| QUI | −0,63 | −0,68 | 0,027 | 0,051 | 0,436 | 0,359 | ||||||||||
| Escherichia coli | CIP | CIP | −2,45 | −2,24 | −1,91 | 0,001 | 0,002 | 0,014 | 0,673 | 0,623 | 0,509 | |||||
| β-lac | −1,94 | −1,75 | −1,60 | 0,003 | 0,002 | 0,007 | 0,611 | 0,627 | 0,570 | 0,1 | −1,05 −1,03 | 0,166 0,132 | 0,702 | |||
| IBL | −3,48 | −2,37 | −1,83 | 0,006 | 0,001 | 0,012 | 0,544 | 0,700 | 0,518 | 1 | −1,82 | 0,033 | 0,731 | |||
| AMOX-CA | −2,59 | −2,06 | 0,003 | 0,015 | 0,605 | 0,502 | 1 | −2,44 | 0,023 | 0,607 | ||||||
| PIPC-TZ | −7,00 | −6,44 | 0,007 | 0,039 | 0,536 | 0,392 | ||||||||||
| CTAZ | CIP | −0,78 | −0,75 | −0,74 | <0,001 | 0,001 | 0,001 | 0,764 | 0,786 | 0,736 | ||||||
| QUI | −0,34 | −0,38 | −0,40 | 0,006 | 0,012 | 0,053 | 0,579 | 0,519 | 0,392 | |||||||
| β-lac | −0,38 | 0,077 | 0,307 | |||||||||||||
| PIPC-TZ | −2,20 | −2,01 | 0,003 | 0,069 | 0,594 | 0,355 | 0 | −2,73 | 0,091 | 0,602 | ||||||
| CTAX | CIP | −0,59 | −0,60 | −0,69 | 0,002 | 0,001 | <0,001 | 0,617 | 0,705 | 0,814 | 1 | −1,09 | 0,085 | 0,730 | ||
| QUI | −0,31 | −0,36 | −0,45 | 0,001 | 0,001 | 0,001 | 0,704 | 0,708 | 0,707 | |||||||
| β-lac | −0,42 | 0,016 | 0,536 | |||||||||||||
| IBL | −0,44 | 0,044 | 0,416 | |||||||||||||
| PIPC-TZ | −1,89 | −1,83 | −2,67 | 0,002 | 0,006 | 0,001 | 0,621 | 0,541 | 0,723 | 0 | −1,65 | 0,195 | 0,623 | |||
| Cef 3.a | −4,56 | 0,008 | 0,556 | |||||||||||||
| AMOX-CA | CIP | −1,40 | −1,37 | −1,35 | <0,001 | 0,001 | <0,001 | 0,766 | 0,898 | 0,837 | 1 | −1,25 | 0,112 | 0,898 | ||
| QUI | −0,68 | −0,72 | −0,89 | <0,001 | 0,001 | 0,004 | 0,840 | 0,700 | 0,721 | 0 | −1,58 | 0,004 | 0,925 | |||
| β-lac | −0,57 | 0,073 | 0,313 | |||||||||||||
| PIPC-TZ | −4,24 | −3,07 | −3,21 | <0,001 | 0,029 | 0,066 | 0,753 | 0,427 | 0,360 | 0 | −4,00 | 0,070 | 0,753 | |||
| PIPC-TZ | CTAZ | −7,17 | <0,001 | 0,760 | 1,2 | −2,01, −5,86 | 0,059, 0,003 | 0,739 | ||||||||
| SMI | ||||||||||||||||
| S. aureus | CLOC | ERY | −0,95 | 0,035 | 0,550 | 2 | −0,79 | 0,012 | 0,807 | |||||||
| MAC | −1,93 | 0,006 | 0,745 | 2 | −1,40 | 0,017 | 0,735 | |||||||||
| CLI | MAC-LIN | −2,14 | 0,013 | 0,740 | 2 | −1,56 | 0,001 | 0,933 | ||||||||
| P. aeruginosa | TOB | AMG | −0,55 | 0,019 | 0,626 | 1,2 | −0,13, −0,33 | 0,064, 0,064 | 0,576 | |||||||
| E. coli | CTAZ | GEN | −0,11 | 0,043 | 0,522 | 1 | −0,08 | 0,079 | 0,426 | |||||||
| AMG | −0,17 | 0,038 | 0,541 | 1 | −0,10 | 0,029 | 0,579 | |||||||||
| QUI | −0,55 | 0,045 | 0,515 | 2 | −0,51 | 0,021 | 0,697 | |||||||||
| AMOX-CA | β-lac | −0,18 | 0,093 | 0,399 | 1 | −0,15 | 0,125 | 0,463 | ||||||||
| PIPC-TZ | −1,95 | −1,87 | −1,90 | 0,019 | 0,037 | 0,107 | 0,629 | 0,704 | 0,434 | 0,1 | −1,43, −1,39 | 0,051, 0,019 | 0,931 | |||
| PIPC-TZ | β-lac | −0,29 | −0,22 | 0,001 | 0,034 | 0,807 | 0,554 | 1,2 | −0,14, −0,20 | 0,001, 0,001 | 0,928 | |||||
AMG: aminoglucósidos; AMOX-CA: amoxicilina con ácido clavulánico; β-lac: betalactámicos; Cef 3.a: cefalosporinas de tercera generación; CIP: ciprofloxacino; CLI: clindamicina; CLOC: cloxacilina; CTAX: cefotaxima; CTAZ: ceftazidima; ERY: eritromicina; GEN: gentamicina; IBL: combinaciones de betalactámicos con inhibidores de betalactamasas; IMIP: imipenem; LEV: levofloxacino; MAC: macrólidos; MAC-LIN: macrólidos- lincosaminas; PDL: polynomial distributed lag models ‘retardos de distribución polinómica’; PIPC-TZ: piperacilina con tazobactam; QUI: quinolonas; SMI: servicio de medicina intensiva; SMQ: servicios medicoquirúrgicos; TOB: tobramicina.
En el SMI, las relaciones son menos significativas y únicamente el consumo de piperacilina con tazobactam se asocia a la disminución del 1,9% de la sensibilidad a amoxicilina con ácido clavulánico en los 3 retardos para E. coli.
Respecto a los retardos más significativos con los modelos PDL, en el ámbito de los SMQ la repercusión del consumo de imipenem y de cefalosporinas de tercera generación sobre la disminución de la sensibilidad a ciprofloxacino en P. aeruginosa (con una estimación aproximada del 13 y el 7%, respectivamente) aparece en el mismo año. De igual manera en E. coli la influencia del consumo de piperacilina con tazobactam sobre la disminución de la sensibilidad a cefalosporinas de tercera generación (en torno a un 2%) y a amoxicilina con ácido clavulánico (4%) se aprecia de forma inmediata. Por el contrario, el consumo de ciprofloxacino, amoxicilina con ácido clavulánico y ceftazidima repercute sobre la sensibilidad con 1 año de demora. Así, en E. coli el consumo de ciprofloxacino tiende a disminuir la sensibilidad a cefotaxima y a amoxicilina con ácido clavulánico en un 1% al año siguiente y el consumo de ceftazidima parece disminuir la sensibilidad a piperacilina con tazobactam en un 5,8% a los 2 años.
En el ámbito del SMI, se sigue observando la tendencia del resto del hospital en cuanto a la influencia inmediata del consumo de piperacilina con tazobactam sobre la sensibilidad de amoxicilina con ácido clavulánico en E. coli. Una repercusión más lenta se observa en el resto de las relaciones, 1 año de demora en el caso del consumo de aminoglucósidos y la sensibilidad a tobramicina en P. aeruginosa y a ceftazidima en E. coli. Esta demora llega a 2 años en S. aureus, entre el consumo de macrólidos-lincosaminas y la sensibilidad a cloxacilina y clindamicina (en torno al 1,5%) y entre el consumo de betalactámicos y la sensibilidad a piperacilina con tazobactam en E. coli.
DiscusiónEste estudio muestra la repercusión que el consumo de antimicrobianos ejerce sobre la sensibilidad a los mismos antimicrobianos (RS) o sobre la sensibilidad a otros antimicrobianos no relacionados (RM) en un hospital general que presenta un incremento en el número de ingresos y de la actividad quirúrgica durante un período de 13 años. Los resultados obtenidos permiten destacar 3 puntos: en primer lugar, las quinolonas, las combinaciones de betalactámicos con inhibidores de betalactamasas, las cefalosporinas (de tercera generación y cefepima), los carbapenémicos, los aminoglucósidos, la cloxacilina y los glucopéptidos han experimentado un incremento importante; en segundo lugar, todos los antimicrobianos que han visto incrementado su consumo, a excepción de piperacilina con tazobactam, cefepima y glucopéptidos, han presentado disminuciones significativas de sensibilidad y, en tercer lugar, mientras que el consumo de determinados antimicrobianos parece repercutir sobre la sensibilidad a otros antimicrobianos de manera inmediata (imipenem, cefalosporinas de tercera generación y piperacilina con tazobactam), otros antimicrobianos muestran una repercusión más lenta con demoras de 1 año (ciprofloxacino, amoxicilina con ácido clavulánico y aminoglucósidos) o 2 años (macrólidos-lincosaminas sobre la sensibilidad a cloxacilina en S. aureus).
El consumo total de antimicrobianos ajustado por la estancia pasó de 41,5 a 64,4 DDD/100 estancias por día en 2005, lo que está en consonancia con el elevado consumo hospitalario que refleja el estudio ARPAC en países del sur de Europa (mediana de 72,2 DDD/100 estancias por día, rango intercuartílico de 47 a 90, frente a una mediana para el total europeo de 49.6 DDD/100 estancias por día)14. Este estudio forma parte del proyecto de la Comisión Europea «Resistencia bacteriana; prevención y control» (ARPAC), y recogió datos de consumo de 139 hospitales (2 terceras partes con un número inferior a 500 camas) de 5 áreas geográficas y reflejó variaciones significativas en el consumo total y por familias de antibióticos entre estas áreas (menor consumo en Europa central y paises bálticos), pero no se modificó significativamente en razón del tamaño del hospital, del índice de case-mix y del estatus docente. Los escasos estudios de consumo en los SMI europeos con la metodología de DDD revelan mayores consumos en hospitales con estatus docente de gran tamaño y con unidades de críticos no quirúrgicos (133 DDD/100 estancias por día en hospitales no docentes frente al rango de 146 a 187 DDD/100 estancias por día en hospitales universitarios)15–18. De acuerdo con estos datos, el consumo en el SMI de este hospital, que en 2005 alcanzó 189 DDD/100 estancias por día, puede considerarse elevado.
La relación entre el consumo de quinolonas, cefalosporinas de tercera generación, imipenem y macrólidos y la resistencia bacteriana coincide con lo publicado en estudios previos2,4,19–22. El aumento del consumo de quinolonas se ha asociado al aumento de resistencia a quinolonas en enterobacterias y en P. aeruginosa4,19–22 y, como daño colateral, con la selección de SARM1,2,21–26, de E. coli y de K. pneumoniae resistente a cefalosporinas de tercera generación27–29 y de Acinetobacter y de P. aeruginosa resistentes a carbapenémicos30,31. En este último caso, recientemente conocido, las quinolonas pueden seleccionar mutantes de gramnegativos que sobreexpresan una amplia variedad de bombas de expulsión que afectan a un amplio abanico de antimicrobianos30. En el presente estudio, el consumo de ciprofloxacino parece estar asociado al aumento de cepas de E. coli resistentes a cefalosporinas de tercera generación y de cepas de P. aeruginosa resistentes a ceftazidima e imipenem.
Por su parte, el consumo de cefalosporinas de tercera generación se ha asociado al incremento de Klebsiella pneumoniae productora de betalactamasas de espectro extendido (BLEE), de cepas de Enterobacter, P. aeruginosa y Acinetobacter resistentes a estas moléculas y como daño colateral la selección de SARM, enterococos resistentes a vancomicina y diarrea por Clostridium difficile32–41. El presente estudio muestra que el consumo de cefalosporinas de tercera generación parece seleccionar de forma inmediata cepas de P. aeruginosa resistente a ciprofloxacino y con una demora de 2 años, cepas de E. coli resistente a cefotaxima y a piperacilina con tazobactam. La hiperproducción de BLEE y TEM-1 en algunas cepas de E.coli, junto con alteraciones de la permeabilidad, puede ocasionar resistencia a las combinaciones de betalactámicos con inhibidores de betalactamasas42,43.
El aumento del consumo de carbapenémicos se asocia al aislamiento de cepas de P. aeruginosa y de Acinetobacter resistentes a estos antimicrobianos por activación de bombas de expulsión que eliminan quinolonas y carbapenémicos30. Este mecanismo puede explicar la estrecha relación entre consumo y resistencia observada en este estudio en P. aeruginosa entre ambos grupos de antimicrobianos.
El hallazgo de la relación entre el consumo de macrólidos y la resistencia a cloxacilina en S. aureus en medicina intensiva coincide con lo que han observado otros autores1,2,24,44, aunque todos los antimicrobianos son capaces de seleccionar cepas de SARM, con la posible excepción de los glucopéptidos45.
Por el contrario, la relación entre el consumo de aminoglucósidos y las combinaciones de betalactámicos con inhibidores de betalactamasas y la resistencia bacteriana coincide sólo parcialmente con otros estudios. Tradicionalmente se ha considerado que su elevado consumo no afecta a la sensibilidad a otros antimicrobianos no relacionados30. En el presente estudio, el consumo de aminoglucósidos y de gentamicina en particular, en medicina intensiva se asocia a la resistencia de ceftazidima en E. coli. La presión selectiva de pautas de antibióticos que contengan, entre otros, rifampicina (el gen de resistencia a rifampicina se ha asociado a blaVEB−1) o aminoglucósidos permitirían la coexpresión de genes que codifican resistencia a antibióticos no relacionados, como cefalosporinas o carbapenémicos (por ejemplo, betalactamasa GES-2)46,47. Por su parte, el reemplazo del uso de cefalosporinas de tercera y de cuarta generación por piperacilina con tazobactam ha conseguido reducir las tasas de K. pneumoniae productora de BLEE, sin coste biológico en resistencia48,49. Sin embargo, recientemente se ha relacionado el consumo de piperacilina con tazobactam con el aumento de resistencia a la propia molécula en Acinetobacter29, en E. coli y en K. pneumoniae50. El presente estudio muestra que su consumo parece repercutir de forma inmediata en la sensibilidad a otros antibióticos, como cefalosporinas de tercera generación y amoxicilina con ácido clavulánico.
Este trabajo tiene varias limitaciones:
1) Las variaciones de la sensibilidad no deberían atribuirse sólo al consumo de antimicrobianos. A pesar de que otros factores no incluidos en el modelo pueden afectar a los patrones de sensibilidad, el hecho de considerar sólo las relaciones con r2>0,5 supone que al menos el 50% de la variación de la sensibilidad puede explicarse por la variación del consumo de antimicrobianos, lo que parece un objetivo razonable. Aunque no hay consenso sobre la magnitud del coeficiente de correlación que se debe considerar, de acuerdo con Friedrich et al12 un coeficiente de correlación de al menos 0,7 es un marcador apropiado para este tipo de estudios.
2) Este trabajo se ha limitado a hacer explícitas las relaciones con pendiente negativa que implicaban aumentos de consumo con descensos de sensibilidad, de acuerdo con estudios similares3–5,12,19–21. No obstante y como refieren otros autores, también se han observado relaciones con pendiente positiva (aumento de uso con aumento de sensibilidad o descenso de uso con descenso de sensibilidad). Sin embargo, en este trabajo y con los criterios de inclusión aceptados (el porcentaje anual de sensibilidad fue superior al 70% y tuvo un r2>0,5), sólo representan el 1,8% de las RS y el 14,6% de las RM. Friedrich et al12 atribuyen su hallazgo a factores no incluidos en el modelo de regresión (como medidas de control de la infección).
3) Para evitar la autocorrelación temporal, otros autores han utilizado bien diseños transversales en varios hospitales de forma simultánea mediante la utilización de modelos con ecuaciones de estimación generalizada y retardos prefijados23 o bien la modelizan con modelos de promedio móvil integrado de autoregresión51, aunque se requieren series largas y estables, lo que no siempre es posible. En este trabajo se ha intentado paliar en la medida de lo posible este efecto mediante el análisis de la autocorrelación residual y su inclusión en el modelo así como mediante el uso de modelos PDL que permiten incorporar varios retardos de forma simultánea y analizar el retardo con mayor peso, la tendencia significativa y el tamaño y el signo del efecto.
4) No se ha desarrollado una tipificación molecular de los microorganismos, por lo que no se puede descartar la posibilidad de transmisión de paciente a paciente, un factor de confusión frecuente en este tipo de estudios. Sin embargo, cuando se han hecho estudios de tipificación molecular sólo el 14,5% de las infecciones nosocomiales se asocian a la transmisión de paciente a paciente52.
FinanciaciónLos proyectos de investigación 2003/11034 del Departamento de Sanidad del Gobierno Vasco y BIO04/URM/11 de la Fundación Vasca de Innovación e Investigación Sanitarias (BIOEF) financiaron este trabajo.