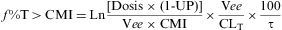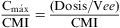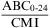La lectura interpretada del antibiograma se basa fundamentalmente en datos microbiológicos y farmacodinámicos. La información microbiológica separa las cepas bacterianas en aquellas que no tienen mecanismos de resistencia a los antibióticos y las que sí los tienen. Con esta información y al tratar los parámetros farmacocinéticos de cada antimicrobiano es posible realizar aproximaciones farmacodinámicas que puedan predecir el éxito o el fracaso del antibiótico en una determinada infección. Numerosos estudios realizados han permitido seleccionar 3 índices farmacodinámicos que se asocian al éxito terapéutico de los antibióticos: tasa de concentración máxima/concentración mínima inhibitoria (CMI), tasa de área bajo la curva/CMI y tiempo en que las concentraciones superan la CMI del patógeno. La simulación de Monte Carlo permite calcular el punto de corte de sensibilidad para cada antibiótico-microorganismo y buscar una probabilidad superior al 90% para alcanzar el objetivo. Los criterios clínicos deberían confirmar los puntos de corte o, en caso contrario, obligarán a su reconsideración.
The interpretative reading of the antimicrobial susceptibility test is mainly based on microbiological and pharmacodynamic data. Microbiological information splits bacterial strains into those having antimicrobial resistance mechanisms and that do not. With this information, and using the pharmacokinetic parameters of each antimicrobial it is possible to make pharmacodynamic approaches to predict antibiotic success or failure in an infectious process. Many studies have emphasized the usefulness of three pharmacodynamic indexes associated with therapeutic success: rate maximum concentration/MIC (Cmax/MIC), area under de curve /MIC (AUC/MIC) ratio, and time to concentration excess MIC (T>MIC). The Monte Carlo simulation enables the susceptibility breakpoint to be calculated for each antibiotic-microorganism, trying to achieve its target with a probability greater than 90%. Clinical data should confirm the susceptibility breakpoints or, if not, these breakpoints should be to be reconsidered.
El antibiograma es una técnica in vitro relativamente sencilla de llevar a cabo. En esta, bajo determinadas condiciones estandarizadas, un microorganismo es expuesto a un antimicrobiano y se anota el efecto observado tras un período de incubación. Los resultados obtenidos pueden variar de manera considerable, según las condiciones experimentales, y cualesquiera que estas sean siempre estarán muy alejadas de las existentes in vivo, en el propio foco infeccioso. No obstante, el antibiograma ofrece, por lo general, una información útil, acumulable y fácilmente comparable con datos históricos de nuestro propio laboratorio o de otros1.
El conocimiento de las concentraciones mínimas de un antibiótico necesarias para inhibir (concentración mínima inhibitoria [CMI]) o matar (concentración bactericida mínima) un determinado inóculo bacteriano en condiciones estrictas de estandarización tiene un gran interés y utilidad microbiológica2. Además, la vigilancia de la sensibilidad a través del tiempo tiene asimismo interés epidemiológico, como se ha observado, por ejemplo, en la evolución de la sensibilidad de Streptococcus pneumoniae a los antimicrobianos.
El antibiograma implica su realización en el laboratorio para la interpretación y el informe. Todos estos procesos conllevan una serie de actuaciones sobre las que es preciso investigar más y alcanzar el mayor consenso posible.
Una de las variables más importantes en la realización del antibiograma es elegir el tamaño del inóculo para exponer al antimicrobiano. Se conoce que los valores de la CMI pueden variar considerablemente según la densidad del inóculo, el antibiótico y el microorganismo expuesto3–12. Aunque algunos autores13 han considerado el efecto inóculo como un artefacto in vitro con pocas consecuencias clínicas, otros han demostrado su relevancia en animales de experimentación3,7–9,14 e incluso se han hecho propuestas terapéuticas basadas en este fenómeno real3,4,7,9,15–17.
Una vez realizado el antibiograma y conocida la CMI de un antibiótico determinado frente a un patógeno aislado es preciso interpretar esta CMI en términos de sensibilidad o resistencia mediante los llamados «puntos de corte». Clásicamente se han definido 3 criterios que pueden no coincidir: 1) microbiológico, 2) farmacodinámico y 3) clínico18.
- 1.
Criterio microbiológico (corte epidemiológico o del «tipo salvaje»). Basado en el estudio de un gran número de aislados se describe el punto de corte que separa la población que no posee mecanismos de resistencia adquiridos o seleccionados a un antibiótico determinado o a antimicrobianos que tengan el mismo mecanismo/lugar de acción (población salvaje) de la del resto.
- 2.
Criterio farmacodinámico (corte farmacodinámico). Los datos obtenidos que utiliza este criterio se basan en estudios de laboratorio, incluidos modelos de infección en animales, que se extrapolan a humanos mediante la utilización de técnicas matemáticas o estadísticas. El punto de corte se elige finalmente teniendo en cuenta las concentraciones del antimicrobiano calculado a través de los índices farmacodinámicos que predicen la eficacia in vivo.
- 3.
Criterio clínico (corte clínico). Los puntos de corte se derivan de estudios clínicos prospectivos en humanos en donde se compara la evolución con la CMI del patógeno. Este punto de corte separaría las cepas en 2 grandes grupos: aquéllas en donde existiría una alta probabilidad de éxito terapéutico y aquéllas en que sería más probable observar un fracaso. Debido a las muchas limitaciones de los estudios clínicos, se considera que estos criterios deben servir más para confirmar o no los puntos de corte establecidos, teniendo en cuenta los criterios microbiológicos y farmacodinámicos. Si las tasas de fracaso terapéutico son superiores a las predecidas con los datos microbiológicos y farmacodinámicos, éstos deben ser obligatoriamente revisados.
El punto de corte seleccionado para cada combinación de antibiótico-microorganismo debe basarse en el uso adecuado de los 3 criterios antes definidos18,19. Algunos autores han indicado que el término «punto de corte» debería utilizarse sólo para el valor final seleccionado, mediante el aprovechamiento de toda la información obtenida de todos los criterios utilizados y que servirán para el informe final que realizará el laboratorio de microbiología18.
Al utilizar criterios farmacodinámicos y clínicos es posible categorizar un aislado bacteriano como: 1) sensible, la cepa se inhibe por una concentración de antimicrobiano que está asociada a una alta probabilidad de éxito terapéutico; 2) intermedia, la cepa es inhibida por una concentración de antimicrobiano asociada a un efecto terapéutico incierto, y 3) resistente, la cepa bacteriana es inhibida por una concentración de antimicrobiano asociada a una alta probabilidad de fracaso terapéutico18. La categoría sensible implica que el aislado es inhibido por la concentración habitualmente alcanzada por el fármaco cuando se administra a la dosis habitual. La categoría intermedia incluye aislados cuyas CMI están próximas a las concentraciones generalmente alcanzadas en sangre y tejidos, pero cuya respuesta terapéutica puede ser inferior a la presentada por las cepas sensibles. Esta categoría implica que podría obtenerse eficacia clínica en lugares corporales donde los fármacos se concentran (orina, bilis, etc.) o cuando pueda utilizarse una dosis más alta de la habitual. La categoría resistente implica que el aislado no es inhibido por las concentraciones generalmente alcanzables con la utilización de dosis habituales del fármaco o cuya CMI cae dentro del rango para el que se han descrito mecanismos específicos de resistencia y que la eficacia clínica contra el aislado no se ha demostrado de manera fiable en estudios terapéuticos18.
FarmacocinéticaLa farmacocinética es la ciencia que estudia la absorción, la distribución, el metabolismo y la eliminación de los fármacos. Es el «movimiento» del fármaco a través de nuestro organismo1,2,20. Tanto la farmacocinética como la farmacodinamia requieren conceptos bien definidos y terminología estandarizada que precisan de actualización periódica21.
Para los antibióticos que se administran por vía oral es importante conocer la biodisponibilidad absoluta y la variabilidad en la absorción digestiva. Sólo la fracción libre (free) del fármaco es microbiológicamente activa, por lo que se recomienda utilizar este valor (con el prefijo f) en los cálculos farmacocinéticos. Para conocer la distribución del fármaco es preciso determinar las concentraciones séricas máximas (Cmáx) después de la administración de una determinada dosis, el tiempo requerido para alcanzar esta concentración, la semivida sérica, la tasa de unión a proteínas y capacidad de difundir a diferentes tejidos, humores (líquido intersticial) e incluso intracelularmente. Es importante señalar la necesidad de especificar si los parámetros farmacocinéticos de un fármaco determinado se han obtenido durante el estado estacionario (ee) o después de la administración de una dosis única20,21. En el caso de que se vayan a utilizar dosis múltiples de antibiótico es preferible utilizar los parámetros farmacocinéticos obtenidos durante el ee.
Al integrar las concentraciones séricas de fármaco libre en relación con el tiempo, puede calcularse el área bajo la curva (ABC) que suele expresarse en mg×h/l. El ABC obtenida depende no sólo de la dosis administrada, sino de la vía, y existe una clara relación entre este parámetro y la biodisponibilidad (biodisponibilidad absoluta=ABCruta/ABCi.v.). Una vez alcanzada la Cmáx se producen 2 procesos que conducen a la disminución de las concentraciones y a la ulterior eliminación del fármaco. El primer proceso se debe a la dilución del fármaco en el sistema circulatorio y a la distribución a los tejidos fácilmente accesibles (fase α). El segundo proceso (fase β) es consecuencia de la eliminación20. La distribución de los fármacos desde el compartimento vascular al espacio extracelular (donde ocurren la mayoría de las infecciones) depende de las características de éstos (peso molecular, unión a proteínas, hidrofilia o lipofilia) y puede cuantificarse al determinar el volumen de distribución (Vd). Éste es un factor que relaciona la cantidad de fármaco en el organismo con la concentración sérica determinada en el ee y se expresa en l/kg20.
Algunos antibióticos (aminoglucósidos o vancomicina) no tienen alteración en el organismo y se eliminan prácticamente inalterados por vía renal. Otros antibióticos se metabolizan, generalmente en el hígado, donde existe una capacidad limitada y, por tanto, saturable. Si las concentraciones no son excesivas, el fármaco se metaboliza y la farmacocinética sigue un modelo lineal. Sin embargo, si las concentraciones superan la capacidad metabólica del hígado, el fármaco se acumula con lo que pueden alcanzarse concentraciones séricas y tisulares muy elevadas que pueden dar lugar a efectos tóxicos20. Otras veces, además de producirse un aclaramiento (CL) hepático, puede implicarse el propio árbol biliar (ceftriaxona) o el intestino (azitromicina). El metabolismo de los antibióticos puede conducir a transformaciones del medicamento (reacción de fase i) o a su conjugación con otras moléculas del huésped (reacción de fase ii). En el primer caso se puede producir la inactivación, la activación o la conversión en otra sustancia con actividad mayor, menor o igual a la del compuesto original20. Estas reacciones ocurren generalmente bajo el control del sistema citocromo P-450 que a su vez puede activarse por algunos antibióticos (rifampicina) y conducir a un aumento del metabolismo de otros fármacos, tanto antibióticos como de otro tipo, como los estrógenos (incluidos los anticonceptivos). Las reacciones de fase ii generalmente inactivan el medicamento aunque, ocasionalmente, pueden aumentar su actividad. Cuando un fármaco conjugado se excreta al intestino se puede producir una recirculación enterohepática con liberación y absorción posterior del compuesto original20.
La eliminación de los fármacos puede obedecer a una cinética de primer orden, lo que implica que la tasa de eliminación es proporcional a la concentración sérica y, por tanto, está cambiando continuamente. La concentración sérica de los antibióticos que se eliminan de esta forma, que son la mayoría, disminuye en relación con el tiempo de forma exponencial. El CL de estos se define como el resultado de dividir la tasa de eliminación en relación con la concentración sérica: CL (en l/h)=tasa de eliminación del fármaco/concentración sérica20. Otros fármacos se pueden eliminar mediante una cinética de orden 0 que implica una eliminación a tasa constante, independientemente de su concentración20. Unos pocos fármacos pueden saturar sus mecanismos de eliminación, incluso a concentraciones bajas, y como resultado la concentración sérica disminuye linealmente en relación con el tiempo20.
El CL sérico se relaciona tanto con el Vd como con la vida media (CL=0,693×Vd/semivida sérica). Por tanto, un fármaco tardará más en eliminarse cuando se distribuya en un gran volumen o posea una larga vida media20.
La eliminación renal puede tener lugar por filtración glomerular, secreción tubular o difusión pasiva. Cuando exista algún grado de insuficiencia renal habrá que tomar en consideración la vía de eliminación preferente del fármaco con objeto de realizar, si es preciso, algún ajuste de la dosis para evitar su acumulación20.
Desde el punto de vista farmacocinético y como conclusiones, debemos tener en cuenta que la dosis y el Vd determinan la Cmáx, la dosis, la absorción y la eliminación, el ABC y la Cmáx; mientras que la eliminación se correlaciona con el tiempo en que se mantienen las concentraciones séricas.
El conocimiento de los diferentes aspectos farmacocinéticos de cada uno de los antimicrobianos es esencial para inferir las posibilidades de que un antibiótico determinado llegue al foco infeccioso. En este foco el antibiótico se va a encontrar con una serie de condiciones «medioambientales» (pH, potencial de oxidorreducción, cantidad y estado metabólicos del microorganismo, presencia de sustancias inactivadoras del fármaco, etc.) que pueden condicionar la actividad de éste20.
FarmacodinamiaLa farmacodinamia estudia la interacción de los medicamentos con el huésped, la «fuerza de los fármacos». En el caso de los antibióticos, la farmacodinamia estudia el efecto sobre los microorganismos (diana), así como sobre las células del huésped (toxicidad)1,2,20.
Es importante tener en cuenta que esta interacción se establece, o se puede establecer, entre el antimicrobiano y el microorganismo causante del cuadro infeccioso, pero inexorablemente se establecerá entre el antibiótico y la flora saprofita de cada individuo. Esto explica la aparición de disbacteriosis, así como la selección de mutantes resistentes entre la flora saprofita.
Los antibióticos pueden inhibir el crecimiento y la multiplicación de los microorganismos (efecto bacteriostático) o pueden destruirlos (efecto bactericida). La diferencia de actividad suele estar relacionada con el mecanismo de acción del antimicrobiano, pero también con la concentración2. Es importante resaltar que muchos antibióticos ejercen actividad antimicrobiana cuando después de una corta exposición al mismo, la concentración de este ha desaparecido o ha disminuido por inactivación o eliminación (efecto postantibiótico [EPA])2. Todos los antibacterianos producen EPA in vitro cuando las bacterias grampositivas sensibles, como estafilococos y estreptococos, se exponen a los antibióticos2. Los bacilos gramnegativos pueden presentar un EPA prolongado cuando se exponen a antibióticos que inhiben la síntesis de proteínas o de ácidos nucleicos, como los aminoglucósidos, las fluoroquinolonas, las tetraciclinas, los macrólidos, el cloranfenicol y la rifampicina2. En contraste, los bacilos gramnegativos muestran un EPA corto o inexistente cuando se exponen a antibióticos betalactámicos2. La única excepción son las carbapenemas que producen un EPA prolongado frente a Pseudomonas aeruginosa2,22.
Se han descrito otros efectos de los antibióticos más o menos persistentes, pero la mayoría de éstos no ha arrojado información que pueda ser verdaderamente útil para predecir la eficacia de éstos18. La demostración de un EPA in vitro requiere su validación en un modelo animal porque el efecto persistente observado in vitro puede estar ocasionalmente ausente in vivo18.
La actividad de un antimicrobiano puede ser función tanto de su concentración como del tiempo de actuación sobre un determinado microorganismo2,23. Basados en estas características los antibióticos se han clasificado en 2 grupos: 1) antimicrobianos con actividad «dependiente del tiempo» y 2) antimicrobianos con actividad «dependientes de la concentración» (tabla 1).
Clasificación de los antimicrobianos según su efecto antibacteriano
| Dependientes de la concentración | Dependientes del tiempo |
| Aminoglucósidos | Penicilinas |
| Daptomicina | Cefalosporinas |
| Telitromicina | Carbapenemas |
| Metronidazol | Monobactamas |
| Fluoroquinolonas | Clindamicina |
| Vancomicina | |
| Eritromicina | |
| Azitromicina | |
| Claritromicina | |
| Linezolid | |
| Doxiciclina | |
| Tigeciclina | |
| Quinupristina/dalfopristina |
El primer grupo comprende aquellos antimicrobianos que muestran una capacidad bactericida saturada y ligada al tiempo de exposición. El efecto bactericida puede ocurrir a concentraciones ligeramente superiores a la CMI del patógeno, frecuentemente alrededor de 4–5 veces la CMI, sin que esta actividad mejore sustancialmente al aumentar las concentraciones2. En este grupo también se incluyen muchos antibióticos que tienen un efecto predominantemente bacteriostático.
El segundo grupo está constituido por aquellos antimicrobianos cuyo efecto bactericida se manifiesta a concentraciones por encima de la CMI del microorganismo, tanto más cuanto mayor es la concentración2. Muchos de estos antibióticos tienen además un importante EPA, lo que le confiere importantes ventajas farmacodinámicas.
Principales índices farmacodinámicos relacionados con eficacia terapéutica- 1.
Tasa de Cmáx/CMI
Este índice se ha validado en el tratamiento con antibióticos de acción bactericida «dependientes de la concentración», como los aminoglucósidos y las fluoroquinolonas2,24. En el caso de la gentamicina, las tasas superiores o iguales a 10 se han correlacionado con eficacia en el tratamiento de la neumonía nosocomial25 y las tasas superiores o iguales a 8 se han correlacionado con eficacia en el tratamiento de la bacteriemia por P. aeruginosa tratada con gentamicina y tobramicina26. Igualmente, se ha obtenido buena correlación en el tratamiento de la bacteriemia por P. aeruginosa tratada con ciprofloxacino cuando la tasa alcanzada era superior o igual a 826, así como en infecciones graves adquiridas en la comunidad tratadas con levofloxacino con tasas superiores o iguales a 12,227. La obtención de cocientes óptimos no sólo se correlaciona con eficacia terapéutica, sino con un menor riesgo de selección de mutantes resistentes y disminución de la toxicidad20,28.
- 2.
Cociente del ABC/CMI
Este índice también se correlaciona con la actividad bactericida de antibióticos «dependientes de la concentración»2. Existen datos clínicos que apoyan la necesidad de obtener cocientes del ABC/CMI superiores o iguales a 125 (o f ABC/CMI >75) en neumonías graves por bacilos gramnegativos tratadas con ciprofloxacino29. En pacientes con neumonía adquirida en el hospital tratados con levofloxacino también se ha observado que una tasa del ABC/CMI superior o igual a 87 (o f ABC/CMI >62) se correlacionaba con eficacia30. Tasas similares obtenidas con otras fluoroquinolonas se han asociado igualmente con eficacia en el tratamiento de agudizaciones de bronquitis crónicas31,32.
Estudios in vitro en animales de experimentación y datos clínicos indican que las tasas f ABC/CMI de 25–34 son predictivas de erradicación bacteriana en neumonía neumocócica adquirida en la comunidad33–39 y las tasas f ABC/CMI de 100–120 parecen asociarse a una disminuación del riesgo de selección de mutantes resistentes a las fluoroquinolonas34. En el tratamiento de infecciones del tracto respiratorio inferior causadas por Staphylococcus aureus tratadas con vancomicina se ha descrito que las tasas del ABC/CMI superiores a 350 se correlacionaban con eficacia40.
Otros antibióticos cuya eficacia se correlaciona con este índice son la azitromicina, la telitromicina, las tetraciclinas, los glucopéptidos, la quinupristina/dalfopristina y el linezolid41–43.
Un aspecto práctico de los antibióticos «dependientes de la concentración» es que pueden administrarse en dosis altas y a largos intervalos (cada 12 o 24h) ya que muchos de éstos presentan un marcado EPA. Esta dosificación se correlaciona no sólo con eficacia terapéutica sino, como en el caso de los aminoglucósidos, a una menor toxicidad28.
- 3.
Tiempo por encima de la CMI (f T>CMI)
Este índice es el que más se correlaciona con la eficacia de antibióticos cuya actividad bactericida es más «dependiente del tiempo». Para antibióticos betalactámicos se considera deseable alcanzar un tiempo que exceda la CMI del patógeno entre el 20-50% del intervalo de dosificación, y se requieren valores más altos para cefalosporinas y más bajos para carbapenemas2,18,44.
Aunque un determinado microorganismo pueda presentar una CMI algo más elevada que la población «salvaje» en el tratamiento con betalactámicos, es posible conseguir éxito terapéutico mediante el aumento de la dosis con lo que se consigue un tiempo por encima de la CMI (T>CMI) más prolongado. Éste es el caso del tratamiento de infecciones por neumococos con sensibilidad disminuida a los betalactámicos que pueden responder con una dosis mayor del antimicrobiano.
En el tratamiento de la otitis media aguda con betalactámicos, macrólidos y cotrimoxazol se ha demostrado una eficacia superior al 80% cuando el f T>CMI era mayor del 40–60% del intervalo de dosificación2,45,46. Este parámetro también se ha correlacionado con la eficacia de otros antibióticos, como monobactamas, macrólidos y clindamicina47,48.
El tipo de microorganismo infectante es una variable importante para el análisis farmacodinámico. Por ejemplo, algunas infecciones estafilocócicas pueden responder a antibióticos betalactámicos con parámetros de T>CMI menos favorables2. Este hecho parece deberse al EPA mostrado por estos antibióticos frente a estos patógenos.
El T>CMI no es siempre un índice independiente de los otros mencionados. Cuando se administra un antibiótico por vía i.v. y de forma intermitente (bolo) los índices farmacodinámicos de T>CMI, ABC/CMI y tasa de Cmáx/CMI están interrealacionados. Conforme el T>CMI aumenta, así lo hace también el ABC/CMI y la tasa Cmáx/CMI.
¿En qué puede ayudar la farmacodinamia para la interpretación clínica del antibiograma?En los últimos 10 años se viene utilizando, cada vez más, un modelo matemático descrito hace alrededor de 25 años49 que incorpora la variabilidad en los parámetros farmacocinéticos y la distribución natural de los valores de CMI en una población bacteriana (Monte Carlo). Muchos expertos defienden que esta técnica permite establecer mejor los puntos de corte basados en índices farmacodinámicos y que también puede ser útil para mejorar la detección de la resistencia a los antimicrobianos y facilitar, por tanto, el diseño de regímenes terapéuticos más adecuados50. De hecho, la simulación de Monte Carlo es ampliamente utilizada por el EUCAST y, en menor medida, por los CLSI19,51.
La simulación de Monte Carlo requiere ecuaciones diferentes para clases diferentes de antibióticos51,52.
Betalactámicos:
Donde f %T>CMI es la proporción de tiempo en que la concentración sérica libre permanece por encima de la CMI; Ln es el logaritmo natural; dosis es la dosis del antibiótico (mg) administrado por vía i.v. intermitente en bolo; UP es la fracción del fármaco unido a proteínas en suero humano; Vee es el Vd del antimicrobiano en ee (l/kg); CLT es el CL corporal total (l/h) y τ es el intervalo entre dosis (h).
Aminoglucósidos:
Donde la Cmáx/CMI es la máxima concentración alcanzada en suero (mg/l), dosis es la dosis de antibiótico (mg) y Vee es el Vd en ee (l/kg).
Fluoroquinolonas:
Donde ABC0-24 es el ABC de concentración sérica-tiempo desde 0 a 24h (mg×h/l).
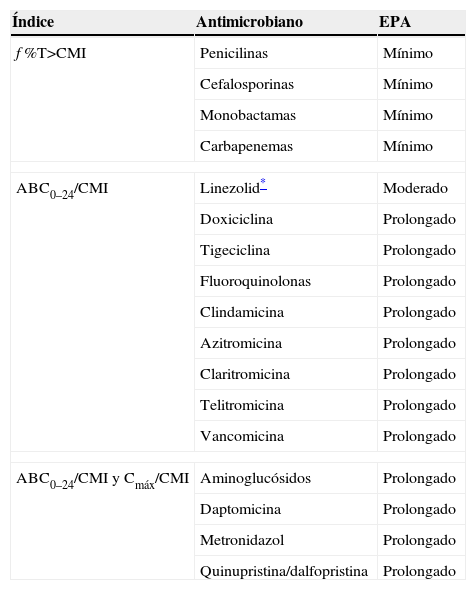
Diferentes estudios farmacodinámicos han permitido concluir qué índices farmacodinámicos se correlacionan mejor con eficacia terapéutica. La tabla 2 muestra los antibióticos cuya eficacia se asocia a un índice farmacodinámico determinado. Es de notar que prácticamente todos los antimicrobianos cuya eficacia se asocia al índice del ABC/CMI presentan un EPA moderado o prolongado.
Índices farmacodinámicos asociados a eficacia terapéutica y efecto postantibiótico
| Índice | Antimicrobiano | EPA |
| f %T>CMI | Penicilinas | Mínimo |
| Cefalosporinas | Mínimo | |
| Monobactamas | Mínimo | |
| Carbapenemas | Mínimo | |
| ABC0–24/CMI | Linezolid* | Moderado |
| Doxiciclina | Prolongado | |
| Tigeciclina | Prolongado | |
| Fluoroquinolonas | Prolongado | |
| Clindamicina | Prolongado | |
| Azitromicina | Prolongado | |
| Claritromicina | Prolongado | |
| Telitromicina | Prolongado | |
| Vancomicina | Prolongado | |
| ABC0–24/CMI y Cmáx/CMI | Aminoglucósidos | Prolongado |
| Daptomicina | Prolongado | |
| Metronidazol | Prolongado | |
| Quinupristina/dalfopristina | Prolongado | |
ABC: área bajo la curva; Cmáx: concentraciones séricas máximas; CMI: concentración mínima inhibitoria; EPA: efecto postantibiótico; f: prefijo de fracción libre (free); T>CMI: tiempo por encima de la concentración inhibitoria mínima.
Mediante las herramientas que la farmacodinamia pone en nuestras manos es posible realizar un análisis de los posibles resultados que podría obtenerse al variar el objetivo por alcanzar en fracciones desde el 0-100% lo que, indirectamente, se correlacionará con los valores de CMI de los patógenos. De esta forma es posible definir cuál sería la CMI máxima para que, con los parámetros farmacocinéticos del antibiótico, se consiguiera más del 90% de probabilidad de alcanzar el objetivo y, de esta forma, poder fijar el punto de corte de sensibilidad. La cifra del 90% es arbitraria y no se ha validado clínicamente, pero se considera que los valores por debajo de este porcentaje pueden asociarse a una disminución significativa de la eficacia del antibiótico18. La simulación de Monte Carlo es, hoy en día, una herramienta imprescindible para determinar los puntos de corte de sensibilidad antimicrobiana53,54.
Conviene tener en cuenta las limitaciones de las simulaciones farmacodinámicas ya que, la mayoría de éstas, proceden de estudios realizados en animales de experimentación y más raramente de ensayos clínicos36,51. Los parámetros farmacocinéticos que se emplean están casi siempre referidos a sangre y se han realizado básicamente en voluntarios sanos, aunque esto podría no ser un factor limitante55. Los índices farmacodinámicos, por sí solos, no son suficientes para garantizar la curación clínica y la erradicación bacteriológica. En un estudio que incluyó un buen número de pacientes con neumonía nosocomial tratados con levofloxacino y después de analizar 18 covariables se observó que la probabilidad de conseguir la erradicación bacteriológica dependía no solo de obtener una tasa del ABC/CMI adecuada, sino de la edad del paciente44. La localización del proceso infeccioso, en donde claramente influye la farmacocinética, desempeña un papel primordial en la eficacia clínica del antimicrobiano, como se ha demostrado en pacientes tratados con levofloxacino en donde, a pesar de obtenerse un óptimo índice de la Cmáx/CMI, las probabilidades de alcanzar el objetivo variaron desde el 100% en infecciones urinarias al 75% en infeccciones de la piel y de los tejidos blandos27.
Si bien la farmacodinamia es una herramienta de extraordinario valor, precisa de datos clínicos, microbiológicos y conocimiento de mecanismos de resistencia microbiana para modular y seleccionar la mejor alternativa terapéutica.
Nota: Sección acreditada por el SEAFORMEC. Consultar preguntas de cada articulo en: http://www.elsevier.es/eimc/formacion