Describimos un brote de infección por Serratia marcescens (S. marcescens) y la investigación epidemiológica que asoció el brote al uso de clorhexidina acuosa al 2% como antiséptico.
MétodoA finales del mes de noviembre del 2014 detectamos un aumento en la incidencia de infecciones por S. marcescens en pacientes atendidos en Urgencias, por lo que nos planteamos la posibilidad de estar ante un brote e iniciamos una investigación epidemiológica.
ResultadoSe aisló S. marcescens en 23 muestras de 16 pacientes y en todos los frascos nuevos de 2 lotes de clorhexidina acuosa al 2%. Se ordenó retirar el desinfectante y se alertó a la Agencia Española del Medicamento (COS 2/2014). El estudio epidemiológico demostró que los aislamientos de las muestras clínicas y las recuperadas de la clorhexidina pertenecían al mismo clon. Una vez retirados los lotes contaminados, no se produjeron más casos.
ConclusiónLa sospecha del brote y la investigación epidemiológica fueron fundamentales para controlar la incidencia.
An outbreak of Serratia marcescens infections outbreak is described, as well as the epidemiological study that linked the outbreak to the use of 2% aqueous chlorhexidine antiseptic.
MethodIn late November 2014 an increasing incidence of S. marcescens isolates was detected in patients treated in the emergency department. It was considered a possible outbreak, and an epidemiological investigation was started.
ResultS. marcescens was isolated in 23 samples from 16 patients and in all new bottles of two lots of 2% aqueous chlorhexidine. The contaminated disinfectant was withdrawn, and the Spanish Drugs Agency was alerted (COS 2/2014). The epidemiological study showed that strains isolated from clinical samples and from chlorhexidine belonged to the same clone. No further isolates were obtained once the disinfectant was withdrawn.
ConclusionThe suspicion of an outbreak and the epidemiological study were essential to control the incidence.
Serratia marcescens (S. marcescens) es un bacilo gramnegativo perteneciente a la familia Enterobacteriaceae, que puede formar parte de la microbiota humana pero también encontrarse en reservorios inanimados pobres en nutrientes1, incluso hospitalarios, como grifos de lavamanos2, fluidos intravenosos3 y champú infantil4, entre otros, a partir de los que a veces da lugar a brotes nosocomiales.
El Hospital Universitario Río Hortega de Valladolid es una institución pública de tercer nivel con 680 camas, que atiende a una población de 256.000 habitantes aproximadamente; la incidencia de bacteriemias por S. marcescens en nuestra institución es muy baja, 3 episodios en 2013 y uno hasta finales de octubre del 2014, y las pocas descritas son de origen nosocomial, motivo por el cual llama nuestra atención, en la última semana de noviembre del 2014, un aumento en la incidencia de los aislamientos de S. marcescens en hemocultivos.
Se trataba en todos los casos de pacientes atendidos en Urgencias; los aislamientos presentaban idéntico antibiograma y la relación del aislamiento con la clínica inicial de los pacientes era escasa o nula. Los siguientes días se continúa aislando este microorganismo en muestras de pacientes no solo de Urgencias, sino también ingresados en UCI, iniciándose un brote que involucró a 16 pacientes y duró un mes.
Este brote condicionó, a instancias de Microbiología y merced a la Dirección Médica del hospital, la creación de una comisión multidisciplinar que coordinó una investigación epidemiológica y microbiológica guiada por lo descrito al respecto en la literatura5-7, que nos condujo a resultados y medidas que terminaron controlando el brote.
Material y métodosLos casos del brote fueron definidos como aquellos pacientes con aislamiento en muestra clínica de S. marcescens desde el 21 de noviembre del 2014, con antibiograma característico, incluyéndose tanto colonizaciones como infecciones. Se consideró colonización cuando no hubo clínica asociada ni tratamiento específico, e infección al aislamiento en el paciente con clínica compatible en el que se pauta tratamiento antibiótico específico.
Investigación microbiológica y epidemiológicaContactamos con la empresa suministradora de los viales para hemocultivos para saber si alguno de sus clientes les había notificado algún caso de contaminación de los mismos.
En la primera reunión de la comisión multidisciplinar que se forma al efecto (3 de diciembre del 2014, 7 casos) se decide:
- 1.
Realizar estudio epidemiológico de los aislados en las muestras clínicas hasta ese momento para confirmar un origen común.
- 2.
Retirar de los servicios implicados (Urgencias de adultos, Urgencias de pediatría y UVI) el material relacionado con la toma de hemocultivos, sustituyéndolo por otro nuevo.
- 3.
Incubar 6 frascos de hemocultivos de Urgencias pediátricas, 8 de Urgencias de adultos y 8 de UCI sin inocular (blancos).
El día 9 de diciembre (9 casos), en la siguiente reunión, se decide iniciar la búsqueda del microorganismo en aquellos productos farmacéuticos e incluso útiles implicados en el procedimiento de obtención del hemocultivo.
Se eligieron los correspondientes a Urgencias pediátricas, por ser una localización pequeña que suponía un volumen de trabajo asequible para Microbiología y porque los responsables del servicio habían recogido y tenían guardado todo el material.
Decidimos estudiar: la clorhexidina acuosa al 2% Bohmclorh® (6 frascos), povidona yodada (10 frascos), el gel de manos (2 frascos), el agua oxigenada (2 frascos), el alcohol (6 frascos), crema de manos de urea (un frasco) y los tortores.
En todos ellos se realizó una siembra en caldo cerebro-corazón, para hacer pase a las 24 h en agar sangre, y una siembra directa en agar sangre, con lectura a las 24 y 48 h de incubación a 37°C en aerobiosis.
Tras los resultados de esta primera búsqueda se recabaron más frascos de clorhexidina acuosa al 2%, sembrándose una muestra de todos los lotes disponibles en el hospital (12 envases cerrados en total) en agar sangre, que se incubó a 37°C, en atmósfera aerobia, durante 48 h.
El procesamiento de las muestras clínicas correspondientes a los pacientes implicados se realizó mediante procedimientos microbiológicos habituales.
La identificación y el antibiograma de todos los aislamientos se realizó mediante el sistema Vitek 2 (bioMérieux®, Francia).
El estudio epidemiológico realizado por la Dra. Ana Vindel en el Centro Nacional de Microbiología se llevó a cabo mediante electroforesis en campo pulsado (PFGE) tras la digestión del ADN cromosómico con XbaI. Enviamos 3 aislados de 3 frascos de clorhexidina acuosa al 2% intactos, 2 del lote i-34 y una del i-35, y 6 aislados de pacientes distintos, 5 de hemocultivos y una recuperada del líquido cefalorraquídeo de una derivación ventricular.
ResultadosDesde el 21 de noviembre del 2014 se detectó en el Laboratorio de Microbiología un aumento en la incidencia de aislamientos de S. marcescens recuperados de hemocultivos. Los 3 primeros correspondían a pacientes atendidos en Urgencias, tanto en el área de Pediatría como en el de adultos. Estos aislamientos presentaban idéntico antibiograma y la correlación del hallazgo microbiológico con la clínica de los pacientes era escasa o nula.
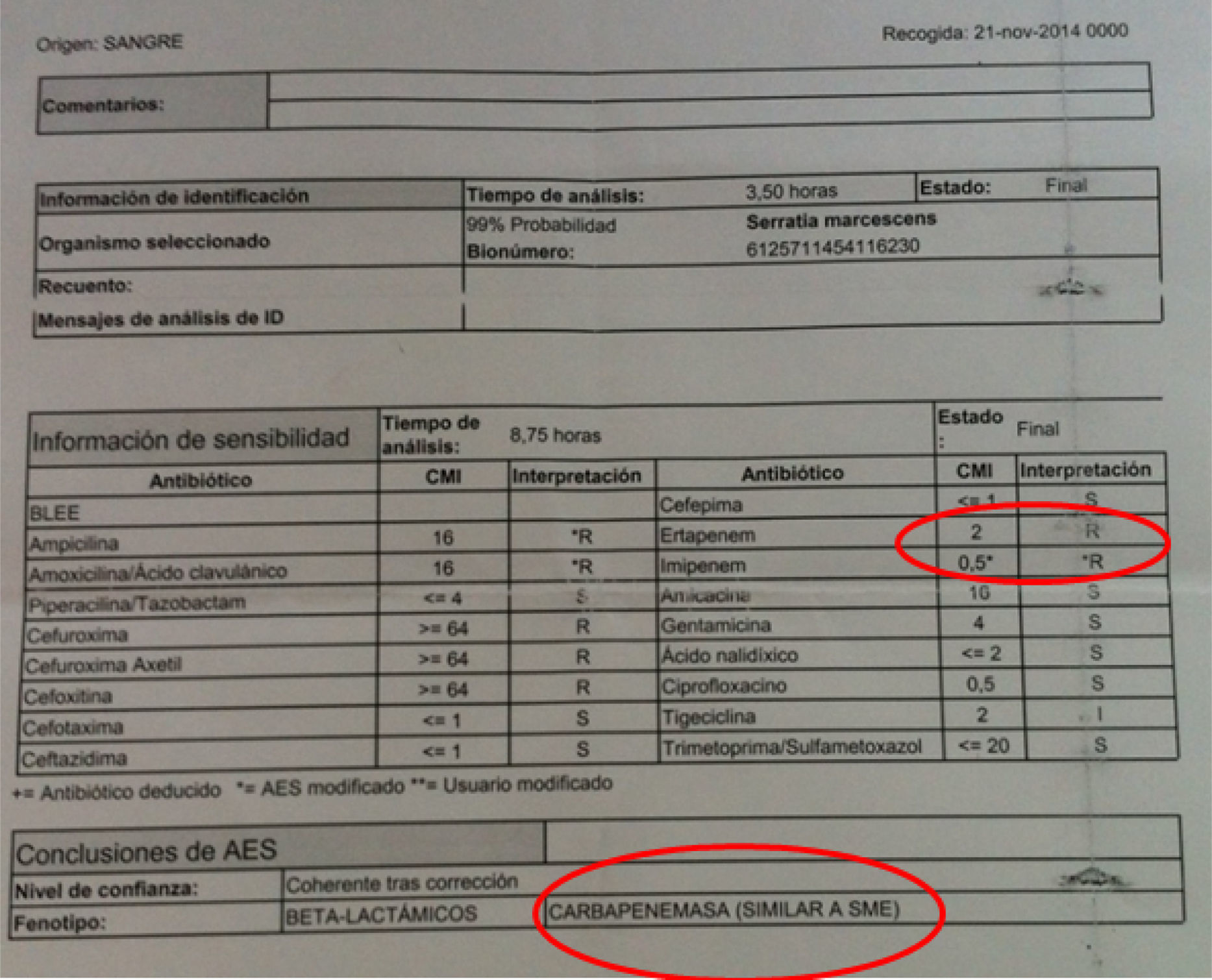
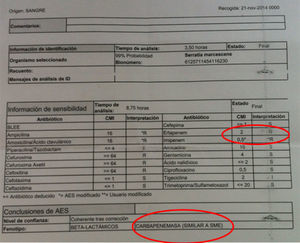
El antibiograma de estas 3 primeras mostraba una peculiaridad y es que nuestro sistema automatizado encontraba para ertapenem una CMI de 2μg/ml, y de 0,5μg/ml de imipenem, motivo por el que el sistema experto sugería que pudiera tratarse de una cepa que expresase una carbapenemasa cromosómica de clase A, Sme (fig. 1). Estudiadas las cepas por E-test, se comportaban como sensibles a ertapenem (CMI 0,25mg/l).
Las particularidades de estos aislamientos se pusieron en conocimiento de los servicios clínicos implicados, para que se valorasen con cautela, quedando constituida el 3 de diciembre, a instancias de la Dirección Médica del hospital, una comisión interdisciplinar (Urgencias pediátricas y de adultos, Microbiología, Medicina Preventiva, Farmacia Hospitalaria, Dirección de Enfermería y Dirección Médica), donde se analizarían periódicamente los hallazgos y se decidirían las medidas a adoptar.
Investigación microbiológica y epidemiológicaA lo largo del mes que duró el brote, se aisló S. marcescens en 23 muestras correspondientes a 16 pacientes. En 11 pacientes, el hallazgo se consideró como una contaminación, y en los otros 5 como infección, cumpliendo criterios de los Centers for Disease Control and Prevention de Atlanta para el diagnóstico de infecciones nososcomiales8. Estas 5 infecciones fueron: una ventriculitis nosocomial en una paciente intervenida en Neurocirugía que requirió una reintervención para el recambio del drenaje del líquido cefalorraquídeo y tratamiento antibiótico con ciprofloxacino, meropenem y amikacina intratecal; 2 bacteriemias asociadas a catéter venoso central, y una bacteriemia primaria, que fueron las 3 tratadas con meropenem, y la otra secundaria a neumonía, tratada con imipenem más ciprofloxacino.
Todos los pacientes evolucionaron favorablemente tras el tratamiento antibiótico.
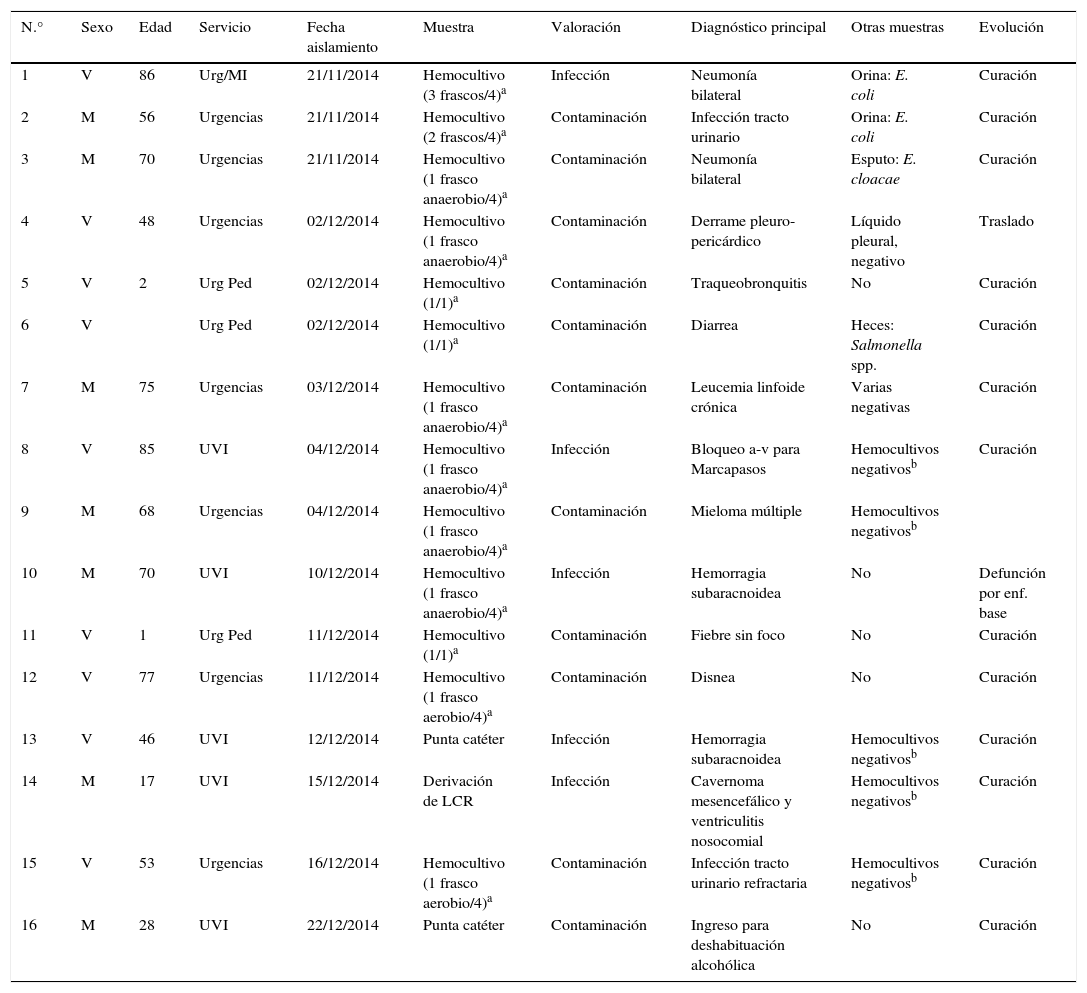
Los datos demográficos de los pacientes, las fechas del aislamiento, las muestras procesadas y algunos datos clínicos se recogen en la tabla 1.
Características demográficas y clínicas de los casos y valoración de las muestras positivas a Serratia marcescens
| N.° | Sexo | Edad | Servicio | Fecha aislamiento | Muestra | Valoración | Diagnóstico principal | Otras muestras | Evolución |
|---|---|---|---|---|---|---|---|---|---|
| 1 | V | 86 | Urg/MI | 21/11/2014 | Hemocultivo (3 frascos/4)a | Infección | Neumonía bilateral | Orina: E. coli | Curación |
| 2 | M | 56 | Urgencias | 21/11/2014 | Hemocultivo (2 frascos/4)a | Contaminación | Infección tracto urinario | Orina: E. coli | Curación |
| 3 | M | 70 | Urgencias | 21/11/2014 | Hemocultivo (1 frasco anaerobio/4)a | Contaminación | Neumonía bilateral | Esputo: E. cloacae | Curación |
| 4 | V | 48 | Urgencias | 02/12/2014 | Hemocultivo (1 frasco anaerobio/4)a | Contaminación | Derrame pleuro-pericárdico | Líquido pleural, negativo | Traslado |
| 5 | V | 2 | Urg Ped | 02/12/2014 | Hemocultivo (1/1)a | Contaminación | Traqueobronquitis | No | Curación |
| 6 | V | Urg Ped | 02/12/2014 | Hemocultivo (1/1)a | Contaminación | Diarrea | Heces: Salmonella spp. | Curación | |
| 7 | M | 75 | Urgencias | 03/12/2014 | Hemocultivo (1 frasco anaerobio/4)a | Contaminación | Leucemia linfoide crónica | Varias negativas | Curación |
| 8 | V | 85 | UVI | 04/12/2014 | Hemocultivo (1 frasco anaerobio/4)a | Infección | Bloqueo a-v para Marcapasos | Hemocultivos negativosb | Curación |
| 9 | M | 68 | Urgencias | 04/12/2014 | Hemocultivo (1 frasco anaerobio/4)a | Contaminación | Mieloma múltiple | Hemocultivos negativosb | |
| 10 | M | 70 | UVI | 10/12/2014 | Hemocultivo (1 frasco anaerobio/4)a | Infección | Hemorragia subaracnoidea | No | Defunción por enf. base |
| 11 | V | 1 | Urg Ped | 11/12/2014 | Hemocultivo (1/1)a | Contaminación | Fiebre sin foco | No | Curación |
| 12 | V | 77 | Urgencias | 11/12/2014 | Hemocultivo (1 frasco aerobio/4)a | Contaminación | Disnea | No | Curación |
| 13 | V | 46 | UVI | 12/12/2014 | Punta catéter | Infección | Hemorragia subaracnoidea | Hemocultivos negativosb | Curación |
| 14 | M | 17 | UVI | 15/12/2014 | Derivación de LCR | Infección | Cavernoma mesencefálico y ventriculitis nosocomial | Hemocultivos negativosb | Curación |
| 15 | V | 53 | Urgencias | 16/12/2014 | Hemocultivo (1 frasco aerobio/4)a | Contaminación | Infección tracto urinario refractaria | Hemocultivos negativosb | Curación |
| 16 | M | 28 | UVI | 22/12/2014 | Punta catéter | Contaminación | Ingreso para deshabituación alcohólica | No | Curación |
Se descartó por parte de la empresa suministradora de los frascos de hemocultivo que pudiera tratarse de una contaminación en el proceso de fabricación de los mismos. En efecto, tras 5 días de incubación, los frascos sin inocular fueron informados por el incubador como negativos.
En cuanto a la búsqueda microbiológica en productos y útiles, solo fueron positivos los cultivos correspondientes a la clorhexidina.
De los 6 frascos de clorhexidina acuosa al 2% recogidos del Servicio de Urgencias pediátricas y sembrados junto al resto de útiles y productos, correspondientes a los lotes i-20, i-29 e i-34, se aisló S. marcescens en los 3 frascos pertenecientes al lote i-34, uno de ellos abierto expresamente para realizar el cultivo.
Tras el procesamiento de los 12 frascos restantes, recogidos de todo el hospital tras los primeros resultados positivos, todos cerrados y pertenecientes a los lotes i-22, i-25, i-26, i-34 e i-35, creció S. marcescens en los 6 frascos correspondientes a los lotes i-34 e i-35.
Al enviar estos aislados procedentes de la clorhexidina acuosa al 2% al Centro Nacional de Microbiología, se nos informó de que había varios hospitales en España que estaban estudiando situaciones similares a la nuestra. Además, el Centro Nacional de Microbiología confirmó la CMI de estos aislados a ertapenem en 0,25mg/l y descartó la presencia de carbapenemasas, incluida Sme.
Control del broteEn la reunión del día 11 de diciembre (12 casos), se decide retirar de todo el hospital la clorhexidina acuosa al 2% Bohmclorh®, sustituyéndola por otra.
Ese mismo día se envía por parte del Servicio de Farmacia Hospitalaria la alerta a la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
Aparecen en los días siguientes otros 4 casos. Tras las pertinentes investigaciones, se averiguó que la clorhexidina acuosa al 2% Bohmclorh® no se había retirado completamente de todo el centro.
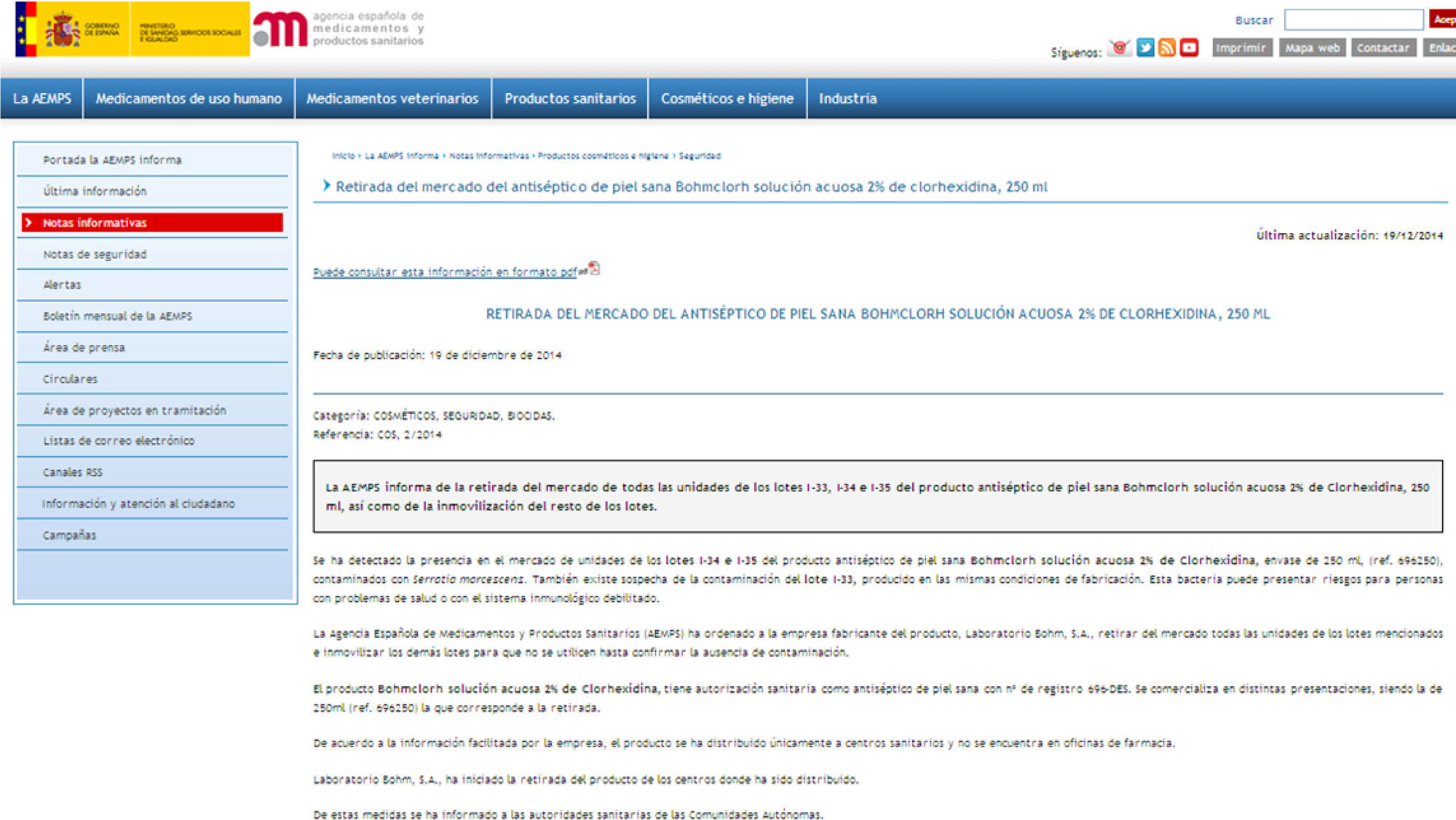
El 19 de diciembre, la AEMPS emitió una alerta (ref. COS 2/2014) (fig. 2) informando de la retirada del mercado de los lotes i-34 e i-35 del producto antiséptico Bohmclorh® solución acuosa al 2% de clorhexidina 250ml por estar contaminados con S. marcescens.
El día 23 de diciembre recibimos el resultado de las pruebas de epidemiología molecular realizadas en el Centro Nacional de Microbiología (fig. 3), que demostraba que tanto las cepas de las muestras clínicas como las de los envases de clorhexidina pertenecen al mismo clon.
El día 30 de diciembre, una vez transcurrida una semana sin casos, se declaró resuelto el brote.
DiscusiónLa posibilidad de emergencia de infecciones, incluso de brotes epidémicos, como consecuencia de la contaminación de material sanitario es un hecho conocido y asumido en el manejo actual de las enfermedades infecciosas. Ello incluye las diferentes soluciones antisépticas, que no están exentas de la contaminación por diferentes microorganismos resistentes a las mismas. Se han descrito casos asociados a povidona yodada, el cloruro de benzalconio y la clorhexidina, entre otros7,9-12. La presente publicación describe un brote de infección por S. marcescens originado a partir de Bohmclorh® solución acuosa al 2% de clorhexidina, desinfectante utilizado en nuestra institución para la limpieza de la piel previa a la extracción de muestras de sangre para hemocultivos o la inserción o mantenimiento de catéteres vasculares.
La revisión sistemática de los aislamientos microbiológicos, sobre todo los que corresponden a muestras estériles, realizada en el Laboratorio de Microbiología, y la baja tasa de bacteriemias por S. marcescens en nuestro hospital permitieron una rápida sospecha de que podíamos encontrarnos en el contexto epidemiológico de un brote. El hecho de tratarse de un microorganismo infrecuente como causa de bacteriemias en el centro afectado es un factor que facilita la sospecha rápida de la existencia de un brote y la investigación de su origen. No obstante, algunos estudios publicados refieren retrasos de hasta un mes en la detección de un brote, debido a una inadecuado seguimiento de los cambios en la prevalencia de determinados microoganismos7.
Este tipo de eventualidades deben servir para subrayar la importancia de mantener actualizados los protocolos de actuación y prevención de la infección nosocomial y la formación y compromiso del personal sanitario respecto a su cumplimiento. En casi todos los brotes de este tipo se han descubierto, a partir de los mismos, deficiencias en los protocolos de prevención y de su cumplimiento. Así, algunas de las publicaciones existentes refieren errores relacionados con la concentración de clorhexidina utilizada, inferior a la recomendada por los protocolos del centro7.
Es asimismo importante una adecuada coordinación de los servicios implicados y un seguimiento exhaustivo de la evolución del brote. En nuestro caso, la implicación de la Dirección Médica del hospital, que de forma inmediata, tras transmitirle la sospecha y transcendencia del problema, coordinó la formación de una comisión interdisciplinar desde la que se plantearon la investigación epidemiológica y las medidas que se adoptaron, contribuyó de forma decisiva al control del brote.
Deben implementarse asimismo medidas para la rápida adopción y ejecución de las decisiones tomadas en estas comisiones por parte del personal sanitario. Dado que con frecuencia estos brotes están asociados a materiales y productos muy vinculados a los cuidados de enfermería, es importante que esta área esté asimismo implicada en el control de la implantación de estas medidas. De hecho, en nuestro caso, los fallos y los retrasos en este sentido posibilitaron que aparecieran nuevos casos posteriores a la orden de retirada de la clorhexidina.
De todos modos, y aun cuando la sospecha y el abordaje de estos episodios sea rápido y eficaz, es muy difícil que no ocasionen, como en este caso, incremento de los costes para el paciente y la institución derivados de tratamientos antibióticos y otras actuaciones diagnósticas y terapéuticas que a veces también prolongan la estancia hospitalaria.
Por último, es fundamental el papel de los centros de referencia que con frecuencia se ven implicados en la identificación y el control de estos brotes epidémicos, sobre todo cuando, como en este caso, afectan a varios centros geográficamente distantes y pertenecientes a diferentes servicios de salud. La participación de este tipo de centros es trascendente en la coordinación de los esfuerzos para la identificación del origen de brote y en la difusión de información a los centros afectados. En nuestro caso, fue fundamental a este respecto el papel del Centro Nacional de Microbiología (Dra. Vindel), que permitió la confirmación del origen clonal del brote, y el intercambio de información entre los diferentes centros afectados, algunos de los cuales han publicado recientemente su experiencia13-15.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses, ni este trabajo ha recibido ningún tipo de financiación.
Los autores agradecen la valiosa contribución de la doctora Ana Vindel del Centro Nacional de Microbiología
Parte de este trabajo fue presentado en el XIX Congreso de la SEIMC y no está presentado a ninguna otra revista para su revisión.