Candida auris es una levadura que fue descrita por primera vez en Japón en 2009 a partir de un exudado de oído y, en los últimos años, por razones desconocidas, ha emergido simultáneamente en varios continentes1–3. Por ello se han emitido alertas sanitarias en diferentes países debido su resistencia a múltiples antifúngicos4,5.
Recientemente, en el Hospital La Fe de Valencia (España), se describieron los primeros casos en Europa de fungemia nosocomial causada por C. auris6. El objetivo de la presente carta es comunicar un caso de candidemia y otro de colonización por C. auris en otro hospital español, geográficamente muy distanciado del anterior, y con la peculiaridad de que en nuestro centro las características de transmisibilidad y virulencia de este patógeno emergente no coincidieron totalmente con las descritas previamente en la literatura.
En octubre de 2016 se aisló una levadura en los hemocultivos, punta de catéter y orina de un paciente ingresado en la unidad de cuidados intensivos (UCI) del Hospital Universitario Río Hortega de Valladolid que presentaba crisis convulsivas en el curso de un proceso neumónico. El crecimiento en medio cromogénico ID (bioMérieux) mostraba un color similar al de Candida parapsilosis. Al intentar realizar su identificación mediante espectrometría de masas (Vitek® MS MALDI-TOF, bioMérieux), si bien se obtuvo un espectro de calidad, no se consiguió ningún resultado, ya que esta levadura no constaba en la base de datos de la versión utilizada. También se intentó realizar la identificación con el sistema Vitek ® 2 (bioMérieux), siendo esta Candida haemulonii con una fiabilidad del 95%. La cepa se remitió al Servicio de Microbiología del Hospital Universitario La Paz de Madrid donde con MALDI -TOF Bruker® se obtuvo como resultado C. auris, sin embargo el score fue insatisfactorio (1,4); esta misma identificación se repitió varias veces utilizando cultivos de distinta antigüedad (24 y 48 h). Puesto que ninguno de los dos sistemas de espectrometría de masas proporcionó una fiabilidad adecuada, la cepa se envió al Centro Nacional de Microbiología para su estudio por métodos moleculares.
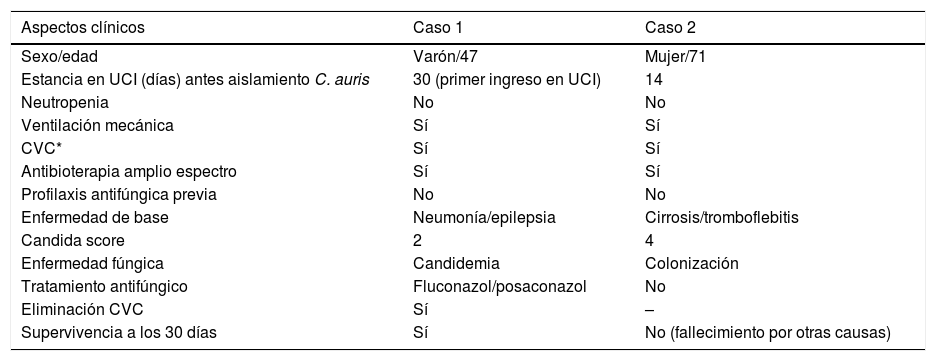
A las seis semanas de la detección de los primeros aislamientos, se aisló una levadura de características similares en una muestra de vigilancia (frotis axilar) de una paciente ingresada también en la UCI. Tampoco se pudo identificar con Vitek® MS, y el sistema Vitek ® 2 lo hizo como C. haemulonii. La cepa se remitió de nuevo al Centro Nacional de Referencia y al Hospital Universitario La Paz de Madrid. En este último centro el sistema MALDI-TOF Bruker® corroboró nuevamente el aislamiento como C. auris. Esta segunda paciente presentaba una cirrosis hepática de origen autoinmune y había ya fallecido por insuficiencia hepática y shock séptico cuando en el cultivo de vigilancia creció la levadura. Finalmente, en el Centro Nacional de Microbiología, la identificación de ambos aislamientos fue confirmada mediante secuenciación como C. auris. Las características clínicas de ambos pacientes se resumen en la tabla 1.
Características clínicas de los pacientes con aislamientos de Candida auris
| Aspectos clínicos | Caso 1 | Caso 2 |
|---|---|---|
| Sexo/edad | Varón/47 | Mujer/71 |
| Estancia en UCI (días) antes aislamiento C. auris | 30 (primer ingreso en UCI) | 14 |
| Neutropenia | No | No |
| Ventilación mecánica | Sí | Sí |
| CVC* | Sí | Sí |
| Antibioterapia amplio espectro | Sí | Sí |
| Profilaxis antifúngica previa | No | No |
| Enfermedad de base | Neumonía/epilepsia | Cirrosis/tromboflebitis |
| Candida score | 2 | 4 |
| Enfermedad fúngica | Candidemia | Colonización |
| Tratamiento antifúngico | Fluconazol/posaconazol | No |
| Eliminación CVC | Sí | – |
| Supervivencia a los 30 días | Sí | No (fallecimiento por otras causas) |
* CVC: catéter vascular central.
Se investigaron retrospectivamente, desde el mes de ingreso del primer paciente hasta la aparición del segundo caso, las especies de Candida poco frecuentes identificadas mediante el sistema Vitek ® 2 en nuestro laboratorio, y se encontraron otros dos aislamientos procedentes de cultivos de vigilancia cuyo resultado era C. haemulonii. Ambos pertenecían a pacientes ingresados en la UCI, se habían detectado en fechas anteriores al último caso y ya no estaban hospitalizados, por lo que no se pudieron confirmar las identificaciones, ya que las cepas no se habían conservado. No obstante, es posible que ambos aislamientos fueran tomados erróneamente por C. haemulonii y que en realidad se tratase de otros dos casos de colonización por C. auris. Este supuesto se asienta en el hecho de que el sistema Vitek® MS (MALDI-TOF) no identificó las levaduras y por ello se recurrió a la tarjeta Vitek ® 2, por lo que la secuencia de acontecimientos fue la misma que en los dos casos confirmados.
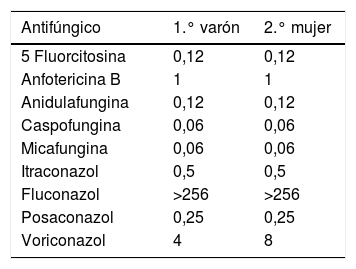
La determinación de la sensibilidad a antifúngicos de las dos cepas se realizó por el método comercializado de microdilución en caldo (Sensititre® Yeast One). La lectura se realizó mediante el cambio de color tras 24 h de incubación. Los resultados se muestran en la tabla 2. Son de destacar las elevadas CMI de fluconazol obtenidas frente a ambas cepas (actualmente no se han establecido puntos de corte ni por el Clinical and Laboratory Standards Institute ni por el European Committee on Antimicrobial Susceptibility Testing para C. auris).
El primer paciente presentaba una candidemia probablemente asociada al catéter central y se trató con fluconazol durante dos días de forma empírica. A pesar de la resistencia de la levadura al fluconazol, la respuesta clínica fue satisfactoria, debido probablemente a que también se le retiró el catéter. Posteriormente, al alta y durante once días, se le administró posaconazol por vía oral. No hubo más hemocultivos positivos, puesto que la candidemia se aclaró al retirar la vía central. El tratamiento antifúngico empírico fue instaurado por clínicos del servicio de Neurología, y cuando se realizó el diagnóstico de certeza, hacía ya días que el paciente había recibido el alta médica. A los tres meses acudió a consultas para revisión de su epilepsia, presentaba buen estado general y fue citado nuevamente para revisión a los seis meses.
Después de siete meses desde el último caso no se ha detectado ningún otro, tampoco se han aislado levaduras de características similares, ni ha aumentado la incidencia de candidemias. Asimismo, tampoco se han identificado en muestras clínicas ni en muestras de vigilancia ninguna de las especies que se pueden confundir con C. auris (C. haemulonii, Candida famata, Candida sake, Rhodotorula glutinis o Saccharomyces cerevisae). En este periodo, solamente se ha detectado un caso de Candida guillermondii en un cultivo de vigilancia (también englobada en las especies de Candida que pueden conducir a identificaciones erróneas5), resultado obtenido mediante Vitek® MS (MALDI-TOF) con una fiabilidad del 99,9%. Tanto las características fenotípicas del cultivo como la técnica proteómica han descartado C. auris, y según referencias previas, MALDI-TOF es un método fiable para la identificación de esta levadura4,5,7,8.
En la literatura, los casos descritos de brotes hospitalarios causados por C. auris han durado meses a pesar de las medidas adoptadas para su erradicación7,8. Se ignora el modo de transmisión de C. auris, aunque está constatado que se aísla en el entorno del paciente afectado, que forma biopelículas y que los brotes remiten o disminuyen cuando se incrementan las medidas de control (higiene de manos, limpieza del entorno, etc.)3,4,7,9,10. En nuestro centro, no ha sido posible conocer el motivo por el que hasta la fecha solo se han detectado dos casos, máxime teniendo en cuenta que no se han implementado medidas de control adicionales.
La vigilancia desde el laboratorio de Microbiología debe basarse en la sospecha ante levaduras que no se puedan identificar por proteómica o que lo hagan como C. haemulonii u otras especies (C. famata, C. sake, S. cerevisae, etc.) con un bajo score6. En nuestro caso, estas cepas sospechosas no se identificaron mediante Vitek® MS. Además de las características fenotípicas de la colonia, también es de ayuda para el diagnóstico el perfil de sensibilidad al fluconazol, puesto que las CMI de este antifúngico frente a C. auris son generalmente muy elevadas. En base a nuestros hallazgos, podría ocurrir que la presencia de esta levadura esté infradiagnosticada, que quizás no siempre origine brotes y que nuestro caso (baja transmisibilidad y virulencia) no sea único.
Cuando en el laboratorio no se disponga de un sistema de espectrometría de masas que incluya C. auris en su base de datos, es imprescindible para una correcta identificación remitir la cepa a un centro de referencia. Las técnicas moleculares que utilizan secuenciación son útiles para la identificación de estas levaduras, aunque retrasan el diagnóstico. Los métodos basados en pruebas bioquímicas (API 20C, Vitek ® 2, etc.) no proporcionan resultados concluyentes y actualmente no son recomendables, aunque podrían utilizarse para la identificación presuntiva en ausencia de otros sistemas confirmatorios. Por tanto, la utilización de métodos proteómicos parece la más adecuada para el ámbito asistencial por su rapidez4,5,7,10, pero cuando el nivel de confianza obtenido sea bajo, la secuenciación es imprescindible.
Sería deseable establecer protocolos de vigilancia e identificación fiables que permitan definir la diseminación de este patógeno en el ámbito asistencial de nuestro entorno.
A Rut Oneizat Cortijo.