La tuberculosis (TBC) es una de las enfermedades infecciosas más prevalentes en gran parte del mundo y constituye un importante problema de salud pública. La Organización Mundial de la Salud la declaró emergencia global en 1993 y, según los datos del registro de TBC del año 20041, España tenía una incidencia de 25 casos por 100.000 habitantes de los que el 11 por 100.000 eran bacilíferos, con una tasa de mortalidad del 2,6%. La multirresistencia primaria era del 1,2% y la secundaria era del 11%.
Dentro de la forma extrapulmonar de la TBC, es importante conocer la afectación ocular ya que su incidencia varía entre el 1 y el 18%2. A pesar de la alta sensibilidad de las técnicas moleculares, el diagnóstico de TBC ocular sigue siendo presuntivo, basado en la presentación clínica, la evaluación sistémica y la respuesta al tratamiento3,4.
Describimos a continuación el caso clínico de un niño de 2,5 años controlado desde los 15 meses por estrabismo convergente en ambos ojos en tratamiento con oclusiones oculares alternas.
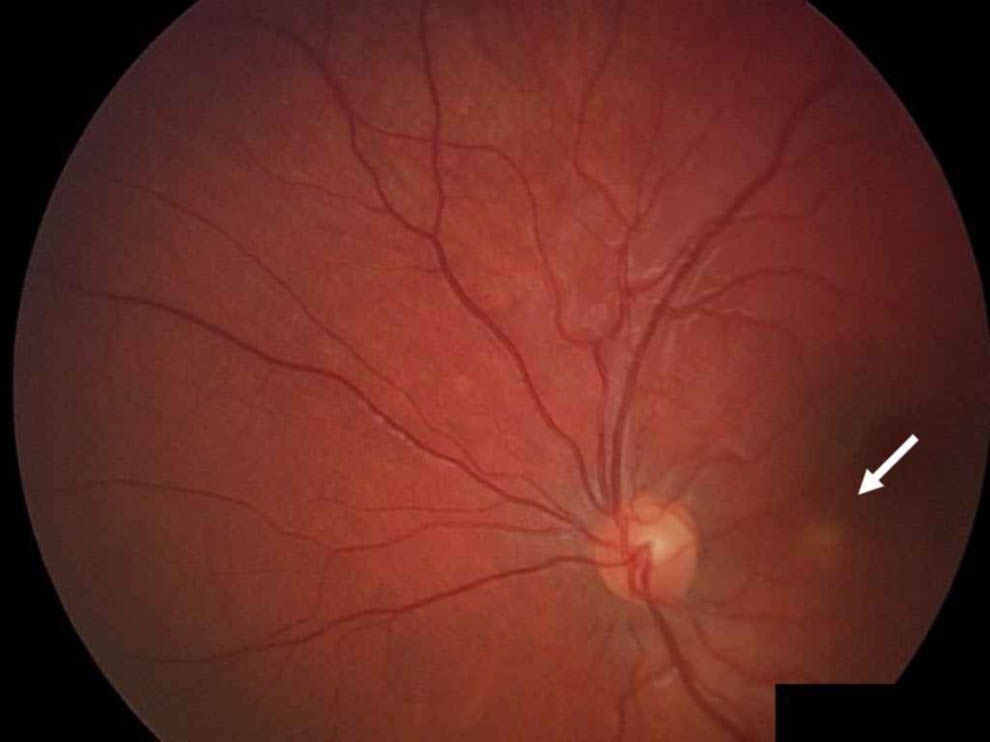
En julio de 2007, en una revisión habitual de fondo de ojo (FO), se observó una lesión coroidea en el ojo izquierdo (OI), asintomática, blanquecina, ligeramente sobreelevada y de localización paramacular (fig. 1); sin embargo, en el ojo derecho no hubo hallazgos. Dos meses más tarde se apreciaron 4 nódulos nuevos con el mismo aspecto, localizados en el trayecto de la arcada vascular temporal inferior, sin signos inflamatorios ni de vasculitis, y con humor vítreo claro. Nuevamente, en el ojo derecho no hubo hallazgos. En la exploración física se observó que el paciente estaba asintomático con buen estado general y presentaba estrabismo convergente. En las exploraciones complementarias se observó: hematimetría, 13.200leucocitos/mm3 (el 45,1% eran neutrófilos y el 47,5% eran linfocitos) y VSG de 48mm/1.a h. La bioquímica básica sanguínea, la gasometría, la proteína C reactiva, los ácidos grasos libres, la beta-OH-butirato y la homocisteína resultaron normales. La serología de toxoplasmosis, rubéola, citomegalovirus, herpes simplex, sífilis, borrelia y brucela resultó negativa. Los cultivos para bacterias, de orina y de líquido cefalorraquídeo, fueron negativos. La radiografía de tórax, la ecografía abdominal y la tomografía axial computarizada craneal resultaron normales. Se realizó el test de Mantoux a las 48h y se observó una induración de 20mm. La baciloscopia y el cultivo para micobacterias de líquido cefalorraquídeo resultaron negativos. La baciloscopia y la detección de ARN de Mycobacterium tuberculosis mediante «Amplified MTD Gen-Probe®(bioMérieux)» en jugo gástrico también resultaron negativas, pero a los 21 días de incubación en los medios líquidos BacT/ALERT® MB (bioMérieux) se obtuvo crecimiento de una micobacteria no cromógena, de crecimiento lento, que se identificó mediante sondas de hibridación «Amplified MTD Gen-Probe®(bioMérieux)» como M. tuberculosis complex.
Se realizó sensibilidad antibiótica en medio Lowestein-Jensen MYCOBIO-T® (bioMérieux), por el método de las proporciones, a los tuberculostáticos de 1.a línea y, posteriormente, a los de 2.a línea, y se mostraron resistentes a isoniacida, rifampicina y rifabutina y sensibles a estreptomicina, etambutol, PAS, pirazinamida, amikacina, capreomicina, clofazimina, kanamicina, ofloxacino y etionamida.
Se realizó genotipado de la cepa y tras la caracterización molecular el patrón obtenido se comparó con los patrones de los aislados multirresistentes (MR) a nivel nacional desde 1998 y con los aislados de MTB en Aragón tipificados desde 2001, presentes en la base de datos de la Universidad de Zaragoza5,6. Esta cepa no se encontraba entre los aislados MR detectados con anterioridad. Tras la comparación con las cepas aisladas de Aragón, el patrón de ésta se agrupó con los 14 aislados, pertenecientes al Cluster ARA21 (8 españoles, 5 rumanos, un ecuatoriano y uno de origen árabe), sensibilidad del Cluster 2 casos resistentes a isoniacida, un caso a isoniacida y etambutol, 11 casos sensibles a todos los fármacos y el caso que presentamos, MR.
En el estudio de convivientes y contactos, el test de Mantoux realizado a padres, abuelos y personal de guardería a la que acudía el niño fue negativo. No se detectó la fuente de infección y no se encontró tampoco lazo epidemiológico con los pacientes del Cluster ARA21.
Se instauró tratamiento durante 16 meses con ciprofloxacino (180mg/12h), pirazinamida (375mg/24h), etambutol (300mg/24h) por vía oral y estreptomicina (325mg) por vía intramuscular, 2 días por semana durante 2 meses y luego una dosis semanal. Evolución: a los 2 meses de tratamiento, en FO sólo se apreciaba un nódulo; en abril de 2008, el nódulo era más pequeño y cicatricial, la papila era normal y el estudio para micobacterias en jugo gástrico fue negativo; en marzo de 2009, el paciente estaba asintomático y continuaba en tratamiento.
Aunque las manifestaciones oculares de la TBC suelen ser sintomáticas2, puede haber casos asintomáticos3, sin concurrir una TBC sistémica activa o enfermedad pulmonar, por lo que es importante realizar un diagnóstico precoz y descartar además otras posibles etiologías, como facomatosis, retinoblastoma, infecciones oculares, toxoplasmosis o etiología autoinmunitaria, lo que en nuestro caso se hizo a la vista de los resultados obtenidos: clínica, serologías y pruebas de imagen.
El genotipado de las cepas de MTB es un instrumento útil para el control de la TBC, permite conocer los patrones de transmisión de la infección, evaluar el estudio de los contactos, investigar brotes y determinar si un nuevo episodio se debe a recidiva o a reinfección7–9.
El tratamiento de la TBC infantil podría prevenir teóricamente la aparición de futuros casos, ya que muchos adultos desarrollan la enfermedad por reactivación de la infección adquirida durante la infancia. A pesar de que los niños con TBC activa no suelen ser bacilíferos, su control y tratamiento contribuye a vigilar los núcleos familiares, colegios, etc., lo que asegura un riguroso estudio de contactos, facilita el diagnóstico temprano de la enfermedad, la instauración rápida de tratamiento y la interrupción de la cadena epidemiológica, y evita la evolución hacia formas más graves de TBC10.
A los profesionales de los servicios de oftalmología, de la Sección de Infecciosos del Servicio de Pediatría del Hospital Universitario Miguel Servet y del Servicio de Vigilancia Epidemiológica de la Dirección de Salud Pública del Gobierno de Aragón, sin cuyo concurso no hubiera sido posible caracterizar este caso.