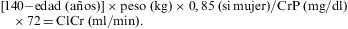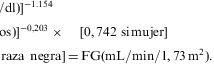En la era del tratamiento antirretroviral combinado, la incidencia de infecciones y tumores oportunistas en pacientes con infección por el virus de la inmunodeficiencia humana (VIH) se ha reducido drásticamente. Al mismo tiempo, se ha producido un aumento progresivo de otras enfermedades no asociadas directamente a la inmunodeficiencia. Las enfermedades renales constituyen una causa cada vez más frecuente de morbimortalidad en los pacientes con VIH. En la población general, la insuficiencia renal crónica tiene una repercusión multiorgánica considerable, que adquiere connotaciones especiales en los pacientes infectados por el VIH. La detección de la enfermedad renal crónica oculta o subclínica es esencial ya que existen medidas eficaces para retrasar su progresión. Por otro lado, el descenso del filtrado glomerular obliga a ajustar las dosis de muchos fármacos antirretrovirales y de otros medicamentos necesarios para el tratamiento de las comorbilidades asociadas. La supresión de la replicación viral, el control estricto de la hipertensión arterial, la dislipidemia y la diabetes, así como evitar el uso de fármacos nefrotóxicos en determinados pacientes son componentes fundamentales de los programas de prevención del daño renal y de la progresión de la enfermedad renal crónica en enfermos con VIH. El tratamiento renal sustitutivo, con trasplante o diálisis, tiene también connotaciones particulares en los pacientes infectados por el VIH. En este artículo se resumen las recomendaciones para la evaluación, el tratamiento y la prevención de las alteraciones renales en pacientes con VIH elaboradas por un grupo de expertos en VIH y Nefrología en representación del Grupo de Estudio del Sida y del Plan Nacional sobre el Sida.
The incidence of opportunistic infections and tumours in HIV-infected patients has sharply declined in the HAART era. At the same time there has been a growing increase of other diseases not directly linked to immunodeficiency. Renal diseases are an increasing cause of morbidity and mortality among HIV-infected patients. In the general population, chronic renal failure has considerable multiorgan repercussions that have particular implications in patients with HIV infection. The detection of occult or subclinical chronic kidney disease is crucial since effective measures for delaying progression exist. Furthermore, the deterioration in glomerular filtration should prompt clinicians to adjust doses of some antiretroviral agents and other drugs used for treating associated comorbidities. Suppression of viral replication, strict control of blood pressure, dyslipidemia and diabetes mellitus, and avoidance of nephrotoxic drugs in certain patients are fundamental components of programs aimed to prevent renal damage and delaying progression of chronic kidney disease in patients with HIV. Renal transplantation and dialysis have also special implications in HIV-infected patients. In this article, we summarise the updated clinical practice guidelines for the evaluation, management and prevention of renal diseases in HIV-infected patients from a panel of experts in HIV and nephrologists on behalf of the Spanish AIDS Study Group (GESIDA) and the National AIDS Plan.
En los últimos años, diversos estudios de cohortes han puesto de relieve la importancia de las enfermedades renales como causa de morbimortalidad en los pacientes con infección por el virus de la inmunodeficiencia humana (VIH) tipo 11–11. Además de las nefropatías asociadas específicamente al VIH o a la coinfección por el virus de la hepatitis C (VHC), la mayor longevidad de los pacientes, la mayor prevalencia de alteraciones metabólicas y la acumulación de riesgo vascular pueden estar favoreciendo el desarrollo de enfermedad renal crónica (ERC) en la población infectada por el VIH. El reconocimiento de que determinados fármacos antirretrovirales pueden producir daño renal en algunos pacientes constituye una preocupación añadida.
Las consecuencias a largo plazo de la disfunción renal crónica en los pacientes con infección por el VIH no son todavía bien conocidas. En la población general, la insuficiencia renal crónica (IRC) tiene una repercusión multiorgánica considerable, que podría tener connotaciones especiales en los pacientes que además están infectados por el VIH. Por otro lado, el descenso del filtrado glomerular (FG) obliga a ajustar las dosis de algunos fármacos antirretrovirales y de otros medicamentos necesarios para el tratamiento de las comorbilidades asociadas.
Para consensuar estrategias para la vigilancia, el control y la prevención del daño renal en pacientes infectados por el VIH, en junio de 2008 se constituyó un grupo de expertos compuesto por médicos especialistas en VIH y nefrólogos en representación del Grupo de Estudio del Sida (GESIDA) de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica y de la Secretaría del Plan Nacional sobre el Sida (PNS). En este artículo se resumen las recomendaciones para la evaluación y el tratamiento de las alteraciones renales en pacientes con infección por el VIH elaboradas por el grupo. El documento completo está disponible en la página web de GESIDA (www.gesida.seimc.org). Las recomendaciones se han jerarquizado siguiendo la clasificación que se expone en la tabla 1.
Clasificación de las recomendaciones empleadas en este documento
| Fuerza de la recomendación |
|
| Calidad de la recomendación |
|
Las enfermedades renales son más frecuentes en los pacientes con infección por el VIH que en la población general7,8,12. Pueden presentarse con un fracaso renal agudo (FRA) o como una ERC. El FRA se define generalmente por una elevación brusca, en días o semanas, de la creatinina sérica de al menos 0,5mg/dl respecto a los valores basales, o por una elevación por encima de 1,5mg/dl (o más de 1,3 veces el límite superior de la normalidad) durante un período de tiempo inferior a 3 meses. La ERC se define por la presencia de una disminución de la función renal, expresada por un FG estimado o por un aclaramiento de creatinina (ClCr) inferior a 60ml/min/1,73m2, o bien por la presencia de daño renal persistente durante al menos 3 meses13,14. El daño renal se detecta habitualmente mediante marcadores bioquímicos, sobre todo elevación en la excreción urinaria de albúmina o proteínas, o alteraciones del sedimento urinario. Las personas con un FG normal pero con marcadores de daño renal presentan un mayor riesgo de desarrollar IRC. En la tabla 2 se exponen los estadios de la ERC según la National Kidney Foundation de EE. UU. (Kidney/Disease Outcomes Quality Initiative [K/DOQI]).
Estadios de la enfermedad renal crónica*
| Estadio | Descripción | FG (ml/min/1,73m2) |
| 1 | Daño renal con FG normal o aumentado | ≥90 |
| 2 | Daño renal con FG, descenso ligero del FG | 60–89 |
| 3 | Descenso moderado del FG | 30–59 |
| 4 | Descenso marcado del FG | 15–29 |
| 5 | Insuficiencia renal terminal | <15 o diálisis |
FG: filtrado glomerular.
Adaptada de las guías americanas Kidney/Disease Outcomes Quality Initiative 2002 de la National Kidney Foundation. La enfermedad renal crónica se define por la presencia de daño renal (alteraciones en las analíticas de orina o en las pruebas de imagen) o una disminución del filtrado glomerular inferior a 60ml/min/1,73m2, durante 3 o más meses.
Los pacientes infectados por el VIH tienen mayor riesgo de desarrollar FRA y ERC4–6,15–21. Las principales causas del FRA y la ERC en estos pacientes se resumen en la tabla 3. Tanto el FRA como la ERC se asocian a una mayor mortalidad en los pacientes con infección por el VIH, con independencia de que reciban o no tratamiento antirretroviral (TAR)3–5,8,17.
Principales causas de fracaso renal agudo y enfermedad renal crónica en pacientes con infección por el virus de la inmunodeficiencia humana
| Fracaso renal agudo |
| Fracaso renal agudo prerrenal y funcional secundario a enfermedades intercurrentes o fármacos |
|
| Fracaso renal agudo parenquimatoso o vascular |
|
| Fracaso renal agudo posrenal u obstructivo |
|
| Enfermedad renal crónica |
|
| Relacionadas con fármacos (antimicrobianos, antirretrovirales, AINE) |
|
AINE: antiinflamatorios no esteroideos; ARA-2: antagonistas de los receptores de la angiotensina 2; IECA: inhibidores de la enzima convertidora de angiotensina; IgA: inmunoglobulina A.
La incidencia del FRA en los pacientes con infección por el VIH hospitalizados durante la era del TAR combinado se sitúa en torno al 6% anual8,9 y triplica la observada en la población no infectada8. La etiología más frecuente es la necrosis tubular aguda relacionada con enfermedades intercurrentes y la nefrotoxicidad por fármacos o contrastes yodados. Se ha observado una estrecha asociación entre el desarrollo de FRA y los predictores tradicionales de mayor riesgo de nefropatía, como la edad, la diabetes mellitus y la ERC previas, la coinfección por el VHC y el diagnóstico de hepatopatía crónica8,22,23. El FRA se ha asociado también a la presencia de inmunodepresión (linfocitos CD4 inferiores a 200 células/mm3), carga viral del VIH-1 elevada, diagnóstico previo de sida y exposición a determinados fármacos antirretrovirales9,23.
En diversos estudios se ha puesto de manifiesto que la prevalencia de la ERC en pacientes infectados por el VIH se sitúa entre el 5–15%3–5, pero en algunas cohortes se ha detectado proteinuria hasta en el 30% de los pacientes6,24. En un estudio realizado recientemente en nuestro entorno, la prevalencia fue del 7,6%25. En muchos casos, la ERC puede pasar inadvertida para los clínicos26, especialmente en los estadios 1 y 2 de la clasificación K/DOQI (tabla 2), en los que el ClCr es superior o igual a 60ml/min26. Se consideran factores que predisponen al desarrollo de disfunción renal crónica la raza negra, la presencia de inmunodepresión (linfocitos CD4 inferiores a 200 células/mm3), una carga viral del VIH-1 elevada, un diagnóstico previo de sida, diabetes mellitus o hipertensión arterial (HTA), y la exposición a tenofovir o indinavir4–6,24,26. La infección crónica por el VHC es también un factor de riesgo reconocido para el desarrollo de disfunción renal27 y puede acelerar la progresión a la insuficiencia renal4,6,22.
Enfermedades renales más frecuentes en pacientes con infección por el virus de la inmunodeficiencia humanaLos pacientes con infección por el VIH pueden desarrollar diversas nefropatías glomerulares, vasculares, tubulointersticiales y obstructivas relacionadas en algunos casos con el propio virus, con los fármacos administrados o con las coinfecciones que presentan (tabla 4).
Principales enfermedades renales en pacientes con infección por el virus de la inmunodeficiencia humana
| Nefropatías glomerulares y vasculares |
|
| Nefropatías tubulares e intersticiales |
|
AINE: antiinflamatorios no esteroideos; IgA: inmunoglobulina A
Nefropatía asociada al VIH (NAVIH). Este tipo de afección glomerular es la nefropatía mejor caracterizada en pacientes infectados por el VIH. Es mucho más frecuente en pacientes de raza negra que en los de raza caucásica (12:1)28–30. La manifestación central de la NAVIH es un síndrome nefrótico (proteinuria superior a 3,5g/día)2,28–32. La proteinuria es masiva en muchos casos (superior a 8–10g/día), aunque su repercusión clínica y analítica (edema, hipoalbuminemia, hiperlipidemia) es menor que en pacientes con otras causas de síndrome nefrótico. La evolución de la NAVIH sin TAR es desfavorable, con un rápido desarrollo de insuficiencia renal que requiere diálisis dentro del primer año del diagnóstico y con una elevada mortalidad31. Su sustrato histológico es una glomeruloesclerosis focal de carácter colapsante, con una intensa afectación tubulointersticial y dilatación de los túbulos renales que, en ocasiones, forman auténticos seudoquistes33.
Aunque no existen ensayos clínicos controlados, datos de estudios observacionales sugieren que el TAR reduce el riesgo de desarrollar NAVIH y mejora el pronóstico de los pacientes que ya han desarrollado esta nefropatía1,34–36. De hecho, la mayoría de las guías de práctica clínica recomiendan iniciar TAR en todos los pacientes con NAVIH, independientemente de la cifra de linfocitos CD4.
Otra opción terapéutica en pacientes con NAVIH es el bloqueo del sistema renina-angiotensina mediante inhibidores de la enzima convertidora de la angiotensina (IECA) o antagonistas de los receptores de la angiotensina 2 (ARA-2). Datos observacionales sugieren que los IECA y los ARA-2 inducen en los pacientes con NAVIH un efecto antiproteinúrico y renoprotector, comparable al observado en otras nefropatías37, y pueden retrasar la progresión de la insuficiencia renal. Algunos estudios han mostrado un descenso de la proteinuria y una tendencia a la estabilización o el enlentecimiento del daño renal en los pacientes con NAVIH tratados con esteroides. Sin embargo, el tratamiento esteroideo puede acompañarse de efectos secundarios importantes y frecuentes, sobre todo en los enfermos con mayor deterioro de la inmunidad38.
Recomendaciones para el tratamiento de la NAVIH:
- •
El TAR (A-II) y los fármacos bloqueantes de la angiotensina (B-III), IECA o ARA-2, solos o en combinación, en dosis crecientes para intentar reducir la proteinuria a valores inferiores a 1g/día y con el objetivo de lograr una TA inferior a 130/80mmHg, constituyen las principales estrategias terapéuticas en los pacientes con NAVIH.
- •
El tratamiento esteroideo sólo debe considerarse cuando no se produce una mejoría de los parámetros de la función renal con el TAR y los fármacos bloqueantes de la angiotensina (C-III).
- •
Las indicaciones de tratamiento renal sustitutivo con diálisis o trasplante en estos pacientes son similares a las de otras nefropatías crónicas en la población general (A-III).
Glomerulonefritis (GN) mediadas por inmunocomplejos. Además de la NAVIH, los pacientes con infección por el VIH presentan una mayor incidencia de otras GN cuya patogenia se atribuye generalmente al depósito glomerular de inmunocomplejos. En las GN por inmunocomplejos no existe la predisposición por la raza negra típica de la NAVIH (de hecho, son más prevalentes en sujetos de raza blanca) y se han descrito sobre todo en países europeos39–41. La histología renal observada en estos pacientes es muy variada, incluye formas proliferativas (10–80%), similares a la nefropatía lúpica, y mixtas proliferativas o esclerosas. En ocasiones no se asocian directamente a la infección por el VIH, sino a otras coinfecciones como las producidas por el virus de la hepatitis B (VHB) o el VHC, relacionadas con una gran variedad de enfermedades renales como la GN membranoproliferativa con crioglobulinemia o la nefropatía membranosa. La nefropatía por depósitos de IgA (GN mesangial con depósitos de IgA) es una de las nefropatías por inmunocomplejos más frecuente en los pacientes con infección por el VIH en Europa.
Aunque el perfil clínico puede orientar hacia el tipo de GN, para el diagnóstico definitivo se requiere una biopsia renal. La indicación de biopsia siempre debe ser individualizada y sopesar el riesgo del procedimiento y los beneficios clínicos que sus resultados pueden aportar al paciente.
Los datos disponibles sobre el tratamiento de las GN mediadas por inmunocomplejos en pacientes con infección por el VIH son muy limitados, incluyendo los coinfectados por el VHC41,42.
Recomendaciones para el tratamiento de las GN mediadas por inmunocomplejos:
- •
En general se recomienda un tratamiento conservador que incluya un control estricto de la TA y el empleo precoz de bloqueantes de la angiotensina para intentar reducir la proteinuria con los mismos objetivos que en la NAVIH (B-III).
- •
En pacientes con insuficiencia renal rápidamente progresiva debe considerarse tratamiento inmunosupresor, dosis altas de corticoides y plasmaféresis (B-III).
- •
Cuando se sospeche que puede estar implicado el VHC en la patogenia, sobre todo si se trata de una GN membranoproliferativa con crioglobulinemia, debe considerarse el tratamiento antiviral con interferón y ribavirina, y en las formas más agresivas tratamiento con esteroides, plasmaféresis o rituximab (B-III).
Nefropatía diabética e hipertensiva. Las complicaciones metabólicas del TAR y el envejecimiento de la población infectada sugieren que el daño renal secundario a diabetes e hipertensión puede tener cada vez mayor importancia en los pacientes infectados por el VIH43. En algunas series de biopsias renales de pacientes con infección por el VIH se ha comunicado la presencia de nefropatía diabética en el 6% de los casos y nefropatía hipertensiva con nefroangioesclerosis en el 4%44.
Recomendaciones para el tratamiento de la nefropatía diabética y de la nefropatía hipertensiva:
- •
El tratamiento recomendado es similar al empleado en la población no infectada por el VIH y debe incluir un control estricto de la TA y el uso precoz de bloqueantes de la angiotensina para intentar reducir la proteinuria (A-II).
- •
Las indicaciones de tratamiento renal sustitutivo con diálisis o trasplante en estos pacientes son similares a las de otras nefropatías crónicas en la población general (A-III).
Microangiopatía trombótica (MAT) e HTA maligna
La incidencia de la MAT, con afección renal o neurológica, probablemente es más alta en los pacientes con infección por el VIH que en la población general45–49. La clínica es similar a la observada en los casos de MAT en pacientes no infectados por el VIH45–48. El curso clínico es agresivo. En la mayoría de los casos se produce insuficiencia renal irreversible y la mortalidad es muy elevada.
Se ha descrito HTA maligna asociada a diversas enfermedades glomerulares en pacientes con infección por el VIH50,51, entre ellas la nefropatía por depósitos de IgA, la GN membranoproliferativa, la nefropatía membranosa y la glomeruloesclerosis focal. Es bien conocida la relación entre HTA maligna y MAT. La MAT puede acompañarse de HTA maligna y, por su parte, la HTA maligna puede poner en marcha una MAT.
Recomendaciones para el tratamiento de la MAT y de la HTA maligna:
- •
Aunque no existe información sobre la eficacia y la seguridad de ninguna intervención terapéutica sobre la MAT en pacientes con infección por el VIH, se recomienda la administración de plasma fresco y plasmaféresis sobre la base de la experiencia con estas medidas en pacientes no infectados por el VIH (B-III).
- •
En la HTA maligna es imprescindible mantener bien controlada la TA (A-II).
Los pacientes infectados por el VIH pueden presentar una amplia variedad de nefropatías tubulares e intersticiales, las principales se enumeran en la tabla 4.
Necrosis tubular aguda. Debe considerarse este diagnóstico ante un FRA progresivo, a menudo con diuresis conservada, en el contexto de un paciente séptico o hemodinámicamente inestable, o cuando se han administrado contrastes yodados o alguno de los fármacos potencialmente implicados, como AINE, bloqueantes de la angiotensina, aminoglucósidos, trimetoprima-sulfametoxazol, pentamidina, anfotericina B, foscarnet, cidofovir o tenofovir.
Nefropatías tubulares por fármacos. El síndrome de Fanconi es la expresión clínica mejor caracterizada de la lesión y la disfunción de las células tubulares proximales del riñón. La forma más florida se caracteriza por un defecto generalizado en la reabsorción a la altura del túbulo proximal, lo que propicia la pérdida urinaria de fosfato, calcio, urato, aminoácidos, glucosa y bicarbonato, entre otros. Esto puede expresarse como fosfaturia y uricosuria desproporcionadas, con desarrollo de hipofosfatemia e hipouricemia, aminoaciduria, glucosuria a pesar de normoglucemia y acidosis tubular renal tipo ii (acidosis metabólica con anion-gap normal), así como proteinuria de tipo tubular, habitualmente menor de 2g/día, hipopotasemia, y poliuria y polidipsia por incapacidad de concentrar la orina. Cuando además de la lesión funcional de la célula tubular proximal se añade lesión estructural y apoptosis de ésta, se desarrolla necrosis tubular e insuficiencia renal que, si se prolonga en el tiempo por persistencia de la noxa inicial, puede cronificarse. Lo habitual, sin embargo, es que el síndrome se presente de forma incompleta, principalmente en forma de hipofosfatemia, glucosuria normoglucémica y proteinuria variables.
Las manifestaciones clínicas del síndrome de Fanconi varían en función del tiempo de evolución y del grado y el tipo de alteración hidroelectrolítica o metabólica predominante. Habitualmente aparece astenia y debilidad muscular, poliuria y polidipsia y, debido a la hipofosfatemia puede desarrollarse osteomalacia con dolores óseos y seudofracturas52,53.
Las causas de síndrome de Fanconi, completo o parcial, son múltiples, con 2 grupos principales: las congénitas, de presentación en la infancia, y las adquiridas, de predominio en la edad adulta, relacionadas con paraproteinemias, enfermedades tubulointersticiales y fármacos o tóxicos (tabla 5). En los pacientes con infección por el VIH, la causa más frecuente de síndrome de Fanconi es el uso de fármacos, principalmente el tenofovir54,55 y con menor frecuencia otros análogos de nucleósidos, como la didanosina y la estavudina53,56,57. Otros fármacos cuya asociación al síndrome de Fanconi se ha establecido bien son el adefovir, utilizado para el tratamiento de la infección por el VHB, y el cidofovir, empleado para tratar las infecciones por citomegalovirus.
Causas de síndrome de Fanconi adquirido
| Toxicidad farmacológica |
|
| Paraproteinemias |
|
| Enfermedades tubulointersticiales |
|
| Toxicidad por metales pesados |
|
Se han identificado diversos factores de riesgo para desarrollar nefrotoxicidad con el uso de tenofovir, entre ellos la presencia de ERC previa, la administración junto con otros fármacos nefrotóxicos, un peso corporal bajo, una mayor edad y un recuento bajo de linfocitos CD458. En algunos estudios, el antecedente de infecciones oportunistas, la presencia de «comorbilidad», la HTA, el dolor crónico (un marcador de uso de AINE), el uso simultáneo de didanosina y la coadministración de inhibidores de la proteasa (IP) potenciados59–62 se han asociado también a un mayor riesgo de nefrotoxicidad con el uso de tenofovir. Los IP potenciados pueden disminuir el aclaramiento renal del tenofovir y favorecer su acumulación en las células del epitelio tubular63. En una revisión reciente de 164 casos de síndrome de Fanconi asociado a tenofovir, el 84% de los pacientes estaba recibiendo simultáneamente IP, en la mayoría de los casos potenciados con ritonavir54. Por último, determinados polimorfismos en los genes que codifican las proteínas transportadoras de tenofovir en las células de los túbulos proximales renales, concretamente determinados haplotipos del gen ABCC2 (MRP2) y del gen ABCC4 (MRP4)64–66, se han asociado también a un mayor riesgo de nefrotoxicidad con el uso de este fármaco.
Nefritis intersticial inmunoalérgica. Además de lesión tubular directa, algunos fármacos pueden causar FRA como consecuencia de una reacción inmunoalérgica caracterizada por un infiltrado intersticial difuso rico en eosinófilos. La diferenciación de este tipo de FRA es muy importante porque un ciclo de corticoides, junto con la retirada del fármaco causal, puede favorecer la recuperación de la función renal basal. Los antibióticos y los AINE son los fármacos que con más frecuencia causan nefritis inmunoalérgica, aunque algunos antirretrovirales como abacavir, indinavir, atazanavir o efavirenz pueden también desencadenarla.
Nefropatía obstructiva intrarrenal por depósito de cristales. Se produce por el depósito masivo y la potencial obstrucción de cristales a nivel tubular tras el tratamiento con fármacos con baja solubilidad en orina, sobre todo ante elevadas concentraciones y determinados pH urinarios. Los fármacos implicados en los pacientes infectados por el VIH pueden ser sulfadiazina, indinavir, atazanavir, foscarnet y aciclovir a dosis altas. Con indinavir y atazanavir se ha descrito también nefrolitiasis por acúmulo de los mismos cristales excretados. Una buena hidratación es importante para prevenir y tratar esta complicación, que suele ser reversible, aunque la reacción inflamatoria de los propios cristales puede provocar mayor o menor grado de lesión tubulointersticial crónica persistente.
Recomendaciones para el tratamiento de las nefropatías tubulares e intersticiales:
- •
La retirada del fármaco o la corrección del proceso desencadenante intercurrente son obligadas (A-II). Si la causa desencadenante puede corregirse, el cuadro habitualmente revierte, aunque, dependiendo de la intensidad y la duración de la lesión, puede persistir cierto grado de disfunción renal crónica.
- •
En las nefropatías tubulares deben corregirse los principales trastornos hidroelectrolíticos mediante suplementos de potasio, en caso de hipopotasemia, y suplementos de calcio, fosfato y vitamina D, en caso de hipofosfatemia, dolores óseos y osteomalacia (B-III).
- •
En las nefritis intersticiales inmunoalérgicas graves, un ciclo corto de corticoides (3–4 semanas) administrado precozmente puede favorecer la recuperación de la función renal (B-II).
La prevención del daño renal en pacientes con infección por el VIH debe incluir la actuación sobre los factores de riesgo de la ERC potencialmente modificables (tabla 6), la detección de la ERC oculta, la identificación de la etiología de la ERC y la actuación sobre los factores que influyen en su progresión, con particular atención a los fármacos, tanto antirretrovirales como otros empleados para tratar las complicaciones asociadas a la infección por el VIH.
Principales factores de riesgo para el desarrollo de nefropatía en los pacientes infectados por el virus de la inmunodeficiencia humana
| Factores demográficos |
|
| Factores asociados con la infección por el VIH |
|
| Enfermedades concomitantes |
|
| Uso de fármacos potencialmente nefrotóxicos |
|
AINE: antiinflamatorios no esteroideos.
La incorporación de la evaluación periódica de la función renal a la atención programada de los pacientes infectados por el VIH puede facilitar el diagnóstico precoz de la ERC oculta y permitir la aplicación de medidas orientadas a evitar su progresión. Reconocer con prontitud la presencia de insuficiencia renal en estos pacientes es también importante para ajustar las dosis de aquellos fármacos antirretrovirales cuya eliminación se lleva a cabo preferentemente por esta vía.
Desde el punto de vista operativo, en estas recomendaciones las pruebas empleadas para evaluar la función renal se han clasificado en «estudio renal básico», que se recomienda efectuar a todos los pacientes con infección por el VIH, y «estudio renal ampliado», que debe realizarse en pacientes seleccionados. Conviene recordar la importancia de recoger en la anamnesis los antecedentes personales o familiares de nefropatías y los factores que implican un mayor riesgo para su desarrollo (tabla 6), así como el registro de la TA y el peso corporal.
Estudio renal básicoMarcadores de filtrado glomerularLa determinación de la creatinina plasmática generalmente forma parte de los controles periódicos que se les realizan a los pacientes con infección por el VIH. Sin embargo, las concentraciones de creatinina plasmática no reflejan fielmente las tasas de FG y pueden ser completamente normales en individuos con una reducción significativa del FG.
Para evaluar la función renal es necesario calcular el FG. El método más comúnmente utilizado para ello es el ClCr. El ClCr en orina de 24h es, sin embargo, complejo y puede resultar impreciso por los problemas asociados a la recogida de la orina de 24h. Para solventar esta limitación se han desarrollado fórmulas que permiten estimar el FG a partir de la creatinina plasmática, la edad, el sexo, el peso y la raza. Las más usadas son la ecuación de Cockcroft-Gault (C-G) y la validada en el estudio Modification of Diet in Renal Disease (MDRD) (tabla 7).
La fórmula de C-G, que está basada en un estudio de 249 varones hospitalizados, se correlaciona bien con el ClCr. Esta fórmula ajusta la creatinina por marcadores surrogados de masa muscular (peso y edad) e incluye una corrección para el sexo femenino67. Esta ecuación se ha usado para calcular la función renal en numerosos ensayos clínicos y para determinar el ajuste de dosis de los fármacos en la IRC. Es importante conocer que esta fórmula tiende a sobreestimar el FG en pacientes con ClCr normales. La ecuación de MDRD, que deriva de la medición realizada en 1.628 pacientes con nefropatía crónica (con tasas de FG de entre 20–60ml/min/1,73m2)68, estima el FG corregido para la superficie corporal y es la que recomienda la National Kidney Foundation de EE. UU. La ecuación de MDRD no está validada en pacientes con tasas de FG inferiores a 20 y superiores a 60ml/min, y puede subestimar el FG en pacientes con valores superiores a 60ml/min. La fórmula original (6 variables) ajusta por marcadores surrogados de masa muscular (edad, peso, sexo y raza) y por la concentración de albúmina sérica. Se han desarrollado diversas versiones simplificadas de la ecuación MDRD; todas conservan una excelente correlación con el aclaramiento de iotalamato, que se usó como referencia para derivar la ecuación original69. La fórmula simplificada más empleada incluye sólo 4 variables (no requiere la albúmina ni el peso) y es bastante precisa. Muchos laboratorios la calculan ya de forma automatizada a partir de los valores de creatinina, la edad, el sexo y la raza.
Estas 2 ecuaciones pueden verse afectadas por valores bajos de masa corporal, circunstancia relativamente frecuente en pacientes infectados por el VIH, y en las hepatopatías crónicas en estadios avanzados. No obstante, los resultados de ambas fórmulas se aproximan mucho más a la función renal real que los de la creatinina plasmática y son muy fáciles de obtener con cualquiera de las múltiples calculadoras disponibles en internet (http://www.kidney.org/proffesionals/kdoqi/guidelines.cfm,http://nephron.org/cgi-bin/MDRD_GFR/cgi,http://nephron.org/cgi-bin/CGSI.cgi).
En la población general, se considera normal un FG superior a 90ml/min/1,73m2. Una reducción persistente en el FG de menos de 60ml/min/1,73m2 indica ERC y se asocia a una mayor progresión a fallo renal y a muerte prematura por enfermedad cardiovascular70–72.
Marcadores urinarios de daño renalLa ausencia de una reducción del FG no descarta la existencia de ERC, pues diversas enfermedades renales, sobre todo en sus etapas iniciales, pueden cursar con tasas de FG normales o incluso elevadas. Por esto, junto con la estimación del FG, es necesaria la determinación de marcadores urinarios de daño renal, como la proteinuria y la glucosuria (tabla 8).
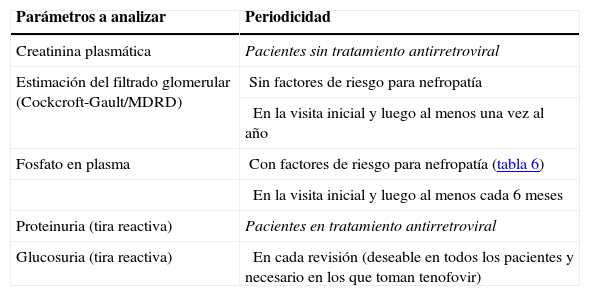
Estudio renal básico a realizar en los pacientes con infección por el virus de la inmunodeficiencia humana
| Parámetros a analizar | Periodicidad |
| Creatinina plasmática | Pacientes sin tratamiento antirretroviral |
| Estimación del filtrado glomerular (Cockcroft-Gault/MDRD) | Sin factores de riesgo para nefropatía |
| En la visita inicial y luego al menos una vez al año | |
| Fosfato en plasma | Con factores de riesgo para nefropatía (tabla 6) |
| En la visita inicial y luego al menos cada 6 meses | |
| Proteinuria (tira reactiva) | Pacientes en tratamiento antirretroviral |
| Glucosuria (tira reactiva) | En cada revisión (deseable en todos los pacientes y necesario en los que toman tenofovir) |
MDRD: versión simplificada de la fórmula Modification of Diet in Renal Disease obtenida a partir de los valores de creatinina, edad, sexo y raza.
La presencia de proteinuria por encima de la excreción fisiológica máxima diaria (<150mg/día) es un marcador de enfermedad renal, a menudo más precoz que el descenso del FG. Según la cantidad de proteínas eliminada se clasifica en microalbuminuria (30–300mg/día), proteinuria no nefrótica (300mg a 3,5g/día) y proteinuria nefrótica (>3,5g/día). Desde el punto de vista cualitativo, la proteinuria se clasifica en glomerular y tubular (generalmente inferior a 2g/día y con mayor proporción de proteínas de bajo peso molecular, como la β-2-microglobulina y menor proporción de albúmina). La proteinuria persistente generalmente indica enfermedad renal y puede servir para identificar casos incipientes de ERC, en los que aún no hay repercusión sobre el FG.
El método más utilizado para detectar proteinuria es la tira reactiva (dipstick). Se trata de un método semicuantitativo, que detecta sólo albúmina, con un umbral de 10–30mg/dl (300–500mg/día). Pueden existir falsos positivos en caso de hematuria, orina concentrada o muy alcalina y tras la utilización de contrastes yodados, y falsos negativos si la orina es muy diluida, predominan las cadenas ligeras, las globulinas o las mucoproteínas o en el caso de la microalbuminuria por sensibilidad insuficiente del método.
La presencia de glucosuria en ausencia de hiperglucemia (glucosuria normoglucémica) constituye un marcador de disfunción tubular que puede ser útil para el diagnóstico temprano de un síndrome de Fanconi.
Por último, otros parámetros analíticos que suelen determinarse en las revisiones de los pacientes infectados por el VIH aportan información complementaria muy valiosa. Este es el caso de las concentraciones plasmáticas de fosfato, potasio y ácido úrico, que pueden descender por eliminación urinaria excesiva como resultado de una disfunción tubular. En este sentido, la hipofosfatemia es frecuente en los pacientes con nefrotoxicidad inducida por tenofovir, pero su utilidad clínica está limitada por su reducido valor predictivo positivo73.
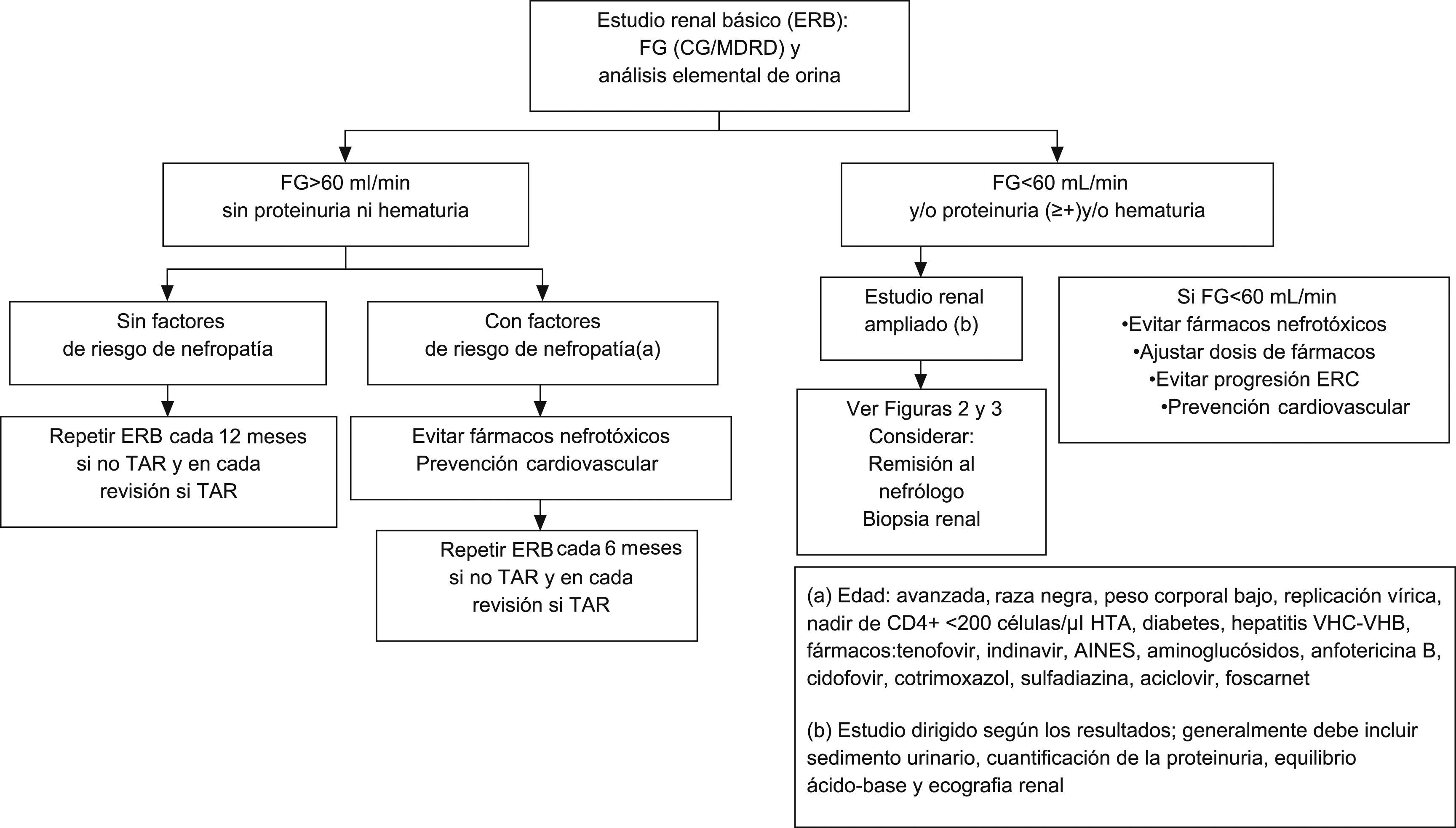
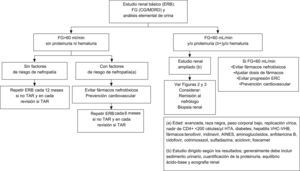
¿Con qué periodicidad debe efectuarse el estudio renal básico?Este estudio básico debe efectuarse en la primera visita tras el diagnóstico de la infección por el VIH, inmediatamente antes de iniciar el TAR y durante el seguimiento posterior (tabla 8). La periodicidad con la que debe repetirse durante el seguimiento puede depender de la existencia o no de factores de riesgo para el desarrollo de nefropatía (tabla 6). Dada la sencillez y el bajo coste, este grupo recomienda que se realice en todas las revisiones programadas de los pacientes que reciben TAR, y muy especialmente en los que toman tenofovir. En los pacientes tratados con tenofovir, aunque la ficha técnica del fármaco recomienda hacer el estudio a intervalos mensuales durante el primer año de tratamiento y trimestrales a partir de entonces, en general se considera que es suficiente con hacerlo en cada revisión. En la figura 1 se resume la actitud a seguir en función de los resultados del estudio renal básico.
Actitud a seguir en función de los resultados del estudio renal básico.AINES: antiinflamtorios no esteroideos; CG: Cockcroft-Gault; ERB: estudio renal básico; ERC: enfermedad renal crónica; FG: filtrado glomerular; HTA: hipertensión arterial; MDRD: Modification of Diet in Renal Disease; TAR: tratamiento antirretroviral; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
Recomendaciones para realizar un estudio renal básico:
- •
En todos los pacientes infectados por el VIH debe realizarse un estudio renal básico (A-III).
- •
Este estudio debe incluir creatinina y fosfato en plasma, una estimación del FG mediante la fórmula MDRD o la de C-G y un análisis elemental de orina que incluya la investigación de proteinuria y glucosuria mediante tira reactiva (A-III).
- •
En los pacientes que no reciben TAR este estudio debe efectuarse: 1) cuando se diagnostica la infección por el VIH; 2) al menos una vez al año si no presentan factores de riesgo para el desarrollo de nefropatía; 3) al menos cada 6 meses cuando uno o más de estos factores están presentes, y 4) antes de iniciar el TAR (A-III).
- •
En los pacientes que reciben TAR se recomienda hacer este estudio básico en todas las revisiones (B-III), especialmente si toman tenofovir (A-III).
Cuando se haya detectado una alteración en el estudio básico, ya sea por alteración del FG, descenso del fosfato sérico o presencia de proteinuria, glucosuria o hematuria en la tira reactiva, debe tratar de identificarse la causa y determinar los factores asociados y el pronóstico. En estos casos puede requerirse un estudio ampliado de marcadores en sangre y orina, y eventualmente pruebas de imagen y biopsia renal.
Análisis de sangreDebe incluir la determinación de los parámetros habituales para el estudio del equilibrio acidobásico (pH y bicarbonato), las concentraciones de iones (sodio, potasio, fosfato, calcio) y ácido úrico, y las serologías para los virus de hepatitis (VHB y VHC) y sífilis. Cuando se sospeche una enfermedad glomerular u otro proceso mediado por mecanismos inmunológicos, es conveniente solicitar crioglobulinas, anticuerpos antinucleares, complemento, electroforesis de proteínas plasmásticas y cuantificación de inmunoglobulinas.
Análisis de orinaLos más importantes son el estudio del sedimento urinario y la cuantificación de la excreción de proteínas. El estudio del sedimento urinario es simple, está disponible en cualquier medio y es muy útil para la detección de nefropatías y uropatías ocultas. Tanto la microhematuria como la leucocituria o la cilindruria son marcadores de enfermedad renal.
Un método sencillo para cuantificar la excreción de proteínas cuando la tira reactiva ha sido positiva es la determinación de los cocientes urinarios de proteínas/creatinina o albúmina/creatinina en una muestra de orina de la primera micción de la mañana. Sus resultados se correlacionan bien con la cuantificación tradicional de la proteinuria de 24h, y evitan los inconvenientes de la recogida de orina de 24h74.
En el caso del cociente proteínas/creatinina, los resultados se expresan generalmente en mg/mg o g/g y el resultado equivaldría al obtenido en la medición de proteinuria en orina de 24h. Por ejemplo, en una muestra encontramos proteinuria de 210mg/dl (o 2,1g/l) y creatinina de 43 (o 0,43g/l), el cociente resultante es 4,9 que equivaldría a una excreción de proteínas en orina de 24h de 4,9g/1,73m2.
El cociente albúmina/creatinina se expresa generalmente como mg de albúmina por gramo de creatinina. Así, en una muestra con albuminuria de 12mg/dl (120mg/l) y creatinina de 40mg/dl (0,40g/l), el cociente será 300mg/g y equivaldría a 300mg de albuminuria/24h. El cociente albúmina/creatinina se considera normal si es inferior a 30mg/g (<3,4g/mol), microalbuminuria si el valor está comprendido entre 30–299mg/g (3,4–33,8g/mol) e indicador de macroalbuminuria («proteinuria») si es superior o igual a 300mg/g (≥33,8g/mol). Todas estas pruebas y aquellas que sólo se realizan en determinadas circunstancias se muestran en la tabla 9.
Estudio renal ampliado que debe realizarse en pacientes infectados por el virus de la inmunodeficiencia humana que presentan anomalías en el estudio renal básico
| Parámetros que deben incluirse siempre |
Los mismos que en el estudio renal básico (tabla 8) más:
|
| Parámetros que deben incluirse en determinadas circunstancias |
Sospecha de glomerulopatía por inmunocomplejos
|
Sospecha de tubulopatía/síndrome Fanconi (especialmente en pacientes tratados con tenofovir)
|
En algunas ocasiones, como en el caso de pacientes en los que exista sospecha de tubulopatía, será necesario completar el estudio con un análisis de orina de 24h, que puede incluir la determinación de glucosuria, fosfaturia, calciuria, albuminuria, proteinuria y aminoaciduria. Cuando la causa de la tubulopatía no es conocida, puede ser conveniente también investigar la presencia de paraproteínas en sangre y orina.
Pruebas de imagenEl método más usado es la ecografía renal. Proporciona información sobre el tamaño y la morfología de los riñones así como sobre su ecogenicidad, y permite el diagnóstico de la uropatía obstructiva unilateral o bilateral.
Consulta al nefrólogo y biopsia renalSi se confirma la existencia de proteinuria o disfunción renal clínicamente significativas o progresivas, es aconsejable consultar con un nefrólogo para que evalúe los resultados de las pruebas realizadas y planifique las estrategias para completar la evaluación y prevenir la progresión de la enfermedad renal.
En determinados pacientes puede ser apropiado realizar un estudio histopatológico para llegar al diagnóstico definitivo de la enfermedad renal de base. La indicación de biopsia debe establecerse cuando de su resultado pueda derivarse un cambio en la estrategia terapéutica de la que se espera un beneficio clínico, sopesando siempre los riesgos que este procedimiento supone. Las indicaciones de biopsia renal se detallan en la tabla 10.
Indicaciones de biopsia renal
| Síndrome nefrótico (proteinuria >3,5g/día o cociente proteínas/creatinina >3,5 con hipoalbuminemia <3g/dl), o bien proteinuria significativa (>1g/día o cociente proteínas/creatinina >1) persistente |
|
| Síndrome nefrítico agudo (hematuria, oliguria, hipertensión arterial, edemas y descenso del FG) o microhematuria intensa persistente |
|
| Fracaso renal agudo o subagudo de causa no conocida o persistente o si existe sospecha clínica de que sea secundario a una enfermedad glomerular (presencia de proteinuria, hematuria macroscópica o alteraciones del sedimento que hagan sospechar un fracaso renal agudo de causa glomerular) o a una nefritis intersticial inmunoalérgica (relación cronológica con fármacos, rash cutáneo, eosinofilia) |
| Enfermedad renal crónica de causa no aparente en pacientes con insuficiencia renal no muy avanzada (FG >30ml/min/1,73m2) y riñones de tamaño normal con cortical conservada |
| Microangiopatía trombótica e hipertensión arterial maligna cuando existe un deterioro agudo de la función renal con proteinuria/hematuria de diverso rango y si la situación general lo permite (tensión arterial controlada, coagulación aceptable) |
FG: filtrado glomerular.
Previamente a la biopsia, debe valorarse la morfología renal con ecografía (la biopsia estaría contraindicada en la mayoría de los pacientes con agenesia renal unilateral, malformaciones renales, riñones pequeños). Debe suspenderse cualquier tratamiento con anticoagulantes y antiagregantes plaquetarios con tiempo suficiente y realizar un estudio de coagulación completo previo. En pacientes de riesgo, como los que presentan insuficiencia renal, puede ser necesario emplear medidas para la prevención de la hemorragia (p. ej. desmopresina intravenosa).
Recomendaciones para realizar un estudio renal ampliado:
- •
En todos los pacientes infectados por el VIH que presenten anomalías en el estudio renal básico debe realizarse un estudio renal ampliado (A-III).
- •
Debe incluir un examen del sedimento urinario, estimación cuantitativa de la proteinuria mediante los cocientes urinarios de proteínas/creatinina o albúmina/creatinina en una muestra de orina de la primera micción de la mañana, análisis del equilibrio acidobásico y del ácido úrico en plasma, serología para VHB y VHC, crioglobulinas, anticuerpos antinucleares, inmunoglobulinas y complemento, ecografía renal y, en determinadas circunstancias, biopsia renal (A-III).
- •
Si se confirma la existencia de enfermedad renal, se recomienda consultar con el nefrólogo (B-III).
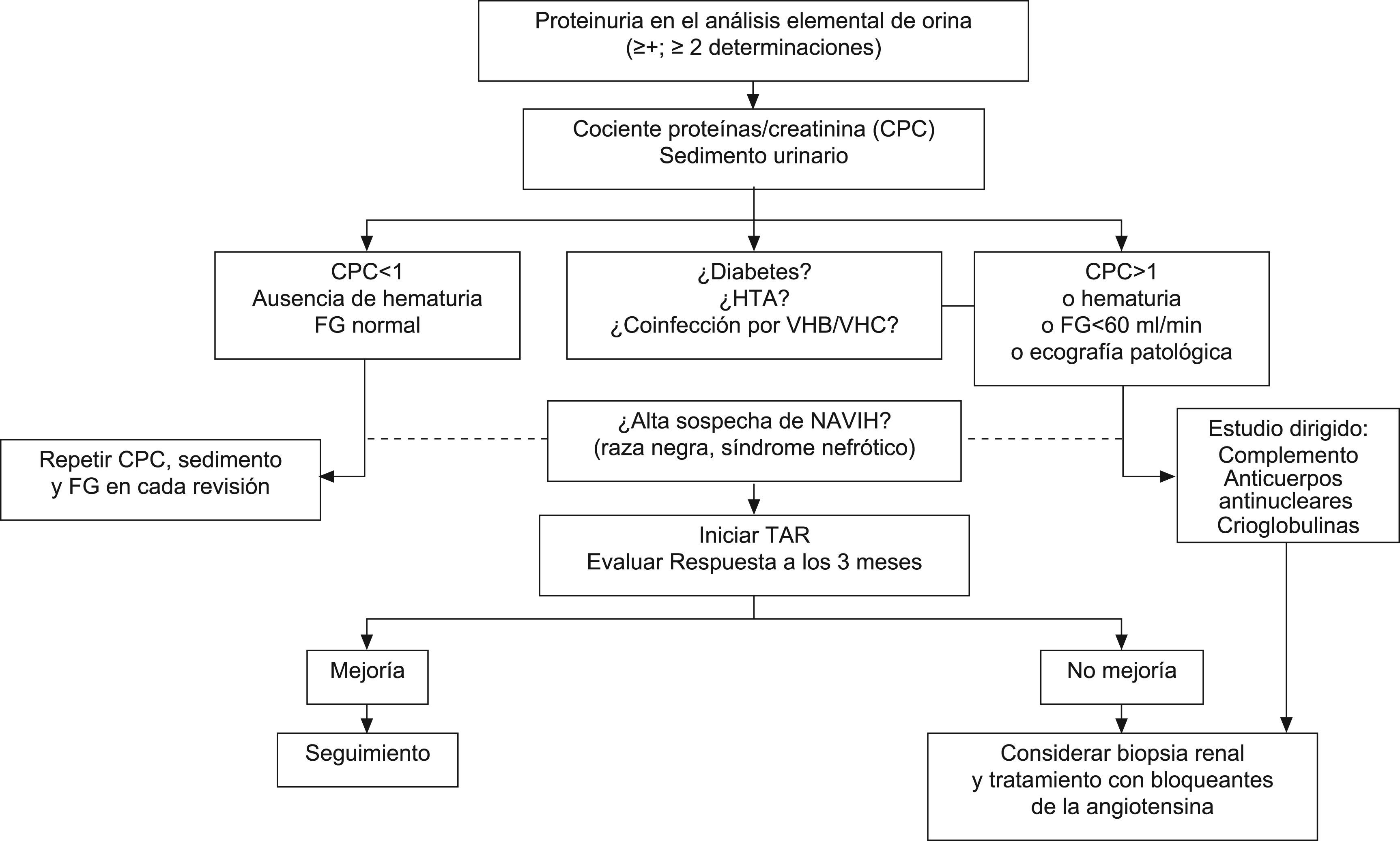
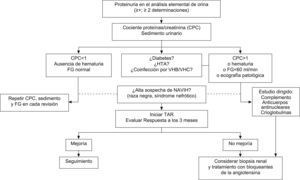
La actitud que debe seguirse en pacientes con proteinuria se muestra en la figura 2. El contexto clínico y los marcadores asociados pueden orientar sobre su origen. Cuando la proteinuria es intensa o existen alteraciones en el sedimento (sobre todo microhematurria y cilindros hemáticos), la causa más probable es una glomerulopatía. Por el contrario, cuando la proteinuria no es intensa y se acompaña de alteraciones de la función tubular, lo más probable es que se trate de una tubulopatía. En presencia de inmunodepresión grave, con o sin síndrome nefrótico, microhematuria y disminución del FG, debe sospecharse una NAVIH o una GN por inmunocomplejos. Cuando existe diabetes mellitus o HTA, lo más probable es que la proteinuria sea secundaria a nefropatía diabética o a nefroangioesclerosis. En presencia de coinfección por el VHB o el VHC, la principal consideración debe ser una GN membranosa o membranoproliferativa.
Recomendaciones para la evaluación y el tratamiento de la proteinuria:
- •
Sea cual fuere la causa de la proteinuria, el tratamiento de los pacientes debe incluir la retirada de los fármacos nefrotóxicos, el control de la HTA y la diabetes —si existieran— y, en todo caso, si la proteinuria es intensa, tratamiento con bloqueantes del sistema renina-angiotensina (IECA o ARA-2) (A-III).
- •
Cuando la proteinuria es superior a 1g/24h o se acompaña de microhematuria o de FG inferior a 60ml/min, debe ampliarse el estudio para identificar la causa (A-III).
- •
Cuando se trate de una proteinuria superior a 1g/24h con un FG normal, se recomienda tratamiento conservador con fármacos bloqueantes del sistema renina-angiotensina (IECA o ARA-2) y seguimiento frecuente (B-III).
- •
Cuando se sospeche una NAVIH, se recomienda iniciar TAR. Si no hay mejoría de las alteraciones renales en el plazo de 3 meses o se consideran otros diagnósticos, debe realizarse una biopsia renal (B-III).
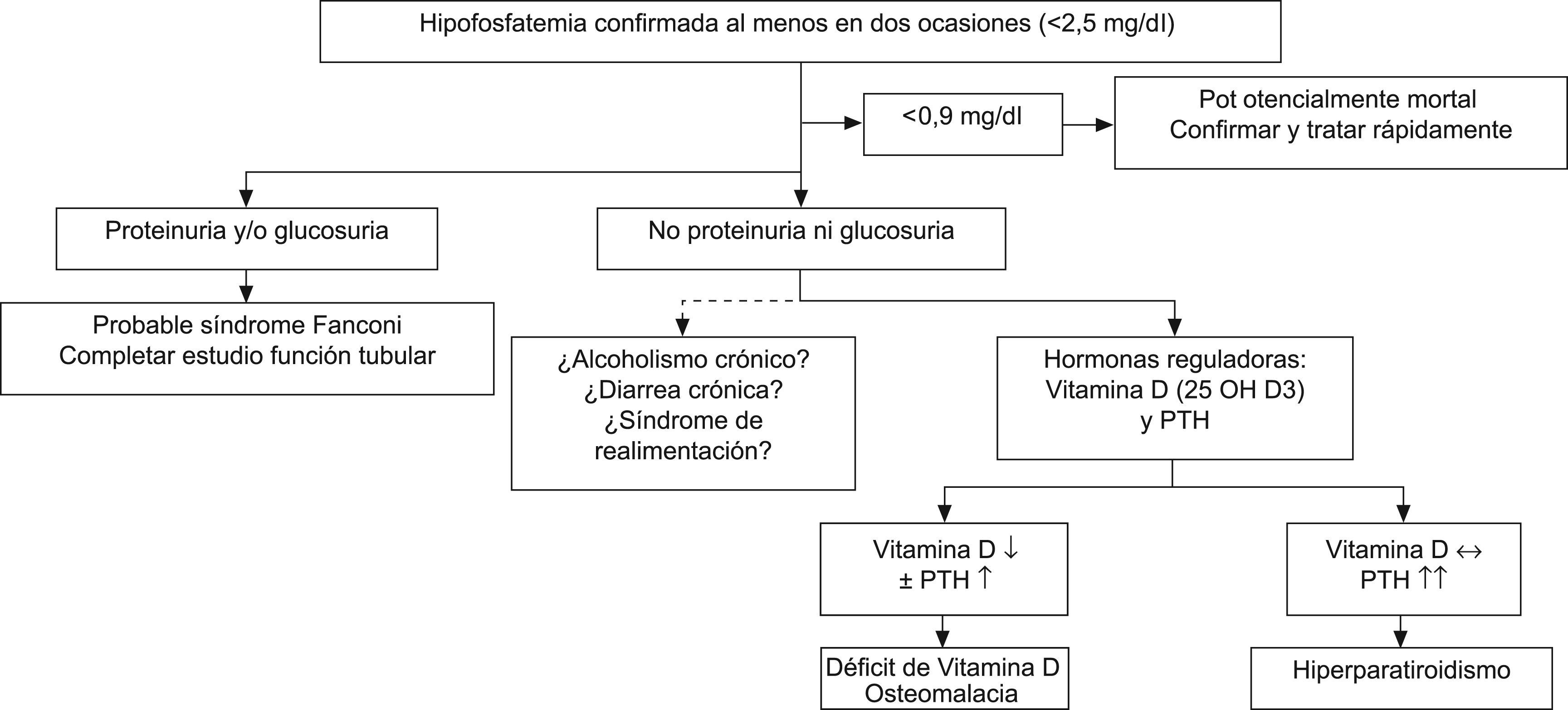
Según los niveles plasmáticos de fósforo, la hipofosfatemia se clasifica en leve (0,65–0,80mmol/l [2–2,5mg/dl]), moderada (0,32–0,64mmol/l [1–1,99mg/dl] y grave (<0,32mmol/l [1mg/dl]). Las hipofosfatemias leve y moderada suelen cursar de forma asintomática, aunque dependiendo del tiempo de evolución pueden manifestarse como cansancio, debilidad muscular y dolores óseos difusos, a veces bastante invalidantes, reflejo de lesiones de desmineralización ósea y osteomalacia. La hipofosfatemia grave, en cambio, se considera una urgencia médica por las graves consecuencias y el riesgo vital que conlleva75.
En el paciente infectado por el VIH, la hipofosfatemia es una alteración relativamente frecuente. Se ha encontrado hipofosfatemia hasta en el 10% de los pacientes sin TAR y en el 20–30% de los que reciben TAR73,76. En la tabla 11 se resumen las principales causas de hipofosfatemia. Para llegar a un correcto diagnóstico es necesario primero distinguir entre un déficit real de fosfato y un descenso aislado y pasajero de las concentraciones plasmáticas, habitualmente debido a redistribución intracelular y extracelular. En series donde se analizó la reproducibilidad de los valores de fosfato en sangre en controles analíticos seriados sin intervención terapéutica, se observó que en un 11% de los casos la hipofosfatemia no se confirmaba o revertía espontáneamente73.
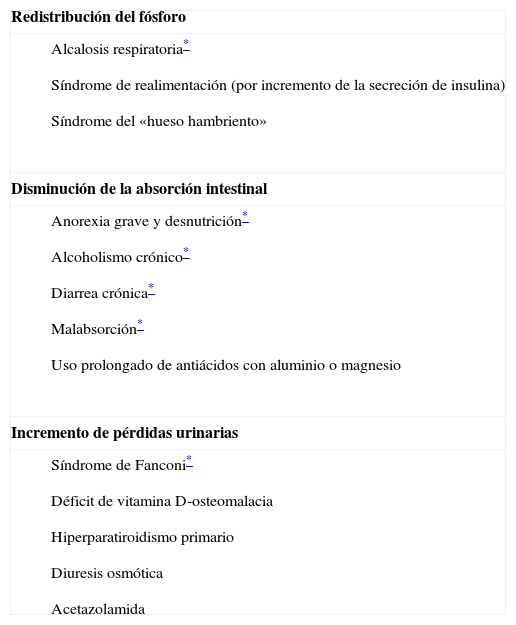
Causas de hipofosfatemia
| Redistribución del fósforo |
|
| Disminución de la absorción intestinal |
| Incremento de pérdidas urinarias |
|
Una vez confirmado que la hipofosfatemia es real y constante, debe valorarse siempre el contexto clínico del paciente e incidir en factores como alcoholismo, la desnutrición grave, la diarrea crónica y sobre todo en los fármacos, antirretrovirales y no antirretrovirales, que esté tomando o haya tomado. Debe estimarse el FG y deben determinarse los niveles de sodio, potasio, uratos, bicarbonato, glucosa, parathormona intacta (PTHi) y calcitriol en sangre, la glucosuria y la proteinuria.
La presencia, junto con hipofosfatemia, de hipouricemia, hipopotasemia, proteinuria, glucosuria con glucemia normal o insuficiencia renal orienta hacia el diagnóstico de síndrome de Fanconi.
Si la hipofosfatemia no se acompaña de ninguna de las alteraciones anteriores y la PTHi está elevada, con niveles normales de vitamina D, debe considerarse el diagnóstico de hiperparatiroidismo primario; si la vitamina D está baja y la PTHi normal o discretamente elevada, debe considerarse el diagnóstico de deficit de vitamina D u osteomalacia. La actitud a seguir en pacientes con hipofosfatemia se esquematiza en la figura 3.
Recomendaciones para la evaluación y el tratamiento de la hipofosfatemia:
- •
La hipofosfatemia debe confirmarse siempre con más de una determinación (A-III).
- •
Deben investigarse otros marcadores renales de tubulopatía proximal, en particular la presencia de proteinuria y glucosuria, y las concentraciones plasmáticas de potasio, uratos y bicarbonato. Si no existe alteración de otros marcadores de disfunción tubular, deben analizarse las hormonas reguladoras del metabolismo fosfocálcico: PTHi y calcitriol en sangre (B-III).
- •
La hipofosfatemia grave (<1mg/dl) requiere una actuación inmediata, en algunos casos con administración intravenosa de fósforo (A-II).
- •
La hipofosfatemia leve o moderada puede resolverse con el tratamiento de la etiología (vitamina D en el déficit de ésta, resección quirúrgica en el caso del hiperparatiroidismo primario y retirada del fármaco o el tóxico en los casos de disfunción tubular proximal secundaria a nefrotóxicos) (B-II). En algunos casos puede emplearse aporte oral de fosfato (B-III).
Las principales causas de ERC en pacientes con infección por el VIH se recogen en la tabla 3. En la tabla 12 se expone el plan de actuación en los distintos estadios de la ERC.
Plan de acción en la enfermedad renal crónica*
| Estadio | Descripción | FG (ml/min/1,73m2) | Acción |
| 0 | Con riesgo aumentado | ≥90 (con factores de riesgo de ERC) | Cribado de ERC |
| Reducción de riesgo de ERC | |||
| 1 | Daño renal con FG normal o ↑ | ≥90 | Diagnóstico y tratamiento de cada una de las causas |
| 2 | Daño renal con ↓ ligera del FG | 60–89 | Tratamiento de comorbilidades Tratamiento para retrasar la progresión Reducción del RCV |
| Vigilar la progresión | |||
| 3 | ↓ Moderado del FG | 30–59 | Evaluar y tratar complicaciones |
| 4 | ↓ Marcado del FG | 15–29 | Preparación para tratamiento renal sustitutivo |
| 5 | Fallo renal | <15 (o diálisis) | Iniciar tratamiento renal sustitutivo |
| Los estadios 1, 2, 3, 4 y 5 identifican a los pacientes que tienen ERC y el 0 identifica a los pacientes con riesgo de desarrollar ERC** | |||
ERC: enfermedad renal crónica; FG: filtrado glomerular; RCV: riesgo cardiovascular.
El diagnóstico y el tratamiento adecuados de los procesos que causan la ERC —cuando sean reversibles— es esencial. Además, debe actuarse sobre los factores que influyen en la progresión de la ERC, tratar las comorbilidades y las complicaciones asociadas e identificar precozmente a los pacientes candidatos a tratamiento renal sustitutivo. Dada la estrecha relación entre ERC y riesgo cardiovascular77, la prevención de la enfermedad cardiovascular es también un objetivo prioritario en los pacientes con ERC.
Existe escasa información en la literatura médica sobre los factores asociados a la progresión de la ERC en pacientes con infección por el VIH. Diversas variables, incluidos un ClCr más elevado en el momento de la biopsia renal, una cifra de linfocitos CD4 más alta, la ausencia de coinfección por el VHC, el uso de IECA o de ARA-2 y el TAR, son factores que se han asociado a un mejor pronóstico renal o a una mayor supervivencia en pacientes con infección por el VIH diagnosticados de ERC mediante biopsia1,36,44.
En la tablas 12 y 13 se muestran los factores y las medidas que pueden influir en la progresión de la ERC en la población general y que podrían operar del mismo modo en los pacientes con infección por el VIH.
Factores asociados con la progresión de la enfermedad renal crónica a insuficiencia renal crónica avanzada
| No modificables |
| Nefropatía de base |
| Factores raciales y poblacionales |
| Modificables |
|
AINE: antiinflamatorios no esteroideos; ARA-2: antagonistas de los receptores de la angiotensina 2; FG: filtrado glomerular; IECA: inhibidores del enzima conversiva de la angiotensina; IRCA: insuficiencia renal crónica avanzada; PA: presión arterial.
Se debe enfatizar la importancia del control de la proteinuria y de la HTA78,79 e insistir en la prevención y el tratamiento precoz de los episodios de deterioro agudo de la función renal (por depleción de volumen u otros) y de la nefrotoxicidad, evitar en lo posible la utilización de sustancias nefrotóxicas (AINE, contrastes yodados, etc.), ajustar la dosis de los fármacos a la función renal, verificar con frecuencia las variaciones de FG cuando se utilizan medicamentos de riesgo y utilizar medidas profilácticas del FRA (p. ej., administración de suero fisiológico cuando se administren contrastes yodados).
Recomendaciones de tratamiento nefroprotector y para la prevención cardiovascular en pacientes con infección por el VIH y ERC:
Dieta y hábitos de vida saludables
- •
Restricción de sal (<6g/día)
- •
Control del exceso de peso
- •
Ejercicio físico (al menos caminar a paso vivo 30–45min 4 días por semana)
Cese del hábito tabáquico (B-II)
- •
Valorar tratamiento sustitutivo y atención especializada antitabaco
Control estricto de la PA (objetivo: menos de 130/80mmHg y menos de 120/70 si existe proteinuria o diabetes mellitus) (A-II)
- •
Primer escalón: IECA o ARA-2
- •
Segundo escalón: diurético
- ○
Diurético tiazídico a dosis bajas o medias (equivalentes a 12,5–25mg de hidroclorotiazida) con función renal leve o moderadamente alterada (hasta creatinina de 2,0mg/dl o FG superior a 30ml/min)
- ○
Diurético de asa con insuficiencia renal moderada o avanzada (FG inferior a 30ml/min)
- ○
- •
Tercer escalón: betabloqueantes (evitar antagonistas del calcio si el paciente recibe tratamiento con inhibidores de la proteasa)
Control de la proteinuria (objetivo: menos de
500–1.000mg/24h) (B-II)
- •
IECA o ARA-2
- •
Si no se logra el objetivo, considerar la combinación de IECA y ARA-2
En pacientes con diabetes, control estricto de la glucemia con HbA1C del 7% o menos (B-II)
- •
Insulina en estadios 4 y 5 de la ERC y antidiabéticos orales en estadios 1–2
- •
En estadio 3 puede usarse gliquidona o glipizida (otras sulfonilureas pueden acumularse y las biguanidas están contraindicadas), tiazolidinedionas, repaglinida, nateglinida y acarbosa
Control estricto de la dislipidemia (B-III)
- •
Dieta adecuada, estatinas, fibratos
Antiagregación plaquetaria (B-III)
- •
Dosis bajas de aspirina, o clopidogrel en caso de intolerancia a la aspirina, en prevención secundaria
En la actualidad, la supervivencia de los pacientes con infección por el VIH en tratamiento renal sustitutivo con diálisis que reciben TAR eficaz no es muy diferente de la de la población general con ERC en diálisis80–82. Esta situación ha permitido el acceso al trasplante renal de un número creciente de pacientes, con unos resultados a corto y medio plazo muy satisfactorios y similares a los de otros grupos de riesgo83.
Consideraciones sobre la diálisis en pacientes con infección por el virus de la inmunodeficiencia humanaExisten varias guías de práctica clínica sobre las principales complicaciones asociadas a la ERC terminal (Kidney diseases: Improving Global Outcomes [KDIGO], K-DOQI, European Best Practice Guidelines, Guías de Práctica Clínica de la Sociedad Española de Nefrología). Aunque la aplicabilidad y la eficacia de estas guías en la población con infección por el VIH no ha sido establecida, salvo algunas consideraciones que se expondrán a continuación, no hay razones para pensar que el tratamiento en estos pacientes deba ser distinto al recomendado para el resto de las personas en diálisis84–87.
Recomendaciones sobre tratamiento renal sustitutivo con diálisis en pacientes con infección por el VIH:
- •
La diálisis no puede contraindicarse en ningún paciente por estar infectado por el VIH (A-III).
- •
La modalidad de diálisis no es un determinante de la supervivencia. Los criterios para seleccionar la modalidad de diálisis deben ser similares a los de otros pacientes con ERC terminal, en función de sus características y preferencias (A-II).
- •
En los pacientes con NAVIH debería plantearse el acceso vascular en fases más tempranas. En el resto de los enfermos se pueden seguir las recomendaciones recogidas en las guías generales de ERC sobre el momento de la realización del acceso para diálisis (B-III).
- •
La fístula arteriovenosa autógena es el acceso vascular de elección en los pacientes infectados por el VIH. Los resultados con los accesos protésicos y catéteres intravenosos pueden ser inferiores a la población no infectada por el VIH (B-II).
- •
Se deben cumplir estrictamente las medidas universales de prevención y desinfección tanto en hemodiálisis como en diálisis peritoneal. No es exigible el aislamiento de sala ni de monitor en hemodiálisis. Es muy conveniente que el paciente realice la diálisis peritoneal y manipule todo el material él mismo y en su domicilio. Se recomienda que, tras eliminar el dializado al inodoro, se añada un desinfectante tipo lejía y se espere 30min antes de evacuarlo hacia la red general. Asimismo, las líneas y las bolsas del líquido peritoneal deberían depositarse tras su uso en contenedores para material contaminante que el paciente pueda llevar al centro sanitario para su eliminación (B-III).
- •
Ante una exposición accidental percutánea o a través de mucosa, se iniciará lo antes posible profilaxis postexposición de acuerdo con las indicaciones del especialista correspondiente (A-III).
- •
En general, el tratamiento de las complicaciones asociadas a la ERC en los pacientes infectados por el VIH debe seguir las recomendaciones recogidas en las guías generales para la población en diálisis (A-III).
- •
Los pacientes con infección por el VIH tienen una mayor morbilidad cardiovascular que la población no infectada y, por otra parte, la ERC per se es un factor independiente de riesgo cardiovascular. Es por tanto previsible una mayor incidencia de episodios cardiovaculares, por lo que deberían extremarse las medidas de prevención cardiovascular (A-III).
- •
La infección por el VHC empeora el pronóstico a largo plazo del paciente con ERC terminal y debe evaluarse con especial atención en estos pacientes. Deben seguirse las recomendaciones específicas sobre el tratamiento de la infección por el VHC en diálisis, que recientemente se han recogido en guías españolas, y las del GESIDA sobre tratamiento del VHC en pacientes con infección por el VIH.
- •
El empleo de eritropoyetina y darbepoetina así como los objetivos de hemoglobina deben seguir las recomendaciones de las guías generales de ERC. Si no hay respuesta al tratamiento debe tenerse presente la posibilidad de toxicidad por otros fármacos o la presencia de infecciones. Para el tratamiento con hierro deben seguirse las recomendaciones habituales para otros pacientes en diálisis.
- •
Los trastornos del metabolismo óseo son frecuentes en estos pacientes y el tratamiento con vitamina D puede resultar beneficioso. Pueden seguirse las recomendaciones recogidas en las guías generales de ERC, si bien la eficacia de estas estrategias necesita confirmarse en la población con infección por el VIH (B-III).
- •
Deben vacunarse frente a la hepatitis A y la hepatitis B si no están inmunizados (B-III). Las respuestas a algunas vacunas puede ser subóptima por el estado de inmunosupresión derivado de la infección por el VIH y de la ERC. Deben seguirse las recomendaciones recogidas en la guía española sobre infecciones virales en diálisis y el documento de consenso de profilaxis de infecciones oportunistas en pacientes infectados por el VIH88 (resumidas en la tabla 14). Siempre que sea posible, las vacunas deben administrarse antes de que el paciente entre en el programa de diálisis.
Tabla 14.Vacunas recomendadas en pacientes con infección por el virus de la inmunodeficiencia humana en diálisis
Streptococcus pneumoniae Si CD4 >200 cel/mm3, administrar una sola dosis Para pacientes vacunados con CD4<200 cel/mm3 que posteriormente alcanzan CD4 >200 cel/mm3, administrar una dosis adicional Es preferible vacunar antes de llegar a IRC terminal Debe revacunarse cada 3–5 años Virus influenza Vacunación anual Hepatitis A Indicada en pacientes sin anticuerpos anti-VHA y con riesgo para la infección por hepatitis A (drogadicción, prácticas sexuales de riesgo) o con hepatopatía crónica, incluida la hepatitis por VHB o VHC Hepatitis B Debe evaluarse a todos los pacientes para conocer su estado serológico y deben vacunarse si no están inmunizados Es preferible vacunar antes de llegar a IRC terminal La tasa de respuesta es baja, por lo que se recomienda administrar una pauta de 3 dosis de la vacuna (0, 1 y 6 meses) con doble cantidad de antígeno (40μg en vez de 20μg) (B-I)88 IRC: insuficiencia renal crónica; VHA: virus de la hepatitis A; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
La experiencia acumulada hasta la actualidad89–94 indica que no hay diferencias en la supervivencia a medio plazo (3–5 años) ni en la supervivencia del injerto entre pacientes con infección por el VIH adecuadamente seleccionados y pacientes no infectados por el VIH. La incidencia de rechazo agudo, sin embargo, puede ser más elevada que en la población no infectada92. Datos preliminares indican que un protocolo inmunosupresor basado en un anticuerpo antirreceptor de IL-2 en la inducción, junto con niveles valle más elevados de ciclosporina y una monitorización predosis de micofenolato en los 6 primeros meses postrasplante, podría asociarse con tasas de rechazo de sólo el 13%97.
Uno de los temores clásicos cuando se planteaba el trasplante de órgano sólido en los pacientes infectados por el VIH era que la inmunosupresión necesaria en el período postrasplante pudiera favorecer la progresión a sida y a muerte relacionada. Sin embargo, los datos disponibles hasta ahora sugieren que no hay más riesgo de infecciones oportunistas o neoplasias en el paciente infectado por el VIH, e incluso algunos de los inmunosupresores podrían mejorar el control de la replicación del VIH89. Con TAR, la cifra de linfocitos CD4 se mantiene estable y la mayoría de los pacientes mantiene carga viral indetectable. Existen datos controvertidos con respecto al riesgo de infecciones bacterianas y a la recuperación inmunológica en los pacientes infectados por el VIH que reciben tratamiento inmunosupresor con timoglobulina98,99.
Un problema importante es el tratamiento de las interacciones farmacocinéticas entre inmunosupresores y algunos antirretrovirales. El uso de antirretrovirales que actúan como inhibidores del citocromo P450 (CYP), como los IP, puede condicionar una elevación de las concentraciones de inmunosupresores (especialmente de los inhibidores de la calcineurina) potencialmente tóxicas. Por el contrario, aquellos antirretrovirales que actúan como inductores, como los inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINN), pueden, aunque más lentamente, disminuir la concentración de inmunosupresores y favorecer el rechazo. Además, el mofetilmicofenolato puede aumentar los niveles intracelulares de abacavir, ddI y tenofovir, lo que puede aumentar su toxicidad95. Por tanto, es necesaria una monitorización del tratamiento89,95.
En los pacientes con coinfección por el VHC y el VIH, el trasplante es más complejo por los siguientes motivos: 1) el tratamiento inmunosupresor postrasplante puede favorecer la replicación del VHC y acelerar la progresión de la hepatopatía crónica96; 2) la infección por el VHC no tratada se asocia a un mayor riesgo de muerte tanto en pacientes en hemodiálisis como en los receptores de trasplante renal; 3) el VHC facilita la aparición de algunos tipos de GN en el receptor de trasplante que pueden condicionar la función y la supervivencia del injerto, y 4) el tratamiento con interferón está contraindicado en el trasplantado renal (por riesgo de rechazo agudo o nefropatía intersticial aguda). A pesar de todo, el trasplante renal mejora la supervivencia global de los pacientes con IRC avanzada infectados por el VHC, y la coinfección no se considera una contraindicación, a menos que exista cirrosis89.
Recomendaciones sobre tratamiento renal sustitutivo con trasplante en pacientes con infección por el VIH:
- •
Todos los pacientes infectados por el VIH con ERC deben ser evaluados como posibles candidatos a trasplante renal de acuerdo con los criterios de inclusión recogidos en el documento de consenso de la Organización Nacional de Trasplantes, el GESIDA, el GESITRA y la Secretaría del PNS resumidos en la tabla 1590 (A-III).
Tabla 15.Criterios de trasplante renal en pacientes con infección por el virus de la inmunodeficiencia humana90
Relacionados con la enfermedad renal que motiva el trasplante Cualquier paciente con insuficiencia renal crónica terminal y una expectativa de vida superior a 5 años
Relacionados con la infección por el VIH Pacientes infectados por el VIH sin criterios de tratamiento antirretroviral (cifra de linfocitos CD4 > 350/μl*)
Pacientes infectados por el VIH con criterios de tratamiento antiretroviral
No haber tenido infección oportunista definitoria de sida, salvo tuberculosis, candidiasis esofágica o neumonía por Pneumocystis jiroveci
Tener una cifra de linfocitos CD4 >200/μl
Tener una carga viral plasmática del VIH indetectable (<50 copias/ml) en el momento del trasplante o tener opciones terapéuticas efectivas y duraderas para el período postrasplante
Criterios generales y relacionados con la conducta de riesgo Abstinencia de drogas (heroína, cocaína) durante al menos 2 años
No consumir alcohol, Cannabis o drogas de diseño durante al menos 6 meses
Evaluación psicológica/psiquiátrica favorable
Comprender la técnica y las obligaciones que el trasplante renal comporta
Tener estabilidad social
En mujeres, no estar embarazada
VIH: virus de la inmunodeficiencia humana.
- •
La complejidad del tratamiento del paciente con VIH que recibe un trasplante renal requiere la colaboración multidisciplinaria de nefrólogos, especialistas en enfermedades infecciosas y expertos en trasplante, además de otros especialistas de apoyo.
- •
Es importante seleccionar la pauta del TAR y ajustar la dosis de los fármacos a la situación de insuficiencia renal avanzada del paciente. Siempre que sea posible se evitará administrar antirretrovirales con toxicidad mitocondrial (p. ej., ddI, d4T). Las necesidades de ajuste de dosis en insuficiencia renal avanzada y en diálisis pueden consultarse en este documento, el documento de TAR del GESIDA/PNS, que se actualiza periódicamente: http://www.gesida.seimc.orgwww.gesida.seimc.org y en otras fuentes acreditadas (http://www.interaccioneshiv.com/).
- •
En los casos de coinfección por el VIH y el VHB, es importante elegir fármacos activos frente a ambos virus (habitualmente una combinación que incluya lamivudina o emtricitabina y tenofovir). Algunos expertos estiman que la presencia de replicación activa del VHB a pesar del tratamiento antiviral constituye un criterio de exclusión para el trasplante.
- •
En los pacientes con coinfección por el VHC y el VIH es imprescindible disponer de una valoración del grado de fibrosis. Debido a la complejidad del trasplante en los pacientes coinfectados por el VHC, siempre que sea posible debe planificarse el tratamiento del VHC antes del trasplante.
- •
Para prevenir infecciones se recomienda vacunación pretrasplante frente a Haemophilus influenzae b, hepatitis B (en los pacientes sin inmunidad), Streptococcus pneumoniae (en no vacunados o vacunados hace más de 3 años), gripe (anual, a principios de otoño), varicela (en pacientes seronegativos, y demorar un mes el trasplante) y hepatitis A. En el período pretrasplante debe investigarse también la presencia de infecciones latentes (incluida la tuberculosis) (A-II). Los detalles pueden consultarse en la web de GESITRA (http://www.gesida.seimc.orgwww.gesida.seimc.org).
- •
El TAR se reiniciará tan pronto como sea posible una vez llevado a cabo el trasplante. Debe prestarse una especial atención a las interacciones farmacocinéticas entre los fármacos antirretrovirales (sobre todo los IP y los ITINN) y los inmunosupresores. Es importante conocer estas potenciales interacciones y monitorizar estrechamente las concentraciones plasmáticas de los inmunosupresores, especialmente en el primer mes (A-III). Siempre que sea posible, se deben elegir pautas con menos interacciones con los inmunosupresores y evitar el uso de fármacos potencialmente nefrotóxicos. Las pautas basadas en inhibidores de la integrasa, como el raltegravir, que no es inductor, inhibidor ni sustrato del CYP, son prometedoras, pero la experiencia es todavía muy limitada. Debe monitorizarse la función renal en aquellos pacientes tratados con tenofovir, que debería cambiarse por otro análogo de nucleósidos u otros fármacos en caso de detectarse una disminución del FG.
- •
Una vez conseguidas las concentraciones plasmáticas adecuadas de inmunosupresores, no se debe modificar el TAR sin consulta ni conocimiento de los especialistas en trasplante y VIH (B-III).
- •
Tras el trasplante, los pacientes deben recibir una gran cantidad de medicamentos (inmunosupresores, antirretrovirales, profilaxis de infecciones oportunistas), lo que puede comprometer la adherencia. Es importante reforzar y evaluar periódicamente el cumplimiento del tratamiento (B-III).
Los episodios de rechazo agudo deben tratarse con bolos de metilprednisolona. La información disponible sugiere que el tratamiento de 2 o más episodios de rechazo se asocia a una mayor tasa de complicaciones, momento en que debe considerarse el abandono (nefrectomía) del injerto. Dada la complejidad del tratamiento del trasplante en el paciente infectado por el VIH, es recomendable que el diagnóstico de rechazo agudo se confirme histológicamente. Debido al riesgo de enfermedad por citomegalovirus y de neoplasias postrasplante, se desaconseja la utilización de OKT3 en el rechazo agudo.
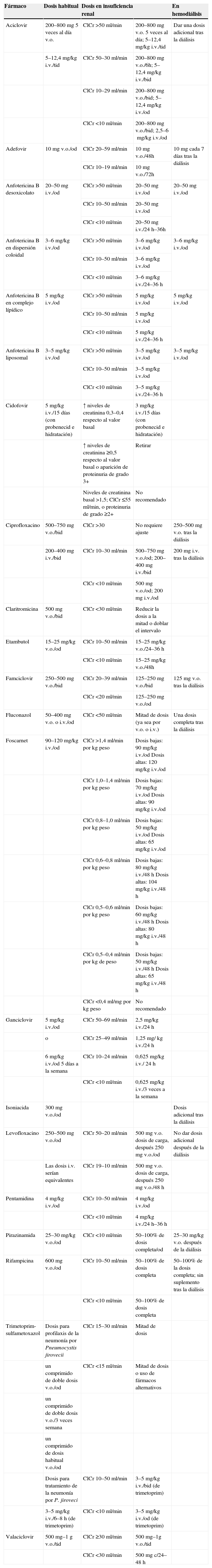
Uso de fármacos en pacientes con infección por el virus de la inmunodeficiencia humana que presentan insuficiencia renal o reciben tratamiento renal sustitutivo con diálisisEn general debe extremarse al máximo la indicación de cualquier fármaco en pacientes con IRC, intentando evitar los que sean nefrotóxicos y, en todo caso, conocer el perfil farmacocinético (biodisponibilidad, vía de eliminación, metabolismo, unión a proteínas), analizar las características y la situación del paciente al que se le va a administrar (edad, sexo, peso, talla, función hepática, función renal, nivel de albúmina, estado de hidratación, equilibrio acidobásico y otros fármacos administrados) y determinar si se requiere ajuste en su dosificación. Los ajustes se pueden realizar reduciendo la dosis, alargando el intervalo de administración o de ambas maneras.
En los pacientes en diálisis se debe conocer el grado de eliminación del fármaco durante la diálisis y dar una dosis suplementaria tras cada sesión si se elimina por esta vía. Es importante hacer hincapié en todos estos aspectos, ya que se ha señalado que con frecuencia los clínicos que atienden a pacientes con infección por el VIH no realizan el ajuste de dosis necesario en las personas con algún grado de IRC100.
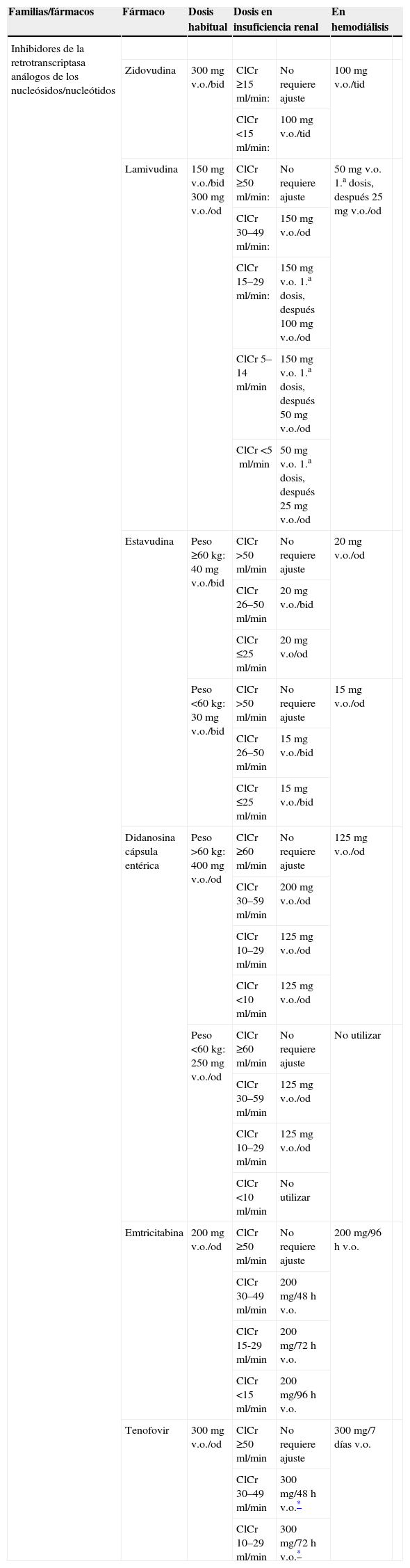
Fármacos antirretroviralesInhibidores de la transcriptasa inversa análogos de nucleósidos/nucleótidosLos inhibidores de la transcriptasa inversa análogos de nucleósidos/nucleótidos (ITIAN) se excretan principalmente por vía renal, en muchos casos no sólo por FG sino también por secreción tubular. El ajuste de dosis es especialmente importante en el caso de fármacos cuya sobredosificación conllevaría un aumento en el riesgo de toxicidad renal, como ocurre con el tenofovir, o en los que con más frecuencia producen toxicidad mitocondrial, como la estavudina101,102 y la didanosina103–105. La presencia de insuficiencia renal se ha asociado con un mayor riesgo de desarrollar acidosis láctica106. Otra de las características comunes a los ITIAN es su baja unión a proteínas y su bajo peso molecular, por lo que son fácilmente eliminados por la diálisis. Debido a ello se recomienda administrar la dosis tras la diálisis; en general, no es necesario administrar dosis extras durante la sesión de diálisis107. El único fármaco de la clase que se diferencia del resto es el abacavir; su metabolismo es principalmente por vía hepática y no requiere ningún ajuste en la insuficiencia renal, si bien sí se recomienda su administración tras la diálisis para reducir la posible eliminación de fármaco durante el procedimiento108. Los ajustes de dosis necesarios para el resto de los ITIAN se resumen en la tabla 16A,B. En pacientes con IRC estable se deben seguir las recomendaciones de dosificación de tenofovir establecidas en la ficha técnica109–111. Debe tenerse en cuenta que la información disponible sobre la seguridad y la eficacia del tenofovir en pacientes con función renal alterada es muy limitada112. Sólo debe emplearse en pacientes con insuficiencia renal si se considera que los beneficios superan a los posibles riesgos. En general no se recomienda su uso en pacientes con ClCr inferior a 50ml/min, excepto cuando no existan otras alternativas. En todo caso, en aquellos pacientes en los que el deterioro de la función renal esté directamente relacionado con el tenofovir o se trate de un trastorno agudo, no se recomienda usar este fármaco.
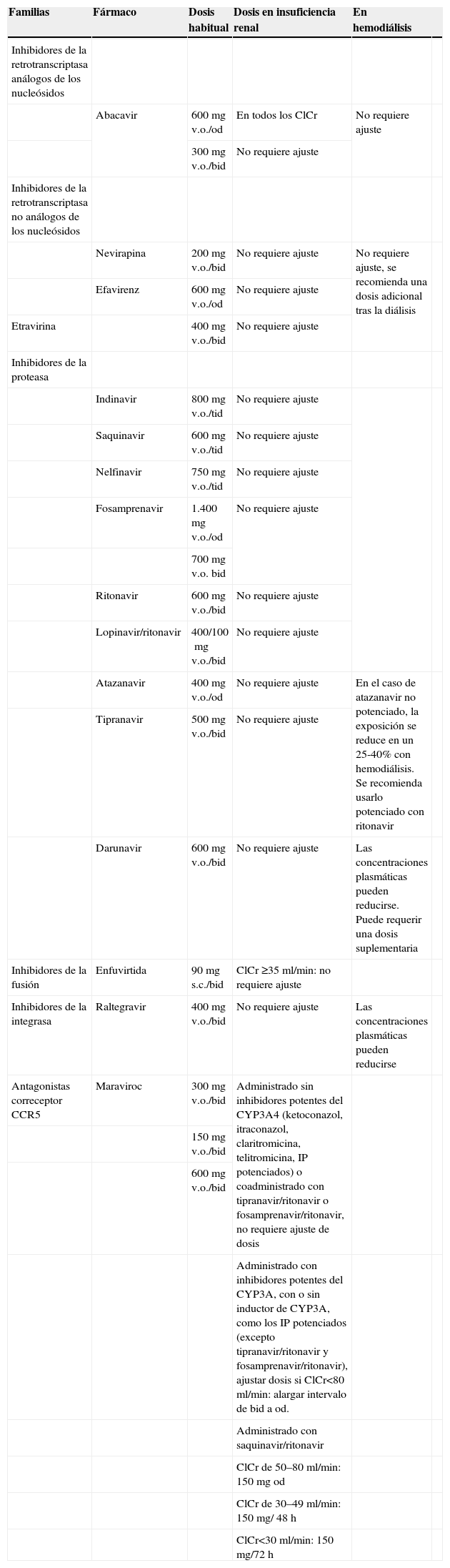
Fármacos antirretrovirales. Ajustes de dosis en pacientes con insuficiencia renal.
| Familias | Fármaco | Dosis habitual | Dosis en insuficiencia renal | En hemodiálisis | |
| Inhibidores de la retrotranscriptasa análogos de los nucleósidos | |||||
| Abacavir | 600mg v.o./od | En todos los ClCr | No requiere ajuste | ||
| 300mg v.o./bid | No requiere ajuste | ||||
| Inhibidores de la retrotranscriptasa no análogos de los nucleósidos | |||||
| Nevirapina | 200mg v.o./bid | No requiere ajuste | No requiere ajuste, se recomienda una dosis adicional tras la diálisis | ||
| Efavirenz | 600mg v.o./od | No requiere ajuste | |||
| Etravirina | 400mg v.o./bid | No requiere ajuste | |||
| Inhibidores de la proteasa | |||||
| Indinavir | 800mg v.o./tid | No requiere ajuste | |||
| Saquinavir | 600mg v.o./tid | No requiere ajuste | |||
| Nelfinavir | 750mg v.o./tid | No requiere ajuste | |||
| Fosamprenavir | 1.400mg v.o./od | No requiere ajuste | |||
| 700mg v.o. bid | |||||
| Ritonavir | 600mg v.o./bid | No requiere ajuste | |||
| Lopinavir/ritonavir | 400/100mg v.o./bid | No requiere ajuste | |||
| Atazanavir | 400mg v.o./od | No requiere ajuste | En el caso de atazanavir no potenciado, la exposición se reduce en un 25-40% con hemodiálisis. Se recomienda usarlo potenciado con ritonavir | ||
| Tipranavir | 500mg v.o./bid | No requiere ajuste | |||
| Darunavir | 600mg v.o./bid | No requiere ajuste | Las concentraciones plasmáticas pueden reducirse. Puede requerir una dosis suplementaria | ||
| Inhibidores de la fusión | Enfuvirtida | 90mg s.c./bid | ClCr ≥35ml/min: no requiere ajuste | ||
| Inhibidores de la integrasa | Raltegravir | 400mg v.o./bid | No requiere ajuste | Las concentraciones plasmáticas pueden reducirse | |
| Antagonistas correceptor CCR5 | Maraviroc | 300mg v.o./bid | Administrado sin inhibidores potentes del CYP3A4 (ketoconazol, itraconazol, claritromicina, telitromicina, IP potenciados) o coadministrado con tipranavir/ritonavir o fosamprenavir/ritonavir, no requiere ajuste de dosis | ||
| 150mg v.o./bid | |||||
| 600mg v.o./bid | |||||
| Administrado con inhibidores potentes del CYP3A, con o sin inductor de CYP3A, como los IP potenciados (excepto tipranavir/ritonavir y fosamprenavir/ritonavir), ajustar dosis si ClCr<80ml/min: alargar intervalo de bid a od. | |||||
| Administrado con saquinavir/ritonavir | |||||
| ClCr de 50–80ml/min: 150mg od | |||||
| ClCr de 30–49ml/min: 150mg/ 48h | |||||
| ClCr<30ml/min: 150mg/72h |
bid: cada 12h; ClCr: aclaramiento de creatinina; od: cada 24h; s.c.: subcutánea; tid: cada 8h; v.o: vía oral.
Fármacos antirretrovirales. Ajustes de dosis en pacientes con insuficiencia renal.
| Familias/fármacos | Fármaco | Dosis habitual | Dosis en insuficiencia renal | En hemodiálisis | ||
| Inhibidores de la retrotranscriptasa análogos de los nucleósidos/nucleótidos | ||||||
| Zidovudina | 300mg v.o./bid | ClCr ≥15ml/min: | No requiere ajuste | 100mg v.o./tid | ||
| ClCr <15ml/min: | 100mg v.o./tid | |||||
| Lamivudina | 150mg v.o./bid 300mg v.o./od | ClCr ≥50ml/min: | No requiere ajuste | 50mg v.o. 1.a dosis, después 25mg v.o./od | ||
| ClCr 30–49ml/min: | 150mg v.o./od | |||||
| ClCr 15–29ml/min: | 150mg v.o. 1.a dosis, después 100mg v.o./od | |||||
| ClCr 5–14ml/min | 150mg v.o. 1.a dosis, después 50mg v.o./od | |||||
| ClCr <5ml/min | 50mg v.o. 1.a dosis, después 25mg v.o./od | |||||
| Estavudina | Peso ≥60kg: 40mg v.o./bid | ClCr >50ml/min | No requiere ajuste | 20mg v.o./od | ||
| ClCr 26–50ml/min | 20mg v.o./bid | |||||
| ClCr ≤25ml/min | 20mg v.o/od | |||||
| Peso <60kg: 30mg v.o./bid | ClCr >50ml/min | No requiere ajuste | 15mg v.o./od | |||
| ClCr 26–50ml/min | 15mg v.o./bid | |||||
| ClCr ≤25ml/min | 15mg v.o./bid | |||||
| Didanosina cápsula entérica | Peso >60kg: 400mg v.o./od | ClCr ≥60ml/min | No requiere ajuste | 125mg v.o./od | ||
| ClCr 30–59ml/min | 200mg v.o./od | |||||
| ClCr 10–29ml/min | 125mg v.o./od | |||||
| ClCr <10ml/min | 125mg v.o./od | |||||
| Peso <60kg: 250mg v.o./od | ClCr ≥60ml/min | No requiere ajuste | No utilizar | |||
| ClCr 30–59ml/min | 125mg v.o./od | |||||
| ClCr 10–29ml/min | 125mg v.o./od | |||||
| ClCr <10ml/min | No utilizar | |||||
| Emtricitabina | 200mg v.o./od | ClCr ≥50ml/min | No requiere ajuste | 200mg/96h v.o. | ||
| ClCr 30–49ml/min | 200mg/48h v.o. | |||||
| ClCr 15-29ml/min | 200mg/72h v.o. | |||||
| ClCr <15ml/min | 200mg/96h v.o. | |||||
| Tenofovir | 300mg v.o./od | ClCr ≥50ml/min | No requiere ajuste | 300mg/7 días v.o. | ||
| ClCr 30–49ml/min | 300mg/48h v.o.* | |||||
| ClCr 10–29 ml/min | 300mg/72h v.o.* | |||||
bid: cada 12h; ClCr: aclaramiento de creatinina; od: cada 24h; tid: cada 8h; v.o: vía oral.
En general, se desaconseja el uso de ITIAN coformulados a dosis fijas (Kivexa®, Truvada®, Trizivir® y Combivir®) en pacientes con ClCr inferior a 50ml/min. En estos casos deben emplearse los fármacos por separado, y realizar los ajustes correspondientes de la dosis de cada fármaco.
Inhibidores de la transcriptasa inversa no análogos de nucleósidosLos ITINN se metabolizan por vía hepática y la excreción por vía renal del principio activo es mínima, por lo que no requieren ajuste de dosis en pacientes con insufuciencia renal. Su eliminación durante la diálisis es también muy escasa dada su alta unión a proteínas113–120.
Inhibidores de la proteasaLos IP se metabolizan fundamentalmente en el hígado. La excreción urinaria supone alrededor de un 10% del principio activo para el indinavir y de un 7,5% o menos para otros fármacos de esta familia. La mayoría de los IP se unen en gran medida a las proteínas plasmáticas, lo que impide que se aclaren durante la diálisis115–117,121–123. Ninguno de los IP actualmente disponibles precisa ajuste de dosis en pacientes con IRC124,125.
Inhibidores de la fusiónLa enfuvirtida, el único inhibidor de la fusión disponible actualmente, se une fuertemente a proteínas126. Su aclaramiento no se altera en pacientes con IRC ni durante la diálisis, por lo que no es necesario realizar ajuste de dosis127,128.
Inhibidores de la integrasaEl metabolismo de los inhibidores de la integrasa es fundamentalmente hepático, con limitada eliminación renal. Datos en voluntarios sanos indican que un 32% del raltegravir se elimina por vía renal, un 9% como fármaco activo y un 23% como metabolito glucuronizado129. En un estudio reciente no se encontraron diferencias significativas en los parámetros farmacocinéticos de raltegravir entre pacientes con IRC (n=10) y sujetos sanos (n=10)130. No se recomienda, por tanto, realizar ningún ajuste de dosis. Todavía no se conoce su aclaramiento durante la diálisis, por lo que puede ser conveniente administrar la dosis después de la diálisis (tabla 16A,B)129. No se han publicado todavía datos farmacocinéticos del elvitegravir en pacientes con IRC o en diálisis, aunque por su metabolismo fundamentalmente hepático131 y la escasa eliminación renal de fármaco activo no se espera que sea necesario realizar ajustes importantes en la dosis.
Inhibidores del correceptor CCR5En la actualidad existen 2 fármacos, el maraviroc (ya comercializado) y el vicriviroc (en fases avanzadas de desarrollo). El maraviroc sufre fundamemente metabolismo hepático a través del CYP3A4. La excreción se realiza fundamentalmente por vía intestinal (76%) y sólo un 25% en orina. El 33% del fármaco excretado es el principio activo sin metabolizar. Aunque no existen datos farmacocinéticos en pacientes con IRC, se han realizado estudios de simulación y en la actualidad sólo se recomienda un ajuste de dosis en pacientes con insuficiencia renal que estén recibiendo inhibidores potentes del CYP3A4, como los IP (excepto tipranavir/ritonavir), ketoconazol, itraconazol, claritromicina y telitromicina. En presencia de estos inhibidores metabólicos, el aclaramiento renal puede llegar a representar hasta el 70% del aclaramiento total de maraviroc y, por tanto, en este caso se puede poducir un incremento significativo de la exposición al fármaco132 (tabla 16A,B).
Fármacos no antirretroviralesFármacos para el tratamiento o la profilaxis de infecciones y tumores asociados a la infección por el virus de la inmunodeficiencia humanaMuchos de estos fármacos precisan ajustes de dosis (p. ej., aciclovir o ganciclovir) o son nefrotóxicos (p. ej., foscarnet, anfotericina, sulfamidas), por lo que se deben emplear con gran precaución en pacientes con insuficiencia renal, ajustar cuidadosamente su dosis y vigilar estrechamente la evolución de la función renal durante su uso. En la tabla 17 se presentan los ajustes de dosis necesarios en función del ClCr de los antivirales, antibacterianos y antifúngicos de mayor uso en estos pacientes. Las necesidades de ajuste de dosis de los fármacos antineoplásicos deben consultarse en fuentes acreditadas133.
Fármacos antimicrobianos. Ajuste de dosis en insuficiencia renal
| Fármaco | Dosis habitual | Dosis en insuficiencia renal | En hemodiálisis | |
| Aciclovir | 200–800mg 5 veces al día v.o. | ClCr >50ml/min | 200–800mg v.o. 5 veces al día; 5–12,4mg/kg i.v./tid | Dar una dosis adicional tras la diálisis |
| 5–12,4mg/kg i.v./tid | ClCr 50–30ml/min | 200–800mg v.o./6h; 5–12,4mg/kg i.v./bid | ||
| ClCr 10–29ml/min | 200–800mg v.o./bid; 5–12,4mg/kg i.v./od | |||
| ClCr <10ml/min | 200–800mg v.o./bid; 2,5–6mg/kg i.v./od | |||
| Adefovir | 10mg v.o./od | ClCr 20–59ml/min | 10mg v.o./48h | 10mg cada 7 días tras la diálisis |
| ClCr 10–19ml/min | 10mg v.o./72h | |||
| Anfotericina B desoxicolato | 20–50mg i.v./od | ClCr >50ml/min | 20–50mg i.v./od | 20–50mg i.v./od |
| ClCr 10–50ml/min | 20–50mg i.v./od | |||
| ClCr <10ml/min | 20–50mg i.v./24h–36h | |||
| Anfotericina B en dispersión coloidal | 3–6mg/kg i.v./od | ClCr >50ml/min | 3–6mg/kg i.v./od | 3–6mg/kg i.v./od |
| ClCr 10–50ml/min | 3–6mg/kg i.v./od | |||
| ClCr <10ml/min | 3–6mg/kg i.v./24–36h | |||
| Anfotericina B en complejo lípídico | 5mg/kg i.v./od | ClCr >50ml/min | 5mg/kg i.v./od | 5mg/kg i.v./od |
| ClCr 10–50ml/min | 5mg/kg i.v./od | |||
| ClCr <10ml/min | 5mg/kg i.v./24–36h | |||
| Anfotericina B liposomal | 3–5mg/kg i.v./od | ClCr >50ml/min | 3–5mg/kg i.v./od | 3–5mg/kg i.v./od |
| ClCr 10–50ml/min | 3–5mg/kg i.v./od | |||
| ClCr <10ml/min | 3–5mg/kg i.v./24–36h | |||
| Cidofovir | 5mg/kg i.v./15 días (con probenecid e hidratación) | ↑ niveles de creatinina 0,3–0,4 respecto al valor basal | 3mg/kg i.v./15 días (con probenecid e hidratación) | |
| ↑ niveles de creatinina ≥0,5 respecto al valor basal o aparición de proteinuria de grado 3+ | Retirar | |||
| Niveles de creatinina basal >1,5; ClCr ≤55 ml/min, o proteinuria de grado ≥2+ | No recomendado | |||
| Ciprofloxacino | 500–750mg v.o./bid | ClCr >30 | No requiere ajuste | 250–500mg v.o. tras la diálisis |
| 200–400mg i.v./bid | ClCr 10–30ml/min | 500–750mg v.o./od; 200–400mg i.v./bid | 200mg i.v. tras la diálisis | |
| ClCr <10ml/min | 500mg v.o./od; 200mg i.v./od | |||
| Claritromicina | 500mg v.o./bid | ClCr <30ml/min | Reducir la dosis a la mitad o doblar el intervalo | |
| Etambutol | 15–25mg/kg v.o./od | ClCr 10–50ml/min | 15–25mg/kg v.o./24–36h | |
| ClCr <10ml/min | 15–25mg/kg v.o./48h | |||
| Famciclovir | 250–500mg v.o./bid | ClCr 20–39ml/min | 125–250mg v.o./bid | 125mg v.o. tras la diálisis |
| ClCr <20ml/min | 125–250mg v.o./od | |||
| Fluconazol | 50–400mg v.o. o i.v./od | ClCr <50ml/min | Mitad de dosis (ya sea por v.o. o i.v.) | Una dosis completa tras la diálisis |
| Foscarnet | 90–120mg/kg i.v./od | ClCr >1,4ml/min por kg peso | Dosis bajas: 90mg/kg i.v./od Dosis altas: 120mg/kg i.v./od | |
| ClCr 1,0–1,4ml/min por kg peso | Dosis bajas: 70mg/kg i.v./od Dosis altas: 90mg/kg i.v./od | |||
| ClCr 0,8–1,0ml/min por kg peso | Dosis bajas: 50mg/kg i.v./od Dosis altas: 65mg/kg i.v./od | |||
| ClCr 0,6–0,8ml/min por kg peso | Dosis bajas: 80mg/kg i.v./48h Dosis altas: 104mg/kg i.v./48h | |||
| ClCr 0,5–0,6 ml/min por kg peso | Dosis bajas: 60mg/kg i.v./48h Dosis altas: 80mg/kg i.v./48h | |||
| ClCr 0,5–0,4ml/min por kg de peso | Dosis bajas: 50mg/kg i.v./48h Dosis altas: 65mg/kg i.v./48h | |||
| ClCr <0,4ml/mg por kg peso | No recomendado | |||
| Ganciclovir | 5mg/kg i.v./od | ClCr 50–69ml/min | 2,5mg/kg i.v./24h | |
| o | ClCr 25–49ml/min | 1,25mg/ kg i.v./24h | ||
| 6mg/kg i.v./od 5 días a la semana | ClCr 10–24ml/min | 0,625mg/kg i.v./ 24h | ||
| ClCr <10ml/min | 0,625mg/kg i.v./3 veces a la semana | |||
| Isoniacida | 300mg v.o./od | Dosis adicional tras la diálisis | ||
| Levofloxacino | 250–500mg v.o./od | ClCr 50–20ml/min | 500 mg v.o. dosis de carga, después 250mg v.o./od | No dar dosis adicional después de la diálisis |
| Las dosis i.v. serían equivalentes | ClCr 19–10ml/min | 500 mg v.o. dosis de carga, después 250mg v.o./48h | ||
| Pentamidina | 4mg/kg i.v./od | ClCr 10–50ml/min | 4mg/kg i.v./od | |
| ClCr <10ml/min | 4mg/kg i.v./24h–36h | |||
| Pirazinamida | 25–30mg/kg v.o./od | ClCr <10ml/min | 50–100% de dosis completa/od | 25–30mg/kg v.o. después de la diálisis |
| Rifampicina | 600mg v.o./od | ClCr 10–50ml/min | 50–100% de dosis completa | 50–100% de la dosis completa; sin suplemento tras la diálisis |
| ClCr <10 ml/min | 50–100% de dosis completa | |||
| Trimetoprim-sulfametoxazol | Dosis para profilaxis de la neumonía por Pneumocystis jirovecii | ClCr 15–30ml/min | Mitad de dosis | |
| un comprimido de doble dosis v.o./od | ClCr <15ml/min | Mitad de dosis o uso de fármacos alternativos | ||
| un comprimido de doble dosis v.o./3 veces semana | ||||
| un comprimido de dosis habitual v.o./od | ||||
| Dosis para tratamiento de la neumonía por P. jiroveci | ClCr 10–50ml/min | 3–5mg/kg i.v./bid (de trimetoprim) | ||
| 3–5mg/kg i.v./6–8h (de trimetoprim) | ClCr <10ml/min | 3–5mg/kg i.v./od (de trimetoprim) | ||
| Valaciclovir | 500mg–1g v.o./tid | ClCr ≥30ml/min | 500mg–1g v.o./tid | |
| ClCr <30ml/min | 500mg c/24–48h |
bid: cada 12h; ClCr: aclaramiento de creatinina; i.v.: intravenosa; od: cada 24h; tid: cada 8h; v.o: vía oral.
El aclaramiento renal de la molécula de peginterferón α-2a es escaso y la farmacocinética se modifica únicamente en pacientes con CICr inferior a 20ml/min, con IRC o en diálisis, donde se produce una reducción del aclaramiento de un 25–45% y se recomienda disminuir la dosis134. En el caso del peginterferón α-2b, su exposición aumenta en pacientes con insuficiencia renal y las dosis se deberían reducir un 50% en casos de IRC avanzada (ClCr <30ml/min) y un 25% en casos de IRC moderada (ClCr <60ml/min)135. La ribavirina se excreta fundamentalmente por vía renal y, en los pacientes con insuficiencia renal, se han descrito episodios de hemólisis grave. En la ficha técnica se especifica que no debe administrarse a los pacientes con creatinina sérica por encima de 2,0mg/dl o ClCr inferior a 50ml/min136, aunque algunos expertos consideran que podría emplearse bajo estrecha vigilancia137.
Fármacos para el tratamiento de las alteraciones metabólicasTratamiento hipolipidemiante
La K/DOQI publicó en 2003 un documento de consenso para el tratamiento de la dislipidemia en pacientes con insuficiencia renal138, recientemente revisado139.
Es importante conocer los ajustes de dosis y las interacciones más relevantes de los fármacos140,141. Los fibratos se deben emplear con precaución en pacientes con insuficiencia renal y, cuando se usen, se recomienda ajustar la dosis a la función renal, reducir el ejercicio físico y evitar la combinación con estatinas para reducir el riesgo de miositis y rabdomiólisis140. Las estatinas se eliminan fundamentalmente por metabolismo hepático. Todas, excepto la pravastatina, se metabolizan por el complejo enzimático del CYP, especialmente la isoenzima CYP3A4, lo que da lugar a una serie de interacciones con otras medicaciones que se usan habitualmente en estos pacientes (ciclosporina A, tacrolimus, antifúngicos azólicos, macrólidos, fibratos, derivados del ácido nicotínico, IP y warfarina).
Los escasos estudios realizados no indican que exista la necesidad de realizar ajustes de dosis de las estatinas en pacientes con IRC142, pero las compañías farmacéuticas que las comercializan recomiendan iniciar el tratamiento con dosis bajas en esta situación y aumentar las dosis con precaución. Se recomienda monitorizar los niveles de CPK y de las enzimas hepáticas para controlar la toxicidad. Estas recomendaciones son especialmente importantes si el paciente toma ciclosporina o tacrolimus.
Insulina e hipoglucemiantes oralesExiste cierta controversia sobre el tipo de insulina que debe utilizarse en caso de IRC; algunos expertos recomiendan no utilizar preparados de larga duración mientras que otros lo aconsejan143,144 Debe tenerse en cuenta que el aclaramiento de insulina puede reducirse y puede haber un aumento de las necesidades, lo que obliga a ser cuidadosos con las dosis y a realizar controles muy frecuentes de la glucemia.
La metformina se elimina sin metabolizar prácticamente en su totalidad por vía urinaria, por lo que se debe usar con suma precaución en pacientes con IRC, comenzar con dosis bajas y vigilar estrechamente la respuesta del paciente y la tolerancia ante los incrementos. De especial relevancia es el mayor riesgo de acidosis láctica en estos pacientes, sobre todo si concurren otros factores de riesgo. No se recomienda su utilización en varones con creatinina superior a 1,5mg/dl ni en mujeres con creatinina superior a 1,4mg/dl145.
El aclaramiento de las sulfonilureas y sus metabolitos se realiza fundamentalmente por vía renal, y se han descrito episodios graves de hipoglucemia en pacientes con IRC terminal en hemodiálisis146, por lo que en pacientes con estadios 3–5 de IRC (ClCr <60ml/min) deben evitarse. Algunas sulfonilureas de segunda generación, como la gliquidona o la glipizida, se pueden usar con seguridad en pacientes con IRC, ya que sus metabolitos son inactivos y existe poco riesgo de desarrollo de hipoglucemia147.
Las tiazolidinedionas se metabolizan por vía hepática y se ha demostrado que son efectivas en pacientes con IRC, incluidos los tratados con hemodiálisis148–151 y los que reciben trasplante renal151, y no se asocian a un mayor riesgo de hipoglucemia.
Fármacos para el tratamiento de la hipertensión arterialLos fármacos de elección en los pacientes con IRC son los bloqueantes del sistema renina-angiotensina, aunque en muchos pacientes puede ser necesario utilizar también diuréticos, betabloqueantes y antagonistas del calcio. Deben recordarse las potenciales interacciones de los antagonistas del calcio con los IP con riesgo de hipotensión y alteraciones de la conducción152. Los diuréticos tiazídicos deben evitarse si la creatinina sérica es superior a 2,5mg/dl o si el ClCr es inferior a 30ml/min. Los diuréticos de asa se utilizan a menudo en pacientes con IRC e HTA no complicada. Se deben evitar los diuréticos ahorradores de potasio en pacientes con IRC grave por el riesgo de hiperpotasemia. Los betabloqueantes hidrofílicos, los antagonistas del calcio y los alfabloqueantes no precisan ajuste de dosis.
Recomendaciones generales sobre el uso de fármacos en pacientes con infección por el VIH que presentan insuficiencia renal o reciben tratamiento renal sustitutivo con diálisis:
- •
En los pacientes con cualquier grado de insuficiencia renal se recomienda vigilar estrechamente la función renal y evitar los fármacos nefrotóxicos (A-III).
- •
En los pacientes con IRC avanzada se debe realizar el ajuste de dosis recomendado por las fichas técnicas de cada medicamento teniendo en cuenta las posibles interacciones entre los diferentes fármacos, más frecuentes y peligrosas en esta situación (A-II).
- •
Es necesario ajustar las dosis de los inhibidores de la ITIAN, excepto en el caso del abacavir (A-II).
- •
No se requiere ajuste de dosis para los ITINN, para los IP, para enfuvirtide ni para raltegravir (A-II).
- •
El maraviroc requiere ajuste de dosis si se emplea en combinación con inhibidores potentes del CYP3A4, como los IP (excepto tipranavir/ritonavir), ketoconazol, itraconazol, claritromicina y telitromicina (A-II).
- •
Se desaconseja el uso de coformulaciones de fármacos antirretrovirales en pacientes con insuficiencia renal significativa. En estos casos deben emplearse los fármacos por separado y realizar los ajustes correspondientes de la dosis de cada fármaco (A-III).
Los autores declaran no tener conflicto de intereses.
A los Drs. J.C. Trullas, F. Cofán y J.E. Losa por sus valiosas aportaciones.
Todos los miembros de este Panel son autores del artículo.
Félix Gutiérrez, Hospital General Universitario de Elche, Alicante.
Rosa Polo, Secretaría del Plan Nacional del Sida, Ministerio de Sanidad y Política Social, Madrid.
Auxiliadora Mazuecos, Hospital Puerta del Mar, Cádiz.
Fernando Lozano, Hospital Universitario de Valme, Sevilla.
Manuel Praga, Hospital 12 de Octubre, Madrid.
Guillermina Barril, Hospital de la Princesa, Madrid.
José Antonio Iribarren, Hospital de Donostia.
José Sanz, Hospital Príncipe de Asturias, Alcalá de Henares.
María Jesús Pérez Elías, Hospital Ramón y Cajal, Madrid.
María José Galindo, Hospital Clínico Universitario, Valencia.
Piedad Arazo, Hospital Miguel Servet, Zaragoza.
Xavier Fulladosa, Hospital Universitari de Bellvitge, Barcelona.
Carlos Quereda, Hospital Ramón y Cajal, Madrid.
Celia Miralles, Hospital Xeral de Vigo, Pontevedra.
Esteban Martínez, Hospital Clinic, Barcelona.
Hernando Knobel, Hospital del Mar, Barcelona.
Jesús Sanz, Hospital de la Princesa, Madrid.
Juan Miguel Santamaría, Hospital de Basurto, Bilbao.
José López-Aldeguer, Hospital La Fe, Valencia.
José M. Miró, Hospital Clinic, Barcelona.
Miguel Cervero, Hospital de Leganés, Madrid.
Pere Domingo, Hospital San Pau, Barcelona.
Rosario Palacios, Hospital Virgen de la Victoria, Málaga.