Coinfección VHB/VIH
Las infecciones por el virus de la inmunodeficiencia humana (VIH) y por el virus de la hepatitis B (VHB) siguen siendo uno de los principales problemas de salud pública a escala mundial. Los datos actuales cifran en alrededor de 40 millones las personas infectadas por el VIH, y en cerca de 400 millones los portadores crónicos del VHB. Se estima que un 6-10% de los sujetos con infección por VIH tienen infección crónica por el VHB. La relevancia de la coinfección VIH-VHB, desde el punto de vista clínico, reside principalmente en 3 aspectos: a) la mayor gravedad del daño hepático por el VHB en pacientes infectados por el VIH (VIH+); b) el incremento del riesgo de hepatotoxicidad debido al empleo de fármacos antirretrovirales, y c) la posibilidad de utilizar antivirales activos frente a ambos virus 1,2.
Interacción entre el VHB y el VIH
Los pacientes con infección crónica por el VHB presentan un estado persistente de activación inmunitaria que, junto con un efecto directo de ciertas proteínas virales, podría favorecer la replicación del VIH. Esto podría dar lugar a una disminución más rápida de la cifra de linfocitos CD4+ con una mayor progresión a sida. Los estudios clínicos realizados que examinan el impacto del VHB sobre la progresión del VIH han mostrado resultados contradictorios, si bien la mayoría no ha observado que la coinfección se asocie a un peor curso de la enfermedad por VIH.
En lo que respecta al papel de la coinfección en la evolución de la infección por el VHB, los pacientes coinfectados presentan un mayor riesgo de cronicidad del VHB, menor tasa de seroconversión espontánea del HBsAg y HBeAg, y valores de ADN del VHB (ADN-VHB) más elevados, aunque la inflamación hepática tiende a ser más moderada. Sin embargo, la prevalencia de la hepatitis crónica HBeAg-negativa, así como el estado de portador inactivo, son menores en los pacientes VIH+. Además, en éstos, es frecuente la aparición de patrones serológicos atípicos, por ejemplo anti-HBc aislado, sobre todo en los que presentan una inmunodeficiencia grave 3.
Tratamiento de la hepatitis crónica B
El objetivo del tratamiento en pacientes con infección crónica por el VHB es detener la progresión de la enfermedad hepática (ya que la infección no es erradicable), para prevenir así el desarrollo de cirrosis y carcinoma hepatocelular. Generalmente, se usan 5 parámetros diferentes para valorar el daño hepático y monitorizar la respuesta terapéutica: ADN-VHB sérico, HBeAg, HBsAg, alanina aminotranferasa (ALT) e histología hepática. Con ellos, los objetivos del tratamiento pueden estratificarse en varios escalones que van de menos a más ambiciosos: normalización de las transaminasas, supresión de la viremia B, seroconversión y mejoría histológica 4.
Una reducción de la inflamación hepática, con disminución o normalización de la alanina aminotransferasa (ALT), puede obtenerse con facilidad, y se asocia generalmente a un enlentecimiento en la progresión de la fibrosis hepática. El título de ALT como marcador de daño histológico es, sin embargo, limitado, ya que las fluctuaciones son frecuentes, y los valores normales no excluyen que pueda haber un daño hepático importante. Por otro lado, en los coinfectados por el VIH, las elevaciones de la ALT pueden deberse a otras causas, como la toxicidad de la medicación antirretroviral.
La supresión de la replicación del VHB (disminución o desaparición del ADN-VHB en sangre) se consigue con muchos de los antivirales aprobados frente al VHB, y es el mejor parámetro para monitorizar la eficacia de cualquier tratamiento anti-VHB en el momento actual. Una reducción significativa de la carga viral del VHB en los pacientes tratados se correlaciona con una mejoría histológica, con seroconversión del HBsAg y con una reducción en el riesgo de desarrollar resistencias. El tratamiento se recomienda en los pacientes HBsAg+ con HBeAg+ que tienen carga viral VHB superior a 10 5 copias/ml, valor umbral que es inferior (de 10 4 y 10 3 copias/ml), en los pacientes con HBeAg negativo o con cirrosis descompensada, respectivamente 3,5.
La seroconversión HBeAg o HBsAg es un objetivo difícil de conseguir, debido al reservorio de cccADN en los hepatocitos infectados. El HBsAg generalmente se considera un marcador de replicación. Sin embargo, a finales de los años ochenta se identificaron mutaciones específicas causantes de la existencia de viremia B en pacientes sin HBeAg. La mutación más frecuente que confiere esta propiedad se encuentra situada en la región pre-core, y es la principal causa de hepatitis B crónica en el área mediterránea 6. El pronóstico a largo plazo de esta forma de hepatitis crónica B parece ser peor 3,6.
Otros beneficios del tratamiento de la hepatitis crónica B en los pacientes coinfectados por el VIH incluyen una mejor tolerancia de la medicación antirretroviral y una reducción del riesgo de transmisión a otros 1,3.
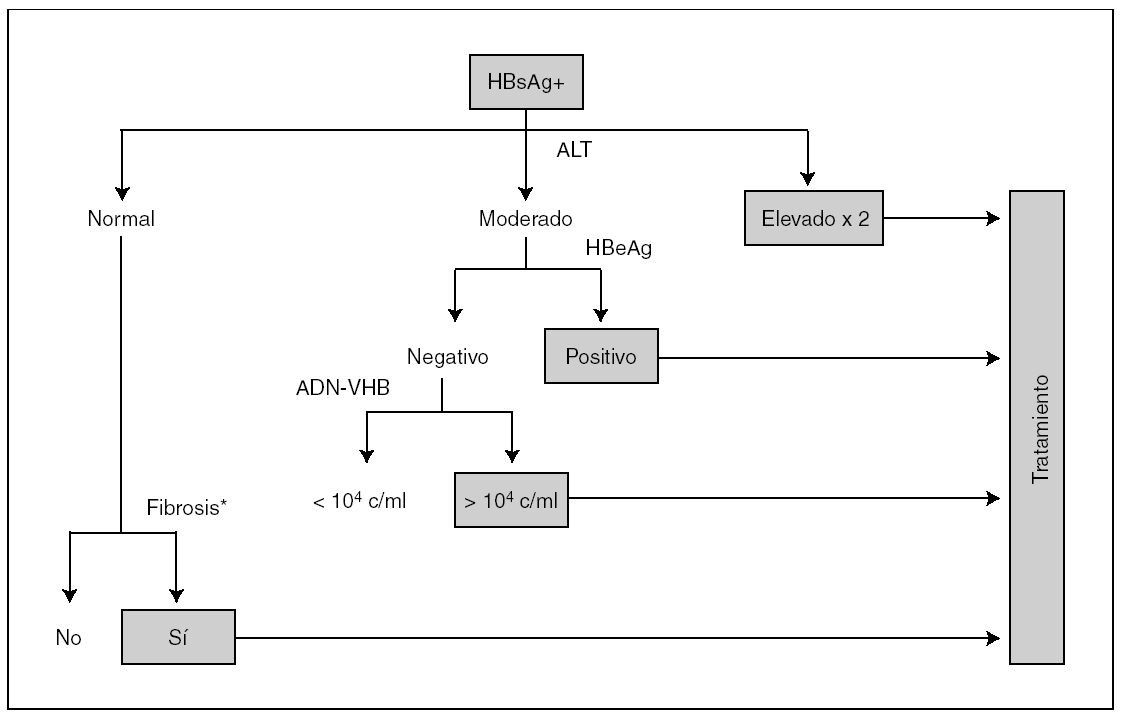
En los pacientes monoinfectados por el VHB, la indicación de tratamiento se basaba, hasta hace pocos años, en los hallazgos histológicos. Actualmente, y sobre todo en los coinfectados por el VIH, el tratamiento se considera atendiendo a otros marcadores, como ya se ha dicho previamente (fig. 1). Sin embargo, la biopsia hepática puede ser de interés en algunos casos, cuando existan dudas sobre la etiología del daño hepático (p. ej., toxicidad farmacológica, alcohol, esteatosis, etc.). Hay que subrayar que, especialmente en pacientes coinfectados VHB/VIH, puede existir cirrosis hepática subclínica a pesar de valores normales de ALT. Las limitaciones de la biopsia se han subrayado en artículos recientes (variabilidad entre muestras, experiencia del patólogo, riesgo de complicaciones y rechazo del paciente). Recientemente, se han desarrollado métodos no invasivos que proporcionan una estimación adecuada del grado de fibrosis hepática; es el caso de diversos marcadores de fibrosis séricos (p. ej., el Fibrotest) o algunas técnicas de imagen, como el FibroScan. Además de permitir una valoración basal, permiten realizar con facilidad un seguimiento longitudinal del daño hepático.
Figura 1. Algoritmo de tratamiento del virus de la hepatitis B (VHB) en pacientes infectados por el virus de la inmunodeficiencia humana (VIH). *Valorado mediante biopsia hepática o pruebas no invasivas, como el FibroScan.
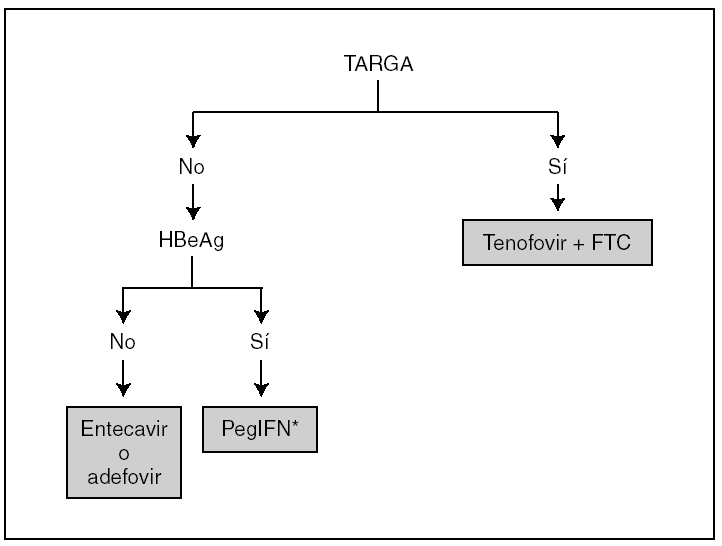
Dado que los nuevos tratamientos anti-VHB proporcionan tasas de respuesta mayores, se aconseja comenzar en fases más precoces de la enfermedad hepática. En pacientes coinfectados no existían, hasta fechas recientes, recomendaciones sobre quiénes debían tratarse 7. La variable que más influye la modalidad de tratamiento de la hepatitis crónica B en los coinfectados es la necesidad de administrar un tratamiento antirretroviral de gran actividad (TARGA) 3. En los pacientes que lo requieren, se aconseja el uso de antivirales con actividad frente a ambos virus, y se recomienda la combinación de un análogo de nucleósido (lamivudina o emtricitabina) y un análogo de nucleótido (tenofovir). Esta combinación proporciona mayor eficacia antiviral y retrasa la selección de mutantes resistentes que la utilización de lamivudina o emtricitabina sin tenofovir. Por el contrario, si no se requiere TARGA, es preferible el uso de fármacos activos frente al VHB pero sin actividad antirretroviral (fig. 2). El interferón (IFN) α es de elección en los pacientes HBeAg+, mientras que el entecavir o el adefovir son buenas opciones en los HBeAg negativos. En sujetos HBeAg negativos con daño hepático mínimo es preferible optar por una actitud expectante. La duración del tratamiento en este último grupo de pacientes no está bien definida, pero podría ser de por vida.
Figura 2. Fármacos de elección para el tratamiento de la hepatitis crónica B en pacientes infectados por el virus de la inmunodeficiencia humana (VIH). *Evitar en cirróticos.
La lamivudina, junto con el adefovir, el entecavir y el IFN-α (y sus formas pegiladas) son los únicos fármacos aprobados para el tratamiento de la hepatitis B. Sin embargo, en el marco de la coinfección por el VIH, se pueden utilizar también FTC y tenofovir. El uso de la terapia de combinación frente al VHB se está investigando. De todas formas, en la práctica clínica es frecuente la combinación de tenofovir y emtricitabina, dada su disponibilidad en forma de un comprimido diario (Truvada®), en pacientes que requieren tratamiento antirretroviral 8,9.
Hepatotoxicidad de los antirretrovirales
Un 5-10% de los pacientes infectados por el VIH que comienzan tratamiento antirretroviral presentan elevaciones significativas de las enzimas hepáticas, al poco de comenzar o tras 4-6 meses de tratamiento. Este porcentaje es superior cuando existe coinfección por el VHB. Algunos de estos fármacos (nevirapina, efavirenz o ritonavir) provocan hepatotoxicidad con mayor frecuencia que el resto. Por todo ello, en los pacientes HBsAg+ que inician TARGA se debe controlar la función hepática. Sin embargo, estas elevaciones pueden ocurrir por otros mecanismos distintos del efecto directo del fármaco. El diagnóstico diferencial se establece principalmente con:
1. Fenómenos de reconstitución inmunitaria: en los pacientes con recuentos bajos de linfocitos CD4+ o carga viral del VIH alta, el tratamiento puede favorecer la respuesta inmunitaria dando lugar a una destrucción masiva de los hepatocitos infectados. En estos casos, no es necesario interrumpir el tratamiento si el paciente permanece asintomático y las transaminasas no se elevan más de 10 veces el límite normal (toxicidad de grado 4), aunque es necesario un seguimiento estrecho de los valores de laboratorio.
2. Reacciones de hipersensibilidad con nevirapina, abacavir o amprenavir. La hepatitis B crónica no parece desempeñar ningún papel en la aparición de este fenómeno.
3. Daño mitocondrial en pacientes que reciben análogos de nucleósidos, especialmente zidovudina, estavudina o didanosina. La esteatosis hepática es más frecuente en mujeres, personas obesas y con combinaciones de estos fármacos, o que están en tratamiento durante períodos prolongados.
Vacunación del VHB: indicaciones y calendario
En los pacientes VIH+ se debe realizar la determinación de marcadores del VHB y, si resultan negativos, proceder a la vacunación. Estos pacientes presentan una respuesta humoral más débil frente a la vacuna del VHB, especialmente si los linfocitos CD4+ se encuentran por debajo de 500 células/μl, y pierden los anticuerpos protectores más rápidamente, con riesgo de infección aguda en el caso de exposición. Debe usarse la dosis convencional (20 μl en los meses 0, 1 y 6-12) en pacientes con una cifra de linfocitos CD4+ > 500 células/μl. Si se encuentran entre 200 y 500 células/μl, se recomienda un calendario intensivo (20 μl en los meses 0, 1, 2 y 12). Tras 3 dosis de vacuna, la tasa de respuesta en pacientes con linfocitos CD4+ > 500 células/μl es del 87 frente al 33% en aquellos con una cifra de entre 200 y 500 células/μl. Los pacientes sin respuesta en el primer ciclo deben recibir dosis de recuerdo o un nuevo ciclo de vacunación con 40 μl en los meses 0, 1, 2 y 6-12, hasta que desarrollen una respuesta satisfactoria (título de anti-HBs > 10 U/l). Los pacientes con cifras de CD4+ < 200 células/μl deben recibir, en primer lugar, TARGA y, cuando la cifra de linfocitos CD4+ haya aumentado por encima de 200 células/μl, vacunarse. Una vez conseguida la inmunización, se debe hacer una determinación de anti-HBs cada año y, en caso de caída del título por debajo de 10 U/l, administrar una dosis de recuerdo.
Diagnóstico y tratamiento de las reactivaciones del VHB
Las elevaciones transitorias de transaminasas en pacientes con infección crónica por el VHB coinfectados por el VIH se producen en 2 situaciones clínicas diferentes. En primer lugar, en pacientes con HBsAg y supresión completa del ADN-VHB que toman terapia antirretroviral con fármacos activos frente al VHB. En estos casos, la interrupción del tratamiento con lamivudina, emcitrabina o tenofovir, el desarrollo de resistencias a estos fármacos o una rápida mejora del estado inmunológico pueden provocar un incremento de transaminasas. Por otro lado, la reactivación del VHB también se ha descrito en los sujetos coinfectados que habían desarrollado anticuerpos anti-HBsAg o que presentaban únicamente anti-HBc. Estos casos de reactivación se han descrito en los que han recibido tratamiento inmunosupresor o que presentan cifras muy bajas de CD4. Estas reactivaciones confirman de forma indirecta que el VHB establece una infección a largo plazo que no se erradica totalmente. Por ello, en los pacientes VIH+ con marcadores de infección VHB pasada, debe considerarse el tratamiento previo para minimizar el riesgo de reactivación en caso de recibir quimioterapia, siendo el uso de análogos de nucleós(t)idos lo más apropiado en este caso.
Coinfección VHC/VIH
En la actualidad, se estima que entre un 1-3% de la población mundial está infectada por el virus de la hepatitis C (VHC). Al igual que el VIH, el VHC se transmite por vía parenteral, mediante el intercambio de jeringuillas o productos sanguíneos contaminados, si bien el VHC es 10 veces más infeccioso que el VIH. Por tanto, en individuos con factores de riesgo, como los usuarios de drogas por vía parenteral (UDVP), es frecuente la coinfección por ambos virus. Así, un 50-70% de los individuos con el VIH en España están coinfectados por el VHC 10,11.
Historia natural de la coinfección VHC/VIH
Desde la introducción del TARGA, la historia natural de la infección por el VIH ha cambiado drásticamente. El descenso de la incidencia de infecciones oportunistas y la consiguiente mayor supervivencia de los pacientes ha dejado paso a la aparición de complicaciones a largo plazo. Esto ha sido particularmente evidente en los pacientes coinfectados por el VHC. Así, en muchos países desarrollados, la enfermedad hepática asociada al VHC es ya la primera causa de muerte en los pacientes VIH+.
Mientras que existen resultados contradictorios sobre si la infección por el VHC puede acelerar la progresión a sida en pacientes VIH+, sí que se ha hallado una influencia clara de la infección por el VIH en el curso natural de la hepatitis C. Éstos presentan las siguientes características con respecto a los monoinfectados por el VHC: a) un incremento de la carga viral del VHC, lo que conlleva una peor respuesta al tratamiento anti-VHC; b) un menor aclaramiento espontáneo del VHC, y c) una más rápida progresión a cirrosis, fallo hepático y carcinoma 12.
Tratamiento antirretroviral y VHC
La coinfección por el VHC es un factor de riesgo claro para el desarrollo de hepatotoxicidad con el uso de los antirretrovirales. Esto parece particularmente evidente para fármacos como la nevirapina o el ritonavir, cuando se utilizan a dosis plenas 13. Hay que reseñar que, aunque la iniciación del TARGA produce un incremento en la carga viral del VHC, éste es transitorio y retorna a la normalidad 6 meses después.
El uso de los análogos de nucleósidos didanosina y estavudina (y particularmente su combinación) se asocia con un mayor riesgo de esteatosis hepática en sujetos coinfectados, por lo que estos fármacos deberían evitarse en la coinfección. En general, las enzimas hepáticas deben monitorizarse estrechamente cuando se inicia TARGA en pacientes coinfectados por VHC, especialmente cuando se utilizan fármacos con perfil hepatotóxico.
Diagnóstico
En todos los sujetos infectados por el VIH debe est udiarse la infección por el VHC. El cribado inicial para la detección de anticuerpos mediante un enzimoinmunoensayo debería acompañarse, en los casos reactivos, de la detección de ARN del virus mediante PCR. Se han comunicado casos con descenso del título de anticuerpos anti-VHC en pacientes coinfectados por el VIH que pueden causar resultados falsos negativos en las pruebas serológicas. Esto sucede particularmente en aquellos pacientes muy inmunodeprimidos (CD4 < 200 células/μl). Por tanto, se recomienda que en las personas VIH+ con anticuerpos anti-VHC negativos, pero con valores elevados de transaminasas, se realice una prueba de reacción en cadena de la polimerasa (PCR) 10,14.
La determinación de genotipos del VHC en los pacientes coinfectados es especialmente relevante. El genotipo constituye el factor predictivo más importante de respuesta al tratamiento. Los pacientes con genotipo 2 y 3 tienen una mejor respuesta que los portadores de genotipos 1 y 4. Por otro lado, la distribución de genotipos refleja la ruta de transmisión. Así, el genotipo 1b explica los 2 tercios de infecciones por VHC postransfusionales y es el predominante en hemofílicos. Por el contrario, los genotipos 1a y 3a son más frecuentes en usuarios de drogas por vía parenteral 12.
Candidatos para tratamiento anti-VHC
La respuesta al tratamiento se correlaciona con la cifra de linfocitos CD4+. Por tanto, en los pacientes naïve para el tratamiento antirretroviral, es aconsejable tratar la hepatitis C cuando los recuentos de linfocitos CD4+ son altos, y no esperar a estados de inmunosupresión más avanzados. En la actualidad, se recomienda que los pacientes con cifras de CD4+ superiores a 350 células/μl y con carga viral para VIH < 50.000 copias/ml, independiente de que reciban TARGA o no, son candidatos ideales a comenzar la terapia frente al VHC. En pacientes con cifras de linfocitos CD4+ entre 200 y 350 células/μl que ya han estado tiempo prolongado con TARGA y muestran una adecuada supresión del VIH, es igualmente conveniente tratar la infección por el VHC. Por el contrario, cuanto la cifra de linfocitos CD4+ es inferior a 200 células/μl, en general debe demorarse el tratamiento del VHC ya que la prioridad es tratar la infección por VIH. Sin embargo, en pacientes con TARGA y con carga viral del VIH indetectable, la decisión del tratamiento anti-VHC será individualizada, teniendo en cuenta factores como la probabilidad de respuesta, el tiempo estimado de tratamiento, la gravedad de la enfermedad hepática y el riesgo de progresión.
Los pacientes con descompensación hepática previa no son buenos candidatos para el tratamiento, por el riesgo de presentar un nuevo episodio debido al interferón o la ribavirina. Idealmente, estos enfermos deberían evaluarse para trasplante hepático. Sin embargo, los pacientes con cirrosis compensada, en estadio A de Child-Pugh, pueden recibir tratamiento si no presentan otra contraindicación. La presencia de trastornos psiquiátricos graves, ingesta elevada de alcohol o consumo de drogas es una contraindicación relativa para el tratamiento. Sin embargo, los pacientes con depresión leve-moderada o que están incluidos en programas sustitutivos de metadona pueden ser candidatos aceptables para el tratamiento bajo estricta supervisión médica 15.
El papel de la biopsia hepática a la hora de tomar decisiones sobre el tratamiento en pacientes coinfectados está en desuso, dado que la mayoría de pacientes coinfectados muestran fibrosis que justifica la administración de tratamiento anti-VHC. Por el contrario, la disponibilidad de técnicas no cruentas que permiten valorar la fibrosis hepática (FIB-4, Fibro-test, FibroScan) ha ganado terreno tanto para la valoración inicial como para el seguimiento de estos pacientes. En los sujetos con genotipos 1 y 4 y que no presentan fibrosis (F0) o es leve (F1) se puede retrasar el tratamiento. Por el contrario, los pacientes infectados con genotipos 2 y 3 pueden ser tratados incluso en ausencia de fibrosis, dada su elevada tasa de respuesta al tratamiento.
Tratamiento
Los sucesivos ensayos clínicos realizados hasta la fecha han demostrado que el tratamiento de elección frente al VHC en los pacientes coinfectados por el VIH es la combinación de interferón pegilado (INF-peg) más ribavirina 16. La respuesta obtenida en estos pacientes es menor que la obtenida en los infectados sólo por el VHC. Así, se han comunicado para los pacientes con coinfección cifras de respuesta viral sostenida de un 40-60% para los genotipos 2 y 3, y menores al 25% para los genotipos 1 y 4. No obstante, los resultados preliminares del estudio PRESCO muestran valores de respuesta final al tratamiento muy similares a los obtenidos en la población seronegativa para el VIH. Estos datos sugieren que una buena selección de candidatos, el uso de dosis altas de ribavirina y el esfuerzo del paciente y su médico por no abandonar el tratamiento pueden ser cruciales a la hora de obtener respuesta 17.
Monitorización de la respuesta al tratamiento
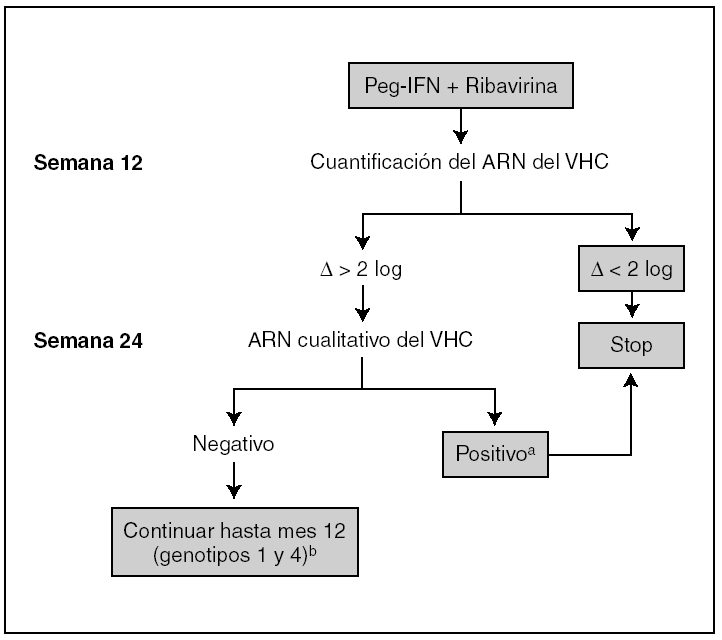
La mayoría de los ensayos clínicos realizados hasta ahora con INF-peg y ribavirina en pacientes coinfectados han puesto de manifiesto que los individuos con respuesta viral sostenida tenían una viremia para el VHC a las 12 semanas al menos 2 log inferior a la basal. Por tanto, se puede predecir de forma temprana la respuesta al tratamiento, pudiendo adoptar la decisión de suspenderlo a las 12 semanas en caso de ausencia de respuesta (fig. 3) 15. Sin embargo, pacientes con valores elevados de ARN-VHC con buena respuesta virológica inicial pueden no alcanzar valores indetectables en la semana 24. Este subgrupo de pacientes, que es escaso entre los monoinfectados por el VHC (< 5%), podría ser mayor en los coinfectados con el VIH, debido a que tienen cargas virales de VHC significativamente más altas.
Figura 3. Algoritmo de tratamiento de la hepatitis C en pacientes infectados por el virus de la inmunodeficiencia humana (VIH). aEn pacientes con carga viral del virus de la hepatitis C (VHC) basal alta, el tratamiento puede prolongarse más allá de las 24 semanas, a pesar del reconocimiento de viremia indetectable en ese momento, si se observa una reducción > 2 log en la semana 12 de tratamiento. bA la vista de la mayor frecuencia de recidivas de la infección por el VHC en pacientes VIH+, en los pacientes que muestran una respuesta virológica adecuada en fases tempranas y que tienen una buena tolerancia al tratamiento anti-VHC, el tratamiento se deberá prolongar a 12 meses en los genotipos 2-3.
Se ha observado que los pacientes coinfectados presentan con más frecuencia recidivas, especialmente en los genotipos 2 y 3, tras 24 semanas de tratamiento a diferencia de lo que sucede en los monoinfectados por VHC. Los estudios actualmente en marcha con terapia extendida (12 semanas para los genotipos 2 y 3, y 18 semanas para los genotipos 1 y 4) establecerán la duración idónea del tratamiento para estos pacientes.
Efectos secundarios del tratamiento anti-VHC e interacciones con antirretrovirales
Los efectos secundarios de los fármacos utilizados para el tratamiento de la infección por el VHC son frecuentes 12,15. Se pueden agrupar en 5 categorías: a) síntomas seudogripales; b) trastornos hematológicos (citopenias); c) trastornos psiquiátricos (depresión, irritabilidad, insomnio); d) síntomas gastrointestinales (náuseas y diarrea), y e) reacción inflamatoria en el lugar de la inyección. El uso concomitante de antirretrovirales puede incrementar algunos de estos efectos. Así, el papel anemizante de la ribavirina se puede potenciar con la administración de zidovudina. En estos casos, a veces hay que modificar el tratamiento antirretroviral o realizar un seguimiento estrecho de los valores de hemoglobina, especialmente durante las primeras 6 semanas. Los análogos de nucleósidos producen daño mitocondrial por inhibición de la polimerasa. La ribavirina puede aumentar las concentraciones intracelulares de los metabolitos de didanosina y, por tanto, potenciar su toxicidad. También se han comunicado casos de descompensación hepática cuando se administran juntos ambos fármacos. Por último, varios estudios sugieren que la ribavirina podría acelerar la pérdida de grasa subcutánea cuando se administra junto con algunos análogos de nucleósidos, en especial con la estavudina.
Correspondencia: Dr. V. Soriano.
Servicio de Enfermedades Infecciosas. Hospital Carlos III.
Sinesio Delgado, 10. 28029 Madrid. España.
Correo electrónico: vsoriano@dragonet.es