Los centros sanitarios de cuidados prolongados (CSCP) pueden definirse como el nivel asistencial que organiza de manera integrada las prestaciones sanitarias y de servicios sociales de acuerdo con las necesidades de los destinatarios. Existe una gran variabilidad dependiendo de las características de los usuarios, del personal asistencial y de la accesibilidad a medios técnicos de diagnóstico, tratamiento o rehabilitación.
En los CSCP la coexistencia de una elevada prevalencia de infecciones y de colonización por microorganismos multirresistentes, junto con altos índices de prescripción de antibióticos, a menudo inadecuada, la elevada transferencia de pacientes con el hospital y la escasez de medios diagnósticos, plantea importantes retos en el control de infecciones relacionadas con la asistencia sanitaria.
Al estudiar la infección en CSCP, uno de los principales problemas es la utilización de criterios estandarizados de infección. Las características especiales de presentación de la infección en el anciano y la escasa disponibilidad de recursos hacen necesario establecer criterios de infección nosocomial estandarizados y validados a nivel mundial que permitan realizar una correcta prevención, vigilancia y control de la infección nosocomial.
La infección nosocomial más frecuente es la de tipo respiratorio, seguida por la urinaria, piel y partes blandas, tracto gastrointestinal y ojos. Los microorganismos problemáticos más frecuentemente identificados en los CSCP son las enterobacterias productoras de betalactamasas de espectro extendido, Pseudomonas aeruginosa multirresistente y Staphylococcus aureus resistente a la meticilina (SARM).
La eficacia en las medidas de control de la infección se basa fundamentalmente en un elevado cumplimiento de las precauciones estándar y la clasificación de pacientes según el riesgo de transmisión de un determinado multirresistente, especialmente del SARM. Esta gradación del riesgo permite racionalizar las medidas a aplicar y la incorporación de aspectos éticos y legales. El nivel de estratificación se establece principalmente en función de la condición de ser colonizado o infectado, de la localización anatómica del germen multirresistente y del grado de las alteraciones de la conducta que puede presentar el paciente.
No están indicados los programas de cribado extensivo o programas de vigilancia complejos propios de los hospitales de agudos. La vigilancia epidemiológica debe adaptarse de forma práctica a las guías clínicas, siendo clave el registro de pacientes colonizados o infectados y la coordinación, mediante la aplicación de programas globales de control, entre los sistemas de salud y sociales.
The long-term care facilities (LTCF) are the health care level that integrates medical assistance and social services according to the requirements of its beneficiaries. There is a great variability depending on the users profile, the professional staff and accessibility to technical resources for diagnosis, treatment or rehabilitation.
In LTCF different factors are shaping a challenge in the infection control. These factors are high prevalence of infection and colonization by multiresistant microorganisms (MROs), a high rate of, often inadequate, antibiotic prescriptions, the high transfer of hospital patients, and the lack of diagnostic resources.
In infection studies in LTCF, one of the main problems is the lack of standard, and well defined, infection criteria. The special features of infections in the elderly population, together with the limited resources, make it necessary to establish standard and worldwide validated criteria in order achieve appropriate monitoring and control of infection.
The most common infection is the respiratory, followed by the urinary, skin and soft tissue, gastro-intestinal tract, and eyes. The problematic microorganisms most frequently identified in LTCF are enterobacteriaceae extended spectrum beta lactamase, Pseudomonas aeruginosa and methicillin-resistant Staphylococcus aureus (MRSA).
A successful infection control mainly depends on two actions. First, a high compliance of standard precautions and second, patient organization according to the risk of transmission of a particular MROs infection, especially MRSA. This risk classification may be a way to rationalize application measures, and the incorporation of ethical and legal issues. The level of stratification is established mainly according to the condition of being colonized or infected, the MROs anatomical location, and the degree of behavioral disorders suffered by the patient.
Implementation of extensive screening programs or complex monitoring programs, as in acute care hospitals are not indicated. The epidemiological surveillance must adapt to clinical guidelines, with the registering of colonized and infected patients being mandatory, along with the coordination between health and social systems by applying global control programs.
La atención hospitalaria tiene actualmente una estrecha relación con los cuidados en atención primaria, con la hospitalización a domicilio, con los centros sociosanitarios de media y larga estancia, e incluso con las residencias geriátricas. Las altas de pacientes en los hospitales de agudos son cada vez más tempranas, y en consecuencia cada vez es más frecuente la presencia de pacientes subagudos en los centros sanitarios de cuidados prolongados (CSCP). En todos estos niveles asistenciales aparece un tipo de infección que se parece más a la nosocomial que a la comunitaria. Como consecuencia de ello se ha cambiado el concepto clásico de infección nosocomial (IN) por el más actual de infección relacionada con la asistencia sanitaria (IRAS), que engloba ambos tipos de infecciones.
Los cambios en los patrones de morbimortalidad en las últimas décadas han dado lugar a un incremento de la esperanza de vida. Este aumento del porcentaje de población envejecida hace que crezca también el número de personas que padecen enfermedades crónicas e incapacitantes. Además, la esperanza de vida de las personas con discapacidades psíquicas, físicas y sensoriales, de distintas clases y en grados diversos, se ha prolongado notablemente. En los últimos años ha aumentado exponencialmente el coste sanitario por este tipo de pacientes. En todos los países desarrollados se ha detectado que estos pacientes denominados «pacientes crónicos complejos», con alta comorbilidad, con alta dependencia física y con un elevado número de ingresos hospitalarios, son los que más recursos sanitarios consumen1. Las nuevas políticas sanitarias están orientadas a mejorar la asistencia de estos pacientes crónicos complejos intentando reducir su estancia en hospitales de agudos, lo que ha provocado un incremento de derivaciones hacia los centros sociosanitarios o a mantenerlos el mayor tiempo posible en una residencia. El incremento de este tipo de población, junto con el cambio en la atención al paciente crónico, ha provocado un incremento significativo de unidades de internamiento destinadas a atender las necesidades específicas de estos pacientes de una manera más eficiente. Esto ha provocado un descenso importante del número de camas en unidades de hospitalización de agudos convencionales. Aproximadamente 3,2millones de estadounidenses viven en long-term care facilities, y casi un millón de personas residen en residencias. En la Unión Europea los mayores de 65años han pasado de ser el 9,6% de la población en 1960 al 16% en 2010. Actualmente hay disponibles unos 3,5millones de camas para poder atender a la población dependiente aportadas por más de 62.000centros de larga estancia que atienden a unos 3,7millones de pacientes/año2. En enero de 2010 existían en España 5.177centros residenciales con un total de 335.380plazas3, y según datos de 2009, aportados por el Instituto Nacional de Estadística, en España había 13.068camas de larga estancia y 14.564 para pacientes psiquiátricos4.
Al revisar la literatura médica de habla inglesa es importante destacar que en el concepto de centros de estancia prolongada, o long-term care facilities, se incluyen los centros sociosanitarios y las residencias del ámbito social. Nuestros CSCP incluyen unidades de larga estancia que se corresponderían con las nursing home, unidades de paliativos, unidades de psicogeriatría y de cuidados intermedios que estarían relacionados con las intermediate care o step-dwon facilities. Los cuidados intermedios a su vez incluirían unidades especializadas en la atención de pacientes en situación subaguda, postaguda, y unidades de convalecencia.
La asistencia en los CSCP plantea varios retos para el control de infecciones: alta prevalencia de infecciones y de tasas de colonización por microorganismos multirresistentes (MMR), frecuente prescripción inadecuada de antimicrobianos, altas tasas de transferencias con el hospital de agudos y baja utilización de técnicas diagnósticas. Todo ello en un entorno de pocos recursos económicos y diagnósticos.
En los últimos años ha aumentado el problema, fundamentalmente por el número creciente de personas mayores con situaciones médicas complejas que requieren atención a largo plazo, por la mayor proporción de residentes que requieren procedimientos invasivos y por el incremento de pacientes en situación subaguda5 (tabla 1).
Cambios en los centros de cuidados prolongados
| Edad muy avanzada. Alto número de pacientes mayores de 85años |
| Aumento de los pacientes procedentes del hospital |
| Pacientes más complejos: traqueotomía, reservorios, sondas PEG, catéteres… |
| Mayor comorbilidad |
| Mayor número de reagudizaciones |
| Menor estancia en agudos: situación subaguda y postaguda en el momento del ingreso |
| Mayor número de ingresos hospitalarios antes del ingreso |
| Mayor número de agudizaciones en planta |
| Mayor número de infecciones en agudos con aumento del consumo de antibióticos |
| Incremento de la infección relacionada con la asistencia sanitaria |
Todas estas circunstancias llevan a considerar la IN en los CSCP como una de las principales amenazas actuales y con riesgo de empeorar próximamente6. Los pacientes de estos centros tienen más posibilidades de padecer una infección porque comparten los elementos propios de un hospital (factores extrínsecos) y los propios de una población vulnerable por su envejecimiento y comorbilidades (factores intrínsecos) (tabla 2).
Factores intrínsecos de riesgo para infección en el anciano
| Déficit de la inmunidad celular y humoral |
| Comorbilidad |
| Patología crónica propia del anciano (diabetes, demencia, patología respiratoria crónica…) |
| Uso excesivo de medicamentos |
| Malnutrición con déficit de proteínas y oligoelementos |
| Déficit funcional |
| Atrofia cutánea |
| Disminución del reflejo de la tos |
| Incontinencia |
| Inmovilidad |
Son pacientes que acaban de sufrir intervenciones quirúrgicas, cateterismos, sondajes, tratamiento con antibióticos, exposición a contaminación por contacto con pacientes colonizados por MMR… aspectos típicos de un hospital de agudos. Se han descrito en multitud de trabajos las causas por las que la población geriátrica tiene una mayor predisposición a sufrir infecciones y a ser portadora de gérmenes multirresistentes7–9.
La presencia de inmovilidad, las incontinencias —sobre todo la fecal—, las úlceras por presión y la necesidad de sondas de alimentación, de vías venosas y de catéteres urinarios predisponen al desarrollo de infecciones.
Otro factor a tener en cuenta es la forma de presentación de la infección en el anciano. En muchas ocasiones se presenta de forma larvada, manifestándose únicamente por una pérdida de función, aparición de incontinencia, inestabilidad, delirium (el delirium hipoactivo tiene una especial importancia por su mal pronóstico) o disminución de la ingesta. No facilita el diagnóstico la ausencia de fiebre o la presencia de una leve febrícula y el incremento del umbral del dolor. Además, en los CSCP predominan en el diagnóstico los criterios clínicos sobre los basados en pruebas complementarias (análisis sanguíneos y microbiológicos). Otra característica fundamental es la utilización prioritariamente de tratamiento antibiótico empírico10. Todas estas peculiaridades deben tenerse en cuenta a la hora de diseñar programas de seguimiento.
Criterios diagnósticos de infección en centros sanitarios de cuidados prolongadosExiste consenso en que la política más eficaz en el control de la infección en los CSCP es la vigilancia de la aparición de infecciones. A la hora de diseñar y valorar estudios sobre infección en los CSCP hay que analizar 2elementos clave.
El primero es la variabilidad, ya que el concepto de CSCP incluye unidades que tienen una estructura, una tipología de pacientes y una relación asistencial con hospitales de agudos muy diferentes. Por ello, la prevalencia y la incidencia de infecciones varían de forma importante según el tipo de unidad que valoremos.
El segundo elemento clave son las definiciones de infección adaptadas a la atención en los CSCP. Diversos estudios han demostrado la inconsistencia de los datos de vigilancia de las IN en los CSCP porque los criterios de infección eran muy diversos y no permitían la comparación de tasas entre centros. Establecer una vigilancia estandarizada requiere el uso de definiciones uniformes y consensuadas de las infecciones más frecuentes. En los últimos 30años se ha realizado un esfuerzo en definir los criterios de infección, y esto ha tenido especial importancia a la hora de realizar estudios de prevalencia y de incidencia que permitan la comparación entre centros. En 1991, Allison McGeer11 estableció unos criterios diagnósticos que han sido universalmente aceptados. Según estos criterios, en el diagnóstico de las IN en los CSCP destaca, por encima de las pruebas de laboratorio o de la radiología, los aspectos basados en la valoración clínica. Las pruebas complementarias están especialmente indicadas cuando se dan infecciones de repetición, existe respuesta desfavorable al tratamiento antibiótico empírico o se encuentran signos de infección en pacientes portadores de gérmenes multirresistentes. Dado que la presencia de comorbilidades puede enmascarar la presentación de un cuadro infeccioso, recomienda descartar posibles causas no infecciosas antes de hacer el diagnóstico de infección: deshidratación, reacción adversa medicamentosa, alteración endocrina, anemia o insuficiencia cardiaca.
Actualmente el perfil de los pacientes de estos centros es el de un paciente más agudo y con mayor comorbilidad, rotación por unidades hospitalarias, número de tratamientos antibióticos e instrumentalización de sus curas (sondas, catéteres…). Por ello, y dado el tiempo trascurrido desde que Allison McGeer publicó sus definiciones, en el año 2012 un grupo de expertos en infecciones, medicina preventiva y geriatría, entre otras especialidades, creyeron que era el momento de actualizar estas definiciones12. Esta actualización está auspiciada y reconocida por los Centers for Disease Control and Prevention (CDC), una de las instituciones más prestigiosas a nivel mundial en la prevención de las infecciones.
Las modificaciones que proponen se basan, principalmente, en 3objetivos:
- 1.
Aumentar el valor predictivo positivo y la sensibilidad de las definiciones. Dada la existencia de trabajos que demuestran que aplicando criterios de vigilancia de IN con medios diagnósticos adecuados aumenta la detección de casos hasta en un 300%13, proponen cambiar la metodología hacia criterios basados en la evidencia científica existente.
- 2.
Focalizar el interés en infecciones potencialmente evitables y con elevada morbilidad o riesgo de provocar brotes epidémicos (hepatitisA, norovirus, algunas cepas de StreptococcusA, sarna y virus de la gripe).
- 3.
Modificar los criterios de infección de localizaciones específicas, especialmente respiratoria y urinaria. Es el principal cambio, y para confirmar el diagnóstico exigen una prueba de laboratorio, ya sea un cultivo positivo para confirmar la infección de orina o una radiografía de tórax para confirmar la existencia de una neumonía. Esto supone un cambio importante en la cuantificación de la IN, ya que no todas las unidades tendrán medios suficientes para poder realizar estas pruebas.
Mantienen las peculiaridades ya descritas por McGeer en cuanto a la presentación de la enfermedad en este tipo de pacientes, la pérdida de función aguda o la desorientación. Proponen mejorar la fiabilidad mediante la utilización de escalas, ampliamente utilizadas en Estados Unidos, para la valoración de la capacidad física. Incorporan el Minimun Data Set de la mayoría de los centros y una modificación de la Confusion Assessment Method Criteria elaborada por Lim y MacFarlane14. También modifican los criterios de fiebre y de leucocitosis (tabla 3).
Criterios clínicos específicos de infección en el paciente de CSCP
| A. Fiebre (una de las 3 opciones) |
| 1. Una determinación de temperatura oral mayor de 37,8¿C |
| 2. Dos determinaciones de temperatura oral mayor de 37,2¿C o 2 rectales de 37,5¿C |
| 3. Una determinación única, en cualquier ubicación (oral, timpánico, axilar), con un incremento de 1,1¿C sobre la temperatura habitual del paciente |
| B. Leucocitosis (una de las 2 opciones) |
| 1. Neutrofilia (≥14.000 leucocitos/mm3) |
| 2. Desviación izquierda en el recuento de leucocitos (16% bandas o ≥1.500 bandas/mm3) |
| C. Deterioro cognitivo agudo sobre la situación basal(Confusion Assessment Method Criteria) |
| 1. Brusca |
| 2. Curso fluctuante |
| 3. Falta de atención |
| 4. Alteración del nivel de conciencia |
| D. Deterioro agudo funcional (Escala ADL delMinimun Data Set) |
| 1. Un nuevo aumento de 3 puntos en total las actividades de la vida diaria (ADL). Puntuación de cada ítem de 0 a 4 puntos, puntuación entre 0 y 28 |
| a. Movilidad cama |
| b. Transferencias |
| c. Deambulación |
| d. Vestirse |
| e. Uso inodoro |
| f. Higiene personal |
| g. Alimentación |
Modificado de Stone et al.12.
En este artículo se adoptan estos criterios revisados para las 4infecciones más frecuentes en los CSCP: infección del tracto respiratorio, infección urinaria, infección de partes blandas e infección del tracto digestivo. La descripción de los criterios de infección considerados como de especial seguimiento en las políticas de control de infección en los CSCP se recoge en las tablas correspondientes (tablas 4-7).
Infección del tracto respiratorio
| A. Síndrome catarral o faringitis (al menos deben estar presentes 2 criterios) |
| 1. Secreción nasal o estornudos |
| 2. Congestión nasal |
| 3. Dolor de garganta, ronquera o dificultad para deglutir |
| 4. Tos seca |
| 5. Adenopatías cervicales |
| La fiebre puede o no estar presente. Los síntomas deben ser nuevos, no imputables a alergias |
| B. Gripe (ambos criterios 1 y 2 deben estar presentes) |
| 1. Fiebre |
| 2. Al menos 3 de los siguientes subcriterios: |
| a. Escalofríos |
| b. Cefalea de nueva aparición |
| c. Mialgias |
| d. Malestar general o pérdida del apetito |
| e. Faringitis |
| f. Aparición de tos seca o aumento de la existente |
| Si los criterios para gripe e infección del tracto respiratorio inferior coinciden, solo debe registrarse gripe |
| C. Neumonía (deben estar presentes los 3 criterios) |
| 1. Radiografía de tórax demostrando la neumonía o la presencia de un infiltrado nuevo |
| 2. Al menos uno de los siguientes subcriterios respiratorios: |
| a. Aparición de tos seca o aumento de la existente |
| b. Expectoración nueva o aumento de la existente |
| c. Saturación de O2 ≤ 94% con aire ambiente o reducción del 13% de la basal |
| d. Anormalidades en la exploración del pulmón nuevas o modificadas |
| e. Dolor pleurítico |
| f. Frecuencia respiratoria ≥ 25 respiraciones/min |
| 3. Al menos uno de los criterios generales de presentación clínica (vertabla 3) |
| Para el diagnóstico de neumonía o infección del tracto respiratorio inferior debe excluirse la presencia de enfermedades subyacentes que pueden imitar su presentación (insuficiencia cardíaca o enfermedades pulmonares intersticiales) |
| D. Infección del tracto respiratorio inferior (todos los criterios presentes) |
Infección del tracto urinario
| Pacientes sin sonda vesical permanente (ambos criterios deben estar presentes) |
| 1. Al menos uno de los siguientes signos o síntomas: |
| a. Disuria o dolor agudo, hinchazón o sensibilidad de los testículos, epidídimo o próstata |
| b. Fiebre o leucocitosis (véase tabla 3) y al menos uno de los siguientes subcriterios: |
| i. Dolor agudo costovertebral |
| ii. Dolor o sensibilidad suprapúbico |
| iii. Macrohematuria |
| iv. Nueva o marcado aumento en la incontinencia |
| v. Nueva o marcado aumento de la urgencia miccional |
| vi. Nueva o marcado aumento de la frecuencia miccional |
| c. En ausencia de fiebre o leucocitosis, 2 o más de los subcriterios del ii al vi |
| 2. Uno de los siguientes criterios microbiológicos: |
| a. ≥ 105 UFC/ml de 1 o 2 microorganismos en muestra de orina espontánea |
| b. ≥ 102 UFC/ml de cualquier número (¿?) de organismos en una muestra obtenida mediante sondaje intermitente |
| La infección urinaria debe diagnosticarse cuando coinciden signos y síntomas de infección y un resultado positivo en un cultivo. También puede diagnosticarse si coincide un hemocultivo y un cultivo de orina positivos aunque no aparezca ningún síntomas urológico, pero no debe haber ningún otro síntoma o signo que sugiera otra localización primaria de la infección |
| Pacientes con sonda vesical permanente (los criterios 1 y 2 deben estar presentes) |
| 1. Al menos uno de los siguientes signos o síntomas |
| a. Fiebre, escalofríos o hipotensión sin que exista otro lugar que explique la infección |
| b. Cualquier cambio agudo en el estado mental o funcional sin diagnóstico alternativo y leucocitosis (ver tabla 3) |
| c. Nueva aparición de dolor suprapúbico o en el ángulo costovertebral |
| d. Exudado purulento alrededor de la sonda, dolor, hinchazón o sensibilidad de los testículos, epidídimo o próstata |
| 2. Cultivo de orina positivo con ≥ 105 UFC/ml de cualquier organismo |
Infección del tracto digestivo
| A. Gastroenteritis (GI) (al menos uno de los siguientes criterios) |
| 1. Diarrea: 3 o más deposiciones líquidas o acuosas por encima de lo normal para el paciente en un plazo de 24 h |
| 2. Vómitos: 2 o más episodios en un período de 24 h |
| 3. Ambos de los siguientes signos o síntomas: |
| a. Cultivo positivo para un patógeno: Salmonella, Shigella, Escherichia coli O157: H7, Campylobacter, rotavirus) |
| b. Por lo menos uno de los siguientes criterios de GI |
| i. Náuseas |
| ii. Vómitos |
| iii. Dolor o malestar abdominal |
| iv. Diarrea |
| Se deben excluir las causas no infecciosas que presenten síntomas de diarrea, nausea o vómitos |
| B. Gastroenteritis porNorovirus(deben cumplirse los criterios 1 y 2) |
| 1. Por lo menos uno de los siguientes subcriterios GI |
| a. Diarrea: 3 o más deposiciones líquidas o acuosas por encima de lo normal del paciente en un plazo de 24 h |
| b. Vómitos: 2 o más episodios en un período de 24 h |
| 2. Detección de Norovirus en una muestra de heces por microscopia electrónica, inmunoanálisis, o por diagnóstico molecular (PCR) |
| En espera de confirmación de laboratorio, se debe considerar como un brote de Norovirus (2 o más casos) si se cumplen la totalidad de los criterios de Kaplana |
| i. Vómitos en más de la mitad de las personas afectadas |
| ii. Un media (o mediana) en el periodo de incubación de 24-48 h |
| iii. Una media (o mediana) en la duración de la clínica de 12 a 60 h |
| iv. No se encuentra ningún patógeno en los coprocultivos |
| C. Infección porClostridium difficile(debe cumplir los criterios 1 y 2) |
| 1. Uno de los siguientes criterios: |
| a. Diarrea: 3 o más deposiciones líquidas o acuosas por encima de lo normal en el paciente en un plazo de 24 h |
| b. Presencia de megacolon tóxico documentado radiológicamente |
| 2. Uno de los siguientes criterios de diagnóstico: |
| a. Una muestra de heces positiva para toxinaA o B, o identificación de toxinaB en cultivos celulares de Clostridium difficile o mediante técnicas moleculares para identificar los genes que producen las toxinas |
| b. Colitis seudomembranosa diagnosticada por endoscopia, cirugía o anatomía patológica de una biopsia |
Infección de piel, partes blandas y mucosas
| A. Celulitis, infección tejidos blandos o infección ulcera (cumplir al menos uno de los siguientes criterios) |
| 1. Presencia de pus |
| 2. Nuevo signo/síntoma o aumento en zona afectada de al menos 4 de los siguientes: |
| a. Calor |
| b. Enrojecimiento |
| c. Inflamación |
| d. Sensibilidad o dolor |
| e. Drenaje seroso |
| f. Un criterio clínico general (véase tabla 3) |
| La presencia de gérmenes a partir de una muestra por hisopo de superficie no es suficiente criterio para confirmar la existencia de infección. Si existen signos de infección el germen aislado en superficie no significa que sea el responsable de la infección en tejidos más profundo. El diagnóstico más fiable se obtiene con la toma de muestras mediante biopsia de tejido o por aspiración con aguja en la zona inflamada |
| Si se detecta más de un paciente con una infección estreptocócica del mismo serogrupo (por ejemplo, A, B, C, G), puede indicar la existencia de un brote |
| B. Sarna (debe cumplir los criterios 1 y 2) |
| 1. Erupción maculopapular pruriginosa |
| 2. Por lo menos uno de los siguientes criterios: |
| a. Diagnóstico médico |
| b. Confirmación de laboratorio (raspado de piel o biopsia) |
| c. Vinculación epidemiológica con un caso de sarna confirmado |
| C. Infección por hongos (oral, perioral y piel) |
| 1. Candidiasis oral (debe cumplir ambos criterios) |
| a. Presencia de muguet en mucosa oral |
| b. Diagnóstico por médico |
| 2. Infección de la piel (debe cumplir los criterios a y b) |
| a. Erupciones o lesiones características |
| b. Diagnóstico médico o por laboratorio de microbiología |
| D. Infección por herpes |
| 1. Herpes simple (debe cumplir los criterios a y b) |
| a. Una erupción vesicular |
| b. Diagnóstico médico o por laboratorio de microbiología |
| 2. Infección por herpes zoster (debe cumplir los criterios a y b) |
| a. Una erupción vesicular |
| b. Diagnóstico médico o por laboratorio de microbiología |
| La reactivación del herpes simplex o el herpes zoster no se considera una infección nosocomial |
| E. Conjuntivitis (debe cumplir al menos un criterio) |
| 1. Pus durante al menos 24 h |
| 2. Eritema conjuntival |
| 3. Dolor conjuntival al menos durante 24 h |
Hasta hace poco tiempo, al no disponer de datos semejantes a los obtenidos en hospitales de agudos, desconocíamos tanto la tasa de IN y la incidencia de MMR como su verdadero impacto. No disponíamos de herramientas bien contrastadas que pudiésemos utilizar para evaluar y valorar este problema. En una encuesta reciente, realizada en Europa, solo en el 15% de los 33 países encuestados habían realizado estudios de prevalencia a nivel nacional/regional, y el 6%, estudios locales de incidencia15.
En Europa, el Centro Europeo para la Prevención y el Control de Enfermedades (ECDC) inició en el año 2010 un estudio entre los países de la Comunidad Europea denominado Healthcare-associated infections in long-term-care facilities (HALT) para determinar la prevalencia, el uso de antibióticos y los factores determinantes asociados16 en los CSCP. Participaron 117centros de 27países, valorando a 14.491pacientes17.
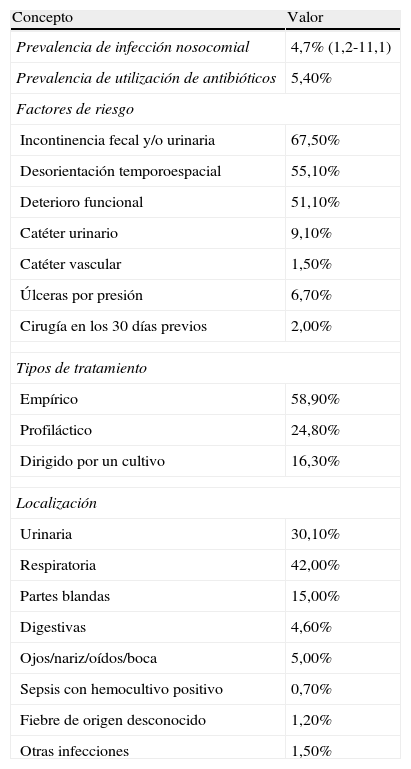
Se analizaron factores de riesgo: incontinencia fecal y/o urinaria, desorientación, alteración funcional, presencia de catéter urinario, catéter vascular, úlceras por presión, otro tipo de úlceras y proceso quirúrgico mayor en los 30días previos. Los criterios diagnósticos se basaron en el juicio clínico del facultativo en base a las definiciones de McGeer (1991). Los resultados más significativos se pueden valorar en la tabla 8.
Resultado estudio HALT 201016
| Concepto | Valor |
| Prevalencia de infección nosocomial | 4,7% (1,2-11,1) |
| Prevalencia de utilización de antibióticos | 5,40% |
| Factores de riesgo | |
| Incontinencia fecal y/o urinaria | 67,50% |
| Desorientación temporoespacial | 55,10% |
| Deterioro funcional | 51,10% |
| Catéter urinario | 9,10% |
| Catéter vascular | 1,50% |
| Úlceras por presión | 6,70% |
| Cirugía en los 30 días previos | 2,00% |
| Tipos de tratamiento | |
| Empírico | 58,90% |
| Profiláctico | 24,80% |
| Dirigido por un cultivo | 16,30% |
| Localización | |
| Urinaria | 30,10% |
| Respiratoria | 42,00% |
| Partes blandas | 15,00% |
| Digestivas | 4,60% |
| Ojos/nariz/oídos/boca | 5,00% |
| Sepsis con hemocultivo positivo | 0,70% |
| Fiebre de origen desconocido | 1,20% |
| Otras infecciones | 1,50% |
HALT: Healthcare-associated infections in long-term-care facilities.
En España no existe un estudio nacional que determine la prevalencia de las IN en los CSCP, pero sí se dispone de estudios autonómicos que determinan estas tasas en amplias zonas del país. En Cataluña, desde el año 2011, dentro del programa de Vigilancia de la Infección Nosocomial en Cataluña (VINCat) del Servei Català de la Salut18 se están realizando 2cortes de prevalencia por año, siguiendo las mismas definiciones y la misma metodología que el estudio HALT, lo que permite comparar los resultados de una forma fiable con la mayoría de los centros sociosanitarios de Cataluña. En último estudio de prevalencia realizado fue en junio de 2012, participaron 41centros sociosanitarios y se analizaron datos de 3.697pacientes. Destaca en este corte del 2012 una prevalencia de IN del 9,2%, la presencia de un elevado porcentaje de pacientes intervenidos en los 30días previos al estudio y la utilización de catéteres vasculares. Las diferencias respecto al estudio europeo se explican por las diferencias en el tipo de unidad analizado. El estudio VINCat se realizó en unidades sociosanitarias con un alto componente sanitario sin que hubiera ningún centro residencial social.
Por sus características, los CSCP son un entorno ideal para la transmisión MMR. Existen pocos datos en nuestro país sobre la etiología de la IN en los CSCP, tanto por el escaso número de estudios existentes como por el bajo número de cultivos microbiológicos realizados en estos centros.
El principal problema en los CSCP, desde el punto de vista epidemiológico, es la elevada prevalencia de portadores/colonizados por MMR. En la actualidad se considera que los CSCP son uno de los principales reservorios de MMR, especialmente de Staphylococcus aureus resistente a la meticilina (SARM). Esta situación epidemiológica hace imposible implantar medidas de erradicación de portadores de multirresistentes en los centros sociosanitarios, por lo que es crucial adaptar guías de control19–22 y políticas de coordinación entre niveles para intentar controlar este problema sanitario. Las infecciones por estos microorganismos se asocian a un aumento de la morbilidad, de la mortalidad y de los costes.
No está indicado el cribado sistemático de todos los pacientes, pero el registro y el control de portadores/colonizados e infecciones utilizando los resultados obtenidos en la práctica clínica habitual es clave para detectar situaciones de riesgo o posibles brotes epidémicos.
Dadas la incidencia y la gravedad asociada a la colonización/infección por SARM, son más conocidas las recomendaciones de manejo de este microorganismo. También debería hacerse un especial seguimiento de otros gérmenes por su relevancia clínica y epidemiológica, tales como enterobacterias productoras de betalactamasas de espectro extendido (BLEE), Pseudomonas aeruginosa, Acinetobacter baumannii y Clostridium difficile. Dado que el germen más prevalente en la actualidad y al que más importancia epidemiológica se le concede es el SARM, a partir de ahora nos referiremos preferentemente a él. En el ámbito sociosanitario prácticamente no existen recomendaciones para el resto de MMR, aunque su manejo podría extrapolarse.
Datos de estudios realizados en nuestro país demuestran que la proporción de pacientes colonizados por SARM es del 30-40% en algunos centros23. La colonización puede localizarse en diversos lugares anatómicos (piel, tejidos blandos, aparato respiratorio u orina), sin que provoque signos o síntomas infecciosos. Normalmente se trata de un paciente frágil con criterios de paciente crónico complejo, con deterioro funcional y cognitivo, que ha ingresado en varias ocasiones y cuya principal patología está asociada a úlceras crónicas, diabetes, isquemia periférica, patología neurológica que condiciona disfagia y/o incontinencia, EPOC…
La infección por SARM provoca una infección localizada (piel, tejidos blandos, aparato respiratorio, urinario…) o diseminada (bacteriemia, sepsis). El perfil del paciente es muy similar al anterior, pero en él es más elevado el antecedente de tratamiento antibiótico de amplio espectro en los 3meses previos, el ingreso hospitalario prolongado, la cercanía de pacientes portadores de SARM y la manipulación mediante sondas y catéteres24 (tabla 9).
Factores de riesgo para infección por multirresistentes
| Aumento de la edad |
| Aumento de la comorbilidad y de la severidad de la patología |
| Incremento de la estancia hospitalaria |
| Ingreso en una unidad de cuidados intensivos |
| Exposición por cercanía a pacientes colonizados o infectados con microorganismos multirresistentes |
| Tratamiento antibiótico prolongado o de amplio espectro previo en los 3 meses anteriores |
| Presencia de sondas, catéteres o procedimientos intervencionistas |
Si bien la colonización por SARM en nuestro entorno es muy alta, el riesgo de infección es bajo, especialmente en infecciones de piel y de partes blandas.
Estrategias para la prevención de microorganismos multirresistentes en centros sanitarios de cuidados prolongadosLas medidas para prevenir el SARM pasan por una estrategia de control individualizada y educación del personal para utilizar de forma óptima las precauciones estándar en el cuidado de los pacientes. Esto incluye reforzar el lavado de manos con soluciones de base alcohólica, la utilización de guantes solo en la exposición a fluidos y piel no íntegra, el uso de bata si hay riesgo de contaminación de la ropa del personal, y además implantar medidas rutinarias de vigilancia del SARM. Las precauciones estándar deben aplicarse a todos los pacientes independientemente de su diagnóstico, a fin de minimizar el riesgo de transmisión de cualquier tipo de microorganismo.
Por falta de evidencia en el impacto sobre tasas de infección/colonización por SARM en los CSCP no se recomienda rechazar la admisión de pacientes colonizados, requerir cribado de SARM previo al traslado, identificar portadores, descolonizar residentes asintomáticos o personal —a menos que estén implicados en la transmisión de infecciones— ni aislar a los pacientes con SARM de lugares y actividades comunes.
Un concepto clave utilizado en la mayoría de las guías es el de riesgo de transmisión por parte de un paciente portador/colonizado. El riesgo aumenta cuanto mayor sea el grado de autonomía, con más deterioro cognitivo, que condiciona un peor cumplimiento de las medidas higiénicas, con situaciones de fragilidad clínica (desnutrición, inmunodepresión, diabetes) y con presencia de lesiones cutáneas y de dispositivos invasivos (sondas, catéteres…).
Una vez identificada una situación de riesgo de transmisión, debe realizarse una gradación de riesgo en base a la condición de ser portador/colonizado o infectado, la localización del microorganismo y las alteraciones de la conducta que dificultan el cumplimiento de las medidas higiénicas y el mantenimiento de las medidas de control. La clasificación se realizaría en bajo, medio y alto riesgo. El mayor riesgo correspondería a un paciente con infección de vías respiratorias y con alteraciones del comportamiento añadidas. El menor riesgo se presentaría en el paciente colonizado en una localización no respiratoria y sin alteraciones de comportamiento.
Dependiendo de esta clasificación de riesgo se establecerán medidas de prevención diferentes, llegando a las precauciones de contacto con aislamiento en habitación individual y visitas restringidas en pacientes de alto riesgo.
Hay que establecer una estrategia de vigilancia básica que permita prevenir las infecciones. La prevención se basa en el tratamiento eficaz y en implementar estrategias básicas de control de infección basadas en la evidencia. Los objetivos más importantes se describen en la tabla 10.
Objetivos más importantes para establecer programa de vigilancia en los centros sanitarios de cuidados prolongados
| Reducir la morbimortalidad atribuible a infecciones en los residentes |
| Prevenir y controlar los brotes |
| Prevenir la adquisición de infecciones por el personal |
| Reducir el uso de antibióticos |
| Mantener el estatus funcional de los enfermos |
| Mantener en condiciones óptimas el entorno social de los residentes |
Para poder llevar a cabo las acciones se requieren recursos humanos suficientes con formación específica, una persona que lidere el proceso, un plan de prevención escrito y el apoyo de los órganos gestores del centro.
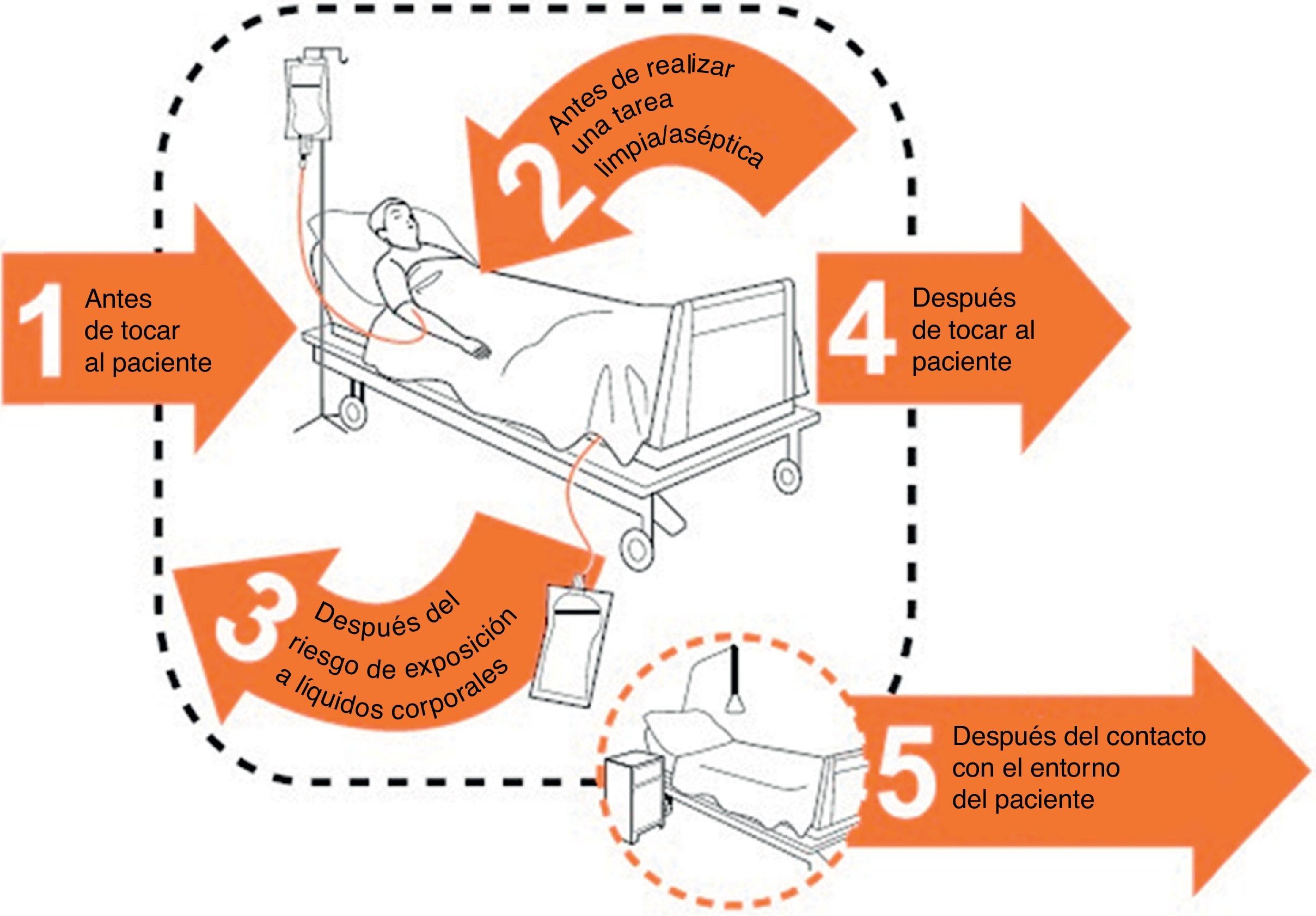
Una alta adherencia a la higiene de manos con soluciones alcohólicas tiene un impacto directo sobre la transmisión de patógenos, el control de los brotes y la reducción de las tasas de infección. Las guías actuales recomiendan el uso de soluciones alcohólicas porque estos productos eliminan parte de las barreras y obstáculos que los profesionales tienen para mantener una correcta higiene de manos. Es básico acercar los dispensadores de soluciones alcohólicas a los puntos de atención del paciente para facilitar el cumplimiento de su uso. Los guantes, utilizados de forma correcta, pueden reducir la contaminación de las manos en un 80%, previniendo la contaminación cruzada y protegiendo a los pacientes y al personal. Deben ser usados exclusivamente en aquellas situaciones en que los profesionales entran en contacto con secreciones de los pacientes y, por lo tanto, dentro de las habitaciones. Su uso inadecuado es fuente de problemas y es la principal causa del incumplimiento en la higiene de manos, pues su uso no exime de una correcta higiene de manos. Los principales indicadores para monitorizar el correcto cumplimiento de la higiene de manos pasan por recoger los consumos de soluciones alcohólicas usados por 1.000pacientes/día y en la observación directa de la adherencia al correcto cumplimento de la higiene de manos siguiendo las directrices de los 5momentos de la OMS (fig. 1).
Las precauciones de contacto no son una opción recomendada frente a la mayoría de los patógenos multirresistentes y deben reducirse a microorganismos o situaciones muy específicos.
Para controlar la aparición de MMR es básico aplicar una correcta política de antibióticos, ya que la principal causa en el desarrollo de resistencias es su consumo en exceso. Existe una relación directa entre el aumento en el consumo de antibióticos y la aparición de resistencias a ellos. Las infecciones nosocomiales causadas por MMR comportan una mortalidad asociada que hay que sumar a la debida a la propia infección.
Para revertir esta resistencia antibiótica es necesario implementar diferentes acciones y esfuerzos que no siempre nos llevan al resultado deseado de forma rápida. Las principales sociedades científicas y organismos oficiales han desarrollado recomendaciones y programas educacionales destinados, sobre todo, a prevenir la aparición de MMR. Ya la OMS, en su Asamblea Mundial de la Salud de 199825, instó a adoptar medidas dirigidas a mejorar tanto la utilización racional de los antibióticos como las prácticas para disminuir la incidencia de las infecciones y la difusión de los gérmenes resistentes. Recomendaba el desarrollo de sistemas de vigilancia que sirviesen para cuantificar el consumo de antibióticos y la incidencia de resistencias.
Disminuir el uso inapropiado de antibióticos es un elemento fundamental dentro de un programa efectivo de control de la infección. Establecer una política de antibióticos es difícil, ya que la mayor parte de los tratamientos son empíricos, frecuentemente se tratan inadecuadamente las colonizaciones, principalmente las de localización urinaria, y se hace con antibióticos de amplio espectro y durante un tiempo excesivo26. Es importante disponer de información sobre la etiología de las principales infecciones, así como conocer de forma periódica las sensibilidades de los principales agentes etiológicos. Este conocimiento facilita el desarrollo de guías de tratamiento ajustadas a la realidad local de cada centro.
ConclusionesActualmente la introducción de MMR en los CSCP es una realidad. Necesitamos establecer mecanismos que limiten el impacto de estos patógenos. Esto es incuestionable, aunque debemos ser muy cautos en la aplicación de medidas de control de la infección. La aplicación de procedimientos muy básicos nos puede ayudar significativamente. Necesitamos incrementar el nivel de nuestros conocimientos respecto a otros patógenos multirresistentes que se dan en los CSCP.
Las características de los CSCP son muy diversaa, y el tipo de unidades determina la complejidad de los cuidados ofrecidos. Estos centros representan una atención muy valiosa en el sistema de salud al proporcionar cuidados de calidad a los pacientes crónicos de estancia prolongada de forma más eficiente que en las unidades de agudos. Estos centros son un recurso muy eficiente para poder descentralizar los cuidados geográficamente y en función de la demanda. Para que esta atención sea la adecuada es necesario determinar los criterios de selección de los pacientes, un mecanismo de pago eficiente y criterios de calidad muy estrictos en los cuidados. Los pacientes tratados en estos centros, por sus especiales características, tienen un riesgo alto de sufrir una IN o de colonizarse por MMR.
Mantener un entorno limpio, un cumplimiento estricto a las precauciones estándar, especialmente la higiene de manos con soluciones alcohólicas, y una adaptación práctica de las guías clínicas existentes tiene un mayor impacto en la prevención de las IN en los CSCP que un programa de cribado generalizado o programas de vigilancia complejos que están más indicados para los hospitales de agudos.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion