El 10% de las asistencias en los servicios de urgencias están relacionadas con procesos infecciosos. Administrar el tratamiento antibiótico de manera precoz y la toma inmediata de otras decisiones diagnóstico-terapéuticas (pruebas complementarias, obtener hemocultivos y muestras microbiológicas, intensidad del soporte hemodinámico, necesidad de ingreso, etc.) repercuten directamente en la supervivencia de los enfermos con infección bacteriana grave (bacteriemia, sepsis grave o shock séptico). En este contexto, el servicio de urgencias representa uno de los eslabones clave donde se establecen la sospecha y el diagnóstico y se inicia el tratamiento, lo que determinará la evolución y el pronóstico en función de la rapidez de esta actuación. Pero las manifestaciones clínicas de los procesos infecciosos son a menudo inespecíficas y variables, lo que dificulta el reconocimiento precoz de estos enfermos y estas situaciones. Los biomarcadores de respuesta inflamatoria e infección se han posicionado desde hace años como herramientas de gran ayuda para el médico de urgencias, mejorando el diagnóstico y el manejo de la infección en urgencias. La intención de esta revisión es poner de manifiesto las evidencias científicas publicadas, aclarar las controversias existentes, comparar la utilidad de los principales biomarcadores de inflamación e infección y generar, a partir de ella, una serie de recomendaciones para su uso con objeto de mejorar el diagnóstico, la valoración pronóstica y el manejo de los pacientes con infección en urgencias.
Infectious processes account for 10% of patient seen in the emergency department. To administer antibiotics early, and before any other therapeutic-diagnostic decisions (complementary tests, microbiological samples, intensity of hemodynamic support, need for admission, etc.) have direct repercussions on the survival of patients with severe bacterial infections (bacteremia, severe sepsis or septic shock). In this context, the emergency department represents a critical level where the suspicion of infection and it diagnosis is made and treatment is started, and the progression and prognosis will be determined by the speed of this action. However, the clinical manifestations of infectious diseases are often non-specific and variable which makes early recognition of these patients and situations difficult. Inflammation and infection biomarkers have been around for years as helpful tools for improving emergency medical diagnoses and management of infection in the emergency department. The aim of this review is to summarize the published scientific evidence, in order to clarify the existing controversies, comparing the usefulness of the major biomarkers of inflammation and infection. It will alas suggest recommendations for their use in order to improve diagnosis, prognostic evaluation and management of infected patients in the emergency department.
El 10% de las asistencias en los servicios de urgencias hospitalarios (SUH) están relacionadas con procesos infecciosos1. La administración precoz del tratamiento antibiótico (AB) y la toma inmediata de otras decisiones diagnóstico-terapéuticas (pruebas complementarias, obtener hemocultivos y otras muestras microbiológicas, intensidad del soporte hemodinámico, necesidad de ingreso, etc.) repercuten directamente en la supervivencia de los enfermos con infección bacteriana grave: sepsis, sepsis grave (SG) y shock séptico (SS)2-5. La sepsis es un claro ejemplo de enfermedad «tiempo-dependiente»6. El 61% de las sepsis que se diagnostican en los hospitales son valoradas en los SUH6,7 y su incidencia se ha incrementado en los últimos años, estimándose recientemente en 367 casos/100.000 adultos/año8. El SUH representa uno de los eslabones clave donde se establece la sospecha y el diagnóstico y se inicia el tratamiento guiado por objetivos («paquetes de medidas»), lo que determinará la evolución y el pronóstico en función de la rapidez de estas actuaciones2.
La definición de sepsis es sencilla: presencia de un síndrome de respuesta inflamatoria sistémica (SRIS) con 2 de los 4 criterios siguientes: temperatura >38 o <36°C, leucocitosis >12.000 o <4.000/mm3, taquipnea >20respiraciones/min y taquicardia >90latidos/min en un paciente con infección9,10. Pero las manifestaciones clínicas de los procesos infecciosos son a menudo inespecíficas y variables (especialmente en el paciente anciano o en el inmunodeprimido), lo que dificulta el reconocimiento precoz de estos enfermos y estas situaciones2,11-13. Además, estos 4 signos de SRIS, aunque muy sensibles son poco específicos y muy comunes en otras situaciones inflamatorias no infecciosas2,14,15, lo que favorece que se prescriban AB innecesarios sin la certeza de que el cuadro sea infeccioso, sobre todo en pacientes con síndrome febril en el SUH (en el 30 al 50% de las ocasiones de etiología no infecciosa se prescriben AB), con la consiguiente presión antibiótica y la posibilidad de aumento de las resistencias y de la virulencia bacterianas2,16. Los biomarcadores de respuesta inflamatoria e infección (BMRIeI) se han posicionado como herramientas de gran ayuda para el clínico a la hora de mejorar el diagnóstico y el tratamiento de la infección al facilitar y adelantar la toma de decisiones vitales en el SUH17-19. Ya en la conferencia de expertos en sepsis del año 2001, conscientes de la dificultad para reconocer y distinguir por los signos y síntomas al paciente con sepsis del SRIS no infeccioso, se estableció la importancia de los biomarcadores, en concreto la proteínaC reactiva (PCR) y la procalcitonina (PCT), en el reconocimiento precoz del paciente con infección grave (SG-SS), en la valoración del grado de respuesta inflamatoria y en la estratificación del riesgo de los pacientes de acuerdo con el sistema PIRO (Predisposición, Infección causal, Respuesta a la infección valorada por lactato y biomarcadores y disfunción de Órganos)10. Incluso se definió un punto de corte inicial (valores de PCR y/o PCT por encima de 2 veces su desviación estándar). Posteriormente, en 2007 la Food and Drug Administration (FDA) consideró a la PCT como indicador pronóstico (de progresión a SG-SS) en pacientes con sepsis para uso conjunto con datos de laboratorio y clínicos. En la actualidad más de 170BMRIeI han sido estudiados pero ninguno tiene suficiente sensibilidad y especificidad para ser empleado rutinariamente en todos los enfermos y en todas las situaciones18,20. Entre ellos, la PCR, el lactato y la PCT (con métodos cuantitativos o semicuantitativos) son los utilizados casi exclusivamente15. Por otra parte, es conocido que en un porcentaje de SUH españoles no existe disponibilidad de cuantificar los BMRIeI.
La intención de esta revisión es poner de manifiesto las evidencias científicas publicadas, aclarar las controversias existentes, comparar la utilidad de los principales BMRIeI (con especial interés en los validados y recomendados por las sociedades científicas de enfermedades infecciosas y medicina de urgencias) y generar a partir de ella una serie de recomendaciones para su uso con objeto de mejorar el diagnóstico, la valoración pronóstica y el tratamiento de los pacientes con infección potencialmente grave en los SUH.
Biomarcadores de inflamación e infección¿Qué entendemos por biomarcador de inflamación e infección?Se define como biomarcador (BM) a aquella molécula medible en una muestra biológica de forma objetiva, sistemática y precisa, cuyos niveles se constituyen en indicadores de que un proceso es normal o patológico y sirven para monitorizar la respuesta al tratamiento20-22. El BM debe proporcionar información adicional a la que se obtiene con los datos clínicos del paciente y ayudar a la hora de tomar decisiones urgentes en los SUH17.
Al BMRIeI ideal, que no existe, se le debería reconocer y exigir la capacidad para:
- 1.
Establecer un diagnóstico precoz (incluso antes de que se manifiesten los signos y síntomas de una infección bacteriana grave como hipotensión, hiperlactacidemia o disfunción de órganos). Por lo tanto, aumentará la seguridad y acortará el tiempo del diagnóstico clínico de la sepsis (frente a otras causas de SRIS provocados por otras enfermedades sistémicas, inflamatorias, infecciones víricas, etc.), permitiendo el inicio más precoz de las medidas terapéuticas adecuadas2,20,21,23.
- 2.
Cuantificar la gravedad y estratificar el riesgo, identificar a los pacientes con infección grave (sepsis, SG y SS) con la máxima sensibilidad, especificidad y valor predictivo positivo (VPP), y descartar los casos con riesgo de mala evolución (como en el caso de bacteriemia) con la mayor especificidad y valor predictivo negativo (VPN)17,21.
- 3.
Monitorizar la evolución de la infección bacteriana y su respuesta al tratamiento, de forma que sirva de guía para la terapia antibiótica (indicación, cese o cambio del AB)17,18.
El punto de corte a establecer en cada BMRIeI (una de las clásicas controversias) va a depender de la situación clínica, del tipo de enfermo, del foco o lugar de la infección y del rendimiento diagnóstico (especificidad, sensibilidad, VPN y VPP) que se quiera conseguir para una decisión determinada (p.ej., si el objetivo es identificar los pacientes con gran riesgo de muerte, bacteriemia o posible evolución a SG-SS, se buscará el BMRIeI y el punto de corte que consiga una mayor especificidad y VPN para estos objetivos). En la tabla 1 se muestran algunas de las utilidades más relevantes para los SUH17.
Principales utilidades y características de los BMRIeI
| - Distinción entre SRIS no infeccioso y S |
| - Distinción entre infección bacteriana y viral |
| - Distinción entre infección bacteriana focal o localizada y sistémica |
| - Detección precoz del paciente con infección grave: S, SG, SS |
| - Predicción de bacteriemia e indicación de obtener hemocultivos y otras pruebas microbiológicas |
| - Estratificación del riesgo de mala evolución, progresión a SG-SS y mortalidad a corto, medio y largo plazo |
| - Orientación en la decisión de alta o ingreso (en observación, UCE, planta o UCI) |
| - Detección de subgrupos de pacientes con indicación de ingreso en la UCI al necesitar tratamientos y/o vigilancia clínica más intensivos |
| - Orientación diagnóstica hacia determinados patógenos en distintas infecciones o situaciones particulares (NAC grave, meningitis, sepsis urológicas, etc.)a |
| - Indicación de tratamiento de soporte agresivo en fases precoces de la respuesta inflamatoria antes de la aparición de determinados síntomas y signos como la hipotensión |
| - Indicación de administración inmediata de antibióticos |
| - Indicación y monitorización del tratamiento antibiótico, su mantenimiento, cese o cambio de pauta |
| - Monitorización de la evolución del paciente y de su grado de respuesta inflamatoria sistémica |
| - Fiabilidad y seguridad de algunos BMRIeI en pacientes neutropénicos, inmunodeprimidos, oncohematológicos, ancianos, con insuficiencia renal o hepática y enfermedades reumatológicasb |
| - Seriación de los BMRIeI (6, 8, 12 y/o 24h) para confirmar un diagnóstico precoz o dudoso a partir de su incremento o de su aclaramiento según un porcentaje estimadoc |
| - Aumento del poder predictivo de otros BM, escalas pronósticas o modelos de predicción al utilizarse en combinación entre ellos («sinergia de los BM»), con variables clínicas o con índices de comorbilidad (p.ej: índice de Charlson) |
| - Definición de distintos puntos o intervalos (detecciones semicuantitativas)a de corte en función de la situación clínica, características del enfermo, foco o lugar de infección y de las decisiones que se necesiten tomar en el SUH según el porcentaje de sensibilidad, especificidad, valor predictivo positivo o negativo a aplicar |
BM: biomarcador; BMRIeI: biomarcadores de respuesta inflamatoria e infección; NAC: neumonía adquirida en la comunidad; S: sepsis; SG: sepsis grave; SRIS: síndrome de respuesta inflamatoria sistémica; SS: shock séptico; SUH: servicio de urgencias hospitalario; UCE: unidad de corta estancia; UCI: unidad de cuidados intensivos.
Adaptada de las referencias 15,17–20.
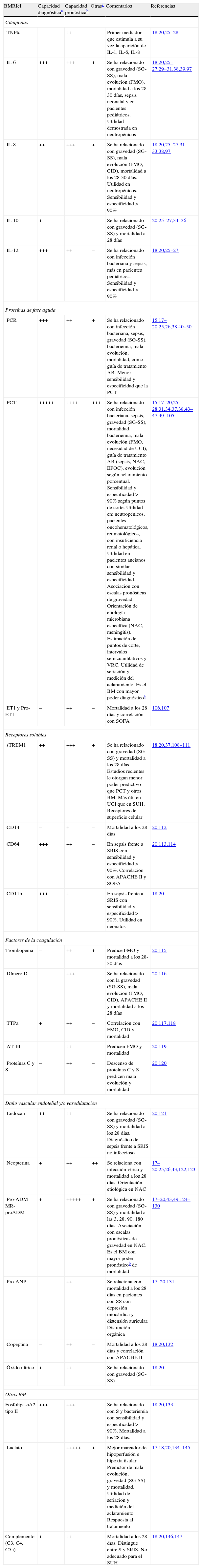
En una revisión reciente en Medline del año 2010 Pierrakos y Vincent20 encontraron 178BM diferentes en los 3.370estudios que relacionaban la sepsis con estos, la mayoría de ellos con el objetivo de evaluar su capacidad pronóstica y, en menor medida, la diagnóstica y otras utilidades, sobre todo en el contexto de pacientes críticos y en la unidad de cuidados intensivos (UCI). Una búsqueda con los mismos criterios («biomarker» and «sepsis») en agosto de 2.012 mostró 4.794 referencias que implican ya a casi 200BM24, de las cuales 573 se referían a PCR y 507 a PCT, lo que nos da una idea del interés y la experiencia crecientes que existe en la actualidad sobre ellos. La naturaleza de los BMRIeI es muy variable (tabla 2), incluyendo citoquinas, proteínas de fase aguda, factores de la coagulación, vasodilatación, daño endotelial, disfunción orgánica, receptores solubles, receptores de superficie celular, etc., aunque solo unos «elegidos» son accesibles desde los SUH y han sido validados17,18,20.
Clasificación de BMRIeI y utilidades relevantes reconocidas en urgencias
| BMRIeI | Capacidad diagnósticaa | Capacidad pronósticab | Otrasc | Comentarios | Referencias |
| Citoquinas | |||||
| TNFα | – | ++ | – | Primer mediador que estimula a su vez la aparición de IL-1, IL-6, IL-8 | 18,20,25–28 |
| IL-6 | +++ | +++ | + | Se ha relacionado con gravedad (SG-SS), mala evolución (FMO), mortalidad a los 28-30 días, sepsis neonatal y en pacientes pediátricos. Utilidad demostrada en neutropénicos | 18,20,25–27,29−31,38,39,97 |
| IL-8 | ++ | +++ | + | Se ha relacionado con gravedad (SG-SS), mala evolución (FMO, CID), mortalidad a los 28-30 días. Utilidad en neutropénicos. Sensibilidad y especificidad >90% | 18,20,25–27,31–33,38,97 |
| IL-10 | + | + | – | Se ha relacionado con gravedad (SG-SS) y mortalidad a 28días | 20,25–27,34–36 |
| IL-12 | +++ | ++ | – | Se ha relacionado con infección bacteriana y sepsis, más en pacientes pediátricos. Sensibilidad y especificidad >90% | 18,20,25–27 |
| Proteínas de fase aguda | |||||
| PCR | +++ | ++ | + | Se ha relacionado con infección bacteriana, sepsis, gravedad (SG-SS), bacteriemia, mala evolución, mortalidad, como guía de tratamiento AB. Menor sensibilidad y especificidad que la PCT | 15,17–20,25,26,38,40–50 |
| PCT | +++++ | ++++ | +++ | Se ha relacionado con infección bacteriana, sepsis, gravedad (SG-SS), mortalidad, bacteriemia, mala evolución (FMO, necesidad de UCI), guía de tratamiento AB (sepsis, NAC, EPOC), evolución según aclaramiento porcentual. Sensibilidad y especificidad >90% según puntos de corte. Utilidad en: neutropénicos, pacientes oncohematológicos, reumatológicos, con insuficiencia renal o hepática. Utilidad en pacientes ancianos con similar sensibilidad y especificidad. Asociación con escalas pronósticas de gravedad. Orientación de etiología microbiana específica (NAC, meningitis). Estimación de puntos de corte, intervalos semicuantitativos y VRC. Utilidad de seriación y medición del aclaramiento. Es el BM con mayor poder diagnósticoa | 15,17–20,25–28,31,34,37,38,43–47,49–105 |
| ET1 y Pro-ET1 | – | ++ | – | Mortalidad a los 28 días y correlación con SOFA | 106,107 |
| Receptores solubles | |||||
| sTREM1 | ++ | +++ | + | Se ha relacionado con gravedad (SG-SS) y mortalidad a los 28 días. Estudios recientes le otorgan menor poder predictivo que PCT y otros BM. Más útil en UCI que en SUH. Receptores de superficie celular | 18,20,37,108–111 |
| CD14 | – | + | – | Mortalidad a los 28 días | 20,112 |
| CD64 | +++ | ++ | – | En sepsis frente a SRIS con sensibilidad y especificidad >90%. Correlación con APACHEII y SOFA | 20,113,114 |
| CD11b | +++ | + | – | En sepsis frente a SRIS con sensibilidad y especificidad >90%. Utilidad en neonatos | 18,20 |
| Factores de la coagulación | |||||
| Trombopenia | – | ++ | + | Predice FMO y mortalidad a los 28-30 días | 20,115 |
| Dímero D | – | +++ | – | Se ha relacionado con la gravedad (SG-SS), mala evolución (FMO, CID), APACHEII y mortalidad a los 28 días | 20,116 |
| TTPa | + | ++ | – | Correlación con FMO, CID y mortalidad | 20,117,118 |
| AT-III | – | ++ | – | Predicen FMO y mortalidad | 20,119 |
| Proteínas C y S | – | ++ | – | Descenso de proteínas C y S predicen mala evolución y mortalidad | 20,120 |
| Daño vascular endotelial y/o vasodilatación | |||||
| Endocan | ++ | ++ | – | Se ha relacionado con gravedad (SG-SS) y mortalidad a los 28 días. Diagnóstico de sepsis frente a SRIS no infeccioso | 20,121 |
| Neopterina | + | ++ | ++ | Se relaciona con infección vírica y mortalidad a los 28 días. Orientación etiológica en NAC | 17–20,25,26,43,122,123 |
| Pro-ADMMR-proADM | + | +++++ | + | Se ha relacionado con gravedad (SG-SS) y mortalidad a las 3, 28, 90, 180 días. Asociación con escalas pronósticas de gravedad en NAC. Es el BM con mayor poder pronósticob de mortalidad | 17–20,43,49,124–130 |
| Pro-ANP | – | ++ | – | Se relaciona con mortalidad a los 28 días en pacientes con SS con depresión miocárdica y distensión auricular. Disfunción orgánica | 17–20,131 |
| Copeptina | – | ++ | – | Mortalidad a los 28 días y correlación con APACHEII | 18,20,132 |
| Óxido nítrico | + | ++ | – | Se ha relacionado con gravedad (SG-SS) | 18,20 |
| Otros BM | |||||
| FosfolipasaA2 tipoII | +++ | +++ | – | Se ha relacionado con S y bacteriemia con sensibilidad y especificidad >90%. Mortalidad a los 28 días. | 18,20,133 |
| Lactato | – | +++++ | + | Mejor marcador de hipoperfusión e hipoxia tisular. Predictor de mala evolución, gravedad (SG-SS) y mortalidad. Utilidad de seriación y medición del aclaramiento. Respuesta al tratamiento | 17,18,20,134–145 |
| Complemento (C3, C4, C5a) | + | ++ | – | Mortalidad a los 28 días. Distingue entre S y SRIS. No adecuado para el SUH | 18,20,146,147 |
Valoración estimada (–, +, ++, +++, ++++, +++++).
AB: antibiótico; AT: antitrombina; BMRIeI: biomarcadores de respuesta inflamatoria e infección; CID: coagulación intravascular diseminada; EPOC: enfermedad pulmonar obstructiva crónica; ET-1: endotelina-1; FMO: fracaso multiorgánico; IL: interleucina; NAC: neumonía adquirida en la comunidad; PCR: proteína C reactiva; PCT: procalcitonin; Pro-ANP: péptido natriurético atrial; S: sepsis; SG: sepsis grave; SOFA: Sepsis Related Organ Failure Assessment; SRIS: síndrome de respuesta inflamatoria sistémica; SS: shock séptico; sTREM-1 (triggering receptor expressed on myeloid cells); SUH: servicio de urgencias hospitalario; TNF: factor de necrosis tumoral; TTPa: tiempo de tromboplastina parcial activada; UCI: unidad de cuidados intensivos; VRC: valor de referencia del cambio clínico.
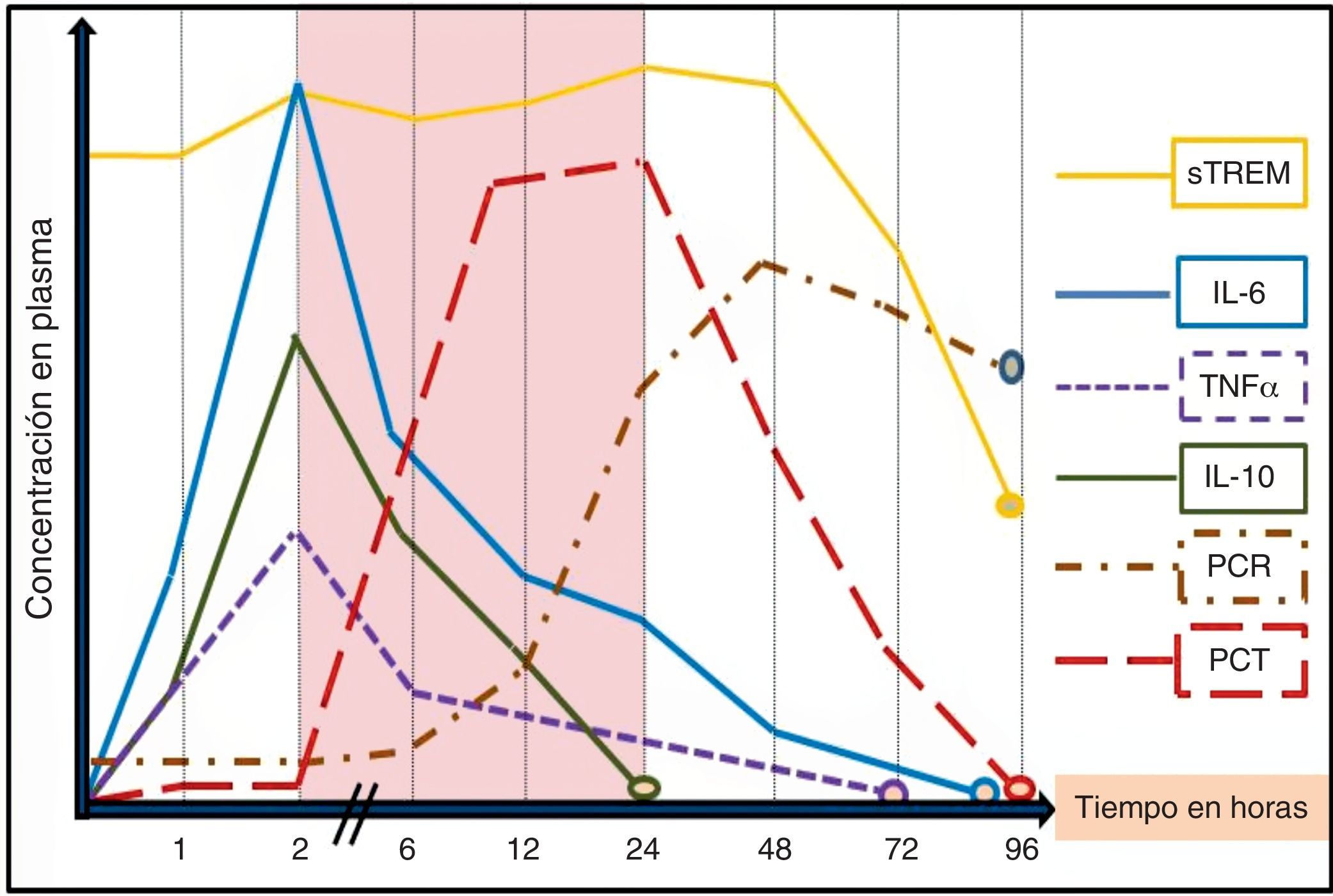
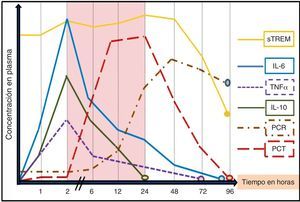
La utilidad de los BMRIeI estará determinada por la «necesidad» de ayuda que tenga el clínico para el diagnóstico de una infección o su pronóstico, la claridad de lo que se pretende conseguir con su determinación («saber para qué se solicita») y el entorno donde se realice la valoración (SUH, UCI, planta, posquirúrgicos, etc.)17, ya que este puede influir tanto por las características de los pacientes como por las posibilidades y por los medios para evaluarlos148. Además de la situación clínica, de las características y de la edad del paciente (algunos BMRIeI precisan ser ajustados en ancianos o neonatos), del foco o tipo de infección y microrganismo, del punto de corte adoptado (y por consiguiente una determinada sensibilidad, especificidad, VPP y VPN), se deben tener en cuenta otros factores importantes a la hora de interpretar los niveles de cada BMRIeI, ya que puede existir una gran variabilidad en los resultados17,18. Se debe considerar si el enfermo ha tomado AB durante las 72h previas (un tratamiento adecuado puede disminuir los valores)69,76,149 y el tiempo de evolución de la sintomatología y de la posible agresión bacteriana17,18. Junto a ello, la propia cinética de los BMRIeI (tiempo de pico máximo sanguíneo de respuesta del BM y vida media) condicionará su utilidad y determinará cuáles de ellos son los más indicados en los SUH (fig. 1). Por estos motivos se hará necesario repetir algunas determinaciones de los BMRIeI a las 6-12 o 24h en los SUH. Dado que la mayoría de los pacientes con fiebre e infección grave acuden al SUH entre las 6 y 48h posteriores al inicio de la sintomatología1,2,6, se estima que la ventana de tiempo entre la segunda y la vigésimo cuarta horas del inicio del estímulo bacteriano (zona sombreada en la fig. 1) sería el periodo clave para poder realizar un diagnóstico inicial precoz, valorar la gravedad con una medición aislada del BMRIeI y, así, poder iniciar cuanto antes la administración del AB adecuado y el resto de medidas terapéuticas2,17. En la figura 1 se reproduce la secuencia de liberación de los BMRIeI en modelos experimentales y humanos tras la administración de endotoxina de Escherichia coli en pacientes sanos o tras infundir en sangre sustancias contaminadas con bacterias. Tanto el factor de necrosis tumoral (TNF) como las interleucinas1 (IL-1), 6 (IL-6), 8 (IL-8) y 10 (IL-10) tienen una rápida respuesta y alcanzan su máximo nivel a las 2-3h. Sin embargo, estas moléculas tienen poca bioestabilidad y una vida media corta, por lo que podrían escapar fácilmente a una sola determinación, lo que limitaría su utilidad en los SUH17,18,20. La PCR tiene una cinética más lenta que la PCT, lo que la hace menos útil en el diagnóstico agudo inicial. Mientras que la PCT comienza a elevarse a las 2-3h después de la agresión bacteriana, la PCR lo hace a las 12h, justo cuando la PCT alcanza su máximo nivel. El hígado continúa sintetizando PCR durante varios días incluso cuando el estímulo inflamatorio ha desaparecido, por lo que puede estar elevada aun cuando la infección esté remitiendo. Además, existen múltiples procesos inflamatorios, agudos y crónicos, que pueden elevar sus niveles disminuyendo su sensibilidad y especificidad significativamente respecto a la PCT45, como se comentará posteriormente. La PCT se eleva en el torrente sanguíneo a las 2-6h tras el estímulo bacteriano y los valores máximos se encontrarán a las 12-36h, ya que tiene una semivida de 20-30h. Se considera que una reducción de 30-50% de PCT en sangre significa que el estímulo ha cesado o que el proceso está en resolución adecuada15,50,75. Por su parte, el sTREM1 tiene un patrón de respuesta más variable a partir de la segunda-tercera horas pero puede mantenerse elevado durante varios días (esto condiciona su utilidad diagnóstica precoz)109. La cinética del lactato dependerá de la existencia de hipoperfusión e hipoxia, por lo que, generalmente, cuando sus niveles se elevan ya nos muestra la existencia de disfunción orgánica y «no nos sirve para un diagnóstico precoz»135,136.
Interleucina 6La IL-6 es sintetizada por las células del sistema mononuclear-fagocítico y se convierte en un estímulo para la liberación de las proteínas de fase aguda. Destaca, junto a la IL-8, como la citoquina con mayor sensibilidad y especificidad para distinguir sepsis de un SRIS no infeccioso y por su poder predictivo de mortalidad30. Especialmente ha sido utilizada en urgencias de pediatría y neonatos (donde los niveles de PCT son fisiológicamente muy superiores a los valores normales en población adulta)39,51 con la ventaja de disponer de un test rápido para los SUH. También se ha demostrado (como con IL-8) su capacidad diagnóstica y pronóstica en neutropénicos31,32,97. Distintos autores han confirmado que la IL-6 posee mayor capacidad diagnóstica de sepsis en adultos que la IL-8, pero significativamente menor que la PCT38,60. En uno de estos estudios, Harbarth et al.60 encontraron para la PCT, la IL-6 y la IL-8 un área bajo la curva (ABC) de 0,92 (IC95%: 0,85-1) vs 0,75 (IC95%: 0,63-0,87) vs 0,71 (IC95%: 0,59-0,83) y sensibilidad y especificidad del 97 y 78, del 67 y 72, y del 63 y del 78%, respectivamente. Recientemente, Meynarr et al.38 publicaron en otro trabajo unos resultados superponibles.
sTREM1El receptor de superficie expresado en las células mieloides (sTREM1) es una molécula emparentada con las inmunoglobulinas que se encuentra en los neutrófilos y en los monocitos. Si bien hace años captó gran interés por los investigadores108,109 y se ha demostrado su incremento en pacientes con sepsis y su relación con la mortalidad y con la gravedad (evolución a SS), estudios posteriores le han adjudicado un menor poder predictivo que la PCT y otros BMRIeI110,111. También se han señalado sus mayores limitaciones en ancianos e inmunodeprimidos. Por ello y por su cinética (fig. 1), en la actualidad su utilidad es controvertida y se centra en las UCI20,110,111.
NeopterinaLa neopterina, un derivado de las pteridinas, es liberada por macrófagos activados que han sido estimulados por el interferón gamma. Se ha considerado como un marcador de infección vírica ya que en esta se eleva de forma más precoz y acentuada que en la infección bacteriana, con buena sensibilidad y especificidad18,20,25. Estudios recientes han corroborado esta utilidad de la neopterina para distinguir entre etiología vírica y bacteriana en infecciones respiratorias (especialmente en la neumonía)43,122,123, pero hay que recordar que también se eleva en las infecciones pulmonares por bacterias intracelulares. Su uso conjunto con la PCT puede elevar su capacidad y el rendimiento diagnóstico mutuo47, pero al evaluar su utilidad, alcanza su pico máximo tras varios días del inicio de la infección y, además, se ha relacionado con otras enfermedades no infecciosas20.
ProadrenomedulinaComo nuevo BMRIeI desde hace unos años se utiliza la proadrenomedulina (proADM). Dado que la medición de ADM es difícil (vida media corta y gran unión a receptores), se utiliza la región medial de la proADM (MRproADM), que tiene más estabilidad. Su concentración aumenta en las situaciones de estrés celular y es reconocida como BMRIeI, pero también de otras enfermedades, entre las que destacan las cardiovasculares17-20. La MRproADM se ha mostrado superior respecto a la PCT en la capacidad predictiva de mortalidad a corto (7-30días) y a medio plazo (90-180días)6 e incluso en estudios con seguimiento de un año130. La mayoría de los estudios publicados de MRproADM evaluaron su capacidad predictiva de riesgo de mortalidad en pacientes con neumonía adquirida en la comunidad (NAC)126-130 de forma independiente o combinada con las escalas pronósticas (PSI, CURB-65) con excelentes resultados. También se demostró su utilidad en el diagnóstico de infección bacteriana frente a la vírica49, de sepsis y su evolución a SS124,125 y como predictor de bacteriemia43. Un aspecto importante de la MRproADM es que sus niveles aumentan con la edad, hecho que hay que tener en cuenta y «corregir» en los mayores de 70años127,152. En un estudio de Christ-Crain et al.125 que comparó MRproADM, PCT, IL-6 y PCR en 101 pacientes con SRIS (de ellos 53 con SG-SS) con 160 controles sanos se comprobó que los niveles de MRproADM (nmol/l) al ingreso son superiores en los SRIS, sepsis, SG-SS ([1,1, rango 0,3-3,7], [1,8, rango 0,4-5,8] y [2,3, rango 1-17,6]), respectivamente, con los de pacientes sanos de la misma edad (0,4, rango 0,21-0,97), con p<0,01. En los pacientes que fallecieron con SG-SS la MRproADM al ingreso era significativamente mayor (p<0,001) que en los que sobrevivieron (8,5nmol/l; 0,8-21) vs (1,7nmol/l; 0,4-17,6), consiguiendo en análisis ROC un ABC de 0,81 similar a la escala de gravedad APACHEII.
LactatoEs considerado el mejor marcador de hipoperfusión e hipoxia tisular, su obtención es rápida y barata y está incluido en todas las recomendaciones de valoración de los pacientes con sepsis, SG y SS en los SUH5,6. Por otro lado, hay que remarcar que el lactato no es un BMRIeI que nos ayude a diferenciar la sepsis de un SRIS no infeccioso, sino que su utilidad se centra en la demostración de hipoperfusión tisular y la valoración de la respuesta al tratamiento en los SUH.
En la tabla 3 se muestran algunos estudios relevantes en los SUH con distintos puntos de corte de lactato. Kruse et al.136, en una revisión sistemática reciente establecieron que todos los pacientes con lactato >2,5mmol/l deben ser estrechamente vigilados y monitorizados clínicamente en el SUH, pues dicho valor es un predictor independiente de gravedad (SG-SS), mala evolución clínica y mortalidad. Del mismo modo concluyeron que la correlación entre los niveles de lactato arterial, venoso periférico y capilar es aceptable, por lo que, como refieren también otros autores7,142,144,145, se recomendaría realizar el lactato venoso como medición inicial y realizar una muestra arterial si el resultado es >2,5 mmol/l7,136. No obstante, y como ocurre con el resto de BMRIeI, distintos estudios han señalado el mayor rendimiento pronóstico cuando se combinan varios BMRIeI. Green et al.135 encontraron en pacientes adultos con procesos infecciosos valorados en los SUH que cuando el lactato es ≥4mmol/l y la PCR ≥10mg/dl el riesgo de muerte a los 28días es muy alto (odds ratio [OR]: 12.3; IC95%: 6,8-22,3). Otro aspecto importante fue comprobar que el aclaramiento del lactato en las 6 primeras horas tras recibir el tratamiento se relacionaba con el pronóstico143, de forma que por cada 10% de aclaramiento del lactato que se consigue, se disminuye un 11% la probabilidad de morir139.
Estudios relevantes del lactato elaborados en los SU en pacientes con infección
| Características básicas del estudio | Muestra (número pacientes) | Características de la muestra de lactato | Objeto del estudio | Puntos de corte (mmol/l) | Resultados | Autor - referencia |
| Prospectivo observacional | 1.278 de más de 18 años diagnosticados de infección | Sangre venosa en urgencias | Mortalidad a los 3 y 28 días | 0-2,5 2,5-4>4 | Mortalidad a los 3 días:1,5% (si 0-2,5mmol/l) con una S: 76% y E: 71%4,5% (si 2,5-4mmol/l) y 22,4% (si >4mmol/l) con una S y E del 91% (IC95%, 90-93%)Mortalidad a los 28 días:4,9% (si 0-2,5mmol/l)9% (si 2,5-4mmol/l) con S: 59% y E: 71%28,4% (si >4mmol/l) con S: 36% y E: 92% | Shapiro et al.137 |
| Prospectivo observacional | 1.287 diagnosticados de infección | Sangre venosa en urgencias | Mortalidad a los 28 días | <2,52,5-4>4 | El lactato predice mortalidad independientemente de la PA (p<0,0001). Si >4mmol/l en pacientes con SS la mortalidad es del 28,8% y en pacientes sin SS del 26,5%. (ABC=0,87). Cuando aún no hay hipoPA (hipoperfusión oculta) un lactato de >4mmol/l traduce hipoxia periférica y se relaciona con mortalidad muy elevada | Howell et al.141 |
| Retrospectivo | 1.655 con 65 o más años con y sin infección | Muestra en urgencias | Mortalidad a los 30 y 60días | 2 | En pacientes ≥65 años con infección un lactato de ≥2mmol/l fue asociado con un RR de mortalidad durante la hospitalización de 1,9-3,6 cuando se comparaba con los pacientes con lactato <2mmol/l. A los 30días de 1,7-2,6 y a los 60 días de 1,4-2,3 (p<0,01) | Del Portal et al.134 |
| Prospectivo observacional | 1.177 de más de 18años con infección o sepsis (707 de urgencias) | Sangre venosa en urgencias | Mortalidad a los 3días | 4 | Grupos según los niveles de lactato iniciales: bajo de 0-2; intermedio de 2,1-3,9 y alto ≥4mmol/l. Según esto se estima la posible mortalidad en el hospital de los grupos del 15, del 25 y del 38% Pacientes con lactato >4mmol/l tienen un OR: 6,1 (3,7-10,5) de muerte para los 3 primeros días con S: 35% y E: 92% y ABC 0,63.La mortalidad hospitalaria con lactato >4mmol/l se presenta con OR: 3 (2-4,6) con S: 19% y E: 93% | Trzeiak et al.140 |
| Prospectivo observacional | 111 pacientes de más de 18años con SG o SS | Sangre arterial en urgencias y seriación a las 6h | Mortalidad a los 60días | – | Pacientes tratados en urgencias donde se comprueba un aclaramiento del lactato >10% a las 6h tienen mayor supervivencia que en los que el aclaramiento es <10% (p=0,005) con S: 44,7% y E: 84,4%.Por cada 10% de aclaramiento del lactato inicial disminuye un 11% la probabilidad de morir | Nguyen et al.139 |
| Prospectivo observacional | 830 pacientes adultos con SG en urgencias | Sangre venosa en urgencias | Mortalidad a los 28días | <22-3,9≥4 | El grupo con lactato 2-3,9mmol/l sin SS o con SS se asociaba a una mayor mortalidad con una OR de 2,05 (p=0,024) y OR de 3,27 (p=0,022), respectivamente.El grupo con lactato ≥4mmol/l se asocia a mayor mortalidad tanto sin SS como con SS con la misma OR: 4,87 (p=0,001).Es decir, independientemente de la disfunción clínica y existencia o no de shock, un lactato de >2mmol/l se asocia a mayor mortalidad | Mikkelsen et al.138 |
ABC: área bajo la curva; E: especificidad; OR: Odds ratio; PA: presión arterial; RR: riesgo relativo; S: sensibilidad; SG: sepsis grave; SS: shock séptico; SU: servicio de urgencias.
La PCR es una proteína de fase aguda liberada en los hepatocitos tras la estimulación de la IL-6 e IL-8 en respuesta a cualquier tipo de inflamación aguda, incluyendo infecciones víricas, bacterianas localizadas y otros procesos inflamatorios, y está involucrada en diferentes funciones inmunológicas20. Desde hace décadas ha sido clásicamente el BMRIeI de referencia de respuesta inflamatoria sistémica (tabla 2), pero plantea bastantes limitaciones y su capacidad diagnóstica (de infección bacteriana, sepsis, SG-SS) y pronóstica (bacteriemia, mortalidad) son insuficientes17,18,45 (salvo que no se disponga de otro BMRIeI), aunque sí superiores a síntomas como la fiebre o el recuento leucocitario45-48. Entre sus debilidades se encuentran su cinética (fig. 1) y su elevación en múltiples procesos infecciosos y no infecciosos45,49. Sus valores normales (0-8mg/l) dependen de la edad, del sexo y de la raza, de forma que para mujeres de 25-70años se fija su límite superior normal sumando 7mg/l al cociente edad/65, y para hombres de 25-70años sumando 1mg/l al cociente edad/65. A partir de los 70 años se sube a 10mg/l el límite superior26,47. No obstante, se han publicado estudios que consiguen resultados muy superiores al utilizar la PCR conjuntamente con otros BMRIeI y con las escalas pronósticas de gravedad126,135, como se puede comprobar en una revisión reciente sobre la utilidad de los BMRIeI en la NAC153.
ProcalcitoninaLa PCT, precursor polipeptídico de la calcitonina, es una proteína sintetizada primordialmente en la glándula tiroides y las células neuroendocrinas del pulmón (células de Kultschitzky). En condiciones normales toda su producción es procesada, por lo que en personas sanas su concentración habitual es casi indetectable (0,043ng/ml en hombres y 0,038ng/ml en mujeres)54,55 y se consideran valores normales a concentraciones <0,05ng/ml51,54,55. Pero se ha visto que muchos otros tejidos pueden producir PCT en situaciones de infección bacteriana y sepsis, incluso en pacientes tiroidectomizados, y sus niveles tienen relación con la carga bacteriana (concentración de endotoxina). Se ha considerado que las citoquinas y las endotoxinas liberadas en los procesos bacterianos inhiben el paso final de PCT a calcitonina, hecho que origina que esta aumente específicamente51. En la tabla 4 se muestran distintos puntos de corte para los métodos sensibles cuantitativos y las situaciones donde estos se deben corregir. Se debe recordar que en muchos SUH y otros dispositivos asistenciales de urgencias se utilizan técnicas semicuantitativas que asignan los valores en intervalos (<0,5, 0,5-2, 2-10 y >10ng/ml de PCT). Si este es el método disponible, también resulta útil, pues tiene gran capacidad diagnóstica y pronóstica para sepsis, SG y SS, bacteriemia, mala evolución clínica y otras funciones44,46,82. En trabajos recientes, Oh et al.82 y Julián et al.46 confirmaron la utilidad de la PCT semicuantitativa que ofrece una sensibilidad y una especificidad mayores del 90% con PCT>2 ng/ml y un ABC de 0,916 (IC95%: 0,83-0,96) para distinguir sepsis, SG y SS de SRIS no infeccioso, y si PCT>10ng/ml con sensibilidad del 98% y especificidad del 87%. De especial interés para los clínicos resulta definir el porcentaje de variación entre 2 mediciones de PCT que nos pueda indicar con seguridad la progresión de la respuesta inflamatoria y la infección, así como un valor numérico fijo comparativo entre 2 mediciones que nos señale que realmente existe evolución en la situación clínica (favorable o no). Estos son, por un lado, el aclaramiento de PCT (30-50% de ascenso o descenso son muy significativos de progresión o resolución, y si estos son del 100% alcanzan una probabilidad del 99%)15,50,55 y, por otro lado, el valor de referencia de cambio clínico (VRC), estimado en 0,45ng/ml54,55, que evita la variabilidad interpersonal y los posibles errores de laboratorio con las técnicas cuantitativas. De forma que si se encuentra una variación entre 2 mediciones de PCT mayor al VRC, siempre habrá que considerar una evolución clínica (mejoría o empeoramiento). Suberviola et al.50 demostraron que la determinación seriada de PCT predecía mejor que una determinación única el pronóstico en los pacientes con SS, de forma que el aclaramiento del 70% a las 48-72h discriminaba la supervivencia hospitalaria con sensibilidad del 94,7% y especificidad del 53%. A la PCT se le han reconocido todas las funciones y utilidades enumeradas en la tabla 1, y dada su particular cinética (elevación precoz a las 4-6h, pico máximo a las 12h, vida media 20-36h) resulta muy útil para tomar decisiones de cribado en la atención al paciente sospechoso de padecer una infección bacteriana15,17. Un aspecto muy interesante de este BMRIeI es que su capacidad diagnóstica y predictiva se mantiene en caso de enfermos con insuficiencia renal94, cirrosis96, oncohematológicos y neutropénicos97-99, ancianos100-103 o con enfermedades autoinmunes o reumatológicas104,105.
PCT: puntos de corte, valores normales, falsos positivos y negativos
| Puntos de corte de PCT (ng/ml):Sanos <0,05Posible infección bacteriana >0,1Probable infección bacteriana >0,25Posible sepsis (gravedad clínica) >0,5Probable bacteriemia >1-2Posible SG-SS >5-10ng/mlPacientes con infección viral <0,5Pacientes con infección bacteriana localizada <0,5Inflamación crónica y enfermedades autoinmunes <0,5 | FP o situaciones donde la PCT puede estar elevada:Neonatos (a partir de 48-72h regresan a valores normales)Trauma grave o cirugía mayor reciente (considerar IB si PCT>1,5-2ng/ml o si existe un aumento entre 2 mediciones de VRC (0,45ng/ml) o del 50% del valor inicialInvasión fúngica masiva (puede mostrar niveles >2-5ng/ml)Shock cardiogénico grave (considerar IB si PCT>2-5ng/ml o si existe un aumento entre 2 mediciones de VRC o del 30-50% del valor inicial)Infección por Plasmodium falciparum (puede mostrar niveles >2-5ng/ml)Anomalías importantes de perfusión (considerar IB si PCT>2-5ng/ml o si existe un aumento de VRC o entre 2mediciones del 30-50% del valor inicial)Carcinoma medular de tiroides (puede mostrar niveles muy altos)Carcinoma microcítico de pulmón (puede mostrar niveles muy altos)Síndrome carcinoide (puede mostrar niveles altos)Isquemia mesentérica y pancreatitis (considerar IB si PCT>2-5ng/ml o si existe un aumento entre 2 mediciones de VRC del 30-50% del valor inicial) |
| FN o situaciones donde la PCT puede estar en rangos normales existiendo una infección:Fases precoces de la infección (6primeras horas). Repetir determinación a las 6-12 o 24hInfección localizada (empiema, absceso)Endocarditis subaguda-crónicaInfecciones por bacterias intracelulares |
FN: falsos negativos; FP: falsos positivos; IB: infección bacteriana; PCT: procalcitonina; SG: sepsis grave; SS: shock séptico; VRC: valor de referencia de cambio clínico.
Adaptada de las referencias 45,46,51,56.
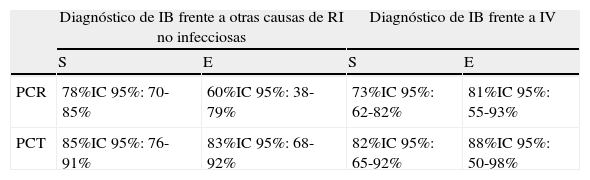
Se trata de la comparación entre 2BMRIeI más estudiada, evaluada y validada en centenares de estudios34,37,38,43,46,49,58-63 y revisiones44,45,47,64-66, por lo que se constituye en una clara referencia cuando se comparan distintos BMRIeI17,18,20, pero pocas veces orientada a los SUH18. Simon et al.44 elaboraron un metaanálisis clásico de 22estudios y 1.386pacientes para evaluar la PCR y la PCT. Seguidamente publicaron una fe de erratas45 sobre el mismo que cambió datos del texto y del abstract (probablemente los más difundidos de su manuscrito que no han sido corregidos por otros autores), pero no así las conclusiones y la discusión, donde la PCT se muestra claramente superior a la PCR (tabla 5) para distinguir infección bacteriana tanto de otras causas de respuesta inflamatoria como de infección vírica. Otras revisiones más recientes47,64,65 han confirmado estas conclusiones respecto a la superioridad de la capacidad diagnóstica de la PCT para sospechar infección bacteriana, sepsis, SG y SS. Aunque alguna revisión sistemática (Tang et al.66) minimiza el valor de PCT, y no la recomendaría de rutina, esta se basa en pacientes de 18estudios de los cuales solo 3 (440pacientes en total) proceden del SUH, por lo que estas limitaciones no permiten sacar conclusiones definitivas. Otro metaanálisis sobre 25estudios y 2.966pacientes de otro tipo (politraumatizados y posquirúrgicos) elaborado por Uzzan et al.154 obtuvo para la PCT una OR de 15,7 (IC95%: 9,1-27,1) frente a la de PCR de 5,4 (IC95%: 3,2-9,2), p<0,0001, y también encontraron diferencias significativas con superioridad de la PCT entre las infecciones bacterianas y las infecciones víricas. En este sentido, un estudio español46 en 300pacientes con SRIS de causa no infecciosa, 100 con sepsis y 30 con SG y SS, demostró que la elevación de la PCT es más sensible y específica que la PCR. Este artículo concluyó que si la PCT es >2 ng/ml se debería ingresar al paciente, obtener hemocultivos y administrar AB de forma inmediata. Esto es debido a que cuando la PCR>60mg/l y la PCT>2ng/ml la probabilidad de sepsis es >90%, y cuando la PCR>90mg/l y la PCT>10ng/ml esta se eleva a más del 98%. Además, cuando la PCT es superior a 2ng/ml se asocia significativamente (p<0,05) con mayor gravedad clínica (SG-SS), mayor mortalidad a los 30días (21% vs 8%), mayor tasa de ingresos (88% vs 36%), mayor estancia hospitalaria (8,5 vs 5,5 días) y mayor tasa de bacteriemia comprobada (20% vs 2%).
Comparación de la proteína C reactiva frente a procalcitonina
| Diagnóstico de IB frente a otras causas de RI no infecciosas | Diagnóstico de IB frente a IV | |||
| S | E | S | E | |
| PCR | 78%IC95%: 70-85% | 60%IC95%: 38-79% | 73%IC95%: 62-82% | 81%IC95%: 55-93% |
| PCT | 85%IC95%: 76-91% | 83%IC95%: 68-92% | 82%IC95%: 65-92% | 88%IC95%: 50-98% |
E: especificidad; IB: infección bacteriana; IC: intervalo de confianza; IV: infección viral; RI: respuesta inflamatoria; S: sensibilidad.
Adaptada de Simon et al.45. Erratum in: Clin Infect Dis. 2005;40:1386-8.
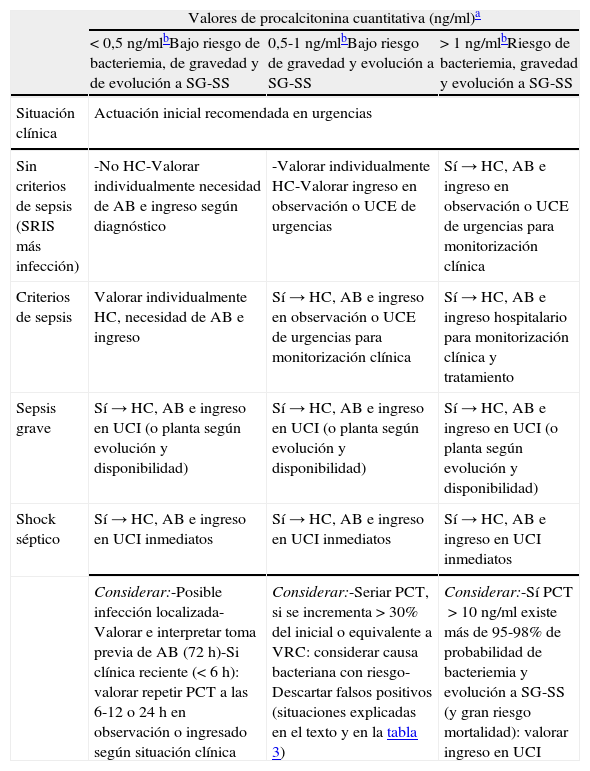
En la valoración del paciente con una infección es muy importante la sospecha y la detección de bacteriemia, ya que esta tiene un significado diagnóstico, pronóstico y obliga a cambiar algunas de las decisiones más importantes (alta-ingreso, extraer hemocultivos, administrar AB adecuado y precoz, etc.)2,155. Por ello, encontrar un modelo predictivo de bacteriemia útil y aplicable en los SUH que evite altas improcedentes e ingresos innecesarios156, y sus consecuencias, se ha convertido en el objetivo de muchos autores que combinan distintas variables clínicas, epidemiológicas y analíticas entre las que se incluyen los BMRIeI, ya que aumentan significativamente el poder predictivo de dichos modelos85-93. La propuesta de Tudela et al.86, que relacionó variables clínicas, analíticas y el índice de comorbilidad de Charlson, consiguió un VPN>95% (IC95%: 90,8-97,6) con una PCT>0,4 ng/ml y un índice de Charlson≥2, lo que la convierte en una opción muy interesante. Otros autores han realizado estudios en la misma línea incluso con puntos de corte muy bajos (PCT de 0,147ng/ml con VPN del 98%)89. Caterino et al.100 llegaron a reducir (para los mayores de 65años) el punto de corte a 0,2ng/ml con VPN97% (IC95%: 92-100). En cualquier caso, ante los distintos modelos, la duda lógica surge al establecer el punto de corte de la PCT>0,4ng/ml, como se establece en algunos modelos, o con PCT>1 o 2ng/ml, como recomiendan otros autores87,93. Por otro lado, se comprobó que al añadir la situación clínica (sepsis, SG o SS) y la PCT al modelo predictivo clásico de Shapiro et al.28 en el SUH, también se mejoró la predicción de bacteriemia (con PCT>2ng/ml predice peor evolución clínica y probabilidad del 20% de bacteriemia). En otro estudio sobre 984 pacientes en urgencias con sospecha de bacteriemia se encontró el 1% de hemocultivos positivos cuando la PCT era <0,5ng/ml, el 8% si PCT era 0,5-2ng/ml, el 20% si >2ng/ml y el 46% cuando era >10ng/ml. Y también se encontraron diferencias significativas relacionando la existencia de bacteriemia con la situación clínica, de forma que los pacientes con sepsis tuvieron el 13% de bacteriemia confirmada, con SG el 28% y con SS el 38%, lo que demostró la relación entre bacteriemia, los niveles de PCT>0,5ng/ml y la situación clínica (sepsis, SG o SS)46,57,89. A partir de todo lo comentado proponemos unas recomendaciones de actuación ante los pacientes con sospecha de infección bacteriana grave y/o bacteriemia para los SUH (tabla 6).
Recomendaciones de actuación en los pacientes con sospecha de infección bacteriana con repercusión sistémica y/o bacteriemia en los servicios de urgencias
| Valores de procalcitonina cuantitativa (ng/ml)a | |||
| < 0,5 ng/mlbBajo riesgo de bacteriemia, de gravedad y de evolución a SG-SS | 0,5-1 ng/mlbBajo riesgo de gravedad y evolución a SG-SS | > 1 ng/mlbRiesgo de bacteriemia, gravedad y evolución a SG-SS | |
| Situación clínica | Actuación inicial recomendada en urgencias | ||
| Sin criterios de sepsis (SRIS más infección) | -No HC-Valorar individualmente necesidad de AB e ingreso según diagnóstico | -Valorar individualmente HC-Valorar ingreso en observación o UCE de urgencias | Sí → HC, AB e ingreso en observación o UCE de urgencias para monitorización clínica |
| Criterios de sepsis | Valorar individualmente HC, necesidad de AB e ingreso | Sí → HC, AB e ingreso en observación o UCE de urgencias para monitorización clínica | Sí → HC, AB e ingreso hospitalario para monitorización clínica y tratamiento |
| Sepsis grave | Sí → HC, AB e ingreso en UCI (o planta según evolución y disponibilidad) | Sí → HC, AB e ingreso en UCI (o planta según evolución y disponibilidad) | Sí → HC, AB e ingreso en UCI (o planta según evolución y disponibilidad) |
| Shock séptico | Sí → HC, AB e ingreso en UCI inmediatos | Sí → HC, AB e ingreso en UCI inmediatos | Sí → HC, AB e ingreso en UCI inmediatos |
| Considerar:-Posible infección localizada-Valorar e interpretar toma previa de AB (72h)-Si clínica reciente (<6h): valorar repetir PCT a las 6-12 o 24h en observación o ingresado según situación clínica | Considerar:-Seriar PCT, si se incrementa >30% del inicial o equivalente a VRC: considerar causa bacteriana con riesgo-Descartar falsos positivos (situaciones explicadas en el texto y en la tabla 3) | Considerar:-Sí PCT>10ng/ml existe más de 95-98% de probabilidad de bacteriemia y evolución a SG-SS (y gran riesgo mortalidad): valorar ingreso en UCI | |
AB: antibiótico; HC: hemocultivos; PCT: procalcitonina; SG: sepsis grave; SRIS: síndrome de respuesta inflamatoria sistémica; SS: shock séptico; UCE: unidad de corta estancia; UCI: unidad de cuidados intensivos; VRC: valor de referencia del cambio clínico (0,45ng/ml).
Adaptada de las referencias 45,46,86,87,92.
En caso de utilizar PCT con valoración semicuantitativa los intervalos serán ajustados (<0,5; 0,5-2 y >2 ng/ml).
Independientemente del valor de PCT: si lactato >2-2,5 mmol/l indica gravedad (investigar causas infecciosas y no infecciosas); si lactato >4 mmol/l indica alta probabilidad de muerte (actuar como etiología bacteriana con riesgo hasta confirmar o descartar). Ambas situaciones (unidas a las recomendaciones de la PCT) nos obligan a estrecha vigilancia clínica y seriación de los niveles de lactato.
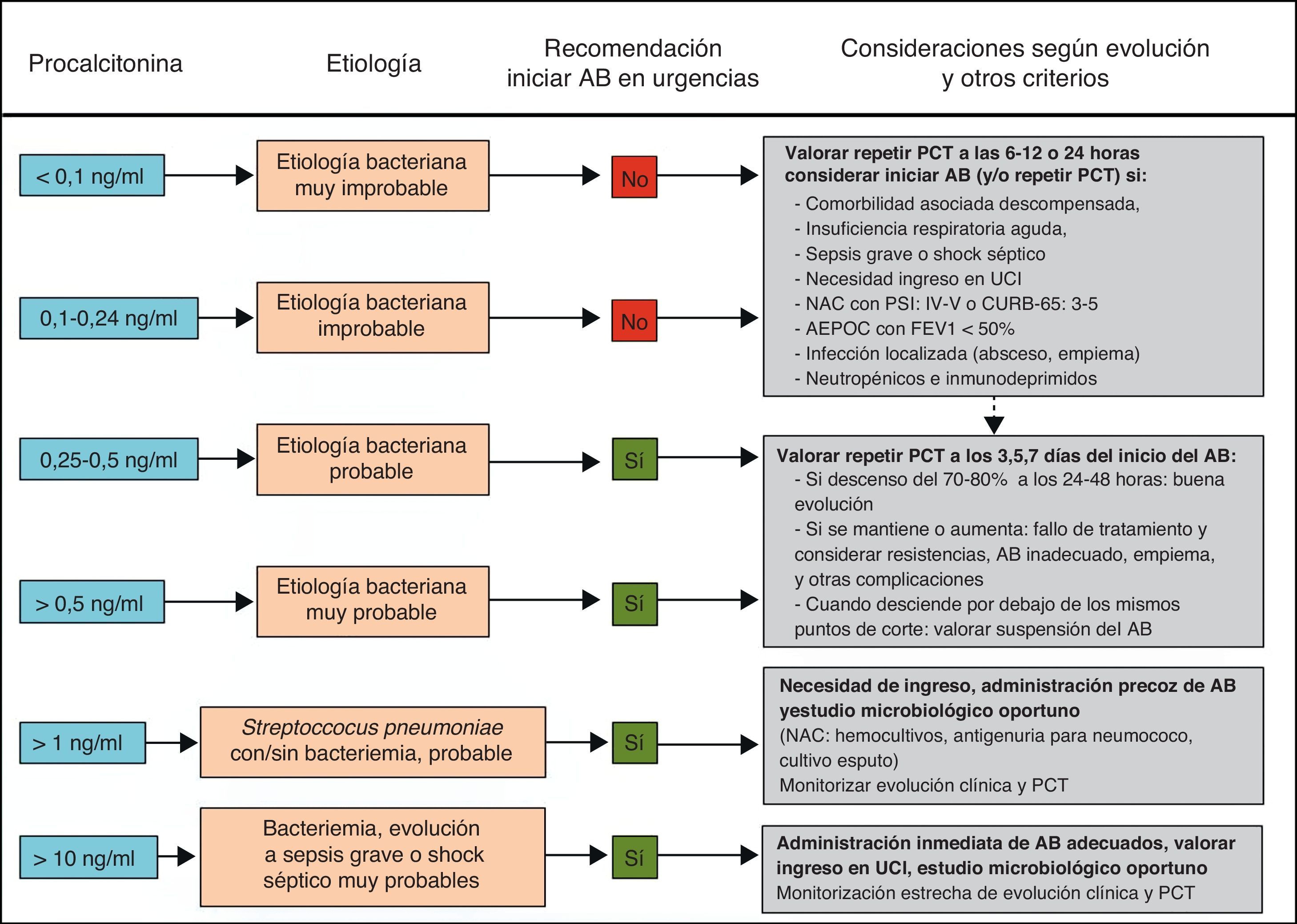
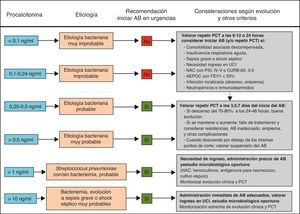
Distintos estudios han demostrado las ventajas del tratamiento guiado por la PCT a la hora de evitar la prescripción innecesaria de AB en procesos donde existe la duda de que la etiología sea bacteriana y para reducir la duración del tratamiento cuando este puede ser excesivo69-81. De esta forma, la estrategia terapéutica basada en la PCT podría reducir el uso de los AB sin empeorar la supervivencia y lograr una disminución de las resistencias, los costes y los posibles efectos adversos en los pacientes71,76,157-159. Los 2 campos de acción más estudiados para estas indicaciones son los pacientes críticos con sepsis74-76 y las infecciones respiratorias bajas (fundamentalmente la NAC73,77-79,81 y la agudización de la EPOC80). Una PCT<0,25ng/ml desaconsejaría la administración inicial de AB ante la baja probabilidad de etiología bacteriana o recomendaría su supresión ante la aparente resolución del cuadro en pacientes con NAC70-72. En el caso de pacientes críticos de vigilancia intensiva el punto de corte de PCT para estas decisiones sería de 0,5ng/ml. Con estas guías se ha podido reducir el tiempo de tratamiento de la NAC y en pacientes con sepsis69-71. En un novedoso estudio con pacientes críticos (307 con tratamiento guiado por PCT y 311 sin PCT76) se observó una diferencia de duración de tratamiento con AB en la UCI de 14,3±9,1días a 11,6±8,2días cuando se realizaba este con la guía de la PCT, p<0,0001. A partir de distintas revisiones recientes71-73,81 proponemos un algoritmo de actuación ante las infecciones respiratorias bajas guiadas por la PCT (fig. 2).
Algoritmo de recomendaciones guiadas por PCT en infecciones respiratorias del tracto inferior en los servicios de urgencias hospitalarios.
AEPOC: agudización de la enfermedad pulmonar obstructiva crónica; AB: antibiótico/s; FEV1: volumen espiratorio forzado en el primer segundo; NAC: neumonía adquirida en la comunidad; PCT: procalcitonina; PSI: Pneumonia Severity Index; UCI: unidad de cuidados intensivos.
Adaptada de las referencias 71–73,81.
Últimamente se han publicado numerosos estudios y recomendaciones en relación a la utilidad de los BMRIeI en la NAC153,160,161 que han incluido, entre otros, a la PCR, la IL-6, la IL-8, la proendotelina-1, la copeptina, el dímero D, la proANP, el sTREM-1, etc. Pero entre ellos destacan la MRproADM126-131, con resultados comparables a las escalas pronósticas de gravedad (EPG) en cuanto a la estimación de mortalidad a los 28-30, 90, 180 y 365días, y la PCT, muy sensible y específica para predecir infección bacteriana en la NAC153,158, su evolución clínica (a SG-SS)162, la posibilidad de bacteriemia163, la mortalidad, para poder orientar hacia el patógeno causante de la NAC83,122,123 (según punto de corte elegido) y para servir de guía de inicio, duración y fracaso del tratamiento AB71-73,81. Las últimas guías de práctica clínica publicadas de NAC de distintas sociedades incorporan los BMRIeI como criterios adicionales a considerar con mayor o menor intensidad164-167. En cuanto a la orientación etiológica se encuentra mayor inflamación sistémica y niveles más elevados de BMRIeI en las NAC con bacteriemia por Streptococcus pneumoniae que progresan a SG o SS. Este patógeno hay que sospecharlo como causante de la NAC si la PCT es >2ng/ml, y en esta situación habría que cubrir empíricamente la posibilidad de una NAC bacteriémica83,122,123,168.
Respecto a la valoración pronóstica de la NAC, la combinación de los BM (PCR, MRproADM o PCT) con las EPG ha demostrado aumentar la capacidad predictiva de estas, por lo que si están disponibles en los SUH podrían mejorar la adecuación de los ingresos en la NAC161,169-172. Menéndez et al.172 demostraron que al añadir la PCR (>25mg/ml) y/o la PCT (>0,5ng/ml) como BMRIeI al PSI (0,81; IC95%: 0,75-0,87) o al CURB65 (0,82; IC95%: 0,76-0,89) se incrementaba el valor predictivo de estas EPG, y esta mejora era aún mayor cuando se combinaban ambos BM con una EPG (PSI+PCR+PCT [0,85; IC95%: 0,79-0,91]) o ambas EPG con un BM (PSI+CURB65+PCR [0,88; IC95%: 0,83-0,93]). Por su parte, Krüger et al.126 encontraron que la MRproADM con un punto de corte de 0,95nmol/l (menor que otros autores) y la PCT (>0,48ng/ml), junto con las EPG y el buen uso del juicio o experiencia del clínico, se convertían en el mejor modelo predictivo de mortalidad a los 28 y 180días.
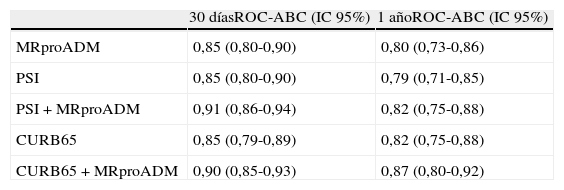
Recientemente, Albrich et al.129 dieron a conocer los resultados de la EPG conocida como CURB65A (que añadía la MRproADM al CURB65) que establecía 3grupos de riesgo: clasei (CURB65 0-1 y MRproADM≤0,75nmol/l) con riesgo bajo de mortalidad y de desarrollo de episodios adversos (0,65 y 3,9%, respectivamente) donde se recomendaba el alta; clase ii (CURB65 2 y MRproADM≤1,5 nmol/l o CURB65 0-1 y MRproADM≤0,75-1,5nmol/l) con riesgo moderado (2,6% de riesgo de mortalidad y 8,6% de riesgo de episodios adversos) donde se indicaba el ingreso en la unidad de corta estancia (UCE)-observación del SUH; clase iii: riesgo alto (MRproADM>1,5nmol/l con cualquier CURB65) en el que se recomendaba la hospitalización. Bello et al.130, en un estudio prospectivo de cohortes de 228 pacientes con NAC también consiguieron aumentar significativamente el poder predictivo a corto y a largo plazo de las EPG PSI y CURB65 (tabla 7).
Capacidad predictiva de mortalidad de los biomarcadores en la NAC
| 30 díasROC-ABC (IC95%) | 1 añoROC-ABC (IC95%) | |
| MRproADM | 0,85 (0,80-0,90) | 0,80 (0,73-0,86) |
| PSI | 0,85 (0,80-0,90) | 0,79 (0,71-0,85) |
| PSI + MRproADM | 0,91 (0,86-0,94) | 0,82 (0,75-0,88) |
| CURB65 | 0,85 (0,79-0,89) | 0,82 (0,75-0,88) |
| CURB65 + MRproADM | 0,90 (0,85-0,93) | 0,87 (0,80-0,92) |
MRproADM: región medial de la proadrenomedulina; NAC: neumonía adquirida en la comunidad; PSI: Pneumonia Severity Index; ROC-ABC: Receiver Operating Characteristic-área bajo la curva.
PCT en el análisis ROC para mortalidad a corto y largo plazo con p<0,0001.
Adaptada de Bello et al.130.
La combinación de los BMRIeI con las EPG se considera la asociación con mayor poder predictivo, pero no se debe olvidar el considerar si el paciente ha recibido tratamiento AB previamente, ya que esta situación altera la interpretación y el valor predictivo tanto de las EPG como de los BM. En este sentido, Krüger et al.149 concluían su estudio afirmando que los niveles de PCT, PCR y leucocitos son predictores de mortalidad a los 28días en pacientes sin tratamiento AB previo, pero no si el paciente lo estaba recibiendo en las 72h anteriores.
En otros procesos infecciososMeningitis agudasEl punto de corte de la PCT para distinguir una meningitis bacteriana aguda (MBA) de una vírica (MVA) es muy variable según los distintos autores (de 0,2 a 5ng/ml con sensibilidad y especificidad mayores del 90%)173-178. Algunos señalan valores entre 0,2-0,5ng/ml de PCT como los óptimos para el diagnóstico de sospecha173,175, con especificidad y VPN del 90%. Otros, como Ray et al.174, aplicando un valor de 2,13ng/ml de PCT consiguieron una sensibilidad del 87%, una especificidad del 100%, un VPP del 100% y un VPN del 99%. También cuando la PCT es >2 ng/ml (p<0,05) se pueden distinguir una MBA (por Streptococcus pneumoniae o Neisseria meningitidis) de una MVA176,177, e incluso cuando la PCT es superior a 10ng/ml en estos pacientes sugiere con gran probabilidad la existencia de bacteriemia y una evolución clínica a SG-SS y su ingreso en la UCI, como han demostrado otros estudios176. A la vista de estos resultados, siempre se debería considerar una MBA en los SUH cuando la PCT inicial sea >0,25ng/ml y así obtener las pruebas microbiológicas pertinentes179 y administrar la cobertura AB adecuada de forma inmediata2.
Infecciones del tracto urinarioEl interés en estos procesos se ha centrado en distinguir las infecciones del tracto urinario (ITU) no complicadas de los casos de pielonefritis agudas (PNA) y sepsis de origen urológico46,93. Van Nieuwkoop et al.180, en un estudio de 581 pacientes adultos encontraron que para distinguir una ITU no complicada de una PNA con una PCT>0,25ng/ml se obtenía una sensibilidad del 95% (IC95%: 0,89-0,98) y una especificidad del 50% (IC95%: 0,46-0,55), por lo que una PCT>0,25ng/ml debe hacer sospechar PNA, y valores >1-2ng/ml, bacteriemia y sepsis urológica46,93.
Perspectivas de futuroJunto con los nuevos BMRIeI que se están evaluando, en la actualidad se estudia con interés por distintos grupos la relación entre los niveles de BMRIeI con la carga bacteriana y la concentración de endotoxina, con el objeto de poder poner en marcha terapias neutralizantes de las mismas de forma precoz y así poder modular la respuesta inflamatoria y mitigar la amplificación de la señal de los mediadores implicados en la cascada inflamatoria. En esta línea iría el uso de eritoran tetrasódico para bloquear el reconocimiento de los patógenos en la unión de los toll-like receptors específicos (TLR-4) con la endotoxina a nivel extracelular, los anticuerpos anti-PCT que disminuyen la toxicidad de la misma y la multiplicación de la respuesta, o los dispositivos adsorbentes de endotoxina (cartuchos de polimixina B para hemoperfusión extracorpórea capaces de adsorber la endotoxina circulante en pacientes con SG por gramnegativos)181. Se busca un punto de corte de PCT que sirva de indicación para poner en marcha estas terapias.
Recomendaciones y conclusionesLas manifestaciones clínicas de los procesos infecciosos son a menudo inespecíficas y variables (especialmente en el anciano o inmunodeprimido), lo que dificulta el reconocimiento precoz de estas enfermedades y situaciones. Como herramientas de ayuda los BMRIeI son capaces de mejorar el manejo de los pacientes con infección en urgencias al proporcionar una información adicional a la valoración clínica y a las exploraciones habituales y así ser capaces de aumentar en su conjunto la capacidad diagnóstica y pronóstica. El BMRIeI nunca puede sustituir a la valoración clínica ni al estudio microbiológico oportuno. El objetivo en pacientes leves será asegurar el diagnóstico (buscando la máxima sensibilidad y el VPP para que «no se escape ninguno»). En los pacientes graves (SG-SS o con sospecha de bacteriemia) se buscará el punto de corte y el BMRIeI que consiga más especificidad y VPN, para poder descartar con la mayor seguridad estas posibilidades.
Dentro de los clásicos BMRIeI, los más representativos son la PCT, la PCR y el lactato. Aunque no existe el BMRIeI perfecto, la PCT se muestra como el más sensible y adecuado, gracias a su particular cinética tanto para una determinación aislada inicial como para su seriación en el SUH, para descubrir al paciente con infección dentro de los que se presentan con fiebre y/o un SRIS, y el más óptimo para el diagnóstico precoz de infección bacteriana, para la valoración de la gravedad (sospecha de bacteriemia y SG-SS) y de la predicción de mortalidad. Junto a ello, su disponibilidad en muchos SUH, la rapidez y la facilidad de su técnica y la gran experiencia acumulada la sitúan como el BMRIeI de referencia. El lactato, marcador de hipoperfusión tisular y elemento clave en el manejo de la SG-SS, ha demostrado su magnífica capacidad predictiva de mortalidad, lo que añadido a su fácil y rápida obtención y a su bajo coste hacen que se mantenga intacta su importancia y utilidad para los SUH como recomiendan los expertos y todas las guías relevantes. Entre los «nuevos» BMRIeI y como probable complemento futuro en distintos procesos y situaciones para la capacidad diagnóstica de infección bacteriana de la PCT se sitúa la MRproADM con el mejor rendimiento pronóstico de mortalidad demostrado. Por estas razones, los autores proponen unas recomendaciones prácticas para la utilización de los BMRIeI en los SUH (tabla 8). Otro aspecto fundamental a considerar siempre es el relacionado con la relación coste-beneficio y la conveniencia de que los SUH puedan disponer de los BMRIeI. A nuestro juicio, y siempre que exista una de las indicaciones comentadas, el precio de una determinación de lactato en la gasometría venosa (1-2€), de PCR (3-4€), PCT (8-10€) o en los casos seleccionados de MRproADM (12€) (medias de los precios de compra comunicados en nuestros centros hospitalarios) no debería ser un obstáculo para su disponibilidad en el SUH, donde una visita al mismo se valora en 228€ y las decisiones de tratamientos AB inadecuados, ingresos improcedentes o altas inapropiadas pueden suponer miles de euros al sistema y un peor pronóstico vital para el enfermo.
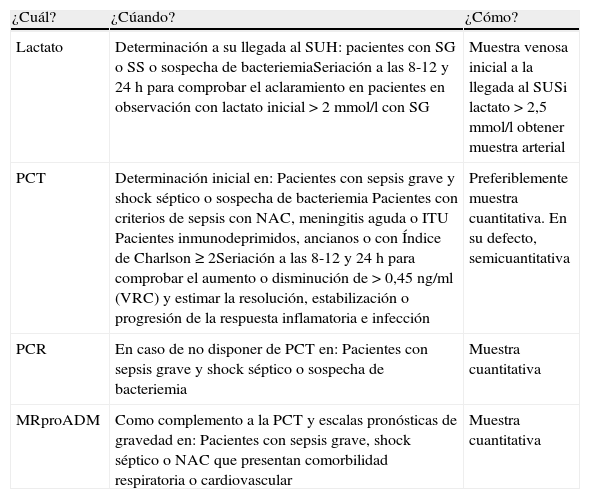
Recomendaciones prácticas del uso de BMRIeI en los SUH
| ¿Cuál? | ¿Cúando? | ¿Cómo? |
| Lactato | Determinación a su llegada al SUH: pacientes con SG o SS o sospecha de bacteriemiaSeriación a las 8-12 y 24h para comprobar el aclaramiento en pacientes en observación con lactato inicial >2mmol/l con SG | Muestra venosa inicial a la llegada al SUSi lactato >2,5mmol/l obtener muestra arterial |
| PCT | Determinación inicial en:Pacientes con sepsis grave y shock séptico o sospecha de bacteriemiaPacientes con criterios de sepsis con NAC, meningitis aguda o ITUPacientes inmunodeprimidos, ancianos o con Índice de Charlson ≥2Seriación a las 8-12 y 24h para comprobar el aumento o disminución de >0,45ng/ml (VRC) y estimar la resolución, estabilización o progresión de la respuesta inflamatoria e infección | Preferiblemente muestra cuantitativa. En su defecto, semicuantitativa |
| PCR | En caso de no disponer de PCT en:Pacientes con sepsis grave y shock séptico o sospecha de bacteriemia | Muestra cuantitativa |
| MRproADM | Como complemento a la PCT y escalas pronósticas de gravedad en:Pacientes con sepsis grave, shock séptico o NAC que presentan comorbilidad respiratoria o cardiovascular | Muestra cuantitativa |
BMRIeI: biomarcadores de respuesta inflamatoria e infección; ITU: infecciones del tracto urinario; MRproADM: región medial de la proadrenomedulina; NAC: neumonía adquirida en la comunidad; PCR: proteína C reactiva; PCT: procalcitonina; SG: sepsis grave; SS: shock séptico; SU: servicio de urgencias; SUH: servicio de urgencias hospitalario; VRC: valor de referencia de cambio clínico.
Además de la situación clínica, de las características y de la edad del paciente, del foco o tipo de infección y de microrganismo, del punto de corte adoptado (y por consiguiente una determinada sensibilidad, especificidad, VPP y VPN), se debe tener en cuenta si el enfermo ha tomado AB durante las 72h previas y el tiempo de evolución desde el inicio de la sintomatología y posible agresión bacteriana. El futuro próximo, que ya es realidad clínica en algunos centros, pasará por disponer de un panel de BMRIeI y la clave estará en saber elegir y combinar, entre ellos y con las escalas y modelos pronósticos, los que nos puedan hacer mejorar el manejo del enfermo con infección grave.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.