Las infecciones relacionadas con los catéteres vasculares son un problema de especial relevancia por su frecuencia, por su morbimortalidad y por ser procesos clínicos potencialmente evitables. En la actualidad, la mayoría de pacientes hospitalizados y un número considerable de enfermos en régimen ambulatorio son portadores de este tipo de dispositivos. El conocimiento sobre la epidemiología de estas infecciones, sobre la metodología más apropiada para su diagnóstico y sobre las estrategias terapéuticas y, sobre todo, preventivas ha experimentado un notable crecimiento. Las estrategias multimodales, que incluyen actividades educativas dirigidas al personal y un paquete de medidas sencillas para su aplicación de manera conjunta, aplicadas a pacientes de alto riesgo han demostrado una gran eficacia para su prevención. En esta revisión se actualizan los aspectos epidemiológicos, diagnósticos, terapéuticos y preventivos de este tipo de infecciones.
Venous catheter-related infections are a problem of particular importance, due to their frequency, morbidity and mortality, and because they are potentially preventable clinical processes. At present, the majority of hospitalized patients and a considerable number of outpatients are carriers of these devices. There has been a remarkable growth of knowledge of the epidemiology of these infections, the most appropriate methodology for diagnosis, the therapeutic and, in particular, the preventive strategies. Multimodal strategies, including educational programs directed at staff and a bundle of simple measures for implementation, applied to high-risk patients have demonstrated great effectiveness for their prevention. In this review the epidemiology, the diagnosis, and the therapeutic and preventive aspects of these infections are updated.
La utilización de dispositivos intravasculares (DIV) percutáneos para la administración de fluidos, productos sanguíneos o fármacos, así como para la monitorización hemodinámica, se ha convertido en un componente esencial de la medicina moderna en los pacientes hospitalizados. Según los datos nacionales del programa de estudio de prevalencia de las infecciones nosocomiales en España (programa EPINE), se considera que alrededor del 70% de los pacientes ingresados en los hospitales son portadores de alguno de estos dispositivos en algún momento de su estancia. En alrededor del 7% de los pacientes el DIV es un catéter venoso central (CVC), colocado de forma temporal o permanente (tipo Hickman® o Port-a-cath®). Asimismo, en el 4% de los pacientes hospitalizados el DIV es utilizado para la administración de soluciones parenterales de nutrición1.
El uso de los catéteres vasculares produce, en ocasiones, infecciones de tipo local o sistémico, como la bacteriemia no complicada o complicada (bacteriemia persistente, tromboflebitis séptica, endocarditis y otras complicaciones metastásicas como abscesos pulmonares, cerebrales, osteomielitis y endoftalmitis). Este tipo de complicaciones tiene una importante morbilidad y una mortalidad no despreciable, siendo la causa más frecuente que obliga a su retirada en cualquier tipo de dispositivo2–4.
Las bacteriemias relacionadas con los catéteres vasculares (BRCV) se encuentran entre las infecciones adquiridas en el hospital de mayor frecuencia5,6. En la actualidad se calcula que entre el 15 y el 30% de todas las bacteriemias nosocomiales se relacionan con el uso de DIV percutáneos7,8. En determinadas unidades de hospitalización, como las unidades de cuidados intensivos (UCI), este tipo de infección se ha relacionado con una elevada morbilidad, una mortalidad atribuible y coste sanitario añadido muy relevante9,10. Aunque la verdadera incidencia de BRCV no es bien conocida, se estima que en Estados Unidos durante el año 2002 se produjeron un total de 250.000 episodios, con una mortalidad atribuible que puede situarse entre el 12 y el 25% (más de 30.000 fallecimientos) y un coste añadido estimado en un rango de entre 3.000 y 56.167 dólares americanos por cada episodio8. Una parte sustancial de las BRCV se asocian con la presencia de un CVC y la estancia de los pacientes en la UCI, aunque en los últimos años se ha documentado la importancia que el problema tiene también en pacientes hospitalizados en unidades convencionales y con otros tipos de catéteres, tales como catéteres venosos periféricos (CVP) o catéteres venosos centrales de inserción periférica (CVCIP), que tienen un uso significativo fuera de las UCI11–16.
Los programas de vigilancia para la prevención de las BRCV, principalmente destinados a la aplicación sencilla de un grupo de medidas preventivas de eficacia demostrada, asociadas con unas campañas educativas dirigidas al personal y puestas en práctica en colaboración con las estructuras directivas de las instituciones, han tenido un impacto significativo en la reducción de las tasas de BRCV en las UCI17–19. La estricta adhesión a las recomendaciones formuladas ha facilitado una reducción del 70% en la frecuencia de los episodios en las UCI norteamericanas. En el año 2009, el número estimado de episodios de BRCV era de 18.000: una reducción del 58% en comparación con los datos correspondientes al año 200120.
En España, desde 1994 existe un programa específico para la vigilancia de las infecciones asociadas a dispositivos adquiridas durante la estancia de los pacientes en las UCI (denominado ENVIN-UCI), con más de 100hospitales participantes21. La información anual proporcionada por este programa ofrece las tasas de BRCV ajustadas por diferentes métodos, como los días de utilización de los DIV, el tiempo de hospitalización en estas unidades o el número de pacientes ingresados en ellas. Con estos datos se pueden efectuar comparaciones de las frecuencias, no solo en cada uno de los centros participantes sino también con los datos agregados suministrados, que permitan implementar programas específicos de prevención y valorar la eficacia de las medidas aplicadas en los mismos. Sin embargo, hasta la fecha no existe en nuestro medio una información precisa acerca de la frecuencia de la BRCV en las salas de hospitalización convencional. En el año 2006 se inició en Cataluña el programa VINCat de vigilancia de las infecciones nosocomiales, con el objetivo principal de reducir la frecuencia de estas infecciones mediante su vigilancia activa y continuada. Un objetivo clave del programa VINCat es el seguimiento continuo de las BRCV en todo el hospital y en todos los tipos de catéteres venosos (con la excepción de los CVC con reservorios implantables y los catéteres arteriales), utilizando un sistema basado en los informes de los hemocultivos positivos de los laboratorios de microbiología de cada institución participante22.
La incidencia de la BRCV varía considerablemente en función del tipo de catéter, de su frecuencia de manipulación y de factores relacionados con el huésped (p.ej., enfermedad de base o estado clínico crítico). Aunque los CVP tienen un riesgo bajo de infecciones relacionadas, a veces pueden ocasionar procesos de especial morbimortalidad asociada23. La mayoría de infecciones graves relacionadas con los catéteres se producen en pacientes portadores de CVC, en especial si están ingresados en la UCI o tienen procesos de base graves como neoplasias, insuficiencia renal crónica en programa de hemodiálisis o tratamiento con nutrición parenteral (NTP) o inmunosupresores24,25.
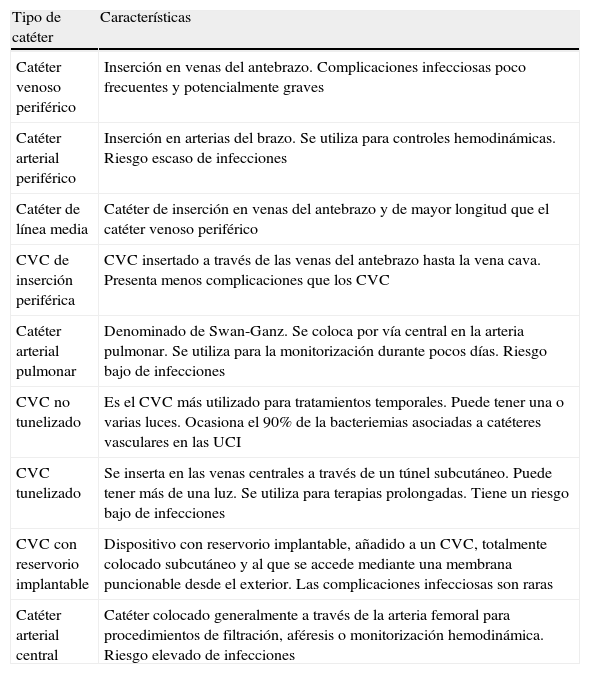
Tipos de catéteres vasculares2,3,26,27Existen numerosos tipos de catéteres vasculares que se clasifican según su modalidad de inserción, su utilización, su tamaño y la vena donde se colocan, el número de luces que contienen y su riesgo de infecciones asociadas (tabla 1). Aunque la utilización de cualquier tipo de DIV comporta un riesgo de desarrollar una infección relacionada, alrededor del 75% de las bacteriemias asociadas se originan en los CVC. Asimismo, en una cuarta parte de todas las BRCV el catéter implicado en su origen se utiliza para la administración de nutrición parenteral28.
Tipos de catéteres vasculares
| Tipo de catéter | Características |
| Catéter venoso periférico | Inserción en venas del antebrazo. Complicaciones infecciosas poco frecuentes y potencialmente graves |
| Catéter arterial periférico | Inserción en arterias del brazo. Se utiliza para controles hemodinámicas. Riesgo escaso de infecciones |
| Catéter de línea media | Catéter de inserción en venas del antebrazo y de mayor longitud que el catéter venoso periférico |
| CVC de inserción periférica | CVC insertado a través de las venas del antebrazo hasta la vena cava. Presenta menos complicaciones que los CVC |
| Catéter arterial pulmonar | Denominado de Swan-Ganz. Se coloca por vía central en la arteria pulmonar. Se utiliza para la monitorización durante pocos días. Riesgo bajo de infecciones |
| CVC no tunelizado | Es el CVC más utilizado para tratamientos temporales. Puede tener una o varias luces. Ocasiona el 90% de la bacteriemias asociadas a catéteres vasculares en las UCI |
| CVC tunelizado | Se inserta en las venas centrales a través de un túnel subcutáneo. Puede tener más de una luz. Se utiliza para terapias prolongadas. Tiene un riesgo bajo de infecciones |
| CVC con reservorio implantable | Dispositivo con reservorio implantable, añadido a un CVC, totalmente colocado subcutáneo y al que se accede mediante una membrana puncionable desde el exterior. Las complicaciones infecciosas son raras |
| Catéter arterial central | Catéter colocado generalmente a través de la arteria femoral para procedimientos de filtración, aféresis o monitorización hemodinámica. Riesgo elevado de infecciones |
CVC: catéter venoso central; UCI: Unidades de Cuidados Intensivos.
Los CVC pueden insertarse mediante 2técnicas diferentes, de forma percutánea o con un procedimiento quirúrgico. Los primeros son los más utilizados en los pacientes hospitalizados y sus lugares de inserción central más comunes son las venas subclavia, yugular o femoral. En los últimos años, los CVCIP se han colocado con mayor frecuencia debido a la facilidad de su inserción (a través de las venas basílica o cefálica del antebrazo), a su reducido número de complicaciones asociadas, incluidas las infecciosas, y a su excelente tolerancia por parte de los pacientes. El extremo intravascular de este tipo de catéteres está colocado a nivel de la vena cava inferior, por lo que permiten cualquier modalidad terapéutica que precise un acceso vascular a las venas centrales (incluidas la administración de fármacos citostáticos, inmunosupresores o nutrición parenteral).
Los CVC no tunelizados, que se insertan por vía percutánea generalmente a la cabecera de los pacientes, pueden ser de poliuretano o de silicona, su utilización generalmente no supera las 4 o 6semanas desde su colocación y ofrecen la posibilidad de ser recambiados, mediante un sistema de guías metálicas, en determinadas circunstancias. Los CVC tunelizados se insertan, con un procedimiento quirúrgico, a través de un túnel subcutáneo alejado unos centímetros del punto de acceso de la vena central. La parte exterior del catéter, por lo tanto, no está en contacto con el lugar de la inserción vascular. El anclaje del catéter se realiza mediante un manguito de Dacron que permite la fijación subcutánea del mismo y que posteriormente se fibrosa. Este manguito, colocado en el trayecto del túnel subcutáneo, proporciona una barrera para la migración de microorganismos desde el exterior, a través de la superficie externa del catéter, hasta el extremo distal intravascular y, con ello, condiciona una disminución del riesgo de infecciones durante las primeras semanas tras la colocación de este tipo de DIV. Una modificación reciente de los CVC tunelizados son los catéteres de Groshong, portadores de un sistema con una válvula de 2 aberturas adyacente que permanece cerrada mientras el catéter no se utiliza, ofreciendo con ello una protección superior frente a la formación de trombosis intraluminal o a la infusión de partículas aéreas.
Los CVC con reservorios implantables constan de un dispositivo, compuesto de materiales plásticos o de titanio, portador de una membrana conectado a un catéter que se coloca en una vena central (generalmente la vena subclavia). Este dispositivo se sitúa por completo por debajo de la piel del tórax, mediante una técnica quirúrgica, y se accede a él a través de la punción externa de la membrana mediante diversos procedimientos.
En las arterias pueden colocarse DIV —destinados generalmente a la monitorización hemodinámica o a la realización de técnicas de depuración sanguínea— de diferentes tipos y accesos. Los más usuales son los colocados a nivel de las arterias periféricas del antebrazo, a nivel central para canalizar la arteria pulmonar (denominado catéter de Swan-Ganz) o a nivel de la arteria femoral. Excepto los utilizados para la depuración renal, el resto de catéteres arteriales están insertados durante períodos cortos de tiempo, por cuyo motivo las complicaciones infecciosas relacionadas son muy infrecuentes.
EpidemiologíaLa bacteriemia asociada al uso de DIV está relacionada con parámetros ligados al paciente, al tipo de catéter y al lugar de hospitalización de los pacientes (tabla 2). Todos estos factores se han correlacionado con un aumento del riesgo en diferentes estudios retrospectivos8.
Factores de riesgo para desarrollar una bacteriemia asociada al uso de los catéteres vasculares
| Ligados al paciente |
| Granulocitopenia |
| Quimioterapia inmunosupresora |
| Pérdida de la integridad cutánea (quemaduras, psoriasis, etc.) |
| Enfermedades de base graves |
| Infección aguda en otra localización |
| Alteración de la microflora cutánea del paciente |
| Falta de cumplimiento de los protocolos de prevención por el personal sanitario |
| Ligados al catéter |
| Composición del catéter |
| Trombogenicidad |
| Capacidad de adherencia de los microorganismos |
| Lugar de inserción y tamaño del catéter |
| Número de luces del catéter |
| Uso del catéter |
| Estrategias de manejo del catéter |
| Tipo de inserción (tunelizado o sin tunelización subcutánea) |
| Duración de la cateterización |
| Colocación del catéter en situación de emergencia |
| Ligados al lugar de hospitalización |
| Unidades de Cuidados Intensivos, Hematología o Nefrología |
| Hospitales terciarios universitarios |
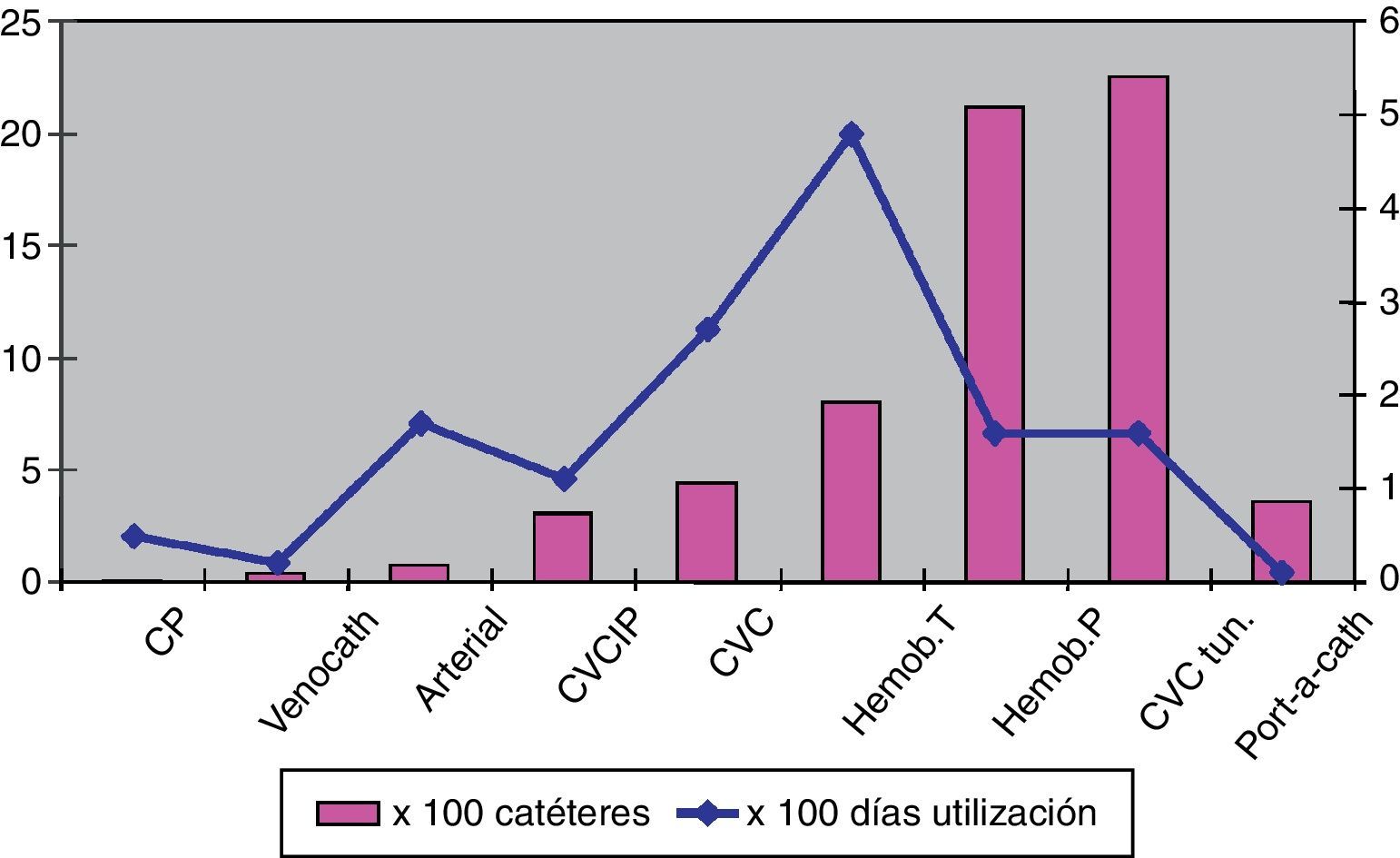
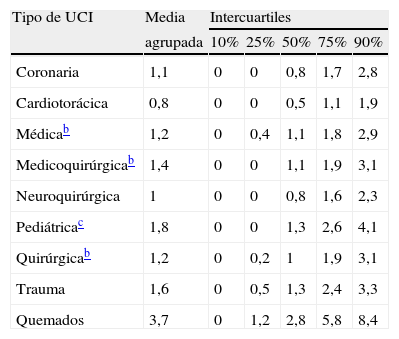
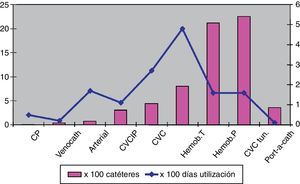
Las frecuencias de BRCV varían en función del tipo de catéter (fig. 1)15,28 y del lugar de hospitalización de los pacientes. De esta manera, las UCI tienen las tasas más elevadas de estas infecciones, que oscilan entre un episodio (en unidades coronarias, cardiotorácicas, médicas, medicoquirúrgicas, neuroquirúrgicas y quirúrgicas) y cercanas a 4 episodios (en unidades de quemados) por cada 1.000días de utilización de los CVC, según los datos reportados por el National Healthcare Safety Network estadounidense para el año 2011 (tabla 3)29. En nuestro país, los datos del ENVIN-UCI correspondientes al año 2012 proporcionan una tasa global de bacteriemia relacionada con los CVC de 2,79episodios por 1.000días de utilización del dispositivo21. En las unidades de hospitalización diferentes a las UCI, las tasas más elevadas se observan en Hematología, Nefrología y Oncología, sobre todo en enfermos portadores de CVC de larga permanencia26,30.
Frecuencia de las bacteriemias asociadas con los diferentes tipos de catéteres vasculares, ajustadas por pacientes y por días de utilización
CP: catéter venoso periférico; CVC tun.: catéter venoso central tunelizado; CVC: catéter venoso central; CVCIP: catéter venoso central de inserción periférica; Hemod. P: catéter para hemodiálisis permanente; Hemod. T: catéter para hemodiális temporal.
Modificado de Maki et al.15.
Incidenciaa de bacteriemia asociada a los catéteres venosos centrales en pacientes ingresados en unidades de cuidados intensivos (UCI), ajustada por tipo de unidad
| Tipo de UCI | Media | Intercuartiles | ||||
| agrupada | 10% | 25% | 50% | 75% | 90% | |
| Coronaria | 1,1 | 0 | 0 | 0,8 | 1,7 | 2,8 |
| Cardiotorácica | 0,8 | 0 | 0 | 0,5 | 1,1 | 1,9 |
| Médicab | 1,2 | 0 | 0,4 | 1,1 | 1,8 | 2,9 |
| Medicoquirúrgicab | 1,4 | 0 | 0 | 1,1 | 1,9 | 3,1 |
| Neuroquirúrgica | 1 | 0 | 0 | 0,8 | 1,6 | 2,3 |
| Pediátricac | 1,8 | 0 | 0 | 1,3 | 2,6 | 4,1 |
| Quirúrgicab | 1,2 | 0 | 0,2 | 1 | 1,9 | 3,1 |
| Trauma | 1,6 | 0 | 0,5 | 1,3 | 2,4 | 3,3 |
| Quemados | 3,7 | 0 | 1,2 | 2,8 | 5,8 | 8,4 |
Datos correspondientes al informe del año 2011 del National Healthcare Safety Network29.
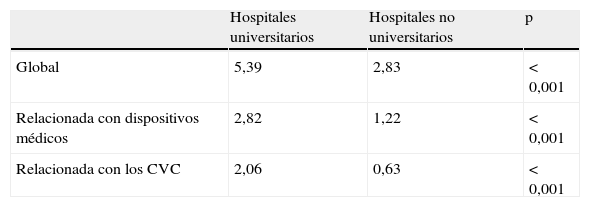
El tipo de hospital influye también en la tasa de BRCV, ya que los hospitales terciarios y universitarios tienen una incidencia alrededor del triple superior a la de los centros no universitarios (2,06 versus 0,63 por cada 1.000pacientes hospitalizados). Esta frecuencia superior se relaciona con la mayor complejidad de los pacientes hospitalizados en las instituciones terciarias (tabla 4)6. En nuestro medio, según los datos del programa VINCat, los hospitales de tamaño superior a las 500camas tienen una tasa global de 0,36episodios por 1.000días de hospitalización; los situados entre 200 y 500camas, de 0,17episodios, y por último, los de menos de 200camas, de 0,09 epsiodios28.
Incidenciaa bacteriemia nosocomial en los hospitales británicos
| Hospitales universitarios | Hospitales no universitarios | p | |
| Global | 5,39 | 2,83 | < 0,001 |
| Relacionada con dispositivos médicos | 2,82 | 1,22 | < 0,001 |
| Relacionada con los CVC | 2,06 | 0,63 | < 0,001 |
CVC: catéteres venosos centrales; NINSS: Nosocomial Infection National Surveillance Scheme (English hospitals).
Proyecto NINSS6.
La capacidad trombogénica de los catéteres y su composición influyen en la capacidad de desarrollar infecciones relacionadas. Ciertos microorganismos, especialmente los estafilococos y Candida, tienen mayor capacidad de adherirse a los catéteres de polivinilo que a los fabricados con teflón8.
El lugar de inserción de los catéteres puede influir en el riesgo de aparición de infecciones. Así, los catéteres colocados en las venas femorales o yugulares tienen un riesgo superior de colonización y de infección que los insertados en las venas subclavias. Los catéteres colocados en las venas periféricas o en venas centrales con inserción periférica (tipo drum) tienen también un riesgo inferior. Por último, el aumento del número de luces vasculares de un catéter puede incrementar el riesgo de infección15,31.
El uso de los catéteres —p.ej., para la monitorización de las presiones pulmonares— puede influir en el desarrollo de infecciones, así como todos los procedimientos relacionados con las prácticas de su inserción y su mantenimiento.
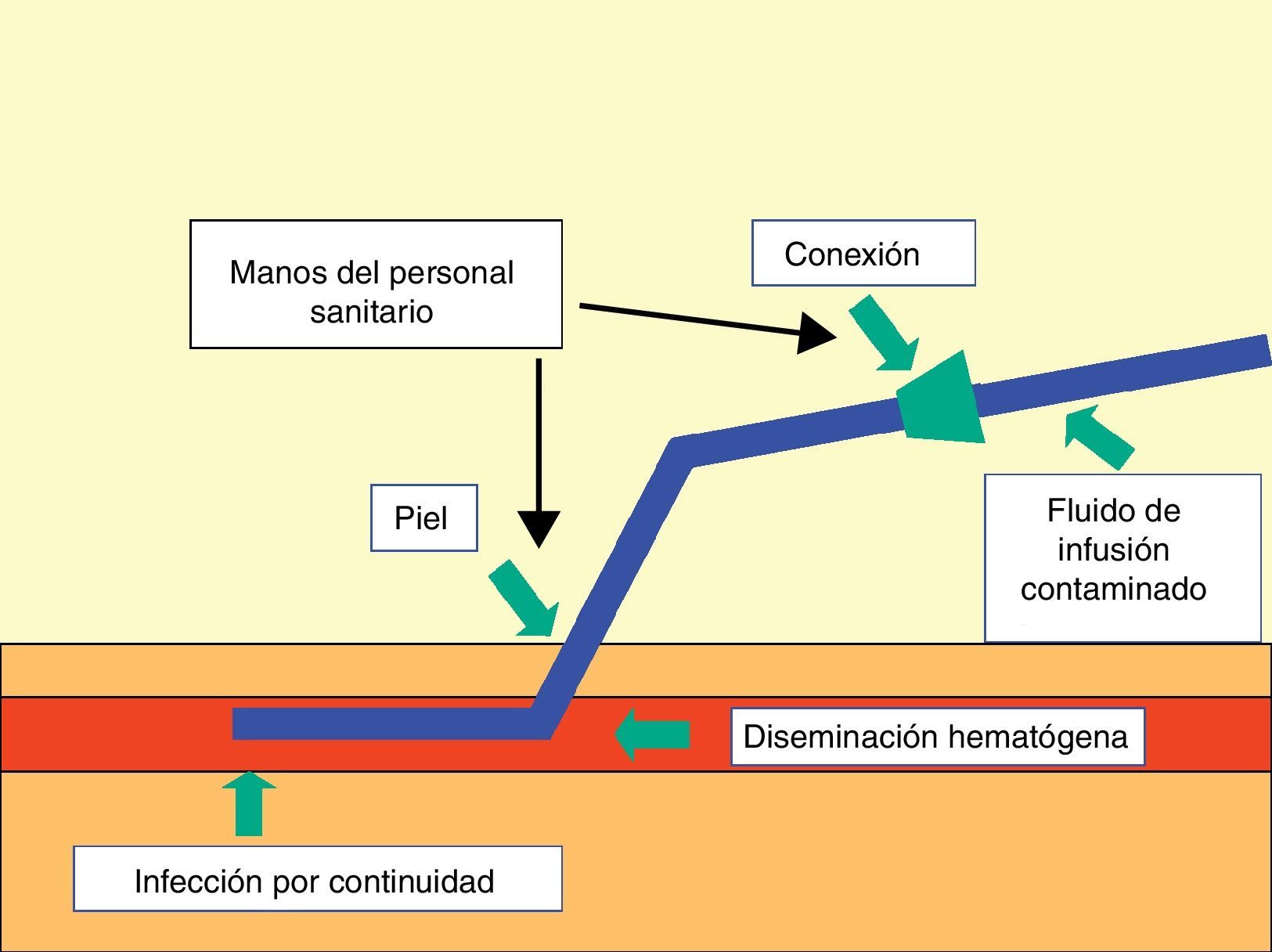
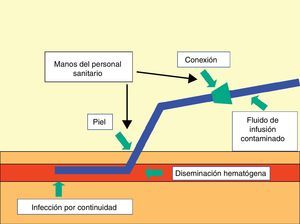
PatogeniaLos microorganismos que producen las infecciones relacionadas con los DIV pueden acceder a los mismos por una vía extraluminal o a través de su superficie intraluminal. La adherencia de estos microorganismos y su incorporación formando biocapas ocasiona la colonización de los catéteres, con la posibilidad de desarrollar una diseminación hematógena32.
Existen 3 puntos importantes por donde acceden los microorganismos a los DIV: a)la contaminación del producto de la infusión; b)la contaminación de la conexión y del espacio intraluminal, y c)la contaminación de la piel adyacente al lugar de su inserción y la superficie extraluminal (fig. 2).
La contaminación de los fluidos administrados por vía parenteral es excepcional en la actualidad, debido a los rigurosos controles de esterilidad y de caducidad a los que están sometidos dichos productos. En estos casos pueden producirse bacteriemias ocasionadas generalmente por bacterias gramnegativas (enterobacterias o bacilos gramnegativos no fermentadores) de especial gravedad y de tipo epidémico. Las soluciones para la NTP que contienen lípidos son las que presentan un riesgo superior, sobre todo si se preparan en los propios centros sanitarios y no se cumplen las debidas normas de esterilidad durante su proceso de elaboración. Estas soluciones pueden contaminarse por diferentes especies bacterianas o fúngicas (como Candida parapsilosis o Malassezia furfur)2,3.
La contaminación del punto de conexión de los catéteres vasculares es la segunda causa más frecuente de llegada de los microorganismos a ellos (tras la relacionada con el lugar de su inserción) y la más común implicada en los DIV de una duración superior a las 2semanas. Es, por lo tanto, la vía usual de colonización de los CVC, sean o no tunelizados, cuando la misma se produce transcurridas las 2 primeras semanas de su implantación. En esta vía de colonización los microorganismos progresan a través de la superficie intraluminal de los catéteres, formando la biocapa de colonización en todo el trayecto de la luz hasta llegar al extremo intravascular33.
El acceso de microorganismos desde la piel adyacente al lugar de la inserción de los catéteres es el mecanismo patogénico más importante para su colonización y posterior infección relacionada. Esta vía de llegada es posiblemente la única en los catéteres colocados por un período de tiempo inferior a los 8días (en ausencia de la contaminación del producto de la infusión). A través del punto de inserción cutánea los microorganismos progresan por la superficie extraluminal de los catéteres y forman la biocapa a dicho nivel, hasta llegar al extremo intravascular de los mismos32.
La colonización de un catéter vascular por diseminación hematógena de un microorganismo originado en un foco distante es muy poco frecuente, observándose fundamentalmente en pacientes críticos con catéteres de larga duración o en enfermos afectos de patologías intestinales crónicas y portadores de DIV para nutrición parenteral. En esta circunstancia no es inusual la existencia de cuadros recidivantes a pesar de la retirada de los catéteres2,3,8.
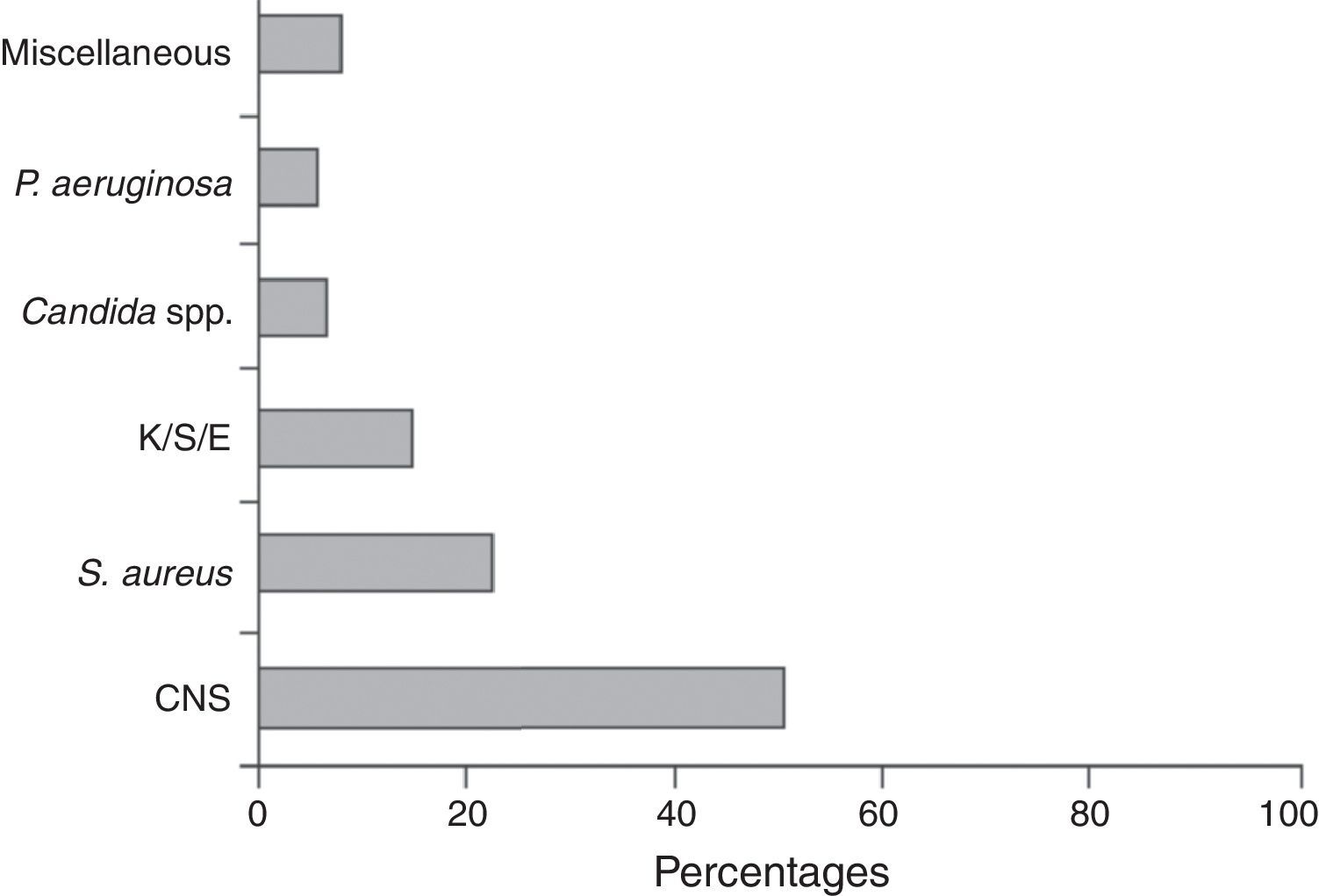
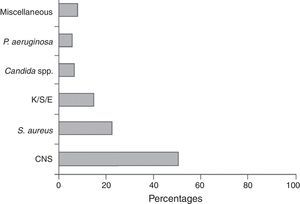
MicrobiologíaLos estafilococos, en especial las especies coagulasa negativos (ECN) y, en menor grado, Staphylococcus aureus son los agentes etiológicos más frecuentes de las infecciones relacionadas con los DIV. Alrededor de dos tercios de todas las infecciones están causadas por estas bacterias, y globalmente sobre el 75% por las diferentes especies de bacterias aerobias grampositivas. Los bacilos gramnegativos (enterobacterias, Pseudomonas aeruginosa y otros no fermentadores) ocasionan alrededor del 20% de los episodios, y los restantes casos son producidos por levaduras, sobre todo por especies de Candida (fig. 3)28.
Agentes etiológicos de 2.860 episodios de bacteriemia de catéter registrados en el programa VINCat, años 2007-2010.
CNS: especies coagulasa negativa de estafilococos; K/S/E: Klebsiella/Serratia/Enterobacter.
De Almirante et al.28, con autorización.
Los catéteres de corta permanencia, especialmente los CVC percutáneos, se colonizan por cualquiera de los microorganismos mencionados, mientras que en la mayoría de pacientes con catéteres de larga permanencia la colonización por estafilococos, especialmente Staphylococcus epidermidis, alcanza valores superiores al 90%23. Los catéteres utilizados para hemodiálisis tienen un elevado porcentaje de colonización por S.aureus, que incluso puede superar a otras especies de estafilococo, por la frecuente colonización de la piel de estos pacientes por dicha especie bacteriana34. Los catéteres utilizados para la administración de la NTP, bien sean de una o de múltiples luces, se pueden colonizar, además de por estafilococos, con una mayor frecuencia por enterobacterias, del tipo Klebsiella pneumoniae, o por levaduras (Candidaspp.)35. Por último, los CVC percutáneos permanentes utilizados para la administración de tratamientos oncológicos tienen una mayor posibilidad de colonización por bacilos gramnegativos, debido a la translocación de las bacterias intestinales en pacientes con las barreras mucosas alteradas30.
El lugar de inserción de los catéteres puede influir en la microbiología de su colonización. Así, los colocados en venas femorales se colonizan a menudo por flora entérica, además de por la flora usual de la piel, mientras que en los insertados en otros territorios vasculares predomina la flora cutánea colonizadora de cada paciente28.
La existencia de brotes epidémicos o de endemias prolongadas por determinados microorganismos, en todo el hospital o en ciertas áreas de hospitalización (como las UCI), puede incrementar la frecuencia de colonización de los DIV por dichos agentes etiológicos, como se observa en casos de S.aureus resistente a la meticilina (SARM) o Acinetobacter baumannii.
Manifestaciones clínicas de infecciones relacionadas con los catéteres vasculares2,3,8La infección relacionada con un DIV representa un hecho de continuidad, empezando con la colonización de la superficie extraluminal o intraluminal del catéter que, de forma ocasional, produce signos locales como eritema, dolor y drenaje purulento por el punto de inserción y potencialmente ocasiona una bacteriemia, con los característicos signos y síntomas de sepsis.
Los signos locales de infección son usuales en las bacteriemias relacionadas con los catéteres vasculares periféricos, mientras que los episodios asociados con los CVC se presentan en general sin signos locales. En ocasiones, el eritema se observa en el trayecto subcutáneo de la tunelización de un CVC.
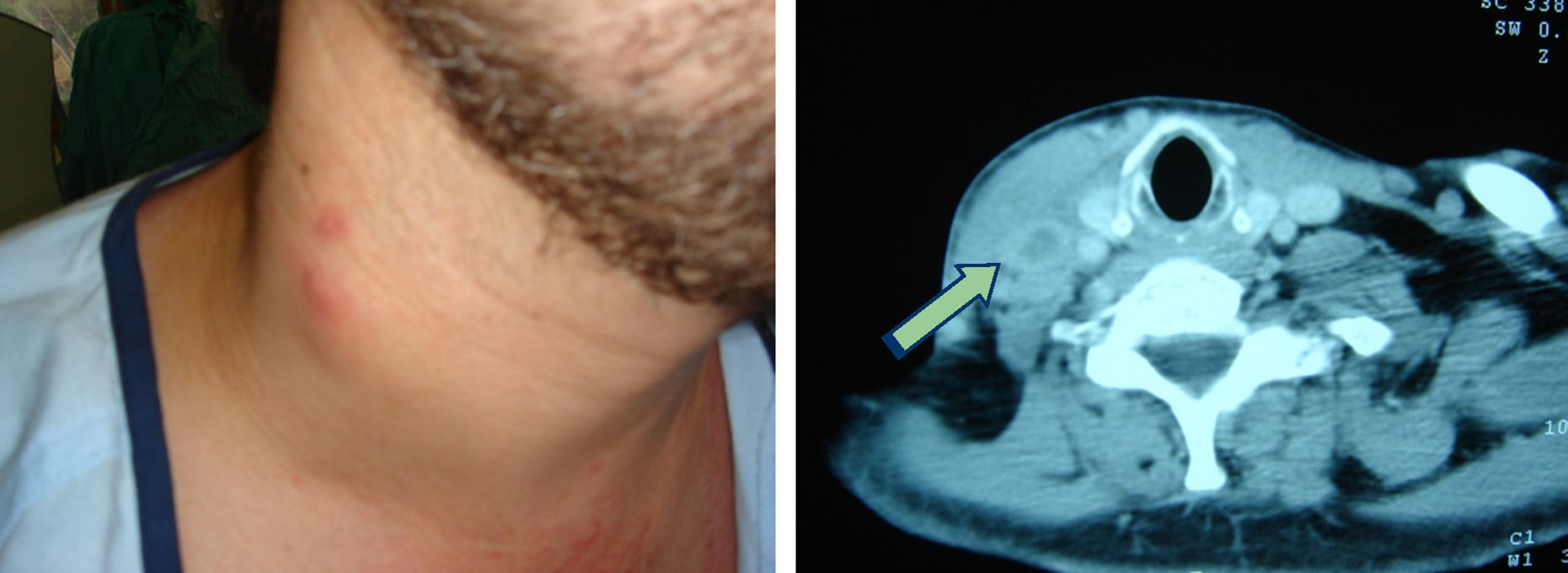
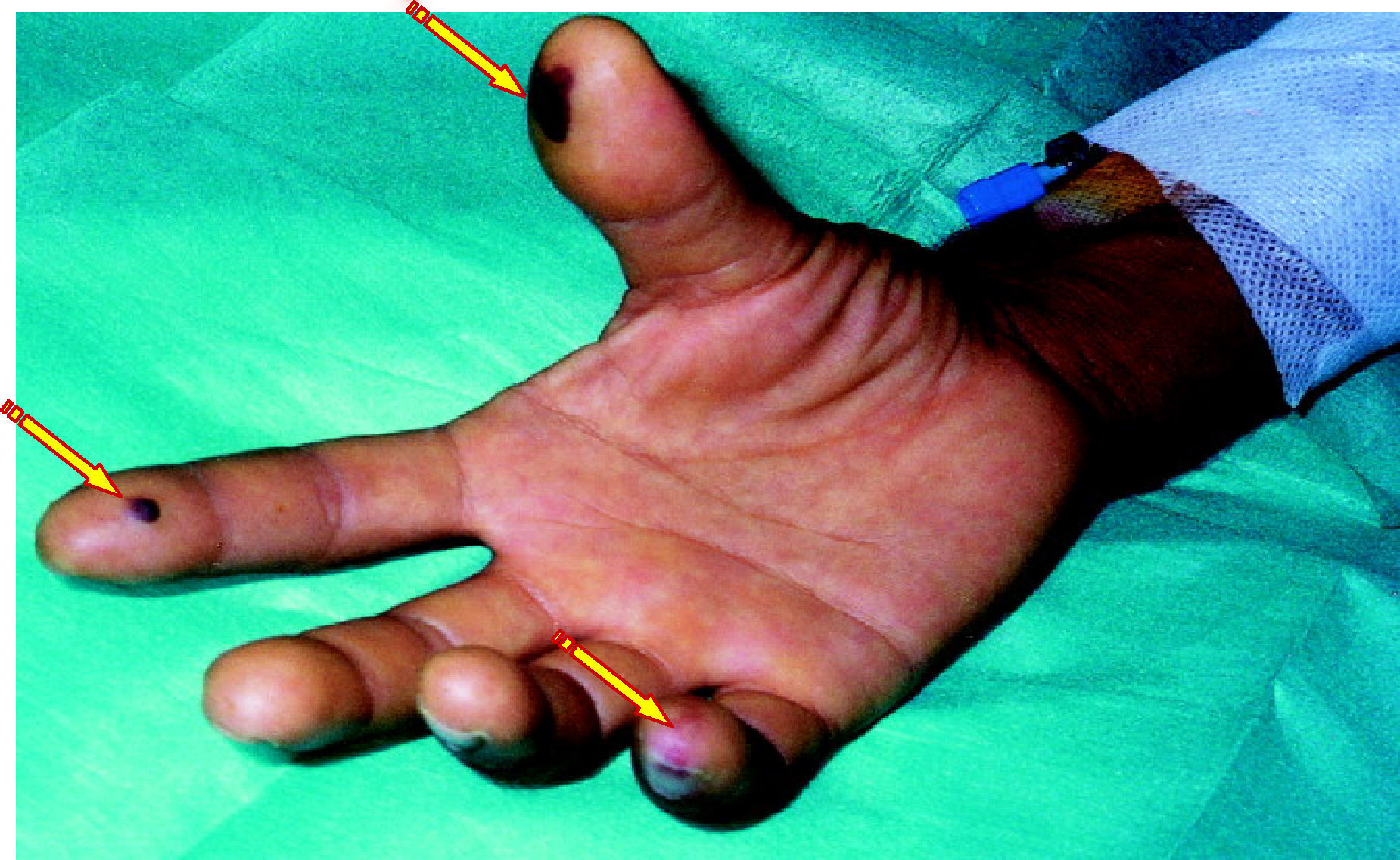
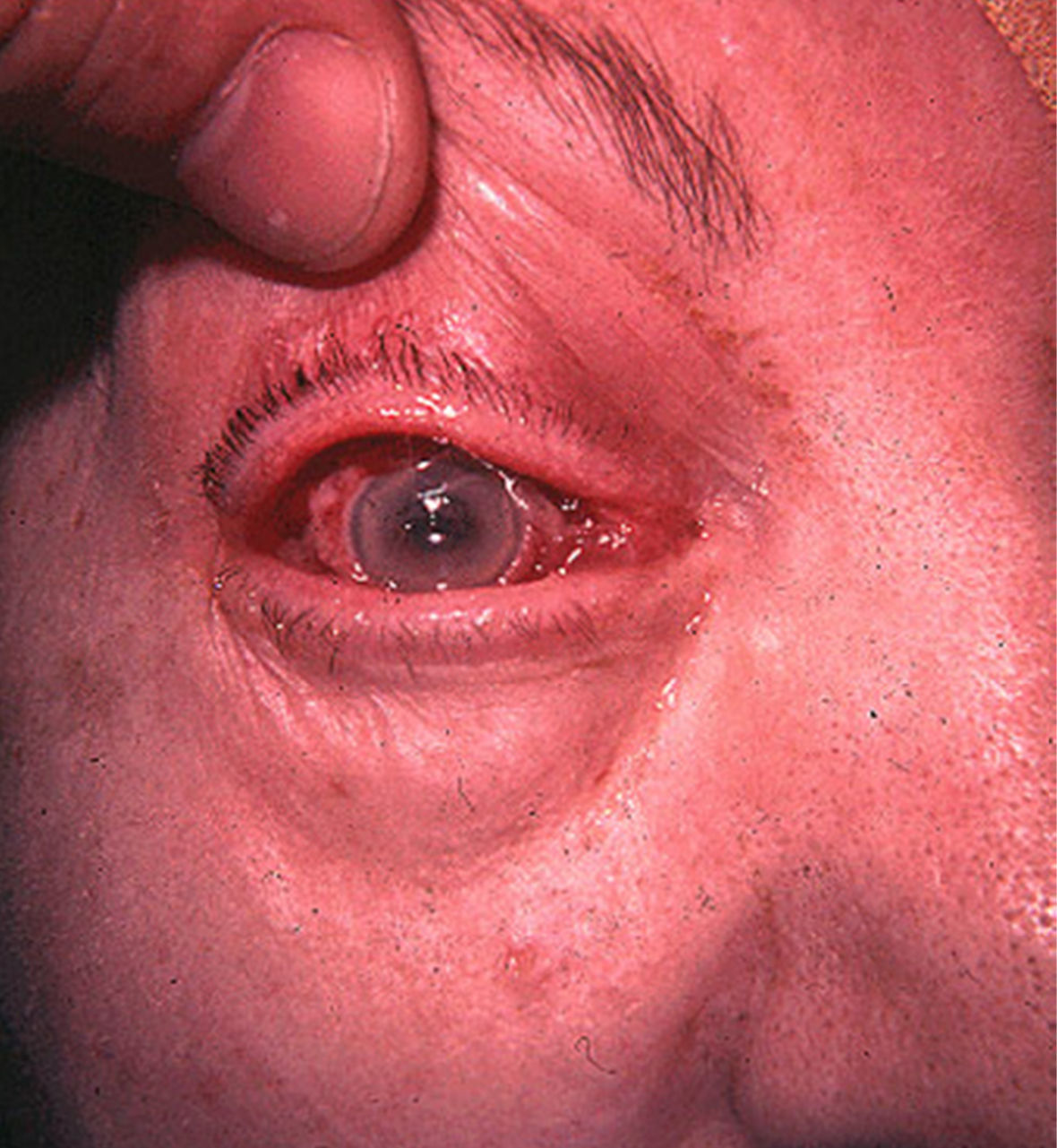
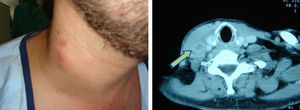
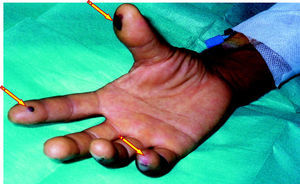
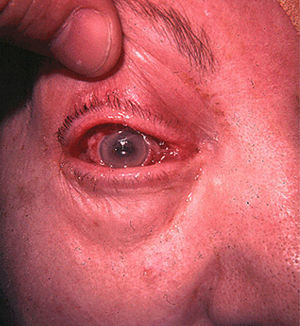
La mayoría de pacientes con BRCV tienen signos de síndrome séptico, con fiebre elevada con escalofríos, taquipnea, taquicardia y leucocitosis. Este cuadro clínico es persistente mientras el paciente continúe siendo portador del catéter vascular. La retirada de un DIV causante de bacteriemia produce, en general, la desaparición rápida de la sintomatología acompañante. La persistencia de la bacteriemia tras la retirada de un DIV puede ser debida a la existencia de complicaciones locales, como la tromboflebitis séptica (fig. 4), o metastásicas, como la endocarditis infecciosa (fig. 5) o la endoftalmitis (fig. 6).
Cualquier microorganismo causante de una BRCV puede producir un síndrome séptico como el descrito con anterioridad, aunque las ECN de estafilococos y Corynebacteriumspp. ocasionan generalmente un cuadro clínico de menor gravedad y únicamente de manera excepcional se acompañan de complicaciones locales o metastásicas. Las infecciones por S.aureus, por bacilos gramnegativos (especialmente P.aeruginosa) o por Candidaspp. son de especial gravedad, y a menudo presentan complicaciones importantes, a nivel local o sistémico, que pueden ocasionar el fallecimiento del paciente si no se administra un tratamiento adecuado, si no se retira el catéter origen de la infección y si no se actúa sobre los focos sépticos secundarios.
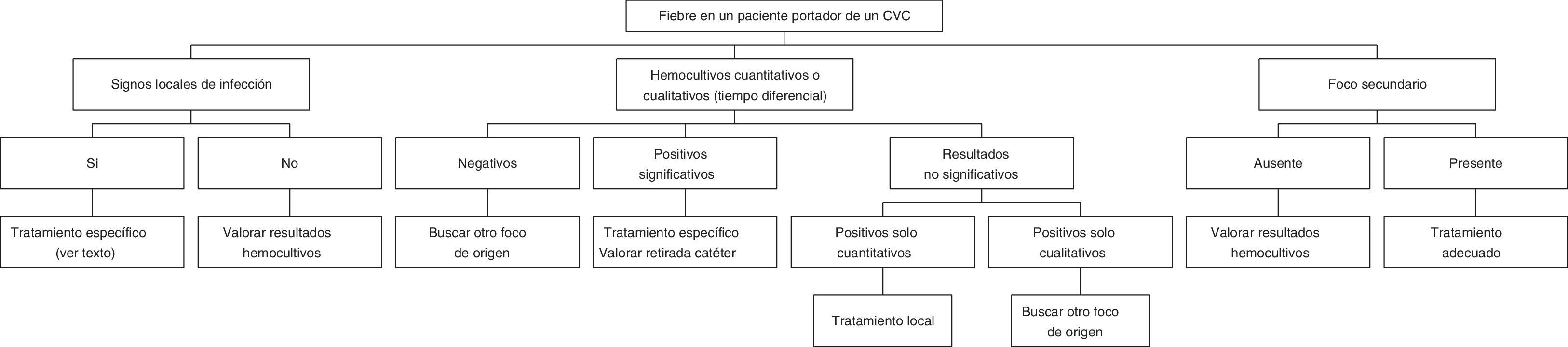
DiagnósticoLa aproximación diagnóstica a las infecciones relacionadas con los DIV consiste en una evaluación clínica cuidadosa y su correspondiente confirmación microbiológica. La sintomatología clínica de las BRCV es de escasa sensibilidad y especificidad. La mayoría de los pacientes tienen fiebre y escalofríos, que pueden acompañarse de hipotensión, hiperventilación, alteración del nivel mental y manifestaciones gastrointestinales inespecíficas, como náuseas, vómitos, dolor abdominal y diarrea. Algunos enfermos tienen signos de infección local, en forma de inflamación o existencia de franco exudado purulento, a nivel del punto de inserción del catéter o del trayecto subcutáneo del mismo si se trata de un CVC tunelizado. Estos signos locales son más frecuentes en las infecciones relacionadas con los catéteres de inserción periférica, y su ausencia no puede excluir nunca su diagnóstico. Por último, la sospecha clínica de una infección relacionada con un DIV puede establecerse por la mejoría rápida de la sintomatología general del paciente, generalmente en un período no superior a las 24h tras la retirada del dispositivo. En la figura 7 se especifica un algoritmo de decisión para la evaluación de la fiebre sin focalidad aparente en un paciente portador de un CVC8.
La detección de determinados microorganismos en los hemocultivos (S.aureus, S.epidermidis Corynebacteriumspp. o Candidaspp.), en ausencia de otro sitio identificable de origen de la infección, aumenta el grado de sospecha de BRCV en los pacientes portadores de estos dispositivos. La coincidencia en especies microbianas detectadas en cultivos de exudados purulentos del sitio de inserción de un catéter y de los hemocultivos es muy importante para establecer el diagnóstico definitivo del foco de origen de la infección.
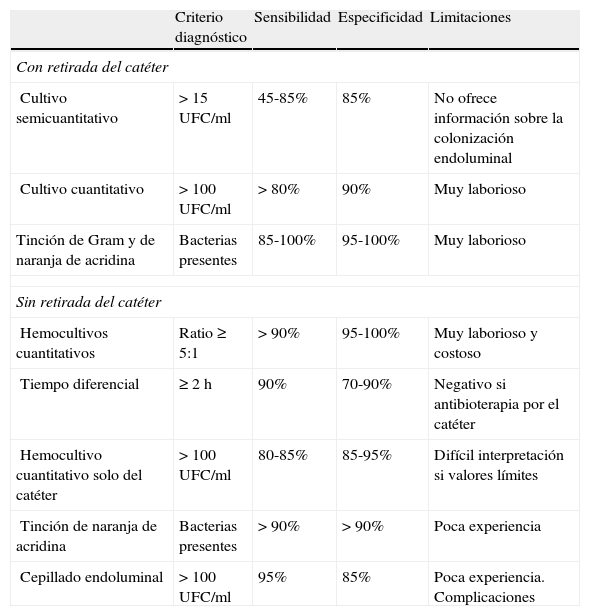
El diagnóstico de confirmación microbiológica del origen de una bacteriemia en un DIV puede realizarse mediante técnicas microbiológicas una vez retirado el dispositivo, o bien antes de su retirada (tabla 5)36–40.
Valoración de las diferentes técnicas diagnósticas para identificar el foco de origen de una bacteriemia asociada con un catéter vascular
| Criterio diagnóstico | Sensibilidad | Especificidad | Limitaciones | |
| Con retirada del catéter | ||||
| Cultivo semicuantitativo | > 15 UFC/ml | 45-85% | 85% | No ofrece información sobre la colonización endoluminal |
| Cultivo cuantitativo | > 100 UFC/ml | > 80% | 90% | Muy laborioso |
| Tinción de Gram y de naranja de acridina | Bacterias presentes | 85-100% | 95-100% | Muy laborioso |
| Sin retirada del catéter | ||||
| Hemocultivos cuantitativos | Ratio ≥ 5:1 | > 90% | 95-100% | Muy laborioso y costoso |
| Tiempo diferencial | ≥ 2 h | 90% | 70-90% | Negativo si antibioterapia por el catéter |
| Hemocultivo cuantitativo solo del catéter | > 100 UFC/ml | 80-85% | 85-95% | Difícil interpretación si valores límites |
| Tinción de naranja de acridina | Bacterias presentes | > 90% | > 90% | Poca experiencia |
| Cepillado endoluminal | > 100 UFC/ml | 95% | 85% | Poca experiencia. Complicaciones |
UFC: unidades formadoras de colonias.
La aproximación terapéutica a un paciente con una infección relacionada con un DIV está influida por una serie de factores importantes: el tipo de dispositivo y su método de inserción, el patógeno causante de la infección, la existencia de una inmunodepresión o neutropenia asociadas, la presencia de comorbilidades o de otros materiales protésicos (especialmente a nivel cardiovascular u ortopédico), la posibilidad de obtención de otros accesos venosos alternativos, la previsión de la duración de la cateterización vascular y la naturaleza y la gravedad de la propia infección40.
Actitud frente al catéter origen de una infecciónLos CVP o los CVCIP no permanentes se han de retirar siempre que se sospeche que son el foco de origen de una bacteriemia. La existencia de signos locales de infección, aun sin bacteriemia relacionada, también es un criterio absoluto de su retirada. En los CVC no tunelizados, con un uso no permanente, y en los catéteres arteriales se ha de actuar igual que en el caso de los CVP. Los CVC de uso permanente, sean o no tunelizados, se han de retirar en caso de bacteriemia relacionada con ellos en las circunstancias señaladas en la tabla 6. El riesgo fundamental de no retirar un catéter origen de una infección, aun en casos de respuesta inicial al tratamiento antimicrobiano, radica en una mayor frecuencia de bacteriemia recurrente y de posibles infecciones metastásicas. El recambio de un CVC origen de una infección, mediante un sistema de guía metálica, tiene un riesgo elevado de recidiva y de posible embolización, por lo que su práctica rutinaria está contraindicada40,41.
Indicaciones para la retirada de los catéteres venosos centrales de uso permanente
| Infección persistente del punto de inserción |
| Signos de infección a nivel del túnel subcutáneo |
| Complicaciones sépticas locales o metastásicas (endocarditis, tromboflebitis séptica o embolismos sépticos pulmonares) |
| Bacteriemia relacionada producida por ciertos microorganismos: S.aureus, bacilos gramnegativos no fermentadores, hongos filamentosos, levaduras y micobacterias |
| Bacteriemia o candidemia persistente transcurridos 3días del inicio de un tratamiento antimicrobiano adecuado |
Las infecciones locales que no se acompañan de síntomas sistémicos, incluidas las supurativas, en pacientes sin inmunodepresión no precisan de tratamiento antimicrobiano sistémico. Los antimicrobianos administrados por vía tópica no ofrecen ningún beneficio para la curación de este tipo de infecciones, una vez retirado el catéter vascular. En los pacientes inmunodeprimidos, la terapia antimicrobiana de las infecciones locales ha de ser similar a la referenciada para las infecciones sistémicas.
La terapéutica antimicrobiana de las infecciones sistémicas relacionadas con los DIV tendría que basarse en la identificación del agente causal, generalmente mediante hemocultivos, y en las pruebas de sensibilidad correspondientes. Sin embargo, si la situación clínica del paciente no es estable, es necesario administrar un tratamiento empírico que ha de incluir antimicrobianos activos frente a los microorganismos grampositivos y gramnegativos que más a menudo causan estas infecciones. La flora predominante en el hospital o en una determinada área del mismo y la existencia de patógenos multirresistentes pueden condicionar la elección de la terapia empírica.
En general, la administración de un glucopéptido (vancomicina a dosis de 15mg/kg cada 12h si la función renal es normal) o un lipopéptido (daptomicina a dosis no inferiores a 6mg/kg cada 24h), asociado a un aminoglucósido (tobramicina o amikacina a dosis únicas diarias convencionales), a un monobactámico (aztreonam a dosis de 1-2g cada 8h) o a una cefalosporina de tercera generación (ceftazidima a dosis de 2g cada 8h), puede ser la terapéutica empírica de elección en la mayoría de circunstancias. En pacientes con colonización previa por bacterias gramnegativas multirresistentes ha de valorarse una cobertura empírica con un carbapenem (imipenem o meropenem a las dosis habituales). La cobertura empírica de una candidemia originada en un catéter vascular únicamente ha de realizarse en circunstancias excepcionales, como podría ser la existencia de una sepsis grave o shock séptico en un paciente crítico con colonización múltiple previa o en enfermos con procesos hematológicos y neutropenia asociada. La elección de fluconazol (a dosis de 800mg/día) o de una equinocandina (caspofungina, anidulafungina o micafungina a las dosis habituales) depende de la existencia o no de exposición previa a los azoles por parte del paciente afectado40,42–44.
Especies coagulasa negativos de estafilococosEn los pacientes inmunocompetentes y sin materiales protésicos diferentes al DIV la retirada del mismo comporta tasas de curación cercanas al 100%, aun en ausencia de tratamiento antimicrobiano sistémico. En los pacientes inmunodeprimidos, neutropénicos o con otros materiales protésicos se recomienda la administración de terapia antibiótica sistémica aun después de retirado el catéter vascular. Los fármacos alternativos a la vancomicina son la daptomicina y el linezolid40.
Staphylococcus aureusLas recomendaciones sobre la retirada o el mantenimiento de los catéteres vasculares causantes de bacteriemia por S.aureus son las mismas independientemente de cuál sea la sensibilidad del microorganismo a la meticilina. La detección de una bacteriemia por S.aureus en un paciente portador de un catéter vascular de cualquier tipo, asociado a la existencia de signos inflamatorios en el lugar de su inserción, obliga a su retirada inmediata45. En 3estudios prospectivos observacionales se ha comprobado que la retirada de un CVC en las bacteriemias relacionadas (incluyendo los casos que no presentan complicaciones) se asocia con una respuesta clínica más rápida y con una tasa inferior de recidivas46–48.
El mantenimiento de un catéter vascular tunelizado o de un dispositivo implantable causantes de una bacteriemia por S.aureus únicamente ha de valorarse cuando no existen signos de infección a nivel del túnel, del lugar de la inserción o de la incisión quirúrgica, el paciente está estable hemodinámicamente y no hay sospecha de complicaciones metastásicas a distancia. En estas circunstancias puede considerarse realizar un tratamiento conservador mediante la utilización de antibioticoterapia local (con la técnica del sellado antimicrobiano) y sistémica. Sin embargo, en diferentes estudios no aleatorizados se ha observado una tasa de fracasos superior al 50% en casos de terapia conservadora en pacientes con catéteres tunelizados y bacteriemia asociada por S.aureus41,49. En los pacientes portadores de un CVC para diálisis con bacteriemia por S.aureus, el mantenimiento del catéter y la infección por una cepa de S.aureus resistente a la meticilina (SARM) son factores de riesgo independientes para el desarrollo de complicaciones. Por lo tanto, esta estrategia de tratamiento conservador únicamente debería aplicarse a pacientes muy seleccionados50.
La elección del tratamiento antimicrobiano sistémico depende de los estudios de sensibilidad de S.aureus y de la posibilidad de alergia a los betalactámicos. Para las cepas sensibles a la meticilina, la cloxacilina (a dosis de 2g cada 4h) o la cefazolina (a dosis de 1-2g cada 8h) son los fármacos de elección. En las infecciones causadas por SARM o si existe alergia grave a los betalactámicos, la terapia puede realizarse con vancomicina, daptomicina o linezolid40,45.
Bacilos gramnegativosEn la mayoría de series publicadas, las infecciones producidas por estos patógenos requieren la retirada del catéter para su curación definitiva, ya que su mantenimiento comporta tasas muy elevadas de recurrencias aun después de terapias sistémicas prolongadas. La terapéutica de estas infecciones se ha de realizar con el antimicrobiano al que el patógeno causal muestre sensibilidad en los estudios de laboratorio. Las cefalosporinas, los monobactámicos, las carbapenemas o las quinolonas fluoradas son los antimicrobianos más utlizados40.
Especies de CandidaLa mayoría de pacientes con candidemia se benefician de la rápida retirada de los catéteres vasculares, ya que ellos son a menudo el foco de origen de la misma. El mantenimiento de los catéteres solamente estaría justificado en pacientes con estabilidad clínica, acceso vascular permanente o dificultad para nueva cateterización, o bien con evidencia clara de un foco de origen de la candidemia diferente a los mismos. En estas circunstancias es imprescindible la realización de una de las técnicas diagnósticas, descritas anteriormente, para descartar de manera absoluta la candidemia relacionada con los catéteres44.
En las formas no graves de la infección y sin antecedentes de exposición previa a los azoles o colonización conocida por una especie resistente a los azoles, el fármaco de elección es el fluconazol (400 a 800mg por día). En los enfermos graves, con inmunodepresión o neutropenia profunda y prolongada, exposición previa a los azoles o colonización por una especie resistente a los mismos, el tratamiento de elección inicial sería caspofungina (70mg de inicio y después 50mg por día), anidulafungina (200mg de inicio y después 100mg por día) o micafungina (100mg por día). La identificación posterior de la especie de Candida y su perfil de sensibilidad antifúngica puede condicionar una modificación de la terapia inicial51,52.
Duración del tratamiento antimicrobianoEn las BRCV causadas por ECN de estafilococos la duración no ha de ser superior a los 7días tras la retirada del catéter. El sellado de la luz del catéter origen de la infección no excluye administrar terapia sistémica si hay una bacteriemia demostrada40,49.
La duración óptima del tratamiento en la bacteriemia no complicada por S.aureus originada en un catéter vascular no está bien definida por estudios controlados. En un metaanálisis se comprobó que tras la administración de 10 a 14días de tratamiento antibiótico sistémico la tasa de recidivas era del 6,1%53. No existe información disponible en la literatura sobre esta actitud en casos de bacteriemia causada por cepas de SARM. Sin embargo, la experiencia derivada de un ensayo clínico controlado hace aconsejable una duración similar del tratamiento antibiótico sistémico en estas situaciones, siempre que el catéter origen de la bacteriemia haya sido retirado y no se trate de una bacteriemia complicada54. La terapia secuencial por vía oral, con fármacos como el linezolid, podría plantearse en pacientes en situación clínica estable, sin complicaciones metastásicas y con hemocultivos negativos tras el inicio del tratamiento antibiótico y la retirada del catéter vascular55.
La práctica sistemática de una ecocardiografía transesofágica a todos los pacientes con bacteriemia por S.aureus originada en un catéter vascular, para evaluar la duración del tratamiento antibiótico sistémico, es un tema no resuelto. La ausencia de riesgo valvular cardíaco (valvulopatía conocida o detectada en el momento de la bacteriemia) y la respuesta clínica y microbiológica en un período de tiempo inferior a las 72h tras la retirada del catéter y el inicio de un tratamiento antibiótico adecuado proporcionan tasas de buena evolución, con ausencia de recidivas o complicaciones, en más del 95% de los pacientes tras una terapia de 10 a 14 días45.
Uno de los factores predictivos más importantes de bacteriemia complicada por S.aureus es la persistencia de la bacteriemia tras la retirada del catéter. En estas circunstancias es necesario realizar una ecocardiografia de buena calidad técnica para descartar la existencia de endocarditis. La duración del tratamiento antibiótico ha de adaptarse a los hallazgos de esta exploración. Asimismo, la tromboflebitis séptica de las venas centrales puede producir un cuadro clínico similar a la endocarditis infecciosa. La ausencia de hallazgos ecocardiográficos indicativos de la existencia de una endocarditis obliga a la realización de un estudio por ultrasonografía de los troncos vasculares en donde haya estado insertado el catéter vascular origen de la bacteriemia y a alargar la duración del tratamiento antibiótico40.
La duración adecuada del tratamiento de las BRCV causadas por bacilos gramnegativos no ha sido evaluada con precisión. En las recomendaciones de los expertos se aconseja la administración de al menos una semana de terapia sistémica tras la retirada del catéter vascular. Con esta actitud terapéutica las recurrencias son excepcionales40.
La candidemia no complicada originada en un catéter vascular precisa de la retirada del catéter y de la administración del antifúngico sistémico durante un período de tiempo de 14días después del primer hemocultivo negativo. Durante la primera semana de evolución es necesaria la práctica de un examen fundoscópico para descartar la existencia de afectación ocular, situación que obligaría a prolongar el tratamiento antifúngico hasta las 4semanas51,52.
Tratamiento conservador de la bacteriemia mediante el sellado con antimicrobianos de los catéteres vasculares41,49.A pesar de que la retirada del catéter es el tratamiento recomendado, en algunos enfermos puede considerarse un tratamiento conservador. En estos casos es fundamental que las concentraciones del antibiótico en el interior de su luz sean elevadas y mantenidas para así superar el fenómeno de tolerancia microbiológica asociada al crecimiento bacteriano en fase vegetativa, que se produce en la biocapa adherida al catéter. Estas técnicas conllevan el sellado endoluminal con antibióticos (antibiotic-lock technique). Este sellado consiste en la adición de antibióticos a la solución anticoagulante que se aplica tras el uso del catéter hasta su próxima utilización. Posibilita incluso evitar la necesidad de administración sistémica de antibióticos más allá de la prolongación del cuadro séptico asociado, aunque en espera de estudios controlados es recomendable la utilización del sellado como un tratamiento aditivo y no sustitutivo de la antibioticoterapia sistémica.
Las dosis utilizadas oscilan entre 1 y 10mg/ml. Se han empleado con éxito en el sellado diferentes antimicrobianos, como vancomicina, teicoplanina, cefazolina, clindamicina, rifampicina, aminoglucósidos y quinolonas. La mayoría de los casos publicados con sellado endoluminal utilizan heparina como anticoagulante. Recientemente se han comunicado en modelos experimentales mejores resultados con la utilización de oxazolidinonas (linezolid y eperezolid) que con vancomicina y gentamicina en infecciones por ECN de estafilococos, así como excelentes resultados en el modelo con daptomicina para S.aureus, tanto sensible como resistente a la meticilina. También se han utilizado con éxito sellados con minociclina, etanol, ácido etilen-diamino-tetracético (EDTA) y etanol y con citrato de taurolidina. En el modelo experimental se ha comprobado la eficacia del sellado con diversos antifúngicos para la infección por Candida, aunque la experiencia publicada en humanos es muy escasa.
El tratamiento conservador ha de llevar siempre implícita una especial vigilancia clínica del paciente, sobre todo durante las primeras 72h. Si el paciente sigue con síntomas sistémicos transcurrido ese tiempo es necesario valorar la retirada del catéter. La mejoría clínica asociada con la negativización de los hemocultivos periféricos puede ser un signo objetivo de una evolución favorable. La duración del tratamiento no está bien establecida, aunque se estima que no debería ser inferior a los 10-14días.
Las contraindicaciones más relevantes para no utilizar esta modalidad de tratamiento conservado de la BRCV son: sepsis grave o shock séptico, infecciones causadas por especies muy virulentas o de difícil erradicación (S.aureus, P.aeruginosa y Candida, especialmente), supuración o signos inflamatorios en el punto de inserción del catéter o en el trayecto subcutáneo de un CVC tunelizado, y recidiva precoz después de un primer tratamiento conservador.
Estrategias de prevenciónEl cumplimiento adecuado de una correcta higiene de manos y el uso de técnicas asépticas durante la inserción y los cuidados de los catéteres vasculares son las medidas fundamentales para la prevención de las infecciones relacionadas. De igual forma, la educación sanitaria de todo el personal sobre las indicaciones de uso de los catéteres vasculares, los procedimientos de inserción y mantenimiento y las medidas de control de las infecciones es también una estrategia preventiva de especial relevancia. Otras medidas preventivas incluyen la elección apropiada de los lugares de inserción de los catéteres, el uso de un material adecuado para cada tipo de catéter, la utilización de medidas de precaución de barrera máximas para la inserción de catéteres venosos centrales, el recambio de los equipos de perfusión a los intervalos adecuados, las curas adecuadas y asépticas de los puntos de inserción y la retirada rápida de los catéteres que no son necesarios para la perfusión de líquidos o medicamentos (tabla 7)56.
Estrategias generales de prevención de las infecciones asociadas con los catéteres vasculares
| Educación sanitaria |
| Realizar campañas de educación sanitaria a los trabajadores respecto a las indicaciones de uso de los catéteres vasculares, los procedimientos de inserción y mantenimiento y las medidas de control para la prevención de las infecciones relacionadas |
| Higiene de manos |
| Realizar una correcta higiene de manos, con agua y jabón o con derivados alcohólicos, para la actuación sobre los catéteres. El uso de guantes no excluye la higiene de manos |
| Técnicas asépticas durante la inserción y el cuidado de los catéteres |
| Mantener una técnica aséptica para la inserción y el cuidado de los catéteres. Para la inserción de los catéteres venosos centrales y de los catéteres arteriales se han de utilizar precauciones de barrera máximas |
| Actuaciones sobre el punto de inserción de los catéteres |
| Desinfectar la piel limpia con una solución de clorhexidina antes de la inserción de los catéteres o al cambiar o manipular los apósitosUsar gasas estériles o apósitos transparentes semipermeables para cubrir el punto de inserciónNo utilizar pomadas de antibióticos o cremas en los puntos de inserciónEvitar el uso del acceso a través de la vena femoral en los adultos. El acceso por vía subclavia es preferible a las vías yugular o femoral.Utilizar en los CVC el número mínimo de luces |
| Retirada de los catéteres vasculares |
| Retirar rápidamente cualquier catéter vascular que no sea necesario su utilizaciónLos CVC o los CVCIP no se han de recambiar de manera rutinaria y en ningún caso se ha de utilizar un recambio mediante guía metálica si existe sospecha de infección relacionada |
| Recambio de los sistemas de perfusión |
| Recambiar los sistemas de perfusión con unos intervalos no inferiores a las 72h, excepto si está clínicamente indicado. Los sistemas para administrar sangre o hemoderivados se han de cambiar cada 4h y los destinados a administrar emulsiones lipídicas cada 24h |
| Accesos de inyección intravenosos |
| Desinfectar los accesos de inyección intravascular preferentemente con alcohol al 70%, o con una solución de clorhexidina o yodada, antes de acceder al sistema |
En los últimos años se han realizado numerosos estudios para comprobar la eficacia de la utilización de catéteres impregnados con diversos antisépticos y antimicrobianos en la prevención de las infecciones relacionadas. En un metaanálisis reciente se ha comprobado que esta estrategia preventiva, de coste muy elevado, puede ser de utilidad para pacientes de riesgo elevado, especialmente para los accesos femorales o yugulares y si las frecuencias de infección son superiores a las esperadas después de aplicar las medidas estándar de prevención57.
El sellado preventivo con antimicrobianos o con soluciones de citrato ha sido evaluado para la prevención de las infecciones relacionadas con determinados catéteres de larga permanencia. En diversos metaanálisis se ha comprobado su posible utilidad en determinadas circunstancias, como los CVC para hemodiálisis, y aunque esta estrategia solo ha sido valorada en catéteres de duración intermedia (máximo 3-4meses), no existe información sobre la posible aparición de resistencias bacterianas y no se ha demostrado un impacto positivo sobre la mortalidad ni sobre los ingresos hospitalarios. El coste y la complejidad de esta medida preventiva son elevados, por lo que no puede efectuarse una recomendación generalizada de la misma58,59.
En relación con los CVP, recientemente se ha demostrado en un estudio prospectivo que su retirada sistemática, transcurridas las primeras 96h desde su inserción, no aporta un beneficio significativo para la disminución de las complicaciones infecciosas asociadas respecto a su mantenimiento, mientras sea precisa su utilización y sus condiciones de uso sean adecuadas60. Este estudio refuerza los datos analizados en una revisión sistemática del tema, que concluía que la retirada de los CVP debe realizarse únicamente cuando esté clínicamente indicada. En las situaciones en las que no pueda garantizarse que la inserción del dispositivo ha sido efectuada con las medidas asépticas adecuadas (p.ej., CVP colocados en servicios de urgencias sobresaturados), esta recomendación no ha sido evaluada de manera suficiente61.
En los últimos años se han implementado estrategias, agrupadas en paquetes de actividades educativas y de intervención mediante la aplicación estricta de una serie de medidas de evidencia científica probada en la inserción y el mantenimiento de los CVC, de prevención de las bacteriemias relacionadas con los catéteres vasculares que han condicionado una reducción muy significativa de las tasas de este tipo de infecciones, fundamentalmente en las áreas de pacientes críticos19. En nuestro país, la aplicación del Programa denominado Bacteriemia Zero ha demostrado en las UCI participantes (68% de las unidades de todo el país) una disminución del 50% en la tasa de BRCV durante un período de 2años62. En los pacientes hospitalizados en unidades convencionales existe menos información sobre la eficacia de este tipo de programas, aunque recientemente se ha publicado que la aplicación de estas estrategias puede ser también eficaz en la reducción de las tasas de bacteriemia asociada a los CVC63. Estas experiencias han sido evaluadas por diversas instituciones que en la actualidad recomiendan que su aplicación sistemática sea prioritaria en todas las instituciones sanitarias para garantizar la seguridad clínica de los pacientes hospitalizados64.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion