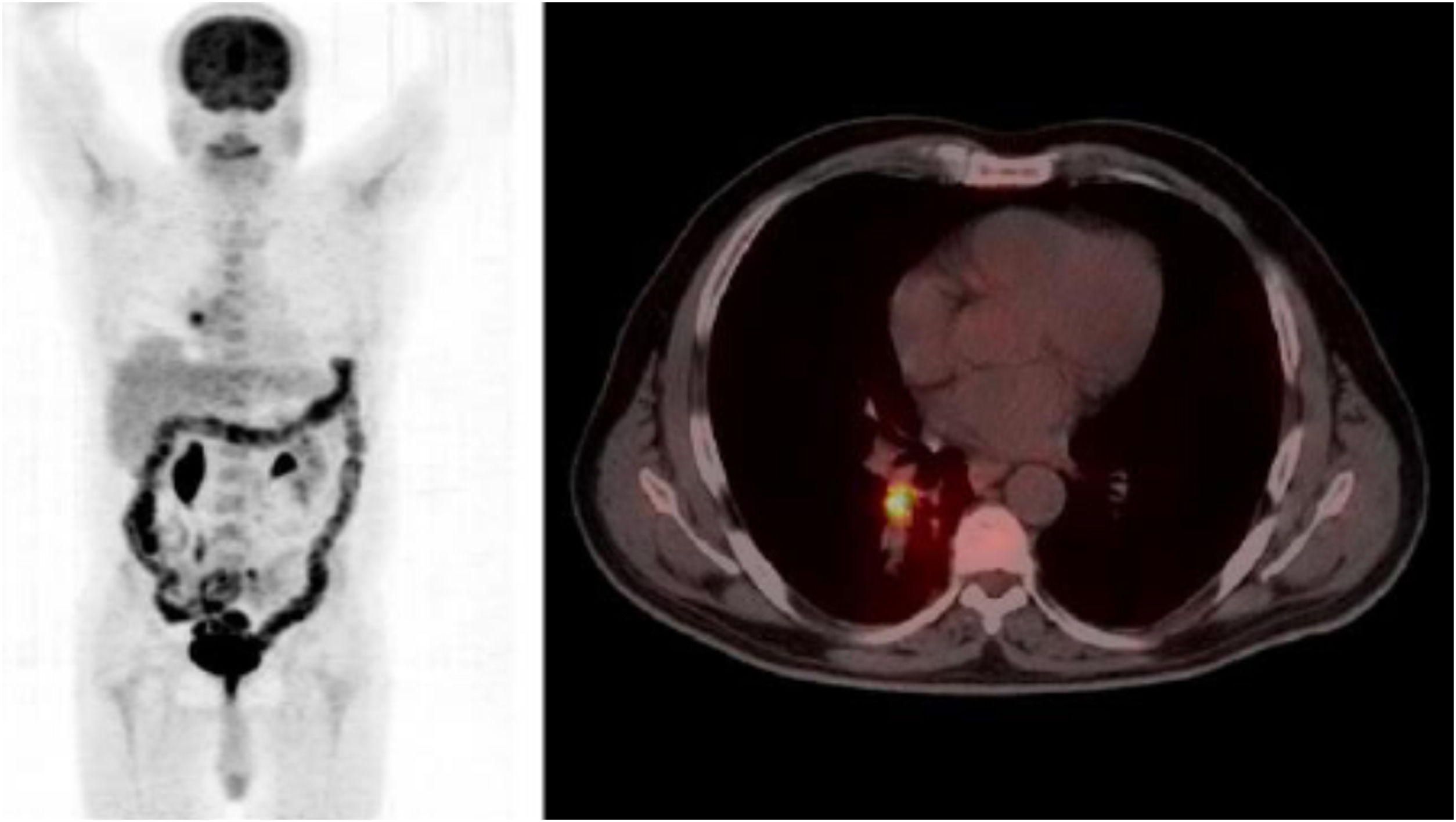
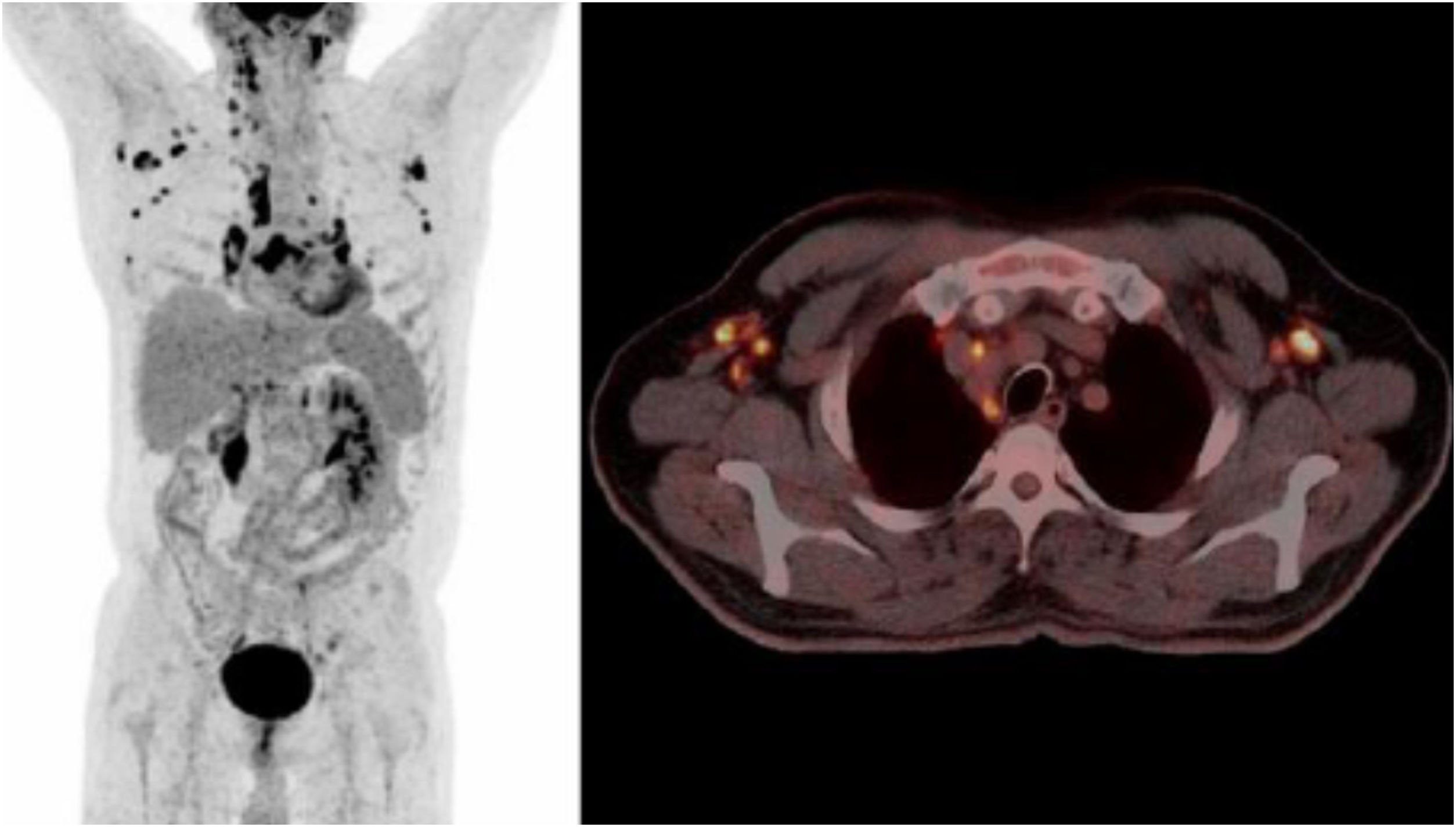
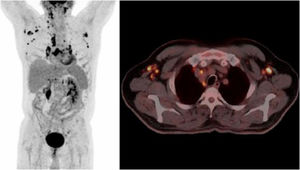
Describimos el caso de un varón de 66 años, diabético en tratamiento con metformina, diagnosticado de un carcinoma escamoso de pulmón en lóbulo superior derecho de 13mm, con extensión a un único ganglio subcarinal (T1N2M0) (fig. 1). Tras la administración de un primer ciclo de quimioterapia con gemcitabina y cisplatino, presentó un cuadro de fiebre de hasta 39°C sin focalidad, con pancitopenia leve asociada. Se inició tratamiento empírico con levofloxacino. Una semana después persistían episodios de fiebre intermitente a pesar de la recuperación hematológica. Al finalizar el segundo ciclo de quimioterapia, se realizó una PET en el que se observaba una progresión adenopática generalizada (fig. 2).
Se realizó una biopsia escisional de una adenopatía axilar izquierda captante en la PET. El diagnóstico anatomopatológico fue compatible con histiocitosis sinusal. Se solicitaron serologías frente a rubéola, brucelosis, CMV, VEB, VIH, VH-6 y sífilis, que resultaron negativas para infección reciente. La prueba de QuantiFERON® (Qiagen, Hilden, Germany) para tuberculosis fue negativa. La IgG frente a Toxoplasma fue positiva (4.642 UI/ml) y la IgM fue resultó también positiva. Se realizó PCR sobre el tejido ganglionar resultando positiva para Toxoplasma spp.
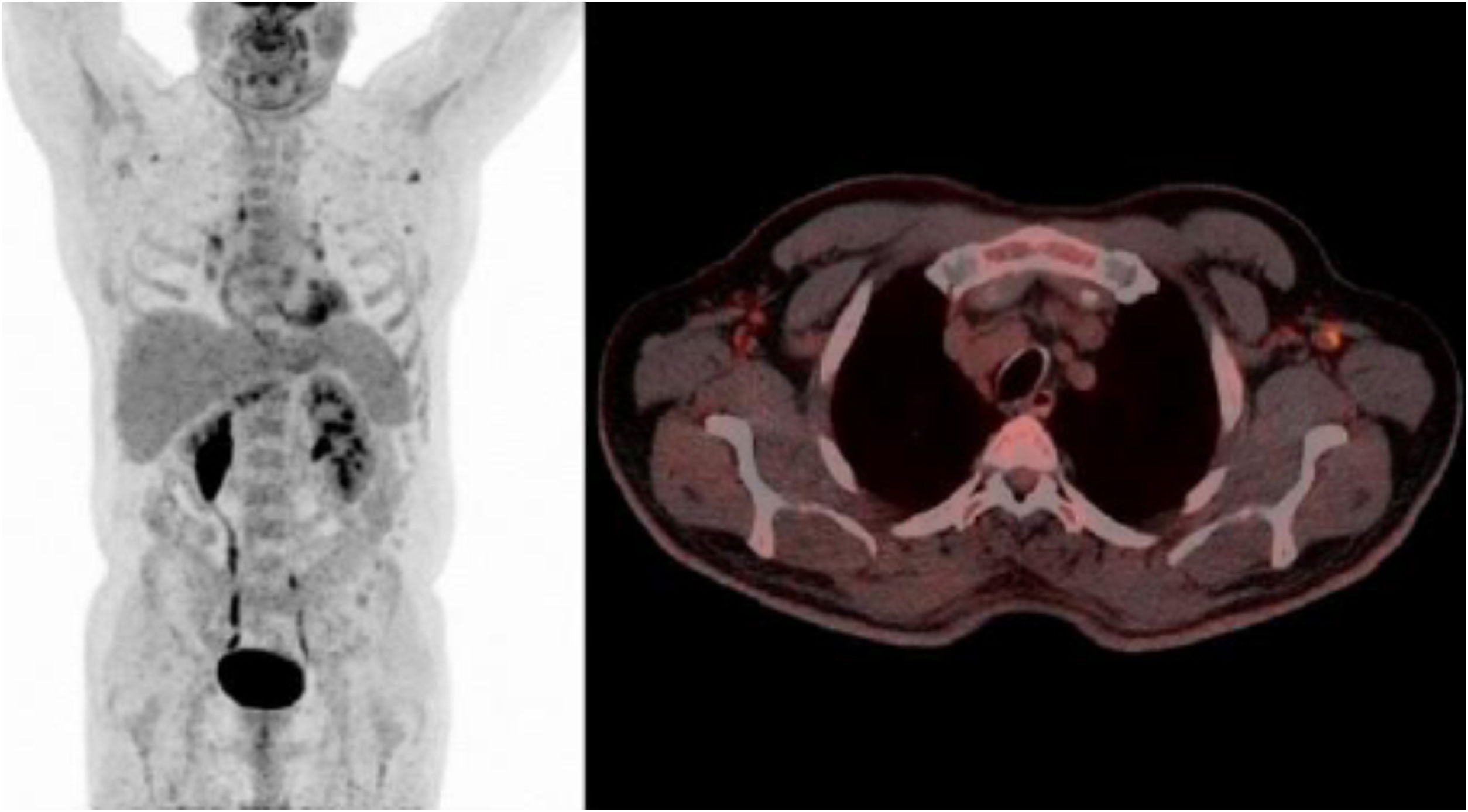
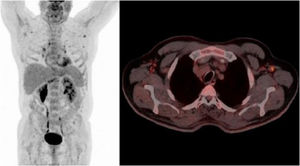
Se estableció el diagnóstico de reactivación de toxoplasmosis. El paciente inició tratamiento con trimetoprim-sulfametoxazol (800/160mg cada 8 h), presentando una franca mejoría clínica. Se repitió la PET a las 3semanas de tratamiento, donde se observó una disminución generalizada de la intensidad de captación en los distintos territorios ganglionares (fig. 3). La serología realizada un mes después del diagnóstico demostró un aumento de IgG (11.034 UI/ml), que fue disminuyendo en determinaciones posteriores, reflejando la evolución natural de una reactivación. El paciente inició posteriormente radioterapia y completó quimioterapia concomitante con buena respuesta, entrando en programa de revisiones periódicas y sin signos de reactivación de la infección hasta la fecha (6 meses después).
Comentario finalLa infección por Toxoplasma gondii (T. gondii) suele cursar habitualmente de forma asintomática en el paciente inmunocompetente. Después de la infección inicial (incluso si es asintomática), la infección latente persistirá durante la vida del huésped. En pacientes con algún tipo de déficit inmunitario (tratamiento quimioterápico con agentes alquilantes, antimetabolitos, infección por VIH, trasplante de precursores hematopoyéticos o de órgano sólido) puede dar lugar a cuadros diseminados con afectación pulmonar, cardíaca y sobre todo del sistema nervioso central, ya que son potenciales factores de riesgo para la reactivación de T. gondii1,2. En estos casos, dada la elevada prevalencia de la infección previa, es más frecuente la reactivación que la primoinfección.
Los casos descritos de reactivación de toxoplasmosis han sido asociados con neoplasias hematológicas2. Por lo que sabemos, no se ha descrito esta asociación con tumores sólidos como en nuestro caso.
El diagnóstico de una toxoplasmosis puede ser un reto en pacientes como el presentado, en los que la presencia de adenopatías de nueva aparición sugiere una progresión de la neoplasia. En la toxoplasmosis, la histología ganglionar es habitualmente inespecífica, siendo habitual la histiocitosis sinusal1,3. El diagnóstico de certeza puede realizarse mediante serología3. La primoinfección se caracteriza por la aparición de anticuerpos de tipo IgM, acompañada de seroconversión con IgG de baja avidez. La IgM puede permanecer en suero durante un largo periodo de tiempo, y con frecuencia su concentración se eleva en las reactivaciones. El patrón típico de la reactivación se caracteriza por un aumento en las concentraciones de IgG de alta avidez, independientemente de la presencia de IgM1,2.
Las técnicas de diagnóstico molecular, como la PCR para T. gondii en suero, líquido cefalorraquídeo o biopsias de tejidos, puede resultar de utilidad3. Estas técnicas pueden ser de ayuda cuando las serologías no son concluyentes, situación frecuente en el paciente inmunodeprimido2. El diagnóstico por imagen puede resultar de ayuda en algunos casos4, como, por ejemplo, en la toxoplasmosis cerebral, donde una imagen compatible justifica el inicio de un tratamiento empírico frente a toxoplasma. Otras entidades que deberían incluirse en el diagnóstico diferencial de este caso son, además de una progresión de la enfermedad neoplásica, la enfermedad de Rosai-Dorfman, síndromes linfoproliferativos, infección por VIH, VEB, CMV y VH-6 o las micobacteriosis1.
En conclusión, la reactivación de una toxoplasmosis debe formar parte del diagnóstico diferencial ante un cuadro poliadenopático en un paciente oncológico, siendo las serologías y la respuesta al tratamiento las principales herramientas diagnósticas. Dada la gravedad que pueden tener las formas diseminadas de la enfermedad, es importante el tratamiento temprano que en muchos casos permite la resolución completa del cuadro.
FinanciaciónNinguna.
Conflicto de interesesJosé Luis del Pozo ha participado en actividades formativas o de consultoría financiadas por Pfizer, MSD, Gilead y Novartis.
Resto de autores: sin conflicto de intereses.
No.