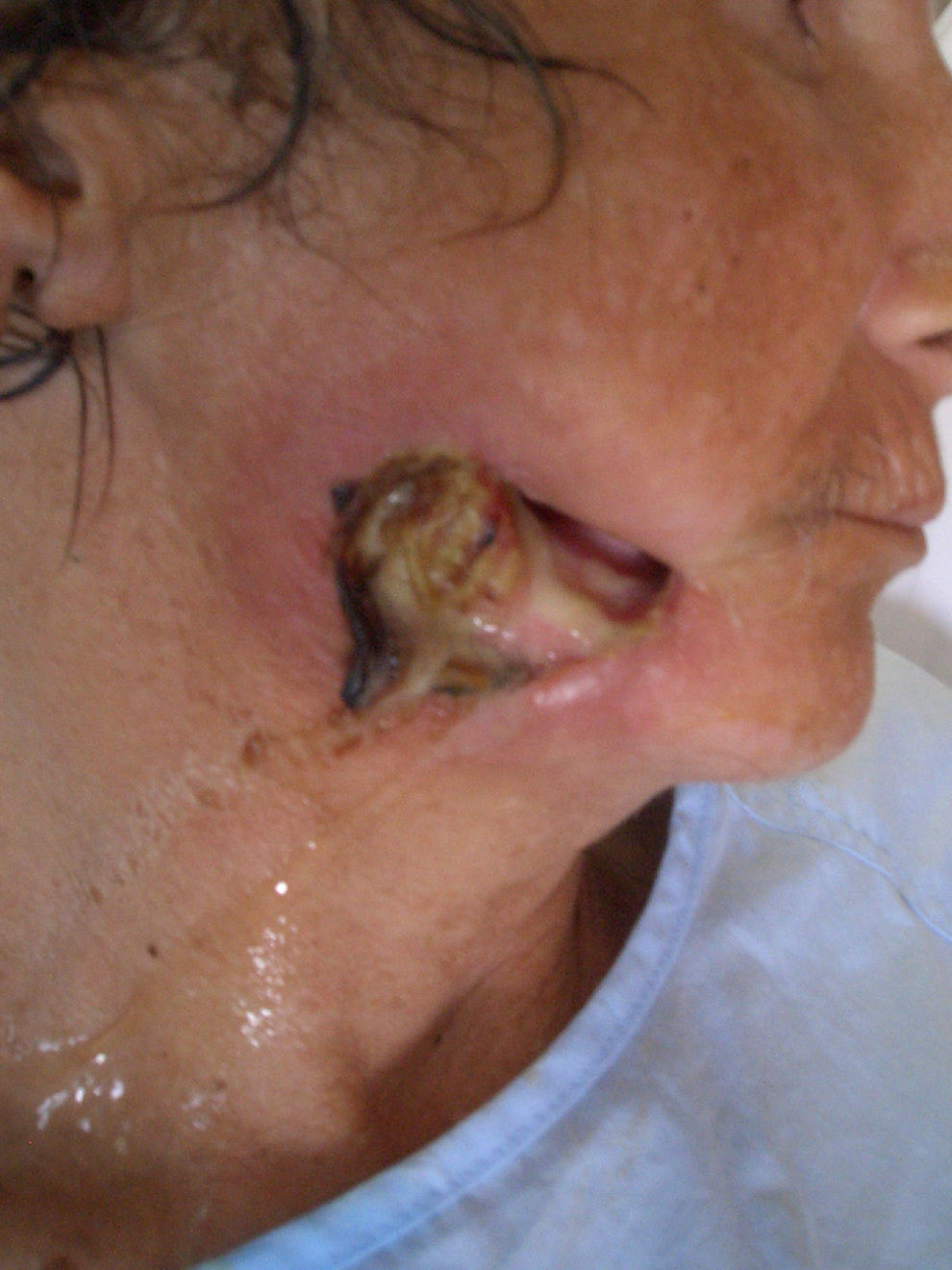
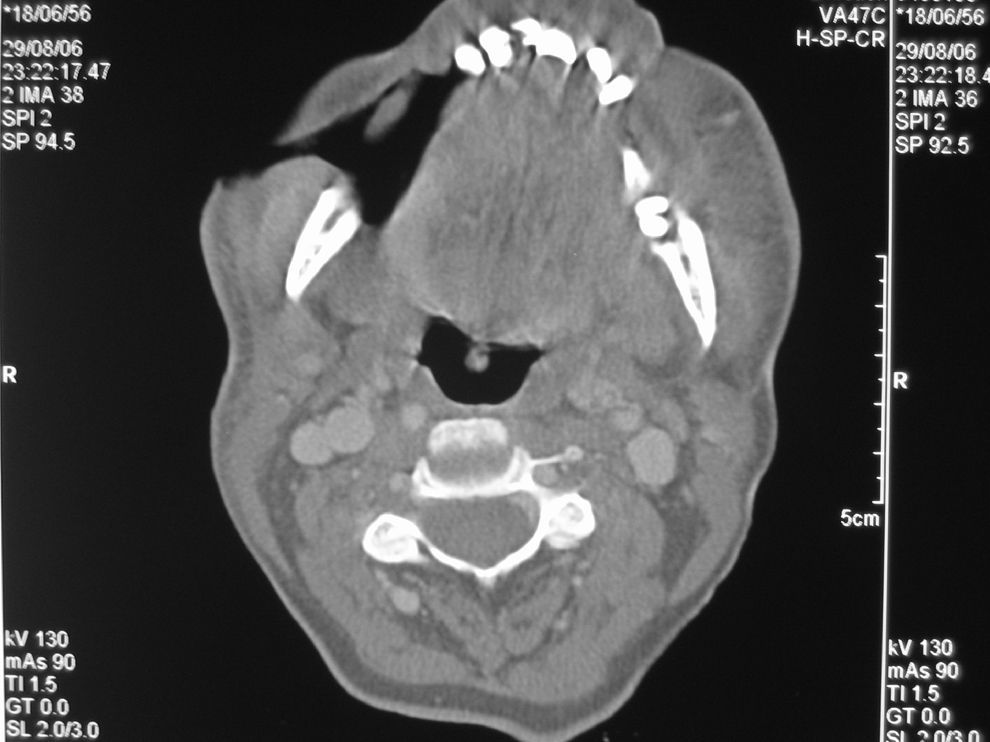
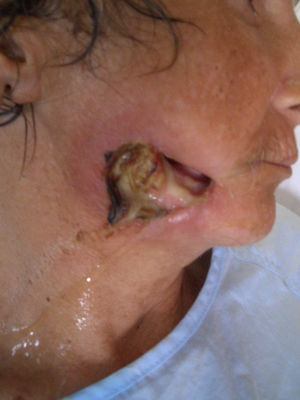
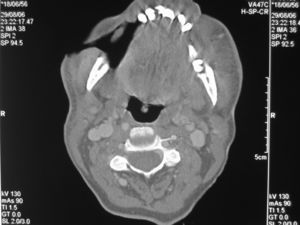
Mujer de 50 años de edad de nacionalidad española con antecedentes de uso de drogas por vía parenteral, hepatopatía por virus de la hepatitis C e infección por virus de la inmunodeficiencia humana (VIH) estadio B3, sin tratamiento antirretroviral desde hacía 8 meses por abandono. La última carga viral de que se disponía era mayor de un millón de copias ARN/ml y los linfocitos CD4 de 6 células/mm3. Presentaba trastorno maniacodepresivo con varios episodios de depresión. En la actualidad vivía sola. Refería una lesión perforante en mejilla derecha no dolorosa de 2 semanas de evolución, que le dificultaba la masticación por la salida de los alimentos a través de ésta. En la exploración física, la paciente estaba afebril, caquéctica (índice de masa corporal [IMC]: 15,62), con halitosis, mal estado general con facies triste y discurso lento. En mejilla derecha presentaba una lesión perforante, de aspecto necrótico, maloliente, de 2cm de diámetro, con emisión de saliva y descarga purulenta (fig. 1). No se palpaban adenopatías y las exploraciones cardiopulmonar, abdominal, de miembros y neurológica fueron anodinas. La analítica mostró leucocitopenia (1.960leucocitos/μl), hemoglobina de 11g/dl, 198.000 plaquetas y una velocidad de sedimentación globular de 79mm/h. Los linfocitos CD4 en ese momento fueron de 30células/mm3 y se solicitó serología luética con reagina plasmática rápida (RPR) negativo. La radiografía de tórax fue normal y la tomografía computarizada maxilar evidenció destrucción de partes blandas con afectación ósea (fig. 2). Una biopsia de la lesión informó la presencia de una úlcera con flora cocácea y trombos en profundidad; tras tinción con plata se visualizaron bacilos helicoidales. La baciloscopia tras tinción de Ziehl-Neelsen fue negativa. En el cultivo de la biopsia se aislaron Staphylococcus aureus sensible a la meticilina, Bacteroides uniformis y Prevotella intermedia.
EvoluciónIniciamos tratamiento con nutrición parenteral, curas locales con antiséptico y tratamiento antibiótico intravenoso con amoxicilina-clavulánico en dosis de 1g cada 8h y metronidazol en dosis de 500mg cada 8h. Posteriormente, se administraron antirretrovirales por vía oral (lamivudina: 300mg/día, zidovudina: 500mg/día y atazanavir: 300mg/día, potenciado con ritonavir: 100mg/día). Cirugía maxilofacial realizó la valoración, y se decidió mantener tratamiento conservador y posterior reconstrucción quirúrgica. Tras evaluación psiquiátrica se diagnostica depresión mayor e inicia tratamiento con antidepresivos (citalopram: 10mg por vía oral/día). En el momento del alta presenta un orificio menor de 1cm y aumento ponderal. Al año del diagnóstico se realizó cirugía reconstructiva.
DiagnósticoCancrum oris (noma) en paciente con VIH estadio B3.
ComentarioEl cancrum oris (también llamado noma, palabra griega que significa devorar) consiste en una gingivitis necrosante ulcerativa con destrucción de tejidos blandos y partes óseas de la región orofacial. Se considera una infección oportunista promovida por la pobreza extrema y la desnutrición1. Aunque la mayoría de los casos comunicados corresponden a zonas geográficas subdesarrolladas, hay que recordar que el noma fue común en Europa y Norteamérica hasta principios del siglo XX1,2. Más recientemente se han comunicado casos esporádicos asociados a la infección por el VIH3,4. La presencia de bacilos fusiformes y espiroquetas son los principales hallazgos en el estudio microscópico de las lesiones de noma3. En los aislamientos microbiológicos Fusobacterium spp. y P. intermedia son los principalmente implicados1,5,6, aunque también se han asociado determinados virus al desarrollo del noma, como citomegalovirus, el virus del herpes simple y el virus del sarampión1. Realmente se piensa en una interacción compleja entre el estado de desnutrición, la alteración del sistema inmunológico y la infección por determinados virus1,2: todo esto conllevaría al deterioro de la integridad de la mucosa, al crecimiento de microorganismos patógenos y al aumento del estrés oxidativo, con el desarrollo de la úlcera oral y posterior evolución1. Se ha postulado también una teoría vascular donde la microtrombosis en los capilares podría desempeñar un papel importante en el desarrollo del noma2. Comienza como una gingivitis que se extiende rápidamente a través de los tejidos orofaciales, principalmente a labio y mejilla, y que llega a producir una lesión perforante que puede afectar a mandíbula, maxilar superior y nariz2. La gingivitis necrosante ulcerativa se considera una lesión precursora del noma2,3,6,7 y es la exposición de hueso el punto de corte entre una entidad y otra. Los factores de riesgo para el desarrollo de noma incluyen la malnutrición, que es una de las principales condiciones asociadas debido a sus consecuencias sobre el sistema inmunitario 1–3,6–8, la pobre higiene oral1,2 y enfermedades como la malaria y la infección por el virus del sarampión en países subdesarrollados donde la vacunación de la población no es global, aunque cualquier enfermedad debilitante puede estar relacionada con el noma, como la infección por VIH, recientemente implicado2–4. Aunque la forma clásica de la enfermedad afecta a niños menores de 12 años que residen en países subdesarrollados, también se han comunicado casos en adultos residentes en regiones subdesarrolladas de Asia9, adultos caucásicos sin los factores de riesgo clásicos10 y pacientes inmunodeprimidos de países desarrollados, especialmente asociados a enfermedades hematológicas y recientemente a infección por el VIH2. La combinación entre gingivitis necrosante ulcerativa e infección por VIH puede suponer un factor importante para el desarrollo de noma en nuestro medio. La edad media de los pacientes con noma e infección por VIH es similar a la de aquellos no infectados; igualmente es más prevalente en niños, pero con un curso más rápido que en la población que no tiene VIH. El tratamiento inicial del noma consiste en realizar tratamiento conservador durante la fase aguda con el uso de desinfectantes tópicos, antibióticos sistémicos y desbridamiento de las zonas necróticas, así como la corrección del estado hidroelectrolítico del paciente y una correcta nutrición parenteral1,2. La reconstrucción quirúrgica puede realizarse de forma temprana después de haberse resuelto el cuadro agudo infeccioso y no parecen existir diferencias en los resultados entre los pacientes con infección por VIH y los no infectados3,4.