Determinar en pacientes infectados por VIH: a) La prevalencia de infección activa por el virus de la hepatitis C (VHC) y el virus de la hepatitis B (VHB), así como de la exposición previa al virus de la hepatitis A (VHA), VHB y VHC. b) La proporción que han sido vacunados frente al VHA y/o VHB. c) La distribución genotípica del VHC y el porcentaje de pacientes que han iniciado tratamiento frente al VHC.
MétodosEstudio prospectivo de corte transversal. Se incluyeron los pacientes infectados por VIH que acudieron a las consultas de enfermedades infecciosas de un hospital de Andalucía entre septiembre 2008 y febrero 2009.
ResultadosSe incluyeron 520 pacientes. Trescientos cincuenta y ocho (69%) enfermos presentaban anticuerpos del VHC positivo, mientras el 71% de ellos tenían ARN-VHC detectable. La distribución genotípica del VHC fue: 153 (62%) genotipo 1, 49 (20%) genotipo 3, y 45 (18%) genotipo 4. Ciento trece (36,5%) sujetos habían recibido tratamiento anti-VHC. La prevalencia de infección activa por VHB fue del 4,4%, mientras que la de exposición previa fue del 54,8%. Cuatrocientos treinta y siete (84%) enfermos presentaron anti-VHA positivo. El 25,6 y el 22,3% de los pacientes susceptibles habían sido vacunados frente al VHA y al VHB, respectivamente.
ConclusionesLa prevalencia actual de infección activa por VHC en los pacientes infectados por VIH sigue siendo elevada en nuestra área. La distribución genotípica del VHC no parece haber sufrido modificaciones notables. El número de pacientes susceptibles de ser vacunados frente al VHA y al VHB que reciben esta terapia preventiva es bajo.
To determine: (a) The prevalence of active infection by the hepatitis C virus (HCV) and hepatitis B virus (HBV) in HIV-infected patients, as well as previous exposure to hepatitis A virus (HAV), HBV and HCV. (b) The proportion of patients who have been vaccinated against HAV and/or HBV. (c) The HCV genotype distribution and the percentage of patients who have started treatment against HCV infection.
MethodsAll HIV-infected patients who attended the Infectious Diseases Unit of a tertiary care hospital in Southern Spain between September 2008 and February 2009 were included in a prospective cross-sectional study.
ResultsA total of 520 patients were included. Three hundred and fifty-eight (69%) patients had positive HCV antibody, while 71% of them showed detectable HCV-RNA. The HCV genotype distribution was: 153 (62%) genotype 1, 49 (20%) genotype 3, and 45 (18%) genotype 4. One hundred and thirteen (36.5%) subjects had received treatment against HCV. The prevalence of active HBV infection was 4.4%, while the exposure to HBV was 54.8%. Four hundred and thirty-seven (84%) patients had positive markers of infection of HAV. Of the patients eligible to be vaccinated, 25.6% and 22.3% patients were vaccinated against HAV and HBV, respectively.
ConclusionsThe current prevalence of active HCV infection remains high in our area. There were no changes in the HCV genotype distribution. The number of patients with indication for HBV and HAV vaccination and receive these vaccines is low.
Un considerable porcentaje de pacientes infectados por el virus de la inmunodeficiencia humana (VIH) están infectados por el virus de la hepatitis C (VHC), debido a que ambos agentes comparten vías de transmisión1,2. Así, estudios realizados en España hace aproximadamente una década, antes de que se generalizara el tratamiento con interferón pegilado (IFN-peg) y ribavirina (RBV), demostraron que entre el 61 y el 65% de los individuos infectados por VIH eran seropositivos para el VHC y que el 85% de estos sujetos tenían viremia plasmática del VHC detectable3. Una de las posibles causas de esta elevada prevalencia era que hace una década solo alrededor del 15% de los pacientes coinfectados por el VIH/VHC había recibido tratamiento frente al VHC3. Asimismo, durante este periodo la infección por el VHC se producía predominantemente por el genotipo 1 (54-64%), seguido por el genotipo 3 (21-28%) y 4 (12-16%)3,4. Por lo que respecta a la información disponible en nuestro país sobre las infecciones por el virus de la hepatitis A (VHA) y el virus de la hepatitis B (VHB) en el paciente infectado por VIH, la prevalencia de infección activa y de exposición previa por el VHB era del 5 y del 60-67%, respectivamente3, mientras que aproximadamente el 75% de estos pacientes habían estado expuestos al VHA3.
En los últimos años la situación epidemiológica de estas coinfecciones en el individuo portador del VIH ha podido cambiar en nuestra área por diversos motivos. Por un lado, en lo que se refiere a la coinfección por VIH/VHC, tanto la disminución del porcentaje de enfermos adictos a drogas por vía parenteral (ADVP)5, que podría haber reducido el riesgo de infección por VHC, como la mayor cobertura y eficacia del tratamiento generalizado con IFN-peg y RBV han podido cambiar la prevalencia de esta coinfección6-8. Además, la distribución de genotipos del VHC ha podido experimentar cambios, dado que la eficacia de la terapia con IFN-peg y RBV es diferente en los genotipos 1, 4 y 3, presentando este último una mayor tasa de respuesta viral sostenida al tratamiento frente al VHC6-8. Por lo que respecta a las coinfecciones por VIH/VHB y VIH/VHA, las mejoras en las condiciones socioeconómicas y de educación, así como la mayor difusión de las estrategias de vacunación recomendadas frente al VHB y al VHA9, han podido cambiar la prevalencia de estas infecciones en nuestra población. Por las razones expuestas, sería de especial interés obtener información actualizada sobre las cuestiones planteadas mediante estudios de prevalencia de infección por VHC, VHA y VHB en pacientes portadores del VIH.
Los objetivos de estudio fueron determinar, en un hospital universitario en el sur de España:
- •
La prevalencia actual de infección activa por VHB y VHC, así como la de exposición previa al VHA, VHB y VHC en pacientes infectados por VIH.
- •
La proporción de los pacientes infectados por VIH que han sido vacunados frente al VHA y/o VHB, dentro de los que son susceptibles de recibir estas vacunas.
- •
La distribución genotípica de la infección por VHC, así como el porcentaje de pacientes coinfectados por VIH y VHC que han iniciado tratamiento frente a este último.
Se trata de un estudio prospectivo de corte transversal realizado en la unidad de enfermedades infecciosas y microbiología de un hospital universitario del sur de España. En él se incluyeron todos los pacientes infectados por el VIH mayores de 18años que fueron evaluados en el área de consultas externas entre septiembre de 2008 y febrero de 2009. En las consultas de esta unidad los pacientes infectados por VIH son evaluados, al menos, una vez cada 6 meses. Los datos se obtuvieron de la entrevista a los pacientes, la revisión de historias clínicas y de las bases de datos del servicio de medicina preventiva y de la unidad de enfermedades infecciosas y microbiología.
Los pacientes susceptibles a ser vacunados frente al VHB fueron los que presentaban antígeno de superficie del VHB (HBsAg) negativo, anticuerpo contra el antígeno del core del VHB (anti-HBc) negativo y anticuerpo frente al antígeno de superficie del VHB (anti-HBs) negativo en determinaciones previas, mientras que se consideró que un enfermo era susceptible de ser vacunado frente al VHA si mostraba previamente anticuerpos totales frente al VHA (anti-VHA) negativo. Toda la información sobre las determinaciones previas de los pacientes susceptibles de ser vacunados frente al VHB o al VHA y la de los vacunados contra estos virus se obtuvo de la revisión de historias clínicas y de las bases de datos del servicio de medicina preventiva y de la unidad de enfermedades infecciosas y microbiología de nuestro hospital.
Determinaciones de laboratorioLa infección por VIH fue diagnosticada por ELISA y confirmada por Western-Blot. La cuantificación de ARN del VHC se realizó por PCR (COBAS® Amplicor HCV Test Roche Diagnostic Systems Inc., Pleasanton, CA, EE.UU.: límite de detección 10IU/ml). Los genotipos del VHC fueron determinados por LIPA (Versant HCV Genotype 2,0 LIPA; Siemens, Tarrytown, NY, EE.UU.). Asimismo, se determinaron los siguientes marcadores serológicos mediante enzimoinmunoanálisis (EIA) (ADVIA Centaur XP, SiemensHealthcare Diagnostics S.L. Tarrytown, NY, EE.UU.): anti-VHA, HBsAg, anti-HBc, anti-HBs y anticuerpo del VHC (anti-VHC).
Análisis estadísticoSe realizó un análisis descriptivo en el que las variables cuantitativas se expresaron como medianas (Q1-Q3) y las variables cualitativas como número (porcentaje). Para analizar las relaciones entre las variables cualitativas se realizaron tablas de contingencia y se aplicó la prueba chi-cuadrado. El análisis estadístico descriptivo e inferencial fue realizado usando el paquete estadístico SPSS 17 (SPSS Software Inc., Chicago, Illinois, EE.UU.).
Aspectos éticosEste estudio se realizó de acuerdo con la declaración de Helsinki y fue aprobado por el Comité de Ética del Hospital Universitario de Valme (Sevilla).
ResultadosCaracterísticas de la población estudiadaUn total de 520 pacientes fueron incluidos en este estudio. La mediana (Q1-Q3) de edad fue 43,5 (39-47) años. Entre la población incluida, 414 (80%) sujetos eran hombres. Trescientos diecinueve (61%) enfermos habían sido previamente ADVP. Ciento once (21%) sujetos habían adquirido el VIH por contacto heterosexual, 75 (14%) eran varones homosexuales (VH) y en 15 (2,9%) sujetos la vía de transmisión del VIH era desconocida. De acuerdo a su lugar de origen, 506 (97%) pacientes eran españoles, 2 (0,3%) portugueses, 2 (0,3%) africanos, 4 (0,7%) latinoamericanos y 6 (1,1%) procedían de Europa del Este.
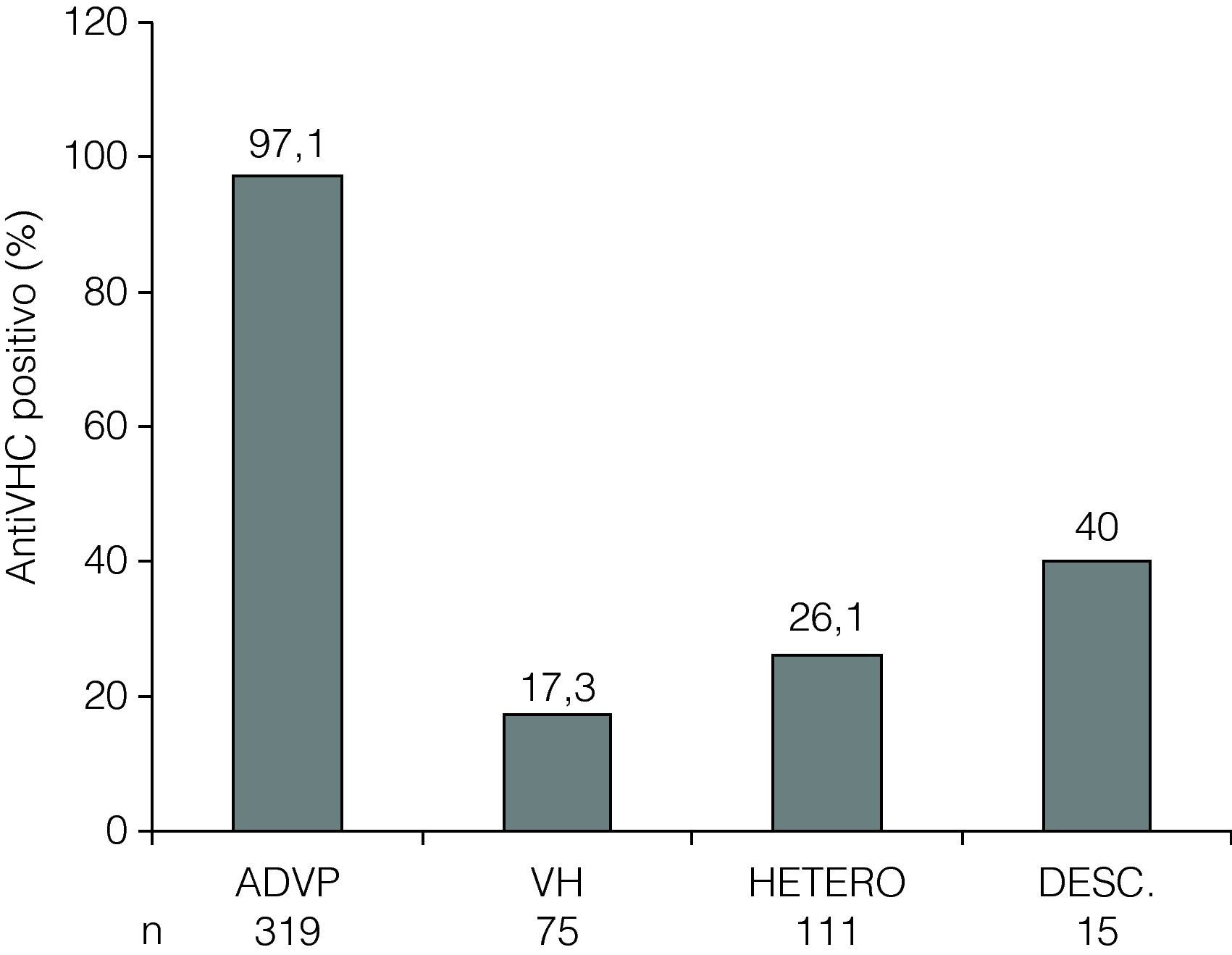
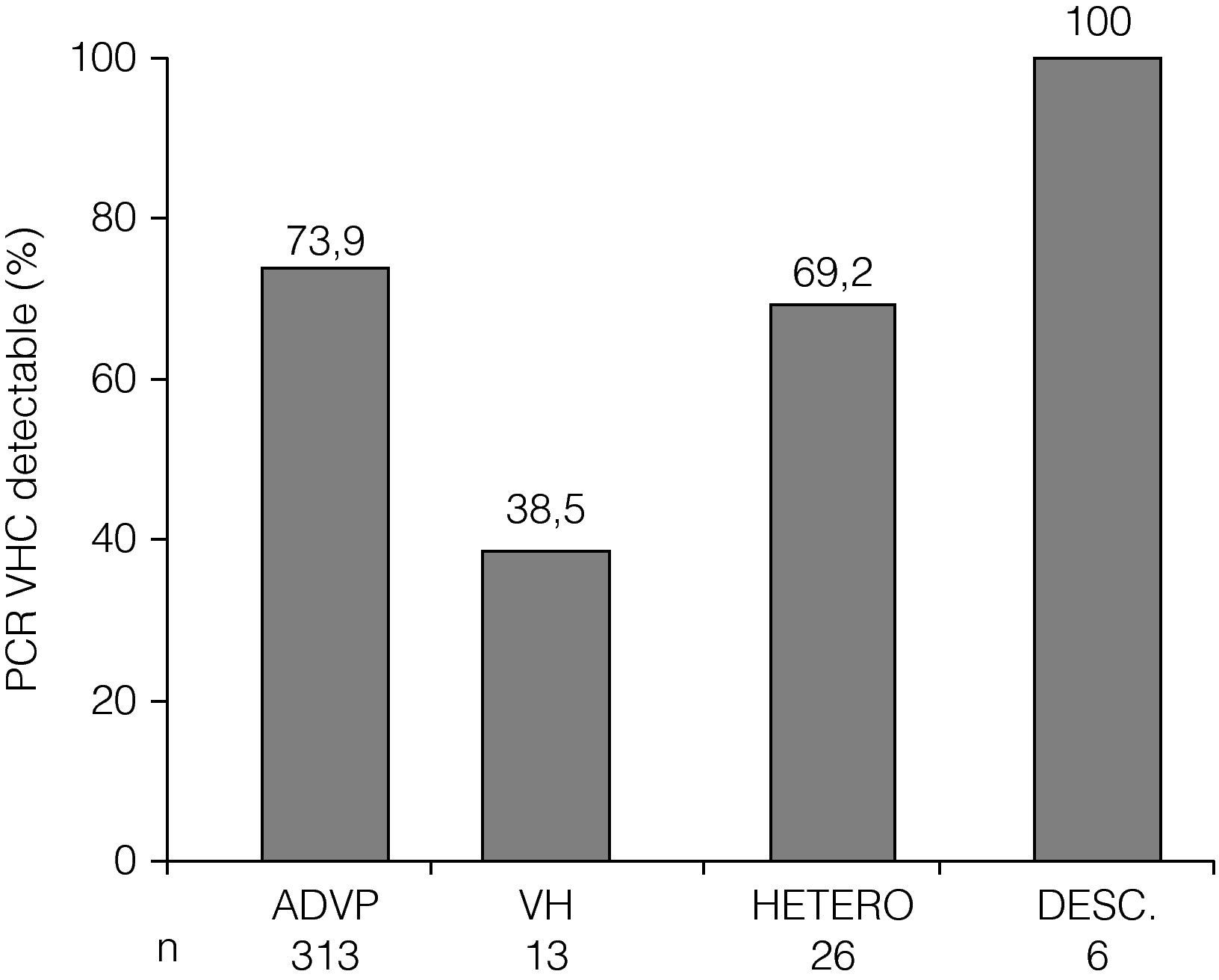
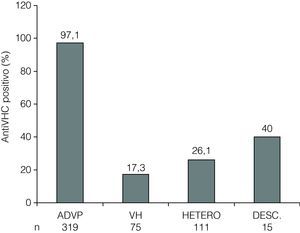
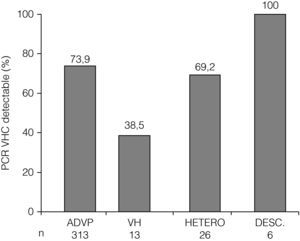
Marcadores de infección por VHCUn total de 358 (69%) individuos presentaron anti-VHC positivo (tabla 1). De estos enfermos, 255 (71%) pacientes tenían ARN-VHC plasmático detectable (tabla 1). La prevalencia de anti-VHC positivo y de ARN-VHC plasmático detectable fue significativamente diferente entre los distintos grupos de riesgo (figs. 1 y 2). La distribución de genotipos del VHC entre los 255 individuos con ARN-VHC plasmático detectable fue: 153 (62%) eran portadores del genotipo 1, 49 (20%) del genotipo 3, 45 (18%) del genotipo 4, y 8 eran no genotipables. Ciento trece (36,5%) pacientes habían recibido tratamiento frente al VHC antes de haber sido incluidos en el estudio.
Prevalencia de los marcadores de infección por el virus de la hepatitis B y C en la población de estudio
| Prevalencia | n=520 |
| HBsAg positivo+anti-HBc positivo, n (%) | 23 (4,4) |
| Anti-HBs positivo+anti-HBc positivo, n (%) | 121 (23,3) |
| HBsAg negativo+anti-HBs negativo+anti-HBc negativo, n (%) | 169 (32,5) |
| Anti-HBc aislado, n (%) | 144 (27,7) |
| Anti-HBs aislado, n (%) | 63 (12,5) |
| Anti-VHC positivo, n (%) | 358 (69) |
| PCR VHC detectable, n (%)a | 255 (71) |
HBsAg: antígeno de superficie del VHB; anti-HBc: anticuerpo contra el antígeno del core del VHB; anti-HBs: anticuerpo frente al antígeno de superficie del VHB.
Prevalencia de anti-VHC positivo en pacientes infectados por VIH por factor de riesgo de infección por VIH. ADVP: adictos a drogas por vía parenteral; VH: varones homosexuales; HETERO: heterosexuales; DESC: desconocido. p<0,0001 para la comparación entre todos los grupos de riesgo.
Prevalencia de ARN-VHC plasmático detectable en pacientes infectados por VIH por factor de riesgo de infección por VIH. ADVP: adictos a drogas por vía parenteral; VH: varones homosexuales; HETERO: heterosexuales; DESC: desconocido. p<0,015 para la comparación entre todos los grupos de riesgo.
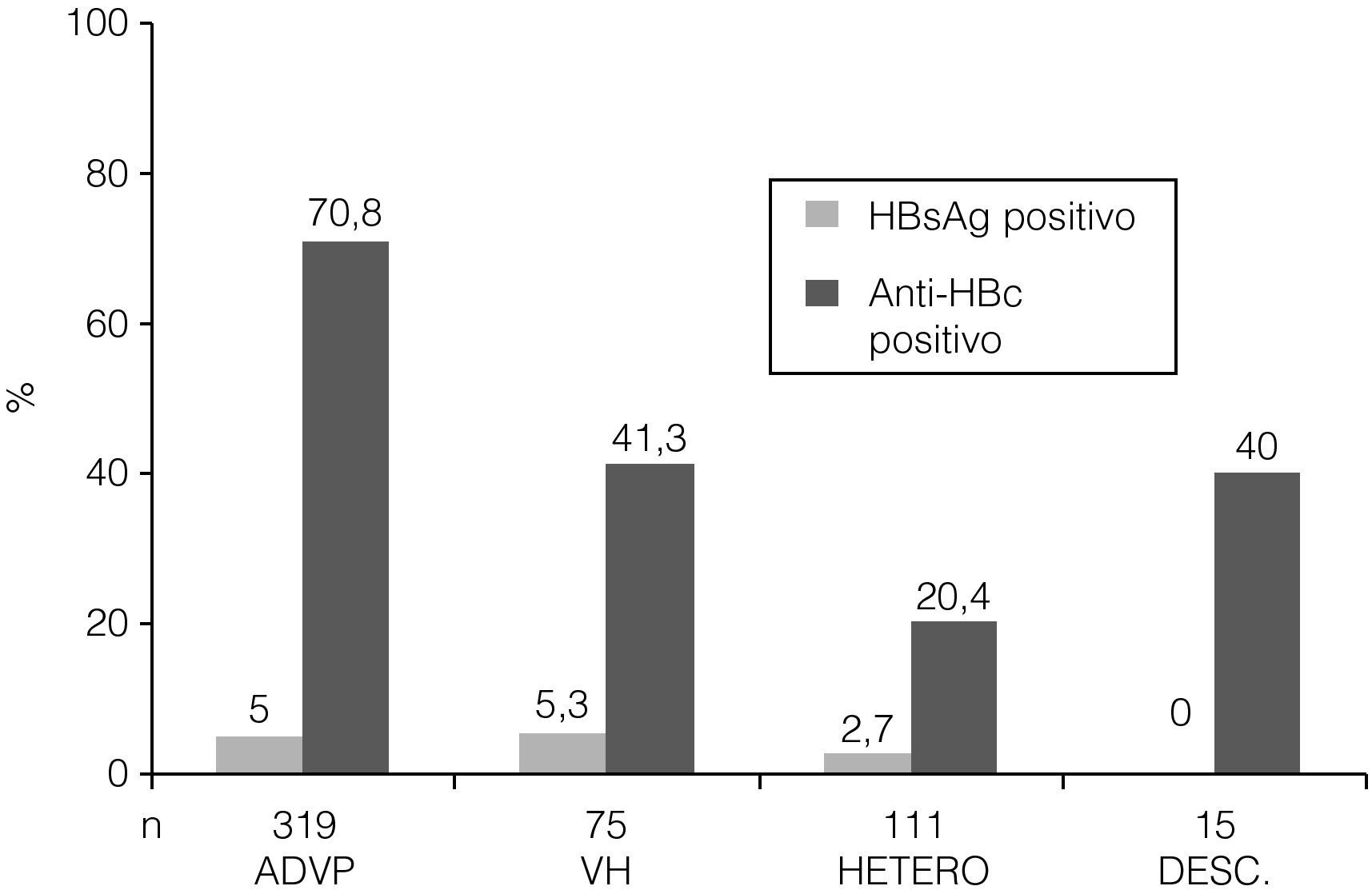
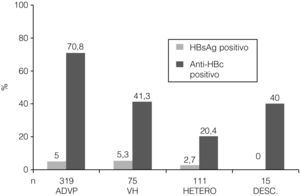
Veintitrés (4,4%) pacientes presentaron una infección activa, ya que fueron seropositivos para HBsAg+ anti-HBc y 169 (32,5%) seronegativos para HBsAg– anti-HBc– anti-HBs– (sin contacto al VHB y sin vacunar) (tabla 1). En 144 (27,7%) sujetos la presencia de anti-HBc aislado fue el único marcador presente de exposición al VHB y 63 (12,5%) mostraban un anti-HBs positivo aislado (tabla 1). La prevalencia de infección activa por el VHB (HBsAg positivo) fue similar entre los diferentes grupos de riesgo, mientras que la de exposición previa (anti-HBc positivo) fue significativamente mayor en los ADVP (fig. 3). Por otra parte, entre los 219 pacientes susceptibles de recibir la vacuna frente al VHB, 50 (22,3%) sujetos habían sido vacunados.
Prevalencia de los marcadores de infección HBsAg y anti-HBc positivo por factor de riesgo de infección por VIH. ADVP: adictos a drogas por vía parenteral; VH: varones homosexuales; HETERO: heterosexuales; DESC: desconocido; HBsAg: antígeno de superficie del virus de la hepatitis B; anti-HBc: anticuerpo contra el antígeno central del VHB; p>0,05 para la comparación de HbsAg positivo entre todos los grupos de riesgo. p<0,0001 para la comparación de anti-HBc positivo entre todos los grupos de riesgo.
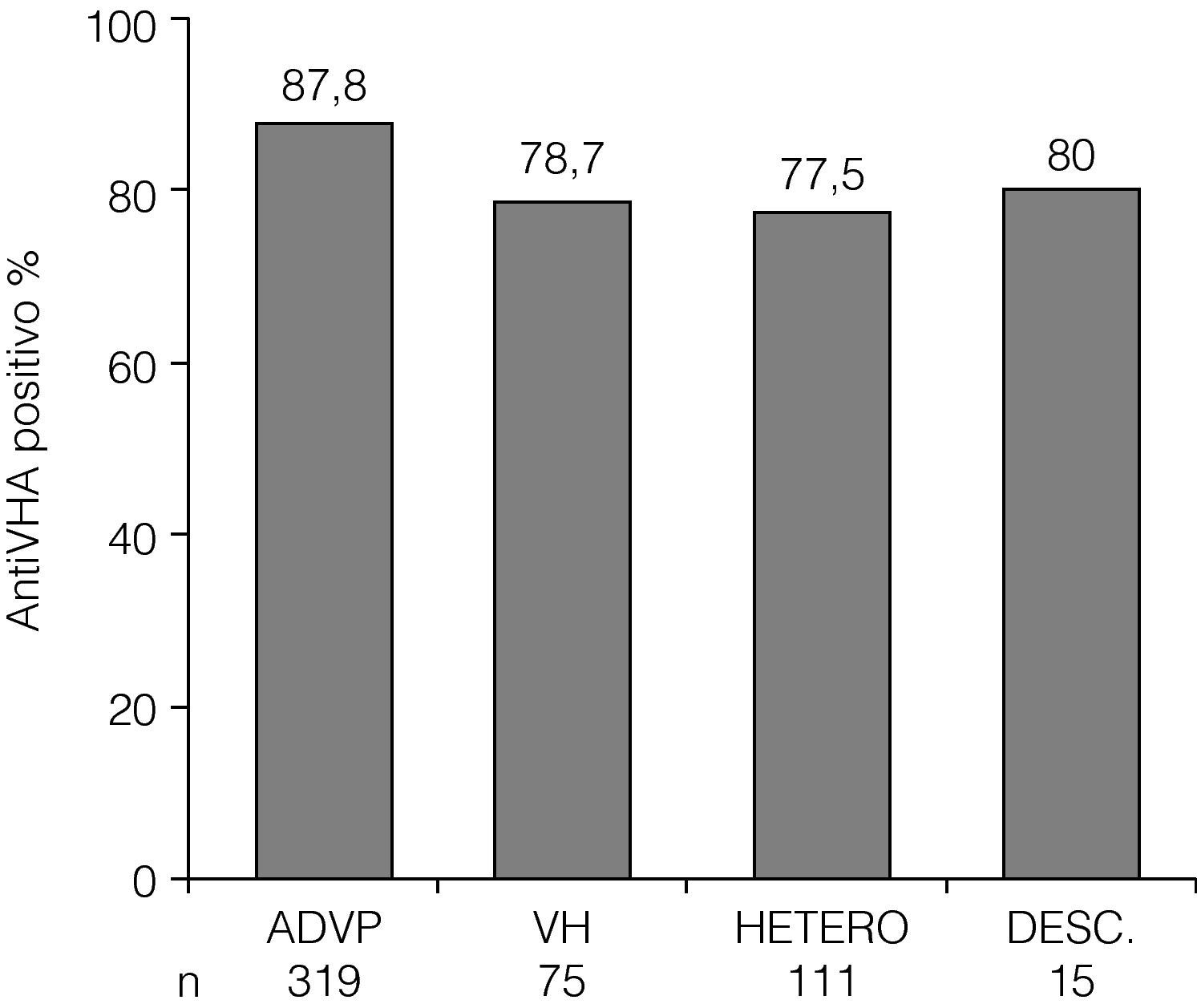
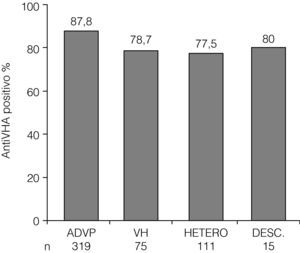
Un total de 437 (84%) enfermos presentaron anti-VHA positivo en suero. La prevalencia de anti-VHA positivo fue significativamente diferente entre los diferentes grupos de riesgo, siendo más elevada entre los ADVP (fig. 4). Ciento ocho (72,5%) de los 149 enfermos con una edad igual o menor a 40 años tuvieron anti-VHA positivo, frente a 329 (88,7%) de los 371 individuos con una edad superior a 40 años (p<0,005). Entre los 113 individuos que no tenían marcadores de exposición al VHA en determinaciones previas, 29 (25,6%) habían sido vacunados frente a este virus.
DiscusiónLa prevalencia actual de infección activa por VHC en pacientes portadores del VIH, en nuestro medio, sigue siendo elevada, siendo esta considerable en los enfermos con riesgo de transmisión del VHC por vía sexual. Esta alta prevalencia de coinfección por VIH/VHC podría deberse, al menos en parte, a que el porcentaje de pacientes que han recibido tratamiento frente al VHC es todavía bajo. Por otro lado, no parece haber tenido una repercusión importante la utilización del tratamiento frente al VHC en un mayor número de pacientes sobre la distribución de genotipos del VHC, ya que esta es similar a la comunicada en trabajos efectuados a principios de la década previa. Asimismo, el porcentaje de pacientes expuestos al VHB y al VHA continúa siendo elevado, mientras existe una importante proporción de individuos susceptibles de ser vacunados frente a estos virus y que no han recibido dicha terapia.
Aunque se ha comunicado una disminución de la frecuencia de ADVP entre los casos de infección por VIH diagnosticados por primera vez entre 1997 y 2006 en España5, lo cual podría haber disminuido la transmisión del VHC, la prevalencia actual de la coinfección por VIH/VHC observada en nuestro hospital continúa siendo alta y similar a la observada en estudios previos que han evaluado esta cuestión en nuestro país3,10,11. Además, los pacientes con antecedentes de ADVP siguen siendo claramente el grupo de mayor riesgo para la coinfección por VIH/VHC. No obstante, se observa un porcentaje considerable de enfermos con anti-VHC positivo o ARN-VHC detectable entre los sujetos con riesgo de transmisión del VHC por vía sexual, tanto en los pacientes heterosexuales como en los VH. De hecho, la prevalencia de anti-VHC positivo en los VH en nuestro estudio es elevada (17%), en comparación con el 6% comunicado en un estudio realizado en 2002 en nuestro país3 y con otros realizados en la década de los noventa12-15. La causa de este incremento en la prevalencia de anti-VHC entre los VH estaría en relación con la persistencia de contactos sexuales múltiples sin protección en este subgrupo de enfermos16,17. Así, la incidencia de nuevos casos de infección por VHC en este colectivo ha aumentado marcadamente en países europeos, Estados Unidos y Australia, donde se ha observado un número creciente de infecciones agudas por este agente, que afecta esencialmente a VH con prácticas sexuales de alto riesgo18.
Por otro lado, en nuestra opinión, una de las principales razones de que la prevalencia actual de infección activa por VHC no haya disminuido en nuestra área sería la aplicación insuficiente del tratamiento con IFN-peg y RBV en los enfermos infectados por VIH. El uso de esta terapia antiviral es prioritario en individuos coinfectados por VIH/VHC, dado que los enfermos que alcanzan una respuesta virológica sostenida, es decir, la erradicación del VHC, consiguen frenar la progresión de la enfermedad hepática, con lo que disminuye considerablemente el número de descompensaciones y muertes por esta causa19. Desafortunadamente, el tratamiento actual frente al VHC tiene determinadas barreras que dificultan el uso extendido de esta terapia20. Sin embargo, en nuestro estudio se observa que más del 35% de los enfermos han sido tratados contra la infección crónica por VHC, lo cual es un porcentaje bastante más alto que lo comunicado en la última década en estudios nacionales e internacionales3,21, lo que demuestra que muchas de las barreras contra esta terapia son salvables. Por lo tanto, son necesarios más esfuerzos por parte de los médicos dedicados a la coinfección por VIH/VHC para tratar a los pacientes candidatos que no tengan contraindicaciones, así como disponer de terapias más eficaces que las actuales contra la infección crónica por VHC en esta población.
El aumento del uso y la diferente eficacia del tratamiento del VHC frente a los diferentes genotipos víricos no han conllevado cambios relevantes en la distribución de los genotipos del VHC en nuestro medio. Así, el genotipo más prevalente, de largo, es el 1, seguido por el genotipo 3, mientras el porcentaje de enfermos portadores de genotipo 4 es igual o ligeramente más elevado con respecto a lo comunicado en los estudios que han evaluado esta cuestión en los últimos años3,4,22.
De forma similar a lo que sucede en la coinfección por VIH/VHC, tanto el VIH como el VHB comparten las vías de transmisión y afectan a grupos de riesgo parecidos, lo que conlleva que la coinfección por estos virus pueda ser frecuente. En bases a estudios previos realizados en España3, alrededor del 5% de los pacientes infectados por VIH presentaban una infección activa por VHB, mientras más del 60% de los enfermos mostraban marcadores serológicos de exposición previa por este virus. Los resultados obtenidos en nuestro estudio no difieren de los comunicados previamente, incluyendo la presencia de una proporción elevada de enfermos expuestos al VHB3. Asimismo, a pesar de que se recomienda la vacunación frente al VHB en los pacientes infectados por VIH con HBsAg negativo sin anti-HBs positivo9, en nuestro hospital solo la recibieron el 22% de los pacientes susceptibles de ser vacunados. Por lo tanto, este dato negativo refleja, al menos en nuestro entorno, la necesidad de que se inicien las estrategias oportunas para incrementar el porcentaje de pacientes infectados por VIH vacunados frente al VHB en los próximos años.Los datos obtenidos en este estudio indican que la prevalencia de exposición previa al VHA en los pacientes con VIH continúa siendo muy elevada en nuestra área, alcanzando porcentajes similares a los comunicados en estudios realizados hace aproximadamente 10 años3. Según nuestros resultados, el impacto de las mejoras higiénico-sanitarias y de las recomendaciones sobre la vacunación en la seroprevalencia actual del VHA en los individuos infectados por VIH no parece haber sido muy importante. No obstante, nuestros resultados muestran diferencias en la prevalencia de exposición al VHA dependiendo de la edad de los pacientes. Así, la proporción de pacientes con anti-VHA fue más elevada en los pacientes mayores de 40 años, lo cual se puede explicar porque hace tres décadas la mayoría de la población española de más de 20 años estaba expuesta al VHA23. Por otro lado, aunque se recomienda la vacunación frente al VHA en los pacientes con infección por VIH que tengan cifras de CD4+ superior a 200 células/mm3 y, de modo especial en los que presenten hepatopatías crónicas9, solamente el 25% de los enfermos susceptibles habían sido vacunados en nuestro hospital.
Este estudio tiene algunas limitaciones. Por un lado, la principal es que se ha realizado en un ámbito local. Por esta razón, los resultados observados en nuestro estudio no se pueden extrapolar a otras áreas, como el resto de España. De hecho, un elevado porcentaje de nuestros pacientes infectados por VIH provienen de centros de deshabituación de drogas, incluyendo las administradas por vía parenteral, lo cual podría influir en los datos de prevalencia de coinfección por VIH/VHC observados en este estudio. Por otro lado, nuestro estudio no puede excluir posibles fallos de la vacunación frente al VHB o al VHA. Así, aunque esta cuestión fue preguntada a todos los enfermos y se revisó la información incluida en las bases de datos de la unidad de enfermedades infecciosas y microbiología y de medicina preventiva de nuestro hospital, no podemos descartar que algún paciente considerado como susceptible se ser vacunado frente al VHA o al VHB en este estudio hubiera sido vacunado en otros centros sanitarios sin conseguir la inmunidad adecuada.
En conclusión, dados los escasos datos disponibles en nuestro país sobre estas cuestiones, la información sobre la situación epidemiológica de las coinfecciones por VHA, VHB y VHC en el paciente infectado por VIH aportada por este estudio es muy relevante, ya que en nuestra opinión podría no ser muy diferente a la de otras regiones de nuestro país. Basándonos en los resultados obtenidos, la prevalencia actual de infección activa por VHC en los pacientes infectados por VIH sigue siendo elevada. Por ello existe una clara necesidad de manejar mejor a los pacientes infectados por VIH/VHC, incluyendo un mayor uso del tratamiento contra el VHC con objeto de erradicar este virus y, con ello, disminuir el grado de fibrosis y la mortalidad por causas hepáticas en estos pacientes. Igualmente, la vacunación frente al VHA y al VHB en los enfermos susceptibles de recibirla debe ser una cuestión prioritaria en los médicos dedicados al manejo de estas coinfecciones.
FinanciaciónEste estudio fue financiado en parte por la red ISCIII-RETIC RD06/006. K.N. es beneficiaria de un contrato postdoctoral de perfeccionamiento «Sara Borrell» del Instituto de Salud Carlos III (SCO/523/2008). J.A.P. es beneficiario de una ayuda de intensificación de la Fundación Progreso y Salud de la Consejería de Salud de la Junta de Andalucía (Referencia AI-0011-2010). C.C. es beneficiaria de un contrato de «Técnico de apoyo a la investigación» por parte del Ministerio de Ciencia e Innovación (PTA-2011-5503-I).
Conflicto de interesesJuan A. Pineda ha efectuado labores de consultoría para GlaxoSmithKline, Bristol-Myers Squibb, Abbott Pharmaceuticals, Gilead, Merck Sharp & Dome, Schering-Plough, Janssen Cilag y Boehringer Ingelheim. Ha recibido ayudas para investigación de GlaxoSmithKline, Roche, Bristol-Myers Squibb, Schering-Plough, Abbott Pharmaceuticals y Boehringer Ingelheim, y compensación económica por conferencias de GlaxoSmithKline, Roche, Abbott Pharmaceuticals, Bristol-Myers Squibb, Gilead, Merck Sharp & Dome, Janssen Cilag, Boehringer Ingelheim y Schering-Plough.