Los antimicrobianos son fármacos distintos al resto. Su eficacia en la reducción de la morbilidad y la mortalidad es muy superior a la de otros grupos de medicamentos. Por otra parte, son los únicos fármacos con efectos ecológicos, de manera que su administración puede contribuir a la aparición y diseminación de resistencias microbianas. Finalmente, son utilizados por médicos de prácticamente todas las especialidades. La actual complejidad en el manejo de las enfermedades infecciosas y del aumento de las resistencias hace imprescindible el establecimiento de programas de optimización del uso de antimicrobianos en los hospitales (PROA).
Este documento de consenso define los objetivos de los PROA (mejorar los resultados clínicos de los pacientes con infecciones, minimizar los efectos adversos asociados a la utilización de antimicrobianos, incluyendo aquí las resistencias, y garantizar la utilización de tratamientos coste-eficaces) y establece recomendaciones para su implantación en los hospitales españoles. Las líneas maestras de las recomendaciones son: la constitución de un equipo multidisciplinario de antibióticos, dependiente de la Comisión de Infecciones. Los PROA necesitan ser considerados programas institucionales de los hospitales donde se desarrollen. Deben incluir objetivos específicos y resultados cuantificables en función de indicadores, y basarse en la realización de actividades encaminadas a mejorar el uso de antimicrobianos, principalmente mediante actividades formativas y medidas no impositivas de ayuda a la prescripción.
The antimicrobial agents are unique drugs for several reasons. First, their efficacy is higher than other drugs in terms of reduction of morbidity and mortality. Also, antibiotics are the only group of drugs associated with ecological effects, because their administration may contribute to the emergence and spread of microbial resistance. Finally, they are used by almost all medical specialties. Appropriate use of antimicrobials is very complex because of the important advances in the management of infectious diseases and the spread of antibiotic resistance. Thus, the implementation of programs for optimizing the use of antibiotics in hospitals (called PROA in this document) is necessary.
This consensus document defines the objectives of the PROA (namely, to improve the clinical results of patients with infections, to minimise the adverse events associated to the use of antimicrobials including the emergence and spread of antibiotic resistance, and to ensure the use of the most cost-efficacious treatments), and provides recommendations for the implementation of these programs in Spanish hospitals. The key aspects of the recommendations are as follows. Multidisciplinary antibiotic teams should be formed, under the auspices of the Infection Committees. The PROA need to be considered as part of institutional programs and the strategic objectives of the hospital. The PROA should include specific objectives based on measurable indicators, and activities aimed at improving the use of antimicrobials, mainly through educational activities and interventions based more on training activities directed to prescribers than just on restrictive measures.
El descubrimiento e introducción de los antimicrobianos en la práctica clínica supuso uno de los mayores avances de la medicina, tanto por sus efectos directos (curación de infecciones) como indirectos (permitiendo el desarrollo de procedimientos terapéuticos asociados a una alta probabilidad de aparición de infecciones graves, como los trasplantes, la ventilación mecánica, etc.)1,2. De hecho, este período de la medicina ha sido denominado por algunos «era antibiótica». La expresión más llamativa del efecto positivo de los antimicrobianos se observa en los pacientes con infecciones graves (sepsis grave y shock séptico) en los que la utilización precoz de antibióticos adecuados se asocia a un beneficio muy marcado en términos de reducción de la mortalidad3,4; ninguna otra intervención terapéutica en medicina tiene un impacto semejante5.
Sin embargo, desde la introducción de los antibióticos se ha comprobado cómo los microorganismos pierden con el tiempo su sensibilidad natural a estos agentes a través de la selección y transmisión de diversos mecanismos de resistencia6,7. Los factores relacionados con este fenómeno son múltiples y con frecuencia difícilmente individualizables, pero cabría destacar la transmisión horizontal de microorganismos resistentes o de mecanismos de resistencia, así como la influencia de la exposición a los antimicrobianos8. La pérdida de sensibilidad a los antibióticos ha sido resuelta, hasta hace poco, mediante el desarrollo de nuevos antimicrobianos. Sin embargo, las escasas perspectivas de desarrollo de nuevos antimicrobianos durante la próxima década9,10 indican que este modelo no puede mantenerse. En la práctica clínica, cada vez es más complicado acertar en la elección empírica de un antimicrobiano activo en pacientes con infecciones graves, lo que conduce a peores resultados clínicos. Se estima que en Europa fallecieron aproximadamente 25.000 personas en 2008 en relación con infecciones producidas por microorganismos resistentes, siendo esperable que este escenario empeore en los próximos años11. Esta situación se ha denominado «crisis antibiótica» y se considera el preludio de una «era post-antibiótica» en la que se anticipa un número creciente de muertes de pacientes con infecciones graves por falta de disponibilidad de tratamientos antimicrobianos con garantías12.
Este problema ha sido reconocido desde hace años por múltiples instituciones científicas, sanitarias y políticas en todo el mundo, siendo considerado actualmente uno de los principales problemas de salud pública, lo que ha motivado el diseño e implantación de estrategias dirigidas a paliar el problema9,13–16. Estas estrategias se han dirigido a 3 áreas. La primera pretende favorecer y agilizar el desarrollo y comercialización de nuevos antimicrobianos con actividad frente a los microorganismos más problemáticos en el momento actual. La segunda se centra en optimizar los mecanismos de control de la infección en los centros sanitarios. Y la tercera, con la intención de alargar la vida útil de los antimicrobianos y de obtener los mejores resultados clínicos en los pacientes con infecciones graves, persigue la optimización del uso de los antimicrobianos.
Es importante resaltar que el uso apropiado de antimicrobianos no solo es necesario en aras de un beneficio ecológico (prolongación de la vida útil de los antibióticos) sino que, fundamentalmente, contribuye a mejorar el pronóstico de los pacientes que los necesitan. Además, la optimización de los tratamientos antibióticos debe minimizar la probabilidad de aparición de eventos adversos relacionados con su uso. Los antimicrobianos son uno de los medicamentos más utilizados en el hospital (entre el 25 y el 41% de los pacientes hospitalizados son tratados con antibióticos y aproximadamente el 60% de los pacientes recibe al menos una dosis durante su ingreso17) y, aunque habitualmente seguros, no están exentos de efectos adversos potencialmente graves. En un estudio español que evaluó la frecuencia de efectos adversos a fármacos en pacientes hospitalizados, el de los antimicrobianos fue el grupo terapéutico en el que se observó una mayor frecuencia18. Recientemente se ha observado que los efectos relacionados con los antibióticos suponen el 20% de las visitas a los servicios de urgencias hospitalarias por toxicidades farmacológicas, doblando la frecuencia de visitas asociadas a otros medicamentos tradicionalmente considerados de «alto riesgo» como los anticoagulantes orales, la insulina o la digoxina19. Por último, y desde una perspectiva institucional, no se debe olvidar que en algunos países desarrollados los antibióticos representan un porcentaje importante del gasto farmacéutico hospitalario20 y que el uso no óptimo de los antibióticos se asocia además con costes indirectos, como la prolongación de la estancia hospitalaria.
De forma repetida a lo largo del tiempo y en distintos ámbitos geográficos se ha comprobado que la utilización de antimicrobianos en el medio hospitalario es mejorable en el 30-50% de los casos21–23. Son muchas las razones que influyen en esta cifra tan elevada24. En primer lugar, la presencia de microorganismos resistentes y su variabilidad entre hospitales e incluso dentro de las diferentes áreas de un mismo hospital hace necesario un buen conocimiento de la epidemiología microbiológica local. En segundo lugar, la selección óptima del antimicrobiano y su posología en los diferentes síndromes infecciosos requieren también una formación específica y actualizada. En tercer lugar, la actitud individual del clínico hacia el uso de estos fármacos frecuentemente se basa en una sensación de seguridad que condiciona una excesiva y evitable presión antibiótica, traducida en prolongaciones innecesarias de los tratamientos o espectros de cobertura redundantes o desproporcionados25. Finalmente existen barreras en las propias instituciones sanitarias que dificultan la utilización óptima de los antimicrobianos en los hospitales, como las limitaciones prácticas para un rápido y correcto procesamiento de las muestras microbiológicas o los retrasos entre la prescripción y la administración de los antimicrobianos24.
Por estos motivos nacieron hace años los programas institucionales de optimización de tratamientos antimicrobianos, que en inglés se denominan más frecuentemente antimicrobial stewardship programs. El término stewardship, que se refiere a la responsabilidad de cuidar u organizar algo que no es propio, no tiene una traducción literal al castellano aplicable para esta acepción26, lo que motiva probablemente que en nuestro idioma no exista un término mayoritariamente aceptado para describir este tipo de actividades. Son numerosas las intervenciones que pueden plantearse con la intención de mejorar el uso de los antimicrobianos en los hospitales, habiendo sido evaluada su eficacia de forma sistemática27. Debido a la importancia de este tipo de actividades y a la gran variabilidad de posibilidades posibles la Infectious Diseases Society of America (IDSA) elaboró recientemente una guía clínica definiendo el marco de actuación y la dinámica de funcionamiento de este tipo de programas en hospitales norteamericanos28.
Existe escasa información sobre la frecuencia con la que se realizan intervenciones de mejora de uso de antibióticos en hospitales españoles. Recientemente se han publicado los datos de una encuesta nacional dirigida a miembros de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) en la que apenas el 40% de los 78 hospitales encuestados realizaban algún tipo de medida programada dirigida a la mejora de la utilización de antibióticos en hospitales29. Destacaba además una significativa variabilidad geográfica así como la escasez de recursos específicamente destinados a este fin como muestra del escaso apoyo institucional percibido por las personas que participaban en este tipo de actividades.
En este contexto, la SEIMC y la Red Española de Investigación en Patología Infecciosa (REIPI; Instituto de Salud Carlos III) han realizado recientemente una serie de actividades encaminadas a poner de manifiesto la importancia del problema de la resistencia a los antibióticos y la necesidad de acciones específicas encaminadas a tratar el problema desde diversas perspectivas, incluida la promoción del uso adecuado de estos fármacos30.
Objetivos del documentoPor todo lo anterior, a iniciativa del Grupo de Estudio de Infección Hospitalaria (GEIH) de la Sociedad Española de Enfermedades Infecciosas (SEIMC) se ha realizado este documento de consenso, que ha sido elaborado y consensuado además con la Sociedad Española de Farmacia Hospitalaria (SEFH) y la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene (SEMPSPH). Este documento pretende justificar la necesidad de implementar programas de optimización de uso de antimicrobianos (PROA) en los hospitales españoles y proponer a los profesionales sanitarios y a las administraciones sanitarias implicados en el problema recomendaciones para la implantación de PROA basadas en un modelo de funcionamiento adaptado a las diferentes circunstancias sociosanitarias de la atención hospitalaria en España. Para ello tiene como objetivos específicos formular recomendaciones sobre:
- –
Los objetivos y prioridades de los PROA.
- –
Las actividades realizables en el seno de los PROA.
- –
La estructura y organización de los PROA en los hospitales españoles.
- –
La evaluación del impacto de las actividades desarrolladas por los PROA.
La filosofía general que este documento plantea sobre los PROA es que deben funcionar como instrumentos de ayuda al prescriptor en la toma de decisiones sobre la utilización de antimicrobianos, priorizando los aspectos no impositivos y los formativos sobre los restrictivos. Por otro lado, su funcionamiento debe estar basado en una estrategia de la mejora continua, debiendo contemplar de manera global los distintos aspectos del uso apropiado de los antimicrobianos.
El documento está dirigido a los profesionales que deben realizar las tareas específicas de mejora de uso de antimicrobianos en los centros y a los gestores sanitarios que deben fomentarlas.
Metodología de elaboración del documentoLas sociedades científicas firmantes designaron a un grupo multidisciplinario de profesionales expertos, procedentes de las áreas de enfermedades infecciosas, farmacia hospitalaria, medicina intensiva, medicina preventiva y microbiología, así como de enfermería, con experiencia en actividades de mejora de uso de antimicrobianos.
Aunque se realizó una revisión exhaustiva de la literatura científica sobre los aspectos relacionados con cada apartado, se consideró fuera de los objetivos de este documento revisar sistemáticamente las cuestiones metodológicas de los estudios publicados en que se evalúan medidas encaminadas a la mejora del uso de antimicrobianos y su impacto. El motivo es que son escasos los estudios aleatorizados y controlados y que la mayoría se basan en un diseño cuasi experimental con comparación antes-después pero con importantes deficiencias metodológicas, debido a la dificultad intrínseca para realizar este tipo de estudios. En los estudios publicados se han evaluado frecuentemente varias medidas implantadas a la vez o de forma progresiva, raramente se ha controlado el impacto de otras variables, sus objetivos han sido a menudo diversos, y se han realizado en distintas situaciones epidemiológicas e históricas no siempre bien definidas. Todo ello dificulta, si no imposibilita, realizar recomendaciones sobre la mayoría de aspectos específicos de los PROA estrictamente basados en la evidencia científica, más allá de que existe evidencia de que las intervenciones para mejorar la prescripción de antibióticos en los hospitales son eficaces27. Así, determinadas actuaciones que muestran un mayor grado de evidencia científica pueden ser innecesarias en muchos centros, por ser incongruentes con su situación epidemiológica, y viceversa. Por ello, hemos evitado clasificar las recomendaciones en función de la fuerza con que se realizan y la calidad de la evidencia que las sustentan.
En su lugar se decidió establecer un sistema de gradación de las recomendaciones en 3 niveles de aplicabilidad según el grado de desarrollo PROA deseado. Se definió un nivel básico para aquellas medidas que debieran ser incorporadas por todos los hospitales; un nivel avanzado para medidas recomendables en centros con un grado mayor de madurez en la implantación de los programas y un nivel excelente en el que se incluyeron medidas a aplicar por hospitales de referencia en esta área. El texto final y las recomendaciones fueron consensuadas por todo el grupo redactor. Finalmente, el documento estuvo disponible para comentarios y sugerencias de los socios de las sociedades firmantes, incorporándose aquellas que el equipo redactor acordó por consenso.
Definición. Necesidades, requerimientos y herramientas para el desarrollo de PROALos PROA han sido definidos como la expresión de un esfuerzo mantenido de una institución sanitaria por optimizar el uso de antimicrobianos en pacientes hospitalizados con la intención de: a) mejorar los resultados clínicos de los pacientes con infecciones; b) minimizar los efectos adversos asociados a la utilización de antimicrobianos (incluyendo aquí la aparición y diseminación de resistencias); y c) garantizar la utilización de tratamientos coste-eficaces31. Por tanto, son programas de mejora de calidad. Para su éxito, es imprescindible que los PROA se constituyan como programas institucionales en los hospitales y que sean liderados por los profesionales con el mayor reconocimiento científico-técnico en el uso de antimicrobianos y en el diagnóstico y tratamiento de las enfermedades infecciosas28,32–34.
Aspectos organizativosComisión de InfeccionesLa Comisión de Infecciones y Política de Antibióticos (o la Comisión de Antibióticos si existe) tiene la competencia de dirigir la política de antimicrobianos del centro, por lo que constituye el marco de referencia natural para el diseño e instauración de un PROA. Pero las actividades de campo del PROA no pueden ser llevadas a cabo por la Comisión, sino que esta necesita crear un grupo operativo al que, bajo su tutela, encomiende el diseño, desarrollo, implantación, seguimiento y evaluación de un programa global de optimización de antimicrobianos. Los PROA deben igualmente contar con el impulso y el apoyo de la Comisión de Calidad del hospital, que deben considerarlos como programas estratégicos para toda el área hospitalaria.
Equipo de antibióticosLa creación de un equipo de profesionales encargado de llevar a cabo las tareas del PROA es una estrategia fundamental para el éxito del programa, y así lo recomienda la IDSA junto con otras sociedades científicas28, basándose en los numerosos trabajos científicos que muestran la utilidad de esta estrategia35–41. Los criterios básicos para la composición de este equipo según estas recomendaciones son los siguientes: a) debe ser multidisciplinario y un número de miembros reducido; b) el núcleo imprescindible debe estar formado por un infectólogo o clínico experto en enfermedades infecciosas, un farmacéutico clínico experto en antimicrobianos, y un microbiólogo experto en resistencia en antimicrobianos, y c) además, cada centro considerará añadir los profesionales de las disciplinas que estime necesarios, considerando que el criterio de selección necesario debe ser el liderazgo profesional en el diagnóstico y tratamiento de las enfermedades infecciosas42–46. Dada la importancia estratégica de las unidades de cuidados intensivos (UCI) en el consumo de antimicrobianos, debe considerarse siempre la inclusión de un especialista en medicina intensiva en el equipo. Este equipo debe trabajar de manera coordinada con el equipo multidisciplinario de control de infecciones, por lo que debe valorarse la inclusión de un especialista en medicina preventiva. Las tareas de coordinación del equipo las realizará idealmente el clínico experto en enfermedades infecciosas. Sería de interés el diseño de mapas de competencias para los profesionales que puedan integrarse en el equipo de antibióticos, que permita la elección de sus miembros y su desarrollo profesional en estas tareas, así como la potencial acreditación profesional de los integrantes del equipo.
Las funciones de este equipo son las siguientes:
- –
Diseño del PROA. Adaptado a las características de su hospital mediante la selección de las estrategias que mejor se ajusten a la situación del centro, a su contexto cultural y organizativo, y a los recursos técnicos y humanos disponibles y alcanzables.
- –
Institucionalización del programa. El equipo debe presentar el programa a la Comisión de Infecciones para su aprobación, tras lo cual realizarían las gestiones necesarias para que sea conocido y aprobado por las diferentes estructuras de gobierno del hospital: Junta Facultativa y Dirección Médica. La Dirección Médica, como garante de la calidad asistencial de los hospitales, tiene la responsabilidad de asumir este grave problema de salud. El objetivo es conseguir el máximo reconocimiento institucional y que el programa se incluya dentro de los objetivos estratégicos del centro e, idealmente, que el cumplimiento del mismo esté sujeto a incentivos. Un aspecto que puede contribuir a la institucionalización del programa es su certificación/acreditación en calidad. Este carácter institucional es básico para facilitar la aceptación del programa por todos los profesionales y para conseguir los recursos necesarios ya que normaliza las actividades del equipo responsable del mismo, al considerarlas tan importantes como cualquier actividad asistencial.
- –
Difusión del programa a todos los profesionales del centro. Para conseguir la aceptación del programa es imprescindible explicarlo previamente a los prescriptores, incluyendo residentes, y mantener un feedback periódico. Los mensajes clave son: 1) el problema: «utilizamos mal los antimicrobianos»; 2) la causa: «el conocimiento insuficiente de las enfermedades infecciosas por la desproporción entre el volumen de conocimientos acumulado, las dificultades crecientes y el escaso tiempo disponible para la formación continuada en enfermedades infecciosas en la mayoría de las especialidades»; 3) las consecuencias: «el aumento de la mortalidad-morbilidad de las infecciones graves; el incremento de las resistencias; y la reducción de los antimicrobianos disponibles»; y 4) la mejor solución posible: «un programa global para la optimización del uso de los antimicrobianos», resaltando que se trata de un programa profesional para mejorar la calidad asistencial, alejado de las medidas de control del gasto, y de cuyos resultados se informará puntualmente47–50. El programa debe ser presentado a los servicios en sus sesiones formativas. Otra medida de difusión complementaria es la comunicación a través de la Intranet u otras herramientas similares del centro.
- –
Seguimiento y evaluación del programa. Los miembros del equipo deben realizar las tareas de campo del programa, por lo que deben realizar una parte de su tarea asistencial ligada al mismo.
El funcionamiento del equipo de antibióticos debe normalizarse y especificarse. Así, debe mantener un contacto frecuente, con reuniones formales de periodicidad semanal, quincenal o mensual en función de las necesidades cuyo contenido debe quedar documentado y debe ser comunicado a la Dirección del hospital así como a la comisión de infecciones y/o de política antibiótica. Asimismo se deben distribuir explícitamente a cada miembro del equipo las tareas y objetivos a realizar.
Recursos técnicos y humanosEl PROA necesita recursos humanos y materiales, y corresponde a los servicios directamente implicados y a Dirección Médica proporcionarlos. Debe realizarse un análisis detallado de la necesidad de recursos humanos en función de la inversión de tiempo y esfuerzo y los resultados esperables. En el caso de que hagan falta más recursos, se planteará la posibilidad de redistribuir las tareas de los servicios y unidades implicados en el equipo de antibióticos en función de una diferente priorización de sus actividades, y/o la necesidad de que se aporten nuevos recursos por parte de la dirección del centro.
Respecto a los recursos materiales, el equipo debe contar con un lugar adecuado para realizar sus reuniones y con los recursos técnicos necesarios para analizar la información y proporcionar la formación acordada (ordenadores, programas informáticos, proyectores, acceso a bibliografía actualizada, representación en la página web institucional, etc.). El hospital debe proveer el acceso de PROA a datos hospitalarios básicos necesarios para el cálculo de los distintos indicadores de proceso o de resultado (estancias, ingresos, mortalidad por GRD, etc.). Los recursos técnicos necesarios o aconsejables para llevar a cabo el programa desde los ámbitos de microbiología y farmacia51 se muestran en el listado de recomendaciones.
Objetivos e indicadores de los PROAObjetivos de los PROALos objetivos genéricos de los PROA en los hospitales consisten en: 1) mejorar los resultados clínicos; 2) reducir los efectos adversos relacionados con la utilización de antibióticos, incluyendo la resistencia, y 3) garantizar una terapia coste-efectiva31. Estos objetivos deben figurar en el PROA del centro, que además debe añadir objetivos específicos en cada uno de ellos. El orden de los elementos enumerados es intencionado. Puede parecer sorprendente priorizar los resultados clínicos cuando los antimicrobianos resultan tan eficaces. Sin embargo, es bien conocido que el tratamiento antimicrobiano inadecuado es causa de mortalidad en pacientes con sepsis y la frecuencia con que esto ocurre es sorprendentemente elevada5. Aunque los resultados clínicos dependen en parte del huésped, del microorganismo y de la gravedad del proceso, numerosas variables entre las que destacan la propia metodología diagnóstica, el momento de inicio del tratamiento, la correcta elección del agente, su dosificación y duración, la instauración de medidas adyuvantes y el conocimiento de las interacciones farmacológicas tienen un impacto definitivo en el pronóstico. Si a esto se añade el elevado número de antimicrobianos disponibles, la necesidad de manejar información microbiológica (no siempre fácil de interpretar) y la creciente dificultad clínica en la evaluación de los pacientes, es fácil de entender la complejidad de la toma de decisiones en este área. Todo lo anterior se traduce en frecuentes tratamientos inapropiados, subóptimos o, directamente, no indicados52. Se comprende entonces que la disponibilidad de equipos multidisciplinarios que establezcan estrategias encaminadas a la mejora no solo de la prescripción de los antibióticos sino, más concretamente, del manejo de las infecciones en el hospital, pueda generar beneficios directos para los pacientes.
Por otro lado, una prescripción de mayor calidad tendrá como consecuencias seguras la reducción de los efectos adversos y de las interacciones clínicamente significativas. Habitualmente, también la mejora de los resultados clínicos conlleva reducciones de los costes, al menos de los indirectos53.
La inclusión de estrategias de reducción de costes a igualdad de resultados clínicos es un aspecto institucionalmente relevante de los PROA. Los programas de optimización de uso de antimicrobianos han demostrado de forma consistente ahorros anuales en consumo de antibióticos que, dependiendo de la magnitud del programa, pueden llegar a superar los 600.000 euros. Por tanto, se puede afirmar que este tipo de programas ahorran más recursos que los que consumen, es decir, que su propio funcionamiento permite retornar, habitualmente con creces, la inversión inicial necesaria para su puesta en marcha y funcionamiento28.
Como se discutirá, las evidencias respecto de la reducción de las resistencias mediante los PROA no son sólidas. No obstante, los beneficios de estos programas justifican su puesta en marcha, incluso en el supuesto de que su influencia en el desarrollo de resistencias no pudiera demostrarse.
Los beneficios teóricos, y por tanto los objetivos de los PROA, no terminan aquí. La instauración de estos programas mejora la satisfacción de los profesionales y de los propios pacientes, ya que ambos se sienten más protegidos y mejor atendidos. Además, las actividades organizativas respaldadas por la dirección de la institución, cuando van encaminadas tan directamente a los resultados clínicos, son bien aceptadas por los profesionales. Por otra parte los PROA, al incluir siempre actividades y elementos educativos, contribuyen a la formación continuada y la formación de posgrado (especialistas en formación) y, por último, al utilizar datos centralizados, mejoran los sistemas de información y gestión del propio centro. Se trata, en definitiva, de programas de calidad54.
Indicadores de funcionamiento de los PROACada una de las intervenciones realizadas en los PROA debe estar dirigida a la consecución de objetivos predeterminados. Como en cualquier programa de calidad, la verificación de la consecución de los objetivos reside en la medición de indicadores. Los objetivos y sus indicadores deben responder al acrónimo «SMART» (eSpecíficos, Medibles, reAlizables, Relevantes y precisos en el Tiempo).
En todo programa de calidad se distinguen, al menos, 2 tipos de indicadores: los de proceso y los de resultado. Si, por ejemplo, se establece como uno de los objetivos del PROA «mejorar la atención a los pacientes con bacteriemia por Staphylococcus aureus», un indicador de proceso (cómo se están prescribiendo los antibióticos) podría consistir en medir el porcentaje de pacientes con dicha infección producida por cepas sensibles a meticilina que son tratados con cloxacilina o cefazolina y no con vancomicina. Por el contrario, un indicador de resultado (medida del efecto real de la intervención dirigida al objetivo) consistiría en medir la tasa de mortalidad y las complicaciones de la bacteriemia por S. aureus. Aunque los indicadores de resultado son, obviamente, los más relevantes, pueden estar influidos por otros factores externos al programa, de manera que los indicadores de proceso se encuentran más «cercanos» a los protagonistas de la intervención, nos informan más directamente sobre su funcionamiento y permiten comparaciones más precisas entre centros. En tanto que los PROA establezcan objetivos específicos clínicos, microbiológicos y económicos, así sus indicadores deberán monitorizar estos aspectos27,55.
La cuestión de los indicadores de los PROA es probablemente uno de los aspectos en los que más se debe avanzar con la puesta en marcha de estos programas. A menudo se ha confundido la obtención de determinados indicadores relativamente accesibles (porcentaje de resistencias, consumo de antibióticos) con los propios objetivos de los programas. Sin duda, las instituciones deben monitorizar el consumo de antibióticos y las resistencias bacterianas, dado que su conocimiento será esencial para detectar problemas, conocer el medio y, también, para medir indicadores de ciertos problemas en el control de infecciones. Sin embargo, hasta ahora la mayor parte de los PROA no han definido prioritariamente objetivos clínicos, en parte por la dificultad para medir indicadores relacionados, pero sobre todo, por haber buscado la justificación o el apoyo institucional en función de resultados económicos. En coherencia con la misión enunciada, los PROA deben elegir prioritariamente objetivos e indicadores clínicos, que pueden relacionarse con los económicos mediante la expresión de ratios coste/efectividad.
La mayor parte de los estudios sobre el impacto de los PROA en el consumo y sobre todo en la resistencia antimicrobiana tienen limitaciones metodológicas debido a la dificultad de diseñar estudios controlados para evaluar el impacto de las intervenciones sanitarias. En todo caso, es importante que se tengan en cuenta las recomendaciones metodológicas para diseñar estudios que evalúen este impacto55.
Monitorización del consumo de antimicrobianos e impacto de los PROA sobre el consumo de antimicrobianosHabitualmente, la medida del consumo de antimicrobianos en el hospital se lleva a cabo con datos agregados, considerando, de menor a mayor precisión, la cantidad global de antibióticos comprados, dispensados o administrados en el lugar y período que se desea analizar. En los ámbitos sanitarios en que no se factura al paciente habitualmente se utilizan datos de dispensación. En este caso, idealmente habría que considerar también las cantidades de antibiótico retornadas.
Con frecuencia se comete el error de adjudicar mayor relevancia a los antibióticos con mayor coste directo. Por el contrario, se debe intentar monitorizar el consumo hospitalario de todos los antimicrobianos, ya que las reducciones en el consumo de determinados antibióticos suele verse acompañada del aumento de consumo de otros, que incluso pueden tener mayor repercusión ecológica o suponer cambios en la eficacia clínica.
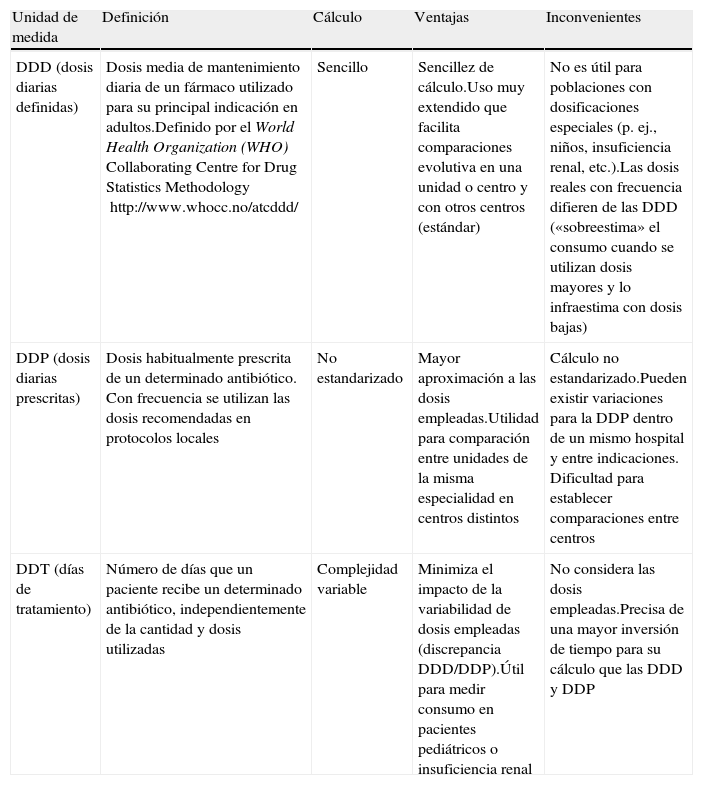
La medición del consumo utilizando datos agregados permite monitorizar la evolución del consumo de antimicrobianos en el hospital de forma global o por áreas y grupos de fármacos así como establecer, teóricamente, comparaciones con otros centros. Las principales unidades de medida sobre el consumo de antimicrobianos se enumeran en la tabla 1. La dosis diaria definida (DDD) es, en el momento actual, la unidad más empleada ya que permite establecer comparaciones de una forma más generalizada aunque no está exenta de importantes limitaciones, entre las que cabe destacar la imposibilidad de comparar áreas como pediatría o nefrología (en las que las dosis utilizadas discrepan significativamente de la DDD) y, sobre todo, el hecho de que una misma DDD puede expresar exposiciones a los antibióticos muy diferentes en distintas áreas en función del tipo de dosificación empleada y su duración (tabla 2)56,57. Como denominadores, se utilizan clásicamente las estancias y los ingresos, que pretenden indicar la población potencialmente expuesta, pudiendo usarse ambos, que pueden ser complementarios58.
Unidades de medida más utilizadas para el cálculo del consumo de antimicrobianos (numeradores)
| Unidad de medida | Definición | Cálculo | Ventajas | Inconvenientes |
| DDD (dosis diarias definidas) | Dosis media de mantenimiento diaria de un fármaco utilizado para su principal indicación en adultos.Definido por el World Health Organization (WHO) Collaborating Centre for Drug Statistics Methodology http://www.whocc.no/atcddd/ | Sencillo | Sencillez de cálculo.Uso muy extendido que facilita comparaciones evolutiva en una unidad o centro y con otros centros (estándar) | No es útil para poblaciones con dosificaciones especiales (p. ej., niños, insuficiencia renal, etc.).Las dosis reales con frecuencia difieren de las DDD («sobreestima» el consumo cuando se utilizan dosis mayores y lo infraestima con dosis bajas) |
| DDP (dosis diarias prescritas) | Dosis habitualmente prescrita de un determinado antibiótico. Con frecuencia se utilizan las dosis recomendadas en protocolos locales | No estandarizado | Mayor aproximación a las dosis empleadas.Utilidad para comparación entre unidades de la misma especialidad en centros distintos | Cálculo no estandarizado.Pueden existir variaciones para la DDP dentro de un mismo hospital y entre indicaciones. Dificultad para establecer comparaciones entre centros |
| DDT (días de tratamiento) | Número de días que un paciente recibe un determinado antibiótico, independientemente de la cantidad y dosis utilizadas | Complejidad variable | Minimiza el impacto de la variabilidad de dosis empleadas (discrepancia DDD/DDP).Útil para medir consumo en pacientes pediátricos o insuficiencia renal | No considera las dosis empleadas.Precisa de una mayor inversión de tiempo para su cálculo que las DDD y DDP |
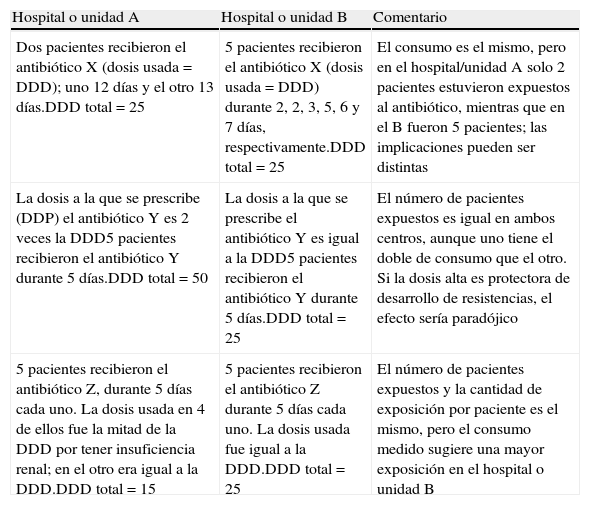
Ejemplos de que el consumo medido en datos agregados (en este caso, DDD/100 estancias) puede no corresponderse con el nivel de exposición individual a antibióticos. En todos los casos se trata de ejemplos ficticios que corresponderían a un consumo determinado en 100 estancias
| Hospital o unidad A | Hospital o unidad B | Comentario |
| Dos pacientes recibieron el antibiótico X (dosis usada = DDD); uno 12 días y el otro 13 días.DDD total=25 | 5 pacientes recibieron el antibiótico X (dosis usada = DDD) durante 2, 2, 3, 5, 6 y 7 días, respectivamente.DDD total=25 | El consumo es el mismo, pero en el hospital/unidad A solo 2 pacientes estuvieron expuestos al antibiótico, mientras que en el B fueron 5 pacientes; las implicaciones pueden ser distintas |
| La dosis a la que se prescribe (DDP) el antibiótico Y es 2 veces la DDD5 pacientes recibieron el antibiótico Y durante 5 días.DDD total =50 | La dosis a la que se prescribe el antibiótico Y es igual a la DDD5 pacientes recibieron el antibiótico Y durante 5 días.DDD total=25 | El número de pacientes expuestos es igual en ambos centros, aunque uno tiene el doble de consumo que el otro. Si la dosis alta es protectora de desarrollo de resistencias, el efecto sería paradójico |
| 5 pacientes recibieron el antibiótico Z, durante 5 días cada uno. La dosis usada en 4 de ellos fue la mitad de la DDD por tener insuficiencia renal; en el otro era igual a la DDD.DDD total =15 | 5 pacientes recibieron el antibiótico Z durante 5 días cada uno. La dosis usada fue igual a la DDD.DDD total=25 | El número de pacientes expuestos y la cantidad de exposición por paciente es el mismo, pero el consumo medido sugiere una mayor exposición en el hospital o unidad B |
En la medición del consumo mediante datos agregados deben considerarse las siguientes cuestiones:
- –
La periodicidad de la medición (trimestral, semestral, anual). Dependerá del tamaño del centro/unidad y de las medidas implantadas.
- –
La unidad a la que se refiere el análisis. Los datos deben calcularse para el hospital completo y, al menos, estratificados por tipos de servicios (cuidados críticos, servicios médicos y servicios quirúrgicos). Idealmente, deben proporcionarse datos individualizados para las unidades de mayor consumo o importancia estratégica, como las UCI.
- –
Qué antimicrobianos medir y como clasificarlos. Deben calcularse el consumo global (todos los antimicrobianos), por grupos e, individualmente, de aquellos de mayor consumo o importancia estratégica o sometidos a intervención. Los antimicrobianos suelen agruparse por grupos farmacológicos (por ejemplo, penicilinas, cefalosporinas, carbapenémicos, etc.), pero esta clasificación tiene importantes limitaciones ya que las indicaciones pueden ser muy diferentes (por ejemplo, cefazolina y ceftacidima). Una alternativa muy útil y no excluyente con la anterior es clasificar los antimicrobianos teniendo en cuenta las indicaciones clínicas de los antimicrobianos (por ejemplo, evaluar el consumo de todos los antiseudomónicos o de todos los fármacos usados frente a grampositivos resistentes).
En cualquier caso, estas medidas no evalúan la exposición individual de los pacientes a los antibióticos ni la calidad de las prescripciones. A pesar de sus limitaciones, la monitorización del consumo de antimicrobianos en una institución permite detectar diferencias en los patrones de uso respecto a otros centros y, sobre todo, los cambios dentro de un determinado centro, indicando la existencia de problemas potenciales de utilización de antibióticos que requieran estudios e intervenciones específicas. Es, por tanto, recomendable que los PROA monitoricen el consumo de antimicrobianos en el hospital, y que esta medición incluya, por una parte, indicadores que permitan la comparabilidad con otros centros, y por otra, consideraciones específicas en función del tipo de hospital, hábitos de prescripción y principales problemas existentes. Es conveniente que los PROA diseñen informes estándar de consumo de antimicrobianos en función de sus circunstancias y que estos informes sean presentados de forma periódica a la Dirección Médica y a la Comisión de Infecciones y Política Antibiótica. Estos informes deben, además, ser remitidos a todos los servicios y utilizarse en sesiones específica de análisis al menos con los servicios más relevantes. Sin embargo, también es importante que estos programas sean capaces de explorar de una manera flexible el consumo de antimicrobianos más allá de los informes estándares, como estrategia de búsqueda de problemas relacionados con la prescripción.
Monitorización de las resistenciasLa monitorización de las resistencias deber ser un elemento obligatorio en cualquier institución hospitalaria ya que resulta imprescindible para el establecimiento de guías locales de tratamiento empírico.
La ecología de la resistencia a antibióticos es un fenómeno extremadamente complejo, sujeto a múltiples condicionantes que pueden dificultar enormemente su análisis59. Muchos de los mecanismos de resistencia afectan a antibióticos de diversas clases, pudiéndose por tanto seleccionar resistencias cruzadas. Por otro lado, los genes de resistencia con frecuencia están localizados en elementos genéticos móviles que pueden portar múltiples determinantes de resistencia, de tal forma que la utilización de un antibiótico que seleccione resistencia a sí mismo o a su grupo estará también seleccionando resistencias a otros antibióticos. Otros factores como la distinta capacidad de los antimicrobianos para seleccionar resistencias, el impacto de la duración y la dosificación del tratamiento, así como las estrategias de control de la infección o el flujo de pacientes entre instituciones, pueden explicar los cambios observados en mayor grado que el impacto de un PROA. De igual forma, hay diferencias importantes en la estabilidad y el coste biológico de los diferentes mecanismos de resistencia. Desde el punto de vista microbiológico, la resistencia a antibióticos puede estar mediada por la selección de mutaciones cromosómicas durante la exposición al antibiótico, la adquisición de determinantes de resistencia por mecanismos de transferencia horizontal y la diseminación clonal de cepas resistentes7,8. La utilización de los antibióticos tiene un impacto importante pero desigual en los 3 casos; mientras que en el primero el impacto es directo e inequívoco, el segundo y sobre todo el tercero están muy influidos por la epidemiología local y por las políticas de control de las infecciones de cada centro.
Tampoco resulta sencillo decidir qué y cómo monitorizar. Los puntos de corte habitualmente utilizados (los establecidos por el Clinical Laboratory Standard Institute [CLSI] y por European Committee of Antimicrobial Susceptibility Testing [EUCAST]) para definir las bacterias resistentes se encuentran alejados de los valores de concentración mínima inhibitoria (CMI) modales que presentan las poblaciones salvajes carentes de mecanismos de resistencia. Por esta razón solo podrían inferirse mecanismos de resistencia de alto nivel, excluyendo los de bajo nivel de resistencia que en numerosas ocasiones preceden a los de mayor nivel60. Como alternativa es posible emplear los llamados puntos de corte epidemiológicos (epidemiological cut-off o ECOFF) y que separan las poblaciones salvajes de aquellas que presentan cualquier mecanismo de resistencia, incluidos los de bajo nivel de expresión (www.eucast.org).
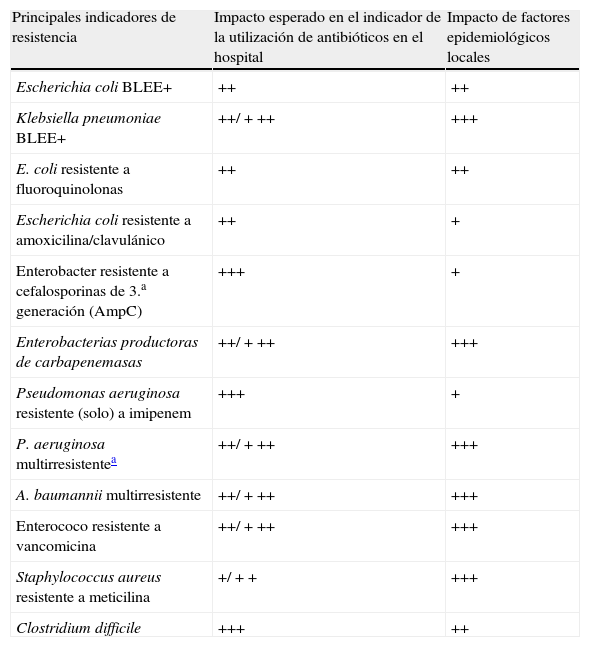
Por otra parte se deberían monitorizar los fenotipos asociados a los mecanismos de resistencia y no exclusivamente los datos brutos de resistencia por antimicrobianos. Los principales indicadores de resistencia que pueden ser utilizados (combinaciones de microorganismos y mecanismos de resistencia) y el impacto relativo de la presión antibiótica y los factores epidemiológicos locales se recogen en la tabla 3. Estos indicadores se deben monitorizar de forma integrada, ya que una medida concreta encaminada a reducir la presión selectiva ejercida por un antibiótico concreto para disminuir la resistencia a ese antibiótico puede determinar el aumento de la utilización de otros antibióticos con el consiguiente aumento de resistencia.
Principales indicadores de resistencia e impacto relativo de la presión antibiótica y los factores epidemiológicos locales
| Principales indicadores de resistencia | Impacto esperado en el indicador de la utilización de antibióticos en el hospital | Impacto de factores epidemiológicos locales |
| Escherichia coli BLEE+ | ++ | ++ |
| Klebsiella pneumoniae BLEE+ | ++/+++ | +++ |
| E. coli resistente a fluoroquinolonas | ++ | ++ |
| Escherichia coli resistente a amoxicilina/clavulánico | ++ | + |
| Enterobacter resistente a cefalosporinas de 3.a generación (AmpC) | +++ | + |
| Enterobacterias productoras de carbapenemasas | ++/+++ | +++ |
| Pseudomonas aeruginosa resistente (solo) a imipenem | +++ | + |
| P. aeruginosa multirresistentea | ++/+++ | +++ |
| A. baumannii multirresistente | ++/+++ | +++ |
| Enterococo resistente a vancomicina | ++/+++ | +++ |
| Staphylococcus aureus resistente a meticilina | +/++ | +++ |
| Clostridium difficile | +++ | ++ |
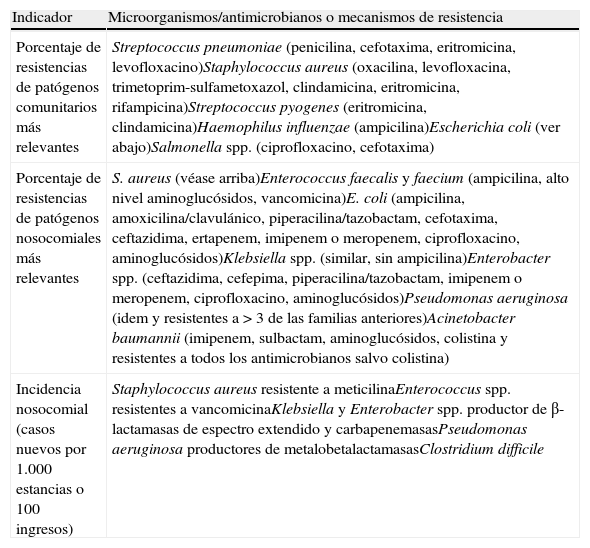
Finalmente, además de elegir los indicadores adecuados y de contextualizarlos en el marco epidemiológico local, es importante definir cómo se miden estos indicadores. La aproximación más sencilla y habitual es la determinación periódica de los porcentajes de resistencia a los diferentes antibióticos de los diferentes microorganismos (tabla 4). Si bien esta información es necesaria y útil, en particular si se realiza un análisis pormenorizado en las distintas áreas del hospital, es obligado trabajar conjuntamente con los responsables del control de la infección nosocomial y compartir la información epidemiológica sobre la incidencia de microorganismos resistentes en la institución (recientemente se han publicado recomendaciones al respecto en EE. UU.)61 ya que ambas aproximaciones pueden ofrecer información complementaria de utilidad en la monitorización del impacto de los PROA (tabla 4)62,63. Es conveniente incluir solo un microorganismo por paciente, aunque en algunos casos los distintos aislados de un mismo paciente puedan tener cambios en la sensibilidad. Además, es importante separar los microorganismos según su procedencia. Como resulta imposible recoger información epidemiológica de todos los aislados (aunque esto debe intentarse con todos los microorganismos multirresistentes de interés nosocomial), una norma sencilla y útil, aunque no exacta, es considerar como nosocomiales aquellos aislados de pacientes ingresados, y como de procedencia comunitaria aquellos procedentes de atención primaria, consultas externas y urgencias. Finalmente, resulta útil diferenciar los aislados que proceden de UCI.
Indicadores recomendados para el seguimiento de resistencias a adaptar a las distintas situaciones epidemiológicas
| Indicador | Microorganismos/antimicrobianos o mecanismos de resistencia |
| Porcentaje de resistencias de patógenos comunitarios más relevantes | Streptococcus pneumoniae (penicilina, cefotaxima, eritromicina, levofloxacino)Staphylococcus aureus (oxacilina, levofloxacina, trimetoprim-sulfametoxazol, clindamicina, eritromicina, rifampicina)Streptococcus pyogenes (eritromicina, clindamicina)Haemophilus influenzae (ampicilina)Escherichia coli (ver abajo)Salmonella spp. (ciprofloxacino, cefotaxima) |
| Porcentaje de resistencias de patógenos nosocomiales más relevantes | S. aureus (véase arriba)Enterococcus faecalis y faecium (ampicilina, alto nivel aminoglucósidos, vancomicina)E. coli (ampicilina, amoxicilina/clavulánico, piperacilina/tazobactam, cefotaxima, ceftazidima, ertapenem, imipenem o meropenem, ciprofloxacino, aminoglucósidos)Klebsiella spp. (similar, sin ampicilina)Enterobacter spp. (ceftazidima, cefepima, piperacilina/tazobactam, imipenem o meropenem, ciprofloxacino, aminoglucósidos)Pseudomonas aeruginosa (idem y resistentes a > 3 de las familias anteriores)Acinetobacter baumannii (imipenem, sulbactam, aminoglucósidos, colistina y resistentes a todos los antimicrobianos salvo colistina) |
| Incidencia nosocomial (casos nuevos por 1.000 estancias o 100 ingresos) | Staphylococcus aureus resistente a meticilinaEnterococcus spp. resistentes a vancomicinaKlebsiella y Enterobacter spp. productor de β-lactamasas de espectro extendido y carbapenemasasPseudomonas aeruginosa productores de metalobetalactamasasClostridium difficile |
Como hemos mencionado, resulta muy difícil establecer relaciones causales entre los PROA y la evolución de las resistencias. Además, pocos estudios han investigado con una metodología sólida su impacto microbiológico. Hasta ahora, la evidencia más convincente se ha obtenido en los estudios encaminados a la reducción de la incidencia de la diarrea asociada a Clostridium difficile64.
Calidad de la prescripción y resultados clínicosEstudios de calidad de las prescripciones. Con objeto de detectar los problemas locales del empleo de antimicrobianos, los PROA deben incluir estudios periódicos de la calidad de la prescripción. En función de las circunstancias y necesidades, se realizará en todo el centro, en áreas o unidades concretas, en determinados síndromes o situaciones clínicas (pacientes con neumonía, bacteriemia, bacteriuria, etc.) o antimicrobianos específicos. Así como se ha demostrado que los PROA mejoran sustancialmente la calidad del uso de antibióticos65,66, pueden emplearse estudios de calidad de la prescripción como indicadores de objetivos específicos del PROA. Metodológicamente hay varios aspectos que se deben considerar:
Definiciones. En la literatura médica se emplea habitualmente el término tratamiento apropiado para referirse a aquel que es activo frente al patógeno causante de la infección, mientras que se reservaría el término de tratamiento adecuado para el que, además de ser apropiado es correcto en dosificación, duración y vía de administración, así como que siga las recomendaciones de tratamiento vigentes, sean externas o locales. Los tratamientos deben clasificarse como profilácticos (indicados para la prevención de una potencial infección), empíricos (utilizados antes de conocer la etiología y sensibilidad del patógeno causante) o dirigidos (utilizados una vez conocidas éstas, se hayan tenido o no en cuenta).
Evaluación transversal vs. longitudinal. La evaluación puede realizarse de manera transversal (en un día concreto) o longitudinal (a lo largo de toda la prescripción). En el primer caso, pueden evaluarse el porcentaje de prescripciones adecuadas o inadecuadas basándose los distintos criterios usados; estos estudios son más sencillos de realizar y analizar, requieren menos recursos y pueden realizarse de manera repetida. Son muy útiles para identificar áreas prioritarias de intervención. En el segundo caso, suelen medirse los días de tratamiento inadecuado y los días de tratamiento innecesario. Son más complejos de analizar y requieren más recursos, pero permiten identificar con mayor precisión puntos de intervención en distintos momentos de la prescripción.
Patrón oro. Debe identificarse el patrón oro con el que se van a comparar la calidad de las prescripciones. Suelen considerase como tal las guías o protocolos del propio hospital (opción preferida por los autores de este documento) o las guías y recomendaciones externas (guías clínicas de sociedades científicas, etc.). En ambos casos se debe considerar su calidad y la adecuación a la situación epidemiológica local. No se aconseja el criterio de los propios evaluadores como patrón oro.
Personal. Las personas que realizan la evaluación deben estar entrenadas en la tarea. Obviamente, los propios prescriptores no deben juzgar sus prescripciones.
Fuente de datos para la evaluación. Habitualmente se realiza revisando la historia clínica, incluyendo los datos microbiológicos, analíticos, radiológicos, etc. Se ha recurrido a observadores «ciegos» que evalúan los tratamientos mediante resúmenes de los casos (case vignettes); esta metodología hace más complejo el proceso y no está exenta de problemas67. La evaluación de la adecuación del tratamiento debe considerar el tipo de paciente (por ejemplo, neutropénico, en situación paliativa, etc.), síndrome infeccioso, gravedad y, en su caso, el microorganismo en cuestión, la dosificación, la vía y la duración.
Es importante recoger información que permita identificar áreas de intervención (por ejemplo, si la prescripción se hizo en urgencias y se ha continuado, si no se han revisado los datos microbiológicos, etc.).
Resultados clínicos. Dado que tradicionalmente muchas de las intervenciones de los PROA se han dirigido a la reducción del empleo de antibióticos mediante estrategias restrictivas, el principal indicador clínico que se ha medido en la mayoría de ellos ha sido la «seguridad», con el objetivo de demostrar que la intervención era capaz de reducir el consumo de antimicrobianos sin perjudicar los resultados clínicos. Una revisión reciente confirma que, efectivamente, es así68. Clásicamente se han empleado la mortalidad durante el ingreso, la mortalidad precoz (a los 7 o 14 días), la mortalidad relacionada con la infección o la curación o mejoría clínica en un día concreto de la evolución. Otros indicadores pueden centrase en los efectos adversos más comúnmente asociados a los antimicrobianos como la diarrea asociada a C. difficile, los cuadros de hipersensibilidad, el desarrollo de insuficiencia renal o las flebitis relacionadas con catéteres. Más allá de «no hacer daño», hemos aprendido que la intervención especializada sobre el manejo clínico de infecciones graves mejora los resultados clínicos medidos en términos de curación, recidivas, estancias o mortalidad atribuible. Es el caso de la bacteriemia estafilocócica69–71, de la candidemia72, de las bacteriemias en general73 o de la sepsis grave74. Estos hechos están llevando a los promotores de los PROA a buscar beneficios clínicos más allá de la posible reducción del consumo de antibióticos o de las resistencias y, por tanto, a establecer objetivos e indicadores sobre resultados clínicos. Ya se mencionó como ejemplo de objetivo clínico la mejora en la atención a la bacteriemia estafilocócica. En este sentido, el PROA puede asociarse a otros programas como las campañas de detección precoz y manejo de la sepsis.
Serán esos indicadores los que nos informarán realmente de la utilidad del programa y su funcionamiento y los que nos permitirán ofrecer información útil a los prescriptores y a los directivos de la institución75. Resulta evidente que solo será posible disponer de buenos indicadores si se cuenta con recursos suficientes para generar y mantener sistemas de información rigurosos. Finalmente, como todo programa de calidad, la aceptación y satisfacción por parte de los «clientes» (en este caso, esencialmente, los prescriptores) habrá de ser uno de los indicadores a monitorizar. En la tabla 5 se muestra una relación de posibles indicadores a seleccionar.
Panel de indicadores de resultado clínico del uso de antimicrobianos
| Indicadores relacionados con efectos adversos de los antimicrobianos |
| Incidencia de efectos adversos grado III o IVIncidencia de diarrea asociada a Clostridium difficileIncidencia de cuadros de hipersensibilidadIncidencia de neurotoxicidad |
| Indicadores relacionados con el pronóstico de infecciones tratadas con antimicrobianos |
| Mortalidad (precoz, global; bruta, atribuible), curación y/o estancia hospitalaria en pacientes con:Sepsis, sepsis grave, shockNeumonía comunitariaMeningitis comunitariaBacteriemia (global o por determinados microorganismos)Neumonías asociada a ventilación mecánicaInfección de localización quirúrgica profunda o de órgano/espacioFiebre y neutropenia |
Una vez evaluadas la situación de la utilización de antimicrobianos y planteados los objetivos a conseguir y la forma de medirlos, los PROA deben planificar las intervenciones a realizar. Hay múltiples tipos de intervenciones dirigidas a mejorar el uso de antimicrobianos. En función de su naturaleza han sido clasificadas en: a) educativas, cuando están destinadas a la formación de los prescriptores sin estar desencadenadas por prescripciones individuales; b) restrictivas, cuando la intervención limita la autonomía del prescriptor; y c) no restrictivas o de ayuda a la prescripción, cuando aún desencadenadas por prescripciones concretas la actuación de PROA no limita la actuación del clínico. También hay que considerar las intervenciones que desde microbiología pueden contribuir a una mejor utilización de los antibióticos.
Intervenciones educativasLa toma de decisiones apropiadas en relación con la prescripción antibiótica exige un conocimiento avanzado sobre los antibióticos, así como sobre aspectos clínicos y microbiológicos de los diferentes síndromes infecciosos y de las circunstancias epidemiológicas de la institución, precisando todos ellos una formación específica. Es por ello por lo que la Organización Mundial de la Salud (OMS) en su estrategia global para el control de la resistencia antimicrobiana propone como una de las principales áreas de actuación el desarrollo de medidas educativas encaminadas a promover el uso prudente de los antimicrobianos en los prescriptores y dispensadores tanto en el ámbito hospitalario como en el comunitario76. En este sentido hay que destacar que si los PROA tienen como objetivo último contribuir a mejorar la utilización de los antibióticos en los hospitales, uno de las principales formas de lograrlo es mejorando el proceso de toma de decisiones a través de actividades formativas que deben integrarse en un programa formativo continuo en uso de antibióticos, que sea evaluable.
Sin embargo, también hay que considerar que la prescripción de antibióticos no depende exclusivamente del grado de conocimiento teórico de todos los aspectos anteriormente mencionados, sino que además está enormemente influida por los hábitos de prescripción del clínico77. Por ello, el médico especialista en formación, que todavía no ha consolidado sus hábitos de prescripción, debe ser una de las dianas preferenciales de las actividades formativas de los PROA, sobre todo cuando los propios residentes así lo reclaman. En una encuesta recientemente realizada en 5 centros hospitalarios españoles mostró que el 70% de los residentes consideraron que la formación recibida en esta materia era escasa o muy escasa78.
A la hora de decidir el enfoque de las actividades docentes es necesario tener en cuenta el escaso impacto en la mejora de la prescripción que tienen las actividades educativas tradicionales como por ejemplo, la realización de seminarios didácticos79. Por el contrario, las actividades formativas que involucran activamente al clínico en la toma de decisiones en escenarios clínicos concretos se han mostrado mucho más eficaces80. Por ello, y al margen de que los PROA tengan en sí mismos una naturaleza educativa, el desarrollo de actividades docentes sobre utilización de antimicrobianos debe ser considerado como un área prioritaria de actuación de estos programas debiendo tener un enfoque eminentemente práctico basado en la solución de problemas clínicos. Las actividades formativas deben planificarse en el contexto de una estrategia global de formación en cada centro. Los PROA deben mantener su independencia en el diseño y conducción de actividades formativas. Más allá de esto, y dado que es responsabilidad del PROA planificar las actividades formativas relacionadas con la utilización de antimicrobianos en el hospital, es conveniente que en las instituciones con PROA se informe con antelación al programa de las actividades formativas relacionadas con utilización de antibióticos que se vayan a realizar en el centro, especialmente aquellas promovidas por o con participación de agentes externos. De esta manera se podrá verificar su adecuación a las normas y acuerdos de política antibiótica local. Dado que la formación es una de las principales áreas de actuación del PROA, las actividades formativas realizadas por estos programas deben ser evaluadas y computadas como una parte más de los objetivos de estos programas.
La tabla 6 incluye algunos de los principales aspectos del uso de antibióticos que deberían ser tratados en las actividades formativas programadas, adaptando el contenido al ámbito asistencial de los destinatarios. El formato de estas actividades puede ser tanto presencial, preferentemente en grupos reducidos, como virtual, aprovechando los principios y oportunidades del e-learning. Independientemente de su naturaleza presencial o virtual, el desarrollo de estas actividades docentes en hospitales con PROA se vería significativamente facilitado si existieran herramientas comunes en forma módulos docentes fácilmente compartibles, en formato electrónico, para su utilización a demanda en cada centro tal y como ocurre en otros países de nuestro entorno81,82 (tabla 7); el desarrollo de una plataforma formativa central o común precisa el apoyo de las instituciones sanitarias.
Principales áreas para la organización de actividades educativas sobre la utilización de antibióticos en los hospitales
| Principios del buen uso de antibióticos en el hospital |
| Consecuencias del uso inadecuado de los antibióticos |
| Epidemiología microbiana. Espectro y seguridad de los principales antibióticos |
| Diagnóstico etiológico de los principales síndromes de las enfermedades infecciosas |
| Tratamiento antibiótico empírico y optimización posterior del mismo |
| Duración de los tratamientos antibióticos |
| Optimización de la dosificación de antimicrobianos |
| Uso de antibióticos en profilaxis quirúrgica |
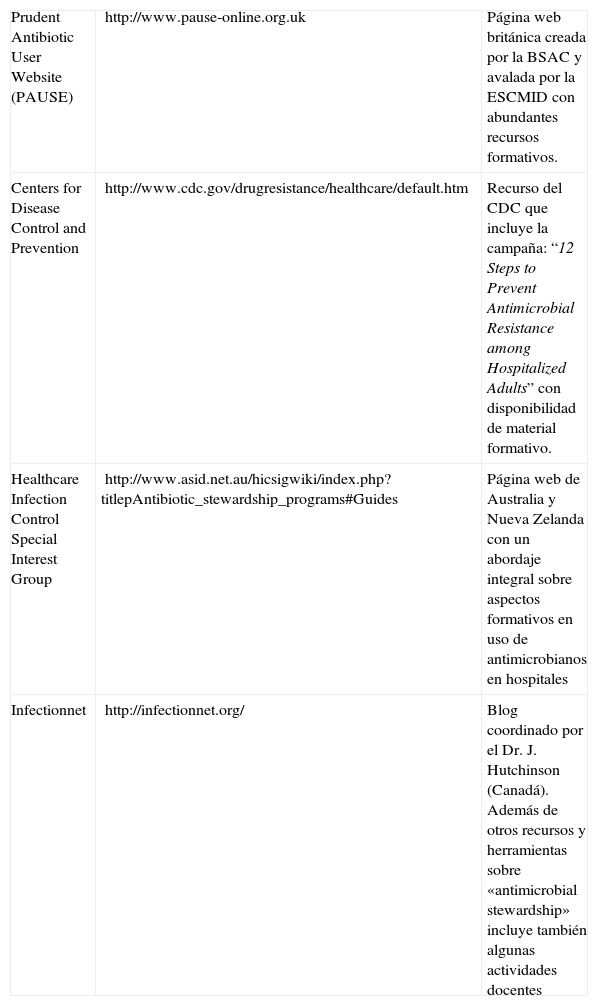
Plataformas web con recursos educativos en optimización del uso de antimicrobianos (adaptada de la European Society of Clinical Microbiology and Infectious Diseases [ESCMID] y la British Society of antimicrobial Therapy [BSAC])
| Prudent Antibiotic User Website (PAUSE) | http://www.pause-online.org.uk | Página web británica creada por la BSAC y avalada por la ESCMID con abundantes recursos formativos. |
| Centers for Disease Control and Prevention | http://www.cdc.gov/drugresistance/healthcare/default.htm | Recurso del CDC que incluye la campaña: “12 Steps to Prevent Antimicrobial Resistance among Hospitalized Adults” con disponibilidad de material formativo. |
| Healthcare Infection Control Special Interest Group | http://www.asid.net.au/hicsigwiki/index.php?titlepAntibiotic_stewardship_programs#Guides | Página web de Australia y Nueva Zelanda con un abordaje integral sobre aspectos formativos en uso de antimicrobianos en hospitales |
| Infectionnet | http://infectionnet.org/ | Blog coordinado por el Dr. J. Hutchinson (Canadá). Además de otros recursos y herramientas sobre «antimicrobial stewardship» incluye también algunas actividades docentes |
Otro aspecto relevante de la formación del uso de antimicrobianos es el de su contextualización dentro del conjunto de oportunidades formativas de los facultativos. En el caso de los residentes es recomendable que se diseñen actividades desde su incorporación al centro, junto con el resto de actividades formativas iniciales comunes, siendo conveniente asegurar en la medida de lo posible su participación, para lo que es necesario el acuerdo y apoyo de las Comisiones de Docencia.
Independientemente de que el residente sea un destinatario prioritario de las actividades formativas programadas desarrolladas por los PROA, éstas deben dirigirse también a los especialistas, reeditándolas periódicamente en función de la demanda en el contexto de las actividades de formación médica continuada de la institución. Asimismo, los PROA deben ser capaces de detectar y responder a las demandas formativas tanto de los médicos especialistas como del resto de profesionales relacionados con la utilización de antimicrobianos. Una forma de detectar estas necesidades es a través de encuestas y/o del registro y categorización de las consultas sobre antibioterapia realizadas a los consultores para el tratamiento de infecciones teléfono específico de antibióticos en los PROA donde éste exista.
En resumen, las actividades formativas constituyen unas de las intervenciones esenciales de los PROA con el objetivo de influir en los hábitos de prescripción y utilización de antibióticos. Para la puesta en marcha de estas actividades se necesita el apoyo institucional que garantice la viabilidad de los recursos y deben estar adaptadas a las características funcionales y estructurales propias de cada centro.
Intervenciones restrictivasLas directrices para la optimización del uso de antibióticos en los hospitales, elaboradas conjuntamente por la IDSA han identificado 2 líneas estratégicas, proactivas, basadas en la evidencia científica, que favorecen la utilización adecuada de los antibióticos28. Estas son: a) estrategias restrictivas, es decir, que limitan el uso de determinados antibióticos; y b) estrategias no restrictivas o no impositivas, entre las que destacan las auditorías prospectivas, con intervenciones y retroalimentación. Ambas líneas de actuación son complementarias y, en general, durante la implementación de programas de optimización del uso de antibióticos, se utilizan simultáneamente.
Las estrategias restrictivas se basan en limitar el uso de determinados antimicrobianos a unas indicaciones específicas mediante fórmulas diversas que restringen su uso. Las estrategias restrictivas y sus problemas principales se resumen en la tabla 8.
Principales estrategias restrictivas y sus principales inconvenientes específicos
| Medida | Potenciales inconvenientes |
| Inclusión de fármacos en la guía farmacoterapéutica del hospital | Heterogeneidad en la toma de decisiones |
| Solicitud específica para el uso de un determinado fármaco | Aumento de la burocraciaEstrategias para evitarlas: falsas indicaciones, solicitud inadecuadamente rellena |
| Aprobación personalizada por equipo de antibióticos previa a dispensación | Disponibilidad del equipo las 24 hPosibilidad de retrasos en dispensación de 1.a dosisBaja aceptabilidad por los prescriptores y posibilidad de conflictosPosibilidad de que se obvie el uso de antibióticos restringido cuando son necesarios |
| Aprobación posterior (siguiente mañana laborable o al día 3) | Baja aceptabilidad por los prescriptores y posibilidad de conflictos |
| Órdenes de retirada automática de un fármaco | Riesgo de suspensión inadecuadaEscasa aceptabilidad por los prescriptores |
| Rotación cíclica | Solo aplicable a determinadas unidadesDeterminadas situaciones existentes pueden hacer inviable su práctica (elevada resistencia a algunos fármacos incluidos en la rotación)Dificultad para mantener la disciplina y aceptabilidad en periodos prolongadosNecesidad de romper la disciplina ante cambios epidemiológicos (aparición de un microorganismo resistente al fármaco que corresponde, etc.) |
Dado que, en nuestro medio, los fármacos precisan haber sido incluidos en la Guía Farmacoterapéutica (GFT) para su uso, la no inclusión de antimicrobianos en la GFT es una medida restrictiva que se aplica sistemáticamente en nuestro entorno. La decisión sobre la inclusión o no de un nuevo fármaco puede ser controvertida, dado que es habitual que los ensayos clínicos realizados para el registro del fármaco demuestren simplemente la no inferioridad en eficacia con respecto al fármaco de referencia y similares datos de seguridad, y suelen ser fármacos más caros que los ya disponibles. En esta situación, otras evidencias como son la situación epidemiológica del centro, la actividad frente a determinados patógenos o situaciones en base a estudios in vitro, en modelos animales o estocásticos y estudios observacionales, el impacto ecológico o la necesidad de disponer de alternativas por cuestiones clínicas o estratégicas deben tenerse en cuenta. Por tanto, es necesario disponer de una metodología adecuada y unificada para la evaluación de antibióticos en los hospitales. Es obvio que los antibióticos no deben ser evaluados bajo los mismos parámetros que otro tipo de fármacos, puesto que se trata de los únicos medicamentos con impacto ecológico y cuya utilidad depende de la situación epidemiológica local. El equipo de antibióticos debe tener un papel protagonista en la evaluación de los antimicrobianos para su inclusión en la guía del centro.
En cuanto a las restricciones que pueden establecerse para la dispensación de un fármaco, pueden usarse distintas estrategias: aprobación previa a la dispensación por el equipo de antibióticos, aprobación diferida (se facilitan las primeras dosis y se evalúa la prescripción posteriormente, aprobando su continuidad o requiriendo un cambio de tratamiento) y aprobación en función de una solicitud por escrito o informatizada específica, que es la menos efectiva de todas. En los hospitales de EE. UU. son frecuentes las fórmulas basadas en la aprobación individualizada previa a la dispensación. En general, las experiencias publicadas han mostrado una reducción sustancial en el uso de los fármacos restringidos, así como de los costes asociados a dichos fármacos83–85, e incluso reducciones en determinadas tasas de resistencias bacterianas86. La mayoría de estos estudios no incluyen resultados a largo plazo. Las otras estrategias han sido menos evaluadas. En general, se considera que las estrategias restrictivas tienen efectos inmediatos, desde el momento de su instauración, y permiten un control muy directo sobre el consumo de antibióticos. En contrapartida, comportan una notable sensación de pérdida de autonomía para los médicos prescriptores y ocasionan frecuentemente mecanismos o estrategias que obvian la restricción, como pueden ser la deficiente cumplimentación de la solicitud de aprobación87 o la prescripción nocturna88 para obviar el periodo de validación. Finalmente, puede que en situaciones en las que el uso de fármaco restringido sea razonable se obvie su uso para evitar la traba burocrática de la aprobación, optándose por otros fármacos no restringidos pero menos adecuados para esa situación clínica o con peor impacto ecológico. Por otra parte, las políticas restrictivas con justificación y aprobación de la prescripción exigen una disponibilidad y dedicación notables por parte del equipo que facilita la aprobación de los fármacos, para evitar retrasos en la dispensación y disfunciones (que en caso de necesitar aprobación previa a la dispensación, debe ser de 24 h al día, todos los días).
Uno de los principales motivos del fracaso de estas estrategias es la falta de los recursos suficientes para su aplicación. La introducción de sistemas computarizados de soporte en tiempo real, que incluyen el análisis de datos clínicos básicos y de los resultados microbiológicos, y que conduce a una prescripción electrónica concreta (y por tanto, restringida) según los datos introducidos, facilita la toma de decisiones89. Estos programas pueden ser también no impositivos, por lo que se tratarán más adelante. Con el desarrollo de nuevas tecnologías computarizadas, algunas basadas en Internet90,91, se ha mejorado la comunicación entre usuarios, consiguiendo una mayor eficacia en la administración de antibióticos y mejorando significativamente la satisfacción de los médicos prescriptores promoviendo además una disminución del gasto farmacéutico.
La implementación de órdenes automáticas de retirada de un antibiótico estaría en la misma línea de aprovechamiento de recursos informáticos. Aunque se han publicado pocos estudios, la experiencia de algún estudio piloto ha demostrado la posibilidad de suspensión automática de un antibiótico bajo determinadas condiciones, sin que supusiera un riesgo añadido para el paciente92; sin embargo, los importantes riesgos de esta práctica, con la posible excepción de la profilaxis antibiótica en cirugía, no la hacen recomendable para los autores de esta guía salvo en situaciones muy concretas.
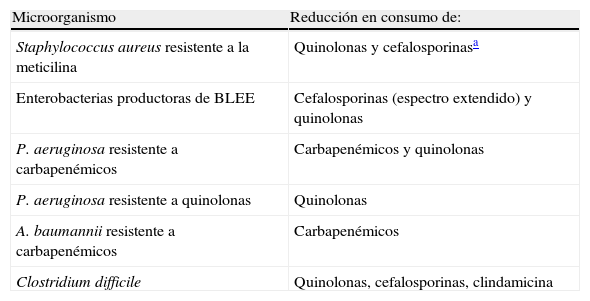
Las principales evidencias sobre la eficacia de las medidas restrictivas en disminuir la emergencia de resistencias bacterianas se han basado en la relación entre la restricción de un grupo de antibióticos y el control de un brote epidémico o de un problema de resistencia antibiótica concreto93,86,94,95. Sin embargo, no siempre las restricciones de un determinado antimicrobiano se han seguido de una caída del número de aislados del microorganismo resistente que se pretendía controlar96–98. La tabla 9 enumera los problemas de resistencia antibiótica actualmente más frecuentes y los grupos de antibióticos en que se puede considerar una reducción de su consumo como ayuda para su control. La restricción de un grupo de antibióticos y el éxito en el control de un brote epidémico puede tener como consecuencias no deseadas el aumento en el consumo de un grupo alternativo99. Este a su vez puede ser responsable de una presión antibiótica selectiva aumentada sobre otro microorganismo o sobre un determinado mecanismo de resistencia con la generación de un problema añadido96. En este sentido, algunos grupos son más partidarios de favorecer las estrategias de diversificación en la prescripción de antibióticos que de las estrategias restrictivas por la problemática anteriormente expuesta. Esta opinión se corresponde con la experiencia de hospitales de Nueva York99, en los que una política restrictiva para las cefalosporinas de amplio espectro implementada con la intención de controlar un incremento de resistencias en Klebsiella spp. condujo a un incremento notable del consumo de carbapenémicos, a la diseminación clonal de una cepa de Acinetobacter baumannii resistente a los mismos y posteriormente a la emergencia de Pseudomonas aeruginosa y Klebsiella spp. también resistentes a imipenem (problema que ha sido denominado como el fenómeno squeezing the balloon94,99). Las conclusiones de esta experiencia cuestionan la utilización de políticas restrictivas para el control de la resistencia antibiótica si no se acompañan de otras estrategias básicas de control de infección que eviten la transmisión cruzada de microorganismos y una vigilancia detallada del consumo del resto de antimicrobianos, y ponen de manifiesto la necesidad de los enfoques globales en los programas de antibióticos, evitando políticas con visión «en cañón de escopeta», obviando los efectos indeseables de una intervención concreta.
Principales microorganismos resistentes y grupos de antimicrobianos en los que se puede plantear la reducción del consumo como ayuda al control de los primeros
| Microorganismo | Reducción en consumo de: |
| Staphylococcus aureus resistente a la meticilina | Quinolonas y cefalosporinasa |
| Enterobacterias productoras de BLEE | Cefalosporinas (espectro extendido) y quinolonas |
| P. aeruginosa resistente a carbapenémicos | Carbapenémicos y quinolonas |
| P. aeruginosa resistente a quinolonas | Quinolonas |
| A. baumannii resistente a carbapenémicos | Carbapenémicos |
| Clostridium difficile | Quinolonas, cefalosporinas, clindamicina |
La rotación cíclica de antibióticos puede considerase también una estrategia de restricción antibiótica. Está dirigida básicamente hacia el tratamiento antibiótico empírico, aunque también modifica el dirigido. Se ha ensayado con grados variables de éxito en diferentes escenarios con un elevado consumo de antibióticos, como las UCI. La base racional para estos programas radica en que se considera que la resistencia antibiótica sigue un esquema cíclico100; la introducción de un nuevo antibiótico se acompaña de un uso intenso del mismo, muchas veces excesivo. Cuando se sobrepasa un determinado umbral, se produce la emergencia de resistencias bacterianas, el antibiótico deja de utilizarse y se cierra el ciclo con la introducción de un nuevo antibiótico. El concepto es preservar la actividad de los antibióticos mediante la rotación programada de los mismos, disminuyendo la presión selectiva causada por el uso continuado de la misma clase de antibióticos en una población determinada101. La duración de cada ciclo depende de la capacidad de los microorganismos en desarrollar resistencias y en cómo el antibiótico es utilizado. Es una estrategia restrictiva porque no está permitida la utilización de otros grupos de antibióticos durante el ciclo de un antibiótico específico. Las primeras experiencias fueron publicadas por Gerding et al.102, quienes practicaron una rotación entre gentamicina y amikacina durante un periodo prolongado de 10 años debido a unas elevadas tasas de resistencia a la gentamicina en bacilos gramnegativos. Aunque la mayor parte de estudios se han efectuado en unidades de hematología y de cuidados intensivos103–105, los resultados en general han sido poco alentadores y han favorecido la instauración de otras estrategias de control de las resistencias bacterianas106.
Medidas no impositivas de ayuda a la prescripciónPara que la prescripción prudente de antibióticos forme parte del comportamiento de los profesionales y para conseguir una mejora continua de la calidad de prescripción es necesario adoptar un abordaje holístico del problema, que tenga en cuenta los factores que influyen en el manejo y prescripción de los antibióticos. En este sentido las denominadas medidas de ayuda a la prescripción se consideran de las más importantes, por su mejor aceptación por parte de los profesionales y por su potencial eficacia a largo plazo. El médico clínico necesita herramientas que le permitan realizar una prescripción optimizada de los antimicrobianos; entre estas herramientas destacan las guías de tratamiento y profilaxis antimicrobiana, las auditorías de optimización del uso de antibióticos, la posibilidad de consultar a expertos, los grupos de apoyo multidisciplinarios y las tecnologías de la información aplicadas a este entorno. Las buenas prácticas deben ser reforzadas positivamente a través de un entorno de trabajo que facilite y refuerce prescripciones optimizadas, manteniendo al mismo tiempo la capacidad de decidir libremente por parte del prescriptor.
Guías de práctica clínica externasLa difusión e implantación local de las guías de práctica clínica realizadas en su mayoría por sociedades científicas es una de las medidas de ayuda a la mejor prescripción antibiótica. Una inmensa mayoría estudios que lo han estudiado han constatado el mejor pronóstico de los pacientes cuando se sigue en el tratamiento empírico lo recomendado en estas guías, incluidas la neumonía comunitaria107–111 y la meningitis112. Un estudio reciente, sin embargo, mostró peores resultados en neumonías nosocomiales graves con riesgo de patógenos multirresistentes; este estudio sugiere que es necesario considerar que la aplicabilidad de las guías clínicas en función de las circunstancias epidemiológicas locales113.
Protocolos y guías locales de tratamiento empírico y dirigidoQuizás sea más interesante la elaboración por cada hospital de protocolos de profilaxis y tratamiento antibiótico empírico y dirigido. A diferencia de las GPC, el protocolo tiene un carácter más normativo y no tiene por qué incluir niveles de recomendación basados en la evidencia científica114. Para su realización se puede recurrir a las guías de sociedades científicas, pero además es imprescindible un profundo conocimiento de la epidemiología local. Es importante la participación multidisciplinaria, incluyendo la participación de todas las especialidades implicadas en el proceso para así favorecer su aceptabilidad y posterior seguimiento. Estos protocolos deben además actualizarse periódicamente incluyendo las posibles nuevas posibilidades terapéuticas y adaptándose a los cambios de los patrones de resistencias. Los procesos infecciosos frente a los que se recomienda que cada hospital elabore sus protocolos específicos de tratamiento empírico y dirigido se resumen en la tabla 10.
Procesos infecciosos en los que se recomienda elaborar protocolos de tratamiento empírico y dirigido
| Infecciones respiratorias |
| Neumonías adquiridas en la comunidad |
| Neumonías nosocomiales no asociadas y asociadas a ventilación mecánica |
| Infecciones de la piel, partes blandas y de las mucosas |
| Erisipela y celulitis |
| Fascitis necrosante |
| Pie diabético |
| Infecciones cardiovasculares |
| Endocarditis |
| Nativas |
| Protésicas |
| Infecciones de marcapasos y desfibriladores automáticos implantables |
| Infecciones relacionadas con los catéteres vasculares |
| Infecciones intraabdominales |
| Colecistitis y colangitis |
| Peritonitis secundaria |
| Peritonitis terciaria |
| Infecciones del tracto urinario |
| Pielonefritis, prostatitis |
| Bacteriuria asintomática (pacientes sondados y no sondados), cistitis |
| Infecciones del sistema nervioso central |
| Meningitis agudas |
| Encefalitis |
| Infecciones osteoarticulares |
| Artritis aguda |
| Osteomielitis aguda |
| Sepsis grave/shock séptico sin focalidad |
Los protocolos deben incluir el tratamiento de primera línea y al menos un tratamiento alternativo así como contemplar situaciones particulares o frecuentes como insuficiencia renal, hepática, alergia a betalactámicos o el embarazo. Además, debe contemplarse el tratamiento dirigido y la duración del mismo.
En el caso de neumonía asociada a ventilación mecánica existen evidencias de que el desarrollo e implementación de protocolos hospitalarios se ha asociado a un aumento de la adecuación de la terapia empírica y a una reducción de la duración del tratamiento antibiótico aunque sin demostrarse en estos estudios una reducción en la mortalidad115,116.
Protocolos de profilaxis antibióticaUna buena parte de los antimicrobianos utilizados en el hospital se prescriben como profilaxis. En este caso se recomienda también formalizar la profilaxis antibiótica a través de protocolos hospitalarios consensuados por los distintos especialistas implicados. Hoy en día, la mayor parte de la profilaxis antibiótica por vía sistémica en cirugía se reduce a una dosis que debe de administrase en los 60 min previos a la incisión de la piel y solo en algunos casos (cirugía prolongada, sangrado intraoperatorio cuantioso) es necesario administrar una segunda dosis.
El no seguimiento de los protocolos de profilaxis es un factor que se asocia de forma independiente con el desarrollo de infección del sitio quirúrgico, siendo un factor más relevante la no administración de la dosis intraoperatoria117. El análisis y difusión anual de los resultados de tasas de infecciones quirúrgicas facilita el seguimiento de los protocolos de profilaxis y contribuye a mantener tasas bajas de infecciones quirúrgicas118.
Programas de auditoríasLos programas basados en recomendaciones personalizadas no impositivas, también denominados audits, se fundamentan en el asesoramiento específico sobre una serie de tratamientos antibióticos que se consideran a priori como susceptibles de optimización. Es necesario desterrar de estos programas la idea que frecuentemente se tiene del término auditoría como proceso potencialmente punitivo o estresante. A diferencia de lo que ocurre con las estrategias impositivas, se basan en la realización de una evaluación de una prescripción y en la elaboración de recomendaciones específicas al respecto para los médicos prescriptores, sin que dichas recomendaciones impliquen una acción restrictiva o impositiva sobre la prescripción. Obviamente, las auditorías deben realizarse en tiempo real.
Es lógico pensar que estas estrategias no impositivas gozan de mejor aceptación por parte de dichos médicos prescriptores y presentan una mayor función educativa a largo plazo si bien sus resultados son menos eficaces a corto plazo y más difícilmente mensurables que en los programas impositivos. Hasta ahora, estas actividades han centrado sus objetivos en los siguientes puntos: 1) emplear precozmente antibióticos de espectro suficiente, acorde a la sospecha clínica, en los casos de infección grave; 2) optimizar y adecuar el espectro antibiótico una vez conocido el patrón de sensibilidad del microorganismo causal de la infección; 3) ajustar la duración de los tratamientos antibióticos; 4) evitar el empleo de antibióticos de manera empírica indiscriminada cuando la clínica no sugiere una infección bacteriana; y 5) evitar el empleo de la vía parenteral en antibióticos con buena biodisponibilidad digestiva cuando la situación clínica lo permite, promocionando la terapia secuencial (paso de la vía intravenosa a oral).
La mayoría de estos programas requieren para su funcionamiento en la práctica clínica las siguientes condiciones:
Acuerdo previo con todos los servicios hospitalarios y feedback continuado de los resultados que facilite la implicación de todos los prescriptores en el programa.
Disponibilidad de un sistema de información diaria relativa a los antibióticos prescritos que permita seleccionar a los pacientes que cumplen los criterios de inclusión en el programa. Como alternativa, se pueden realizar los audits sobre todas las prescripciones de los servicios de manera rotatoria durante periodos establecidos de tiempo, o en pacientes con determinados diagnósticos microbiológicos (bacteriemias, etc.) (tabla 11).
Ejemplos de criterios de inclusión programas de auditorías no impositivas
| Criterio de inclusión en el programa de auditorías | Motivo |
| Selección aleatoria | Permite la revisión global del tratamiento con carácter pedagógico |
| Tercer día de prescripción de antibióticos | El tercer día de un tratamiento suele haber datos microbiológicos disponibles y datos evolutivos suficientes para valorar modificaciones (paso a vía oral, desescalada, aumento de espectro, suspensión, etc.) |
| Séptimo día de prescripción | Permite valorar la posibilidad de suspensión del tratamiento en numerosos síndromes infecciosos |
| Prescripción de antimicrobianos con dosificación más baja o alta de lo habitual | Permite corregir dosis insuficientes o excesivas |
| Prescripción de determinadas combinaciones de antibióticos | Permite evitar combinaciones redundantes o inadecuadas |
| Antimicrobianos poco habituales en determinados servicios (p. ej., carbapenémicos en Psiquiatría) | Permite evaluar prescripciones no habituales que pueden servir como «alarma» |
Revisión de la información clínica y microbiológica de los pacientes seleccionados, y siempre que sea posible y así se haya acordado, incluyendo la visita médica de los pacientes, que permita realizar recomendaciones respecto al tratamiento antibiótico. Las recomendaciones pueden dejarse en forma escrita en la historia clínica, de manera permanente o no (es decir, pueden ser retiradas posteriormente para evitar la sensación de que si no se siguen se puede incurrir en responsabilidad profesional), existiendo la posibilidad alternativa de la comunicación verbal directa, muy bien acogida por muchos prescriptores pero que dificulta la medición del impacto. Es clave que las conversaciones sobre la prescripción y el auditor se realicen en un contexto amable, evitando enfrentamientos, descalificaciones, etc., de manera se establezca una relación de discusión que conduzca al aprendizaje y a la confianza mutua. Obviamente, las recomendaciones deben ser realizadas por expertos reconocidos en el tratamiento de las enfermedades infecciosas (el equipo de antibióticos), lo que mejora su seguimiento por parte de los médicos prescriptores28,31–37.
Las principales recomendaciones que pueden establecerse en las auditorías son: el paso a la vía oral (tratamiento secuencial)119, la optimización de la dosis o forma de administración, el cambio del antimicrobiano prescrito y la suspensión de uno o todos los antimicrobianos (tabla 12). Un primer aspecto relevante en cuanto a la eficacia de estos programas es que la acogida suele ser muy favorable, con una tasa de aceptación de las recomendaciones que supera el 80% en los programas de estas características que han sido evaluados tanto en España120,121 como en otros países122,123. Estos programas han logrado un consumo más racional de los antibióticos y una mejor implantación de las pautas de terapia secuencial, siendo la retirada de antibioterapia y la terapia secuencial precoz las recomendaciones más frecuentemente aceptadas. Cabe destacar la reducción conseguida con estas actuaciones en el consumo cercana al 50% de antibióticos parenterales con buena biodisponibilidad oral (fundamentalmente de quinolonas parenterales) así como en algunos grupos de antibacterianos como los antiseudomónicos y los glucopéptidos. Estos resultados se traducen en un notable ahorro económico directo en antimicrobianos (alrededor del 20%) y la reducción en la incidencia de algunas infecciones nosocomiales como la diarrea por Clostridium difficile. En todos los estudios publicados se constata que la aplicación de los programas son seguros y no contribuyen negativamente en la mortalidad ni en el número de reingresos. Además, estos programas tienen un importante impacto educativo. Así, Briceland et al. comprobaron como durante el primer mes de implantación se establecieron recomendaciones en el 98,6% de los casos, mientras que solo se consideraron necesarias modificaciones en el 54,4% de los tratamientos antibióticos en el séptimo mes123. Es necesario señalar la rapidez con que se regresa a la situación de base en cuanto se interrumpe el programa20.
Principales recomendaciones para la realización de auditorías en el uso de antimicrobianos
| Tipo de recomendación | Recomendaciones específicas | Potenciales ventajas |
| Toma de muestras para el diagnóstico microbiológico | Siempre antes del inicio del tratamiento antimicrobiano, y antes del cambio por fracaso | Permite el tratamiento dirigido de la infección |
| Tratamiento secuencial | Paso del tratamiento intravenoso a oral (con el mismo u otro antimicrobiano) | Reduce los riesgos del uso parenteralReducción de costes |
| Optimización de dosis | Ajuste de dosis por peso, insuficiencia hepática, renal o interaccionesAjuste de dosis y forma de administración por criterios farmacocinéticos y farmacodinámicos | Mejora de eficaciaReducción de toxicidad |
| Cambio del antimicrobiano prescrito | Reducción del espectro: sustitución del antimicrobiano por otro de menor espectro y/o menor impacto ecológicoAumento del espectroCambio por fármaco igualmente activo pero más recomendable por criterios de eficacia, toxicidad o coste | Mejora de eficaciaReducción de la toxicidadReducción del impacto ecológicoReducción de costes |
| Suspensión | Suspensión de todo el tratamiento antimicrobianoSuspensión de alguno de los antimicrobianos utilizados en régimen combinado | Reducción del impacto ecológicoReducción de toxicidadReducción de costes |
En nuestra opinión, estos programas no impositivos, basados en recomendaciones que no discuten la libertad prescriptora del médico se adaptan mejor a la idiosincrasia de la medicina hospitalaria en España. Son programas de más difícil implantación y de mayor complejidad para su evaluación. Por otro lado, requieren de un alto grado de liderazgo científico y de ciertas habilidades de relación y convencimiento por parte del equipo que los desarrolla así como el consenso previo con las unidades hospitalarias implicadas. Se trata de programas intermedios entre los impositivos y los basados exclusivamente en protocolos o guías, y probablemente cuentan con las ventajas de unos y otros (buen cumplimiento de los impositivos y buena aceptación de las recomendaciones estandarizadas). Probablemente lo óptimo es la combinación de varios de ellos (como en las experiencias de Rüttimann et al.124 o la de Bantar et al.38, basada en un equipo multidisciplinario que aplicó el programa en diferentes escalones).
John et al.20, en su artículo de revisión sobre este tema, comentan alguna de las claves para el éxito de estos programas: cualquiera de los sistemas debe mantenerse a lo largo del tiempo para que conserve su eficacia; son más exitosos aquellos más cercanos al prescriptor; tienen más éxito aquellos en los que la acción del especialista en enfermedades infecciosas es más prominente; en cualquiera de ellos debe primar el beneficio del paciente sobre el simple ahorro económico; requieren un esfuerzo continuado por parte del equipo de antibióticos (en un hospital terciario, el mínimo de dedicación calculado que se requiere es media jornada diaria de un facultativo especialista en enfermedades infecciosas121).
Consultoría a expertos y programas de apoyo al manejo de determinados problemas infectológicosSe ha demostrado que determinados procesos infecciosos potencialmente graves tienen una mejor evolución clínica y una menor mortalidad cuando el abordaje se ha hecho con la colaboración de especialistas en enfermedades infecciosas125. En esos mismos estudios se observó que los expertos utilizaban menos antibióticos de amplio espectro, desescalaban a un menor espectro con mayor frecuencia, y realizaban terapia secuencial más precozmente. En estudios más recientes, el problema se centra en microorganismos concretos. En el caso de las bacteriemias por S. aureus se ha demostrado que el seguimiento de las recomendaciones realizadas por especialistas en enfermedades infecciosas se asocia con una mejor evaluación del caso y un manejo clínico más optimizado, un aumento en la frecuencia de curación y una disminución en las recidivas y de la mortalidad69–71,126,127. Otros procesos en los que el manejo de los antibióticos se puede optimizar mediante la consulta a expertos son las infecciones y/o colonizaciones debidas a microorganismos multirresistentes y hongos, aunque en estas 2 áreas la bibliografía es escasa128,129. Un ámbito en el que la consulta al experto para el manejo de los antibióticos es más frecuente es el quirúrgico. Un estudio realizado en Ginebra demostró que la intervención de un especialista en enfermedades infecciosas en una unidad de sépticos de cirugía ortopédica disminuía el consumo de antibióticos y el gasto derivado, sin un aumento del número de recurrencias de las infecciones tratadas130.
Los CDC incluyen la consulta a los expertos para el tratamiento de enfermedades infecciosas serias entre su campaña para la prevención de resistencias (CDC, Campaign to prevente antimicrobial resistance in healthcare settings.http://www.cdc.gov/drugresistance/healthcare/ [consultada el 6 Feb 2011]. Por tanto, la rápida disponibilidad y fácil accesibilidad de infectólogos para la consultoría, habitualmente mediante busca o teléfono móvil, es recomendable en todos los centros.
En consecuencia, se recomienda la disponibilidad de infectólogos para la realización de consultoría en el manejo de infecciones diversas y uso de antimicrobianos.
Además, existen muchas experiencias exitosas de la eficacia de programas activos de apoyo al manejo de determinados procesos infecciosos. Los más clásicos son aquellos que basan su actividad en el seguimiento de las bacteriemias («programas de bacteriemias»), con excelentes resultados clínicos y de coste-efectividad a través de la adecuación del manejo clínico y de la terapia antimicrobiana en función de los resultados de los hemocultivos131,132. Estos programas funcionan en muchos hospitales españoles, y su utilidad hace recomendable su extensión al resto133. Además, pueden diseñarse programas para otro tipo de infecciones, para el manejo de infecciones por microorganismos de difícil tratamiento, etc. Estos programas, aunque no dirigidos específicamente al uso de antimicrobianos, pueden utilizarse como complementarios dentro de los PROA.
En conclusión, la consulta al experto en enfermedades infecciosas y los equipos de apoyo a la prescripción son medidas de gran aceptación y necesarias en cualquier programa de optimización del uso de antimicrobianos.
Sistemas informáticos de apoyo a la decisión clínica en la prescripción de antibióticosLos sistemas informatizados de apoyo a la decisión clínica (CDSS, del inglés computerized decission support system) son sistemas de consulta clínica que, usando datos de estadísticas poblacionales y datos del propio paciente, asisten al médico en el diagnóstico y en la elección del tratamiento. Estos sistemas se han demostrado eficaces en mejorar la atención médica, reducir errores de prescripción y mejorar la adherencia a las recomendaciones89,134.
Existe un creciente número de publicaciones de estos sistemas; sin embargo, es difícil extraer conclusiones sobre la utilidad de los mismos por problemas metodológicos en el diseño de estos estudios y por la ausencia de indicadores de eficacia que hagan referencia a resultados clínicos e impacto de estos programas sobre las resistencias a los antibióticos.
Estos programas no deben sustituir el juicio clínico sino aumentar la información disponible al clínico prescriptor para que tome la decisión correcta, de manera ágil y rápida, evitando el bombardeo de alarmas innecesarias135. Es aconsejable que formen parte del plan global de control de antibióticos. Se han identificado algunas características importantes para el desarrollo de CDSS, resumidas en la tabla 13, algunas de las cuales han demostrado ser especialmente relevantes. En una revisión sistemática se demostró que los aspectos de un CDSS que se asociaban independientemente a mayores posibilidades de éxito de la intervención eran: que el sistema estuviera integrado en el proceso clínico, que proveyera la recomendación en el momento y lugar de la toma de decisiones, y que promoviera acciones, no limitándose a aportar valoraciones136.
Características de los sistemas informatizados de apoyo a la decisión en la selección de antibióticos
| 1. Características generales del sistema |
| a. Integración en el proceso de decisión, en la historia clínica o sistema de prescripción |
| b. Procedimiento informatizado de generación de la recomendación |
| 2. Características de la interacción del clínico con el sistema. |
| a. Recomendación de apoyo a la decisión establecida automáticamente como parte del flujo clínico |
| b. No debe requerir la introducción adicional de información |
| c. Debe argumentarse la razón de no adherirse a la recomendación |
| d. Debe proponerse la recomendación en el momento y lugar de la toma de decisión clínica |
| e. Debe requerirse la aceptación explícita de la recomendación para que se haga efectiva |
| 3. Características del contenido de la recomendación: |
| a. Debe proveer una recomendación, no solo una valoración |
| b. Debe promover la acción, más que la inacción |
| c. Debe justificarse la propuesta |
| 4. Características auxiliares: |
| a. Es aconsejable la implicación de los usuarios en el desarrollo |
| b. Proveer recomendaciones a los pacientes |
| c. Proveer de retroalimentación periódica de la adherencia a las recomendaciones de cada médico |
| d. Es recomendable que vaya asociado a educación convencional |
Existen varios tipos de herramientas de apoyo a la decisión clínica en prescripción de antibióticos137, ordenados de menor a mayor complejidad: 1) sistemas que facilitan el acceso a la información, tanto a datos del paciente como a fuentes de conocimiento; 2) sistemas que alertan al médico antes de determinados resultados de laboratorio, de posibles interacciones o disparidades antibiótico escogido-antibiograma, dosis excesivas, etc.); y 3) sistemas que elaboran consejos de acuerdo a las características del paciente y sus resultados.
Existen múltiples descripciones de intervenciones de este tipo de sistemas informatizados de apoyo a la decisión médica. Las posibilidades de ayudas automatizadas a lo largo de la prescripción son múltiples (incluyendo consulta de criterios diagnósticos de sepsis y foco de infección, recomendaciones de tratamiento, de patrones epidemiológicos locales, alarmas de alergias, ajustes de dosificación por peso, función renal y/o hepática y parámetros PK/PD, recuerdos de suspensión de profilaxis quirúrgica y duración estándar de tratamientos, promoción de la terapia secuencial, etc.). En primer lugar, existen herramientas diseñadas para identificar pacientes con signos de sepsis y activar una alarma que permita diagnosticar y tratar precozmente estos enfermos. Una vez diagnosticado un síndrome clínico, un sistema de ayuda puede recuperar información epidemiológica local sobre la etiología más frecuente y su perfil de sensibilidad antibiótica. A la hora de seleccionar el antimicrobiano, sistemas informatizados de prescripción no muy complejos permiten prescribir según diagnóstico, descargando el antibiótico protocolizado por el hospital para indicación. Existen también descripciones de aplicaciones más complejas que incluyen algoritmos o cálculos probabilísticos para asistir al clínico en la elección del antibiótico.
Gran parte de los sistemas informáticos de prescripción comercializados incorporan ya alarmas de alergias y existen numerosas descripciones de sistemas para dosificar adecuadamente aminoglucósidos y vancomicina. En los sistemas integrados de historia clínica y prescripción electrónicas, es relativamente sencillo introducir herramientas de ajuste de dosis a la función renal. Existen también aplicaciones sencillas para sistemas de prescripción electrónica de fomento de la utilización de quinolonas por vía oral que detectan pacientes con quinolonas vía parenteral y con dieta y otros fármacos por vía oral y elaboran una sugerencia al médico sobre la utilización de esa vía. En sistemas integrados existen herramientas que permiten detectar tratamientos antibióticos discordantes de acuerdo con el antibiograma del microorganismo aislado. Finalmente, la mayor parte de los sistemas electrónicos de prescripción permiten prescribir con fecha de fin o introducir alarmas o recordatorios de duración de tratamiento.
Por último, las herramientas más complejas son los sistemas avanzados de apoyo a la prescripción de antibióticos que utilizando datos específicos del paciente (del registro de sus observaciones clínicas, datos de laboratorio, resultados microbiológicos, patológicos y radiológicos) integra esta información con datos epidemiológicos locales y fuentes de conocimiento o recomendaciones terapéuticas y elabora recomendaciones a lo largo de todo el proceso de prescripción de antibióticos. De estos sistemas, los que más información han generado son dos. El conocido como HELP (Health Evaluation through Logical Processing) desarrollado en el Hospital LDS en Salt Lake City134. Este asistente de antibióticos automatizado elabora una recomendación específica del paciente, en tiempo real, sobre el tipo de antimicrobiano, dosis, vía de administración y duración. Ha demostrado su utilidad en la profilaxis quirúrgica, y los tratamientos dirigido y empírico, la parte más compleja del sistema. El otro sistema, basado en redes de probabilidad bayesiana, conocido como TREAT, ha sido ensayado en la práctica clínica en varios centros, lo que aporta algo que falta a menudo en los estudios de estas aplicaciones, la reproducibilidad en diferentes lugares66.
En conclusión, las medidas de ayuda a la prescripción son una herramienta necesaria y útil en cualquier programa de optimización del uso de antimicrobianos en los hospitales. Entre ellas, algunas se deben considerar básicas como la existencia de protocolos de tratamiento antimicrobiano o la posibilidad de la consulta al experto, y otras avanzadas como los programas de auditoría no impositiva o la utilización de algunas rutinas informáticas para facilitar la prescripción.
Aportaciones del laboratorio de microbiología a la optimización individualizada de la prescripción de antibióticosEl laboratorio de microbiología clínica tiene un papel crítico en el uso adecuado de antimicrobianos ya que proporciona la identificación de los patógenos implicados en el proceso infeccioso y realiza las pruebas de sensibilidad a antimicrobianos de los mismos. Esta información es muy valiosa para optimizar el tratamiento antimicrobiano individual ya que guía la elección del mismo y permite el desescalamiento, pero además se puede utilizar como estrategia para evitar el uso de antimicrobianos de amplio espectro y favorecer el uso de otros también activos pero con menor impacto ecológico. Por otra parte, esta información sirve de ayuda en el control de la infección mediante la vigilancia de microorganismos resistentes. Finalmente, los datos de monitorización de resistencias incluidos en el apartado III.2.2 son facilitados por los servicios de microbiología.
Otra de las importantes aportaciones del laboratorio de microbiología al control de la infección es la aplicación de técnicas moleculares que permiten la identificación de patógenos difíciles de cultivar, evitando potencialmente prolongados tratamientos antimicrobianos empíricos de amplio espectro y que son de gran ayuda para la investigación de brotes.
Puesto que la información incluida en el antibiograma es de gran utilidad para las estrategias de mejora en el uso de antibióticos, es necesario que la determinación de sensibilidad a antimicrobianos, su interpretación y su informe se basen en normas estandarizadas y desarrolladas por diferentes comités nacionales o internacionales como el CLSI138 o el EUCAST139. Del mismo modo, también se deben estandarizar los métodos para detectar fenotipos de resistencia nuevos o emergentes y para ello los laboratorios deben estar adscritos a programas de control de calidad. La realización de pruebas de determinación de sensibilidad a antimicrobianos debe establecer prioridades en cuanto a los antimicrobianos a estudiar, según el microorganismo y la unidad hospitalaria de que se trate: estudio de un número variable pero que permita la inferencia adecuada de mecanismos de resistencia, determinación de su actividad cualitativamente (categorización clínica de sensible, resistente u otras) o cuantitativamente (valor de la CMI). Por otra parte, el laboratorio debe realizar un antibiograma interpretado para anticipar mecanismos de resistencia difíciles de detectar y evitar la utilización inadecuada de antimicrobianos140. También debe priorizar los informes de sensibilidad a emitir, en los que debe prevalecer el interés clínico pero que siempre han de ser selectivos, listando los agentes de primera línea en primer lugar y limitando el número de antimicrobianos informados, siendo recomendable un número de seis; es necesario que esta información esté consensuada. Además se debe evitar proporcionar de manera habitual datos de sensibilidad a antimicrobianos no incluidos en el formulario del hospital o restringidos141. La selección de los antimicrobianos a informar será variable según la prevalencia de resistencia en el hospital y en el área extrahospitalaria, el coste y las indicaciones aprobadas por diferentes agencias y debe estar consensuada entre el laboratorio y los especialistas más implicados en el manejo de las enfermedades infecciosas. Los casos de resistencias inesperadas (por ejemplo, de S. aureus a la vancomicina o de Escherichia coli a carbapenémicos u otros fenotipos no descritos, si ocurrieran) deben informarse siempre y en los casos en que es probable la selección de resistencia in vivo es recomendable incluir comentarios adicionales a los resultados que ayuden a realizar una mejor elección del antimicrobiano a utilizar.
Finalmente, el papel del laboratorio es importante en la identificación y la investigación de brotes mediante técnicas de epidemiología molecular que ayudan a enfocar las adecuadas intervenciones y conducen a reducir las infecciones nosocomiales y los costes. Actualmente el desarrollo de técnicas rápidas de detección de microorganismos resistentes como S. aureus resistente a meticilina facilita su vigilancia y permite una rápida implementación de las medidas de control142.
Intervenciones específicas de los PROA en las UCIEl uso de antibióticos, generalmente de amplio espectro y elevado coste, es muy habitual en los servicios de medicina intensiva. Además, con frecuencia estos antimicrobianos se prescriben en combinación y por periodos prolongados. Esta realidad se justifica por varios motivos que pueden resumirse en que la importancia del tratamiento empírico adecuado precoz. Este hecho es de particular importancia en pacientes críticos3,143. Además, se ha demostrado que el tratamiento antibiótico inadecuado se asocia a una mayor estancia en UCI y hospital con el consiguiente coste asociado144. Además, en estos pacientes puede ser difícil diferenciar el síndrome de respuesta inflamatoria sistémica (SRIS) de causa infecciosa del de causa no infecciosa145, y con frecuencia es difícil en estos pacientes reconocer el foco de infección. Por ello, es importante desarrollar medidas para mejorar la prescripción del tratamiento antimicrobiano específicas en los pacientes críticos con los siguientes objetivos146,147:
- 1.
Mejorar la adecuación del tratamiento antibiótico empírico.
- 2.
Optimizar la dosificación según los parámetros farmacocinéticos y farmacodinámicos de los antibióticos.
- 3.
Suspender precozmente el tratamiento antibiótico en los casos en que no se demuestre enfermedad infecciosa.
- 4.
Favorecer el tratamiento dirigido con antibióticos del espectro más reducido posible.
- 5.
Evitar los tratamientos innecesariamente prolongados.
Los primeros 2 objetivos persiguen una reducción de la mortalidad de los pacientes con sepsis grave o shock séptico mientras que en los objetivos 2 al 5 están más dirigido a reducción complicaciones asociadas al uso de antibióticos y evitar la selección de patógenos multirresistentes en la unidad.
Las distintas medidas para la mejora de la prescripción de antimicrobianos tienen particularidades específicas en las UCI. Así, la introducción del consejo del especialista en enfermedades infecciosas puede mejorar la adecuación del tratamiento antibiótico y la adherencia a las guías locales148. Sin embargo, el seguimiento de los consejos es irregular, y se realiza más frecuentemente cuando la opción propuesta es continuar con la misma terapia antibiótica149. Por ello, se requiere además la realización de protocolos locales de tratamiento con participación multidisciplinaria, incluyendo la participación activa del intensivista experto en enfermedades infecciosas en el consejo del tratamiento antibiótico146.
En cuanto a las guías clínicas, se ha demostrado que el empleo de tratamiento antibiótico acorde a las guías internacionales reduce la mortalidad de los pacientes que ingresan en UCI con infecciones graves como neumonía comunitaria o meningitis110–112.
En cuanto a los protocolos locales, en el caso de infecciones nosocomiales sabemos que los patógenos implicados dependen de la ecología local y que pueden ser muy diferentes de una unidad a otra incluso dentro del mismo hospital, es necesario desarrollar protocolos locales de tratamiento basándose en la epidemiología del hospital. Su desarrollo e implementación se ha asociado a un aumento de la adecuación del terapia empírica y a una reducción de la duración del tratamiento antibiótico aunque sin demostrarse en estos estudios una reducción en la mortalidad115,116.
En cuanto a las campañas formativas, en el ámbito del paciente crítico han demostrado reducir la mortalidad en el contexto de la Surviving Sepsis Campaign, siendo uno de los factores que contribuyen a la mejora en la prescripción antibiótica y su precocidad de administración150,151.
Principalmente son 2 las estrategias de manejo antibiótico en el paciente crítico que se han desarrollado en los últimos años: el «des-escalamiento» terapéutico y la rotación de antibióticos. Mientras que la utilidad de la segunda está cuestionada, el «desescalamiento» terapéutico se ha adoptado en otros ámbitos fuera del paciente crítico.
La optimización mediante reducción del espectro («des-escalamiento» o streamlining) consiste en la administración inicial de tratamiento empírico de amplio espectro con la intención de cubrir todos los posibles patógenos seguido de un ajuste del tratamiento estrechando el espectro antibiótico una vez conocido el agente etiológico. Obviamente, es esencial la toma de cultivos antes del inicio de la antibioterapia para después poder ajustar el tratamiento. Con frecuencia los clínicos son muy reacios a reducir el espectro antibiótico en un paciente en situación crítica: «si el paciente va bien prefiero no modificar el tratamiento» o «si la evolución no es buena no voy a reducir el tratamiento antibiótico» son argumentos por todos conocidos. Sin embargo, diversos estudios han demostrado que es una estrategia segura y que puede llevarse a cabo en el día a día. En un grupo heterogéneo de pacientes críticos, se llevó a cabo el des-escalamiento en el 60% de ellos. Comparados con aquellos en los que no se realizó, no se observaron diferencias en la mortalidad si bien la recurrencia de infecciones fue menor en el grupo de «des-escalamiento»152. Sin embargo, es sin duda en la neumonía asociada a la ventilación mecánica donde se ha preconizado y analizado con más detalle esta estrategia. La tasa de «des-escalamiento» se sitúa en torno al 30-50% de los pacientes con terapia adecuada, la evolución clínica en los que se realiza es similar al grupo comparador153,154 o incluso la mortalidad es menor comparada con la de los que no se modifica la terapia antibiótica155.
La rotación de antibióticos se ha descrito con anterioridad. En las UCI, los estudios realizados han tenido resultados contradictorios respecto a la reducción de bacterias multirresistentes (especialmente bacilos gramnegativos)156,157 y no se ha logrado demostrar un aumento de la adecuación del tratamiento empírico158, por lo que hoy en día no se recomienda su empleo.
Aspectos relacionados con la seguridad en la utilización de antimicrobianosLos efectos adversos relacionados con la utilización de antimicrobianos constituyen un problema importante de salud en el ámbito hospitalario. El sistema de utilización de los medicamentos en los hospitales es complejo, abarca diferentes etapas e implica la participación de diferentes profesionales y está sujeto a errores. Según el ADE Prevention Study159, el 56% de los errores se originan en el proceso de prescripción, el 34% en la administración, el 6% en el proceso de transcripción y el 4% en la dispensación. Un porcentaje importante de estos errores son evitables o prevenibles. Está fuera de los objetivos de este documento revisar las recomendaciones para evitar los errores en la dispensación y administración de medicamentos. Cada institución sanitaria debe identificar los procesos en los que se producen errores con más frecuencia y desarrollar medidas de prevención específicas para cada etapa y para cada uno de los profesionales implicados, dirigidas a mejorar la seguridad en la utilización de los medicamentos43,160. En el caso de los antimicrobianos, existen algunos aspectos específicos que se deben considerar:
- –
Momento de la administración de la primera dosis. Existe relación entre el retraso en la administración de la primera dosis de antimicrobiano activo y la mortalidad en diversas infecciones graves (meningitis, sepsis grave o shock3–5). Deben implementarse medidas que garanticen una rápida disponibilidad del fármaco y su inmediata administración, sin esperar a los horarios estándar para la medicación.
- –
Horario de las dosis siguientes. Es imprescindible no olvidar ninguna dosis del antimicrobiano, y administrarlo según la pauta de dosificación indicada.
- –
Compatibilidad de infusiones. Debe comprobarse en todos los casos que la administración de más de un fármaco se realice por la misma luz del catéter.
- –
Velocidad de la infusión intravenosa. Deben seguirse las indicaciones para la administración (en bolo, en perfusión extendida o en perfusión continua). En caso de indicarse la administración en perfusión extendida o continua debe comprobarse la estabilidad del fármaco.
- –
Alergias a antibióticos. No por obvio, y aunque no sea específico de los antimicrobianos, debe omitirse en este apartado la necesidad de considerar la historia de alergia a antimicrobianos antes de prescribir y administrar los antibióticos que, en ocasiones, por la necesidad de ganar tiempo en la administración de la primera dosis, puede pasar inadvertida. A este respecto debe considerarse también que la mayoría de las ocasiones en que un paciente dice ser alérgico a un antibiótico no lo es realmente y que esto puede conducir a la utilización de fármacos menos eficaces, más tóxicos y más costosos que los tratamientos de primera línea. Por ello, en caso de que un paciente afirme ser alérgico a los antibióticos es fundamental hacer una historia clínica detallada que se centre en el tipo de reacción experimentada, en la utilización reciente de antibióticos de la misma familia que el supuestamente causante de la alergia y si el paciente ha sido evaluado específicamente por un alergólogo. En caso de que la anamnesis no permita descartar razonablemente un cuadro alérgico es recomendable asumir el diagnóstico, plantear una alternativa terapéutica y remitir al paciente a dicho especialista.
La administración de medicamentos es una actividad interdependiente del diplomado en enfermería. Las capacitaciones que ha de tener el profesional de enfermería para responsabilizarse de la administración de fármacos se basan en el conocimiento de estado clínico del paciente, el nombre genérico y comercial del medicamento, presentación y concentración, la dosis terapéutica mínima y máxima, los efectos primarios y secundarios, la vida media del medicamento en la sangre, el metabolismo y la forma de eliminación del fármaco, el sinergismo y antagonismo del medicamento con otros medicamentos, los requerimientos para la conservación de las cualidades físicas y químicas y las normas relativas a la prescripción de medicamentos.
El farmacéutico hospitalario tiene un papel fundamental en la identificación sistemática precoz de efectos adversos, de pacientes susceptibles de monitorización farmacológica, así como de dosis subóptimas e interacciones farmacológicas. Es deseable que desde los PROA se faciliten este tipo de intervenciones.
Seguimiento del documentoRecientemente en nuestro país se ha realizado la primera encuesta sobre las actividades para la mejora de uso de antibióticos y las percepciones de los profesionales29. Tan solo un 40% de los hospitales encuestados disponía de un PROA. La mayor parte de intervenciones se realizaron sobre el desescalamiento, la terapia secuencia y la monitorización de antibióticos estratégicos. Es de destacar que una gran proporción de los hospitales llevaban a cabo estas actividades sin un programa estructurado y sin el apoyo institucional necesario, en detrimento no solo de los recursos destinados sino también de la autoridad del mismo programa. Vistos estos datos, existe una gran oportunidad para ampliar la implantación de los PROA como instrumento de mejora en los hospitales del país.
Tal y como queda reflejado en el presente documento, no existe una correlación perfecta entre la instauración de un PROA eficaz y la reducción de las resistencias, dado que impacto ecológico causado por el uso de antibióticos está más allá de su consumo en los hospitales161. Así mismo quedan por determinar los mejores indicadores para evaluar el beneficio de los PROA. La intención de los autores del documento es hacer hincapié sobre la necesidad de un uso racional de los antibióticos para evitar, no solo el impacto ecológico nefasto que su mal uso comporta, sino también para garantizar tanto la seguridad del paciente como la adecuación de los costes así como la gestión racional de un recurso limitado. En este contexto, este documento marco pretende servir para concienciar a los entes de gobierno sobre la necesidad de dotar de recursos económicos y humanos a los PROA, teniendo en cuenta que a la larga estos programas se sustentan por el propio ahorro que generan124,162.
La difusión del documento se llevará a cabo a través de las sociedades firmantes, mediante su publicación en la revista de la especialidad, su distribución a las comisiones de antibióticos de todos los hospitales del país, autoridades sanitarias con responsabilidad en la calidad asistencial y la presentación a los medios de comunicación general. En un segundo tiempo, al año de su publicación, se plantea la realización de una nueva evaluación de la situación del país mediante una nueva consulta realizada con la misma encuesta citada previamente. En esta segunda consulta se incidirá tanto en las políticas de intervención como en los sistemas de evaluación de los indicadores de resultados y de proceso.
RecomendacionesAspectos organizativosNivel básicoConformación y nombramiento del equipo de antibióticos dependiente de la Comisión de Infecciones y Política Antibiótica, formado al menos por especialistas en estas áreas: enfermedades infecciosas, farmacia hospitalaria y microbiología, con elección de sus miembros en función del liderazgo científico y profesional en el uso de antimicrobianos y las resistencias. Considerar la inclusión de especialistas en medicina intensiva y medicina preventiva.
Establecimiento de las funciones del equipo de antibióticos, que incluyen: el diseño del PROA adaptado al centro, institucionalización del programa, difusión a todos los profesionales implicados del centro, y seguimiento del mismo.
Nivel avanzadoNormalización de las actividades del equipo de antibióticos, actas de reuniones, presentación de informes y evaluación periódica de objetivos.
Nivel excelenteDiseño de mapa de competencias para los distintos miembros necesarios en el equipo de antibióticos y acreditación de las actividades profesionales de los integrantes del equipo de antibióticos en sus actividades específicas.
Acreditación en Calidad del PROA.
InstitucionalizaciónNivel básicoAprobación del PROA por la Comisión de Infecciones y Política Antibiótica del centro, con apoyo explícito de la Dirección del hospital.
Nivel avanzadoInclusión del PROA entre los objetivos estratégicos del hospital.
Nivel excelenteInclusión de incentivos ligados a objetivos del PROA para los distintos servicios asistenciales y los miembros del equipo de antibióticos.
Recursos técnicos y humanosNivel básicoRealización de un análisis detallado de las necesidades de recursos humanos en función de las actividades y objetivos planteados.
Disponibilidad de profesionales para dedicar el tiempo de trabajo imprescindible según el análisis realizado para las actividades básicas del PROA; en caso de que exista necesidad de ampliar los recursos humanos, establecer acuerdos con la Dirección del centro respecto a la redistribución de tareas de los profesionales de los servicios implicados y/o el aumento del número de profesionales.
Disponibilidad de un lugar para reuniones del equipo de antibióticos, disponibilidad de recursos informáticos y medios para la formación, acceso a bibliografía actualizada.
Accesibilidad a datos hospitalarios básicos necesarios para la medición de indicadores (estancias e ingresos totales y por servicios).
Microbiología: medios necesarios para la realización de informes periódicos de resistencias.
Farmacia: medios necesarios para el cálculo fiable de consumos de antimicrobianos y para la implantación de la prescripción electrónica generalizada.
Nivel avanzadoRecursos humanos: disponibilidad de profesionales para dedicar el tiempo de trabajo imprescindible función del análisis realizado para las actividades avanzadas del PROA.
Accesibilidad a datos hospitalarios para la medición de indicadores avanzados (estancia y mortalidad por GRD).
Microbiología: medios necesarios para la realización de informes periódicos de resistencias, incluyendo un aislamiento por paciente y diferenciado por tipos de servicios.
Farmacia: prescripción electrónica asistida con disponibilidad de alertas informáticas para alergias medicamentosas, duración de los tratamientos, riesgos de interacciones farmacológicas y fomento de la terapia secuencial.
Nivel excelenteRecursos humanos: disponibilidad de profesionales para dedicar el tiempo de trabajo imprescindible en función del análisis realizado para las actividades excelentes del PROA.
Microbiología: medios necesarios para la realización de informes periódicos de incidencia de patógenos resistentes de interés según mecanismos de resistencia específicos y clonalidad.
Farmacia: sistemas de prescripción asistidos con consejo de ajuste de dosis según la función renal y/o hepática del paciente, el peso y los parámetros farmacocinéticos y farmacodinámicos.
Objetivos e indicadores de los PROANivel básicoEl PROA debe especificar que sus objetivos genéricos son, por este orden: a) mejorar los resultados clínicos de los pacientes con infecciones; b) minimizar los efectos adversos asociados a la utilización de antimicrobianos (incluyendo aquí la aparición y diseminación de resistencias); y c) garantizar la utilización de tratamientos coste-eficaces.
El PROA debe definir indicadores medibles tanto de proceso como de resultado en función de los objetivos fijados, que permitan evaluar el grado de consecución de esos objetivos.
En una fase inicial, el PROA debe establecer como prioridad el conocimiento de la situación basal de los indicadores y su análisis para el establecimiento y priorización de los objetivos específicos, así como la elección de estándares externos en el consumo (por ejemplo, datos del ESAC), resistencias (por ejemplo, datos del EARSS, considerando que estos datos son solo de bacteriemias), calidad de prescripción y resultados clínicos.
La periodicidad (mensual, trimestral, semestral, etc.) con que deben recogerse los indicadores dependerá del propio indicador, del tamaño del centro o unidad y de las intervenciones implantadas.
En la medida de lo posible, los distintos indicadores de consumo de antimicrobianos y de resistencias se referirán a los mismos periodos de tiempo y unidades o servicios.
El indicador básico de consumo de antimicrobianos recomendado es DDD/100 estancias, medido en función del antimicrobiano dispensado. Este indicador debe ofrecerse para el consumo global de antimicrobianos y para el consumo de antimicrobianos por áreas (médicas, quirúrgicas y de medicina intensiva), y por subgrupos o subfamilias de antimicrobianos según su utilización clínica, e incluyendo además el consumo de antimicrobianos específicos en función de su mayor consumo o relevancia en cada situación.
Realización de informes acumulados periódicos de resistencia a antimicrobianos en función de los puntos de corte recomendados por CLSI o EUCAST, incluyendo un aislado por paciente, y clasificando los mismos en «extrahospitalarios» y «hospitalarios» (véase texto), y clasificando de manera individual los de las UCI.
La selección de los microorganismos y mecanismos de resistencia, y los antibióticos para estos informes se realizarán de acuerdo con el equipo de control de infecciones siguiendo las recomendaciones de la tabla 4.
El PROA definirá al menos un indicador de resultado clínico pronóstico de la antibioticoterapia medibles en el centro (tabla 5).
Los indicadores debe remitirse regularmente a la Dirección del centro y a la Comisión de Infecciones y Política Antibiótica, con la realización de un informe reflexivo sobre los mismos, y a todos los servicios del hospital.
Nivel avanzadoUna vez conocido el nivel de situación de partida, el PROA debe incluir objetivos específicos dentro de los genéricos, priorizados en función del análisis de la situación local.
De manera adicional al indicador del consumo de antimicrobianos en DDD/100 estancias se añade el de DDD/100 ingresos.
Los indicadores de consumo se deben medir adicionalmente por grupos de antimicrobianos en función de indicaciones clínicas (antiseudomónicos, fármacos frente a grampositivos resistentes, etc.).
Adicionalmente a lo referido anteriormente respecto a los informes de resistencia, se incluirá en estos la interpretación de fenotipos asociados a mecanismos de resistencia.
Se realizarán evaluaciones de calidad de prescripción de antimicrobianos mediante estudios transversales que permitan la identificación de áreas de intervención o el impacto de las mismas, al menos en unidades o situaciones específicas seleccionadas basándose en la reflexión de datos de consumo, resistencia o datos clínicos.
Se utilizará como referencia de calidad de prescripción el protocolo o guía del centro, y en su defecto, una guía clínica externa evaluada y adaptada a la situación epidemiológica local. Para la metodología, véase texto.
Como indicadores de resultado, se incluirán al menos un indicador relacionado con efectos adversos y uno relacionado con el pronóstico de las infecciones tratadas con antibióticos (tabla 5).
Nivel excelenteSe realizará un análisis periódico sobre el nivel de cumplimiento de los objetivos en función de los indicadores medidos, con realización de planes de mejora y elaboración de nuevos objetivos según estos.
La medición de DDD se realizará en función de los antimicrobianos administrados.
Adicionalmente, se medirán las DDP y DDT para unidades o antimicrobianos específicos.
Adicionalmente a lo referido anteriormente respecto de los informes de resistencia, adicionalmente se realizarán informes en base a puntos de corte epidemiológicos (ECOFF).
Se realizarán evaluaciones de calidad de prescripción de antimicrobianos mediante estudios longitudinales que permitan la identificación de áreas de intervención o el impacto de las mismas, al menos en unidades o situaciones específicas seleccionados según la reflexión de datos de consumo, resistencia o datos clínicos.
Como indicadores de resultado pronóstico, se incluirán al menos uno relacionado con efectos adversos y al menos dos relacionados con el pronóstico (tabla 5).
Intervenciones educativasNivel básicoEstablecimiento de un programa formativo continuado en uso de antibióticos, evaluable, dirigido al menos a los prescriptores más relevantes, incluyendo especialistas en formación.
Priorización de actividades encaminadas a la resolución de casos prácticos y toma de decisiones.
Nivel avanzadoEvaluación de las necesidades formativas de los prescriptores. Registro de consultas sobre antibioterapia por los consultores y miembros del equipo de antibióticos, y análisis de los indicadores para diseño de estrategias formativas.
Acreditación del programa o programas formativos con obtención de créditos de formación.
Inclusión de actividades formativas en los objetivos individuales de las unidades y los especialistas del centro.
Inclusión del programa de antibioterapia en el plan de formación específica y obligatoria de especialistas en formación, mediante acuerdo con Comisión de Docencia.
Nivel excelenteUso de herramientas de e-learning.
Intervenciones restrictivasNivel básicoGuía fármaco-terapéutica: existencia de un procedimiento normalizado para la inclusión/exclusión de fármacos específicos para antimicrobianos, que incluya el informe del equipo de antibióticos.
Cualquier medida restrictiva para la indicación de fármacos debe haber sido explicada a los prescriptores, adaptarse a las costumbres del centro, tener la menor carga burocrática posible y ser razonablemente flexibles. En ningún caso las medidas restrictivas serán las únicas, ni serán priorizadas sobre las medidas de ayuda a la prescripción.
Pueden considerarse medidas restrictivas para los antimicrobianos nuevos (de manera temporal), de muy alto coste o de alta toxicidad.
Se desaconsejan las órdenes de suspensión automáticas (salvo en profilaxis quirúrgica) y la rotación cíclica de antibióticos salvo circunstancias excepcionales.
Nivel avanzadoEvaluación periódica de los antibióticos e indicaciones incluidas en la guía fármaco-terapéutica del hospital.
Evaluación periódica del impacto positivo y negativo de las medidas restrictivas para fármacos concretos.
Deben considerarse medidas restrictivas temporales para determinados fármacos en determinadas situaciones epidemiológicas, que puedan ser de ayuda para el control de dicha situación.
Nivel excelenteDisponibilidad del equipo de antibióticos las 24 h del día, todos los días.
Medidas no impositivas de ayuda a la prescripciónNivel básicoRealización de guías o protocolos locales de profilaxis, tratamiento empírico y tratamiento dirigido, basados en adaptación de guía externas a la situación epidemiológica y costumbres locales, realizados mediante consenso de los distintos servicios implicados y aprobados por la Comisión de Infecciones (véase texto).
Revisión periódica de los mismos (al menos bienal)
Disponibilidad de infectólogos o expertos en el manejo clínico de enfermedades infecciosas y antibioterapia para consultoría.
Acceso informatizado a datos analíticos, microbiológicos y radiológicos de los pacientes en tiempo real.
Antibiogramas: realización, interpretación e informe según normas estandarizadas establecidas por comités internacionales (CLSI, EUCAST) y laboratorio adscrito a programas de control de la calidad. Selección consensuada de antibióticos a estudiar e informar, con comentarios cuando proceda.
Establecimiento de procedimientos que garanticen la administración segura de los antimicrobianos: administración inmediata de la primera dosis del antibiótico una vez prescrito, cumplimiento de la pauta y dosificación de administración, evaluación de posibles alergias, compatibilidad de infusiones, tiempo de estabilidad de los fármacos.
Aspectos específicos de UCI: priorizar el seguimiento de protocolos y guías clínicas, campañas formativas, importancia de la toma de muestras antes de iniciar o cambiar la antibioterapia, necesidad de desescalar o ajustar el tratamiento con datos microbiológicos, normalizar la consulta a enfermedades infecciosas.
Nivel avanzadoEvaluación sistemática (mediante AGREE) de la calidad de las guías externas y adaptación sistematizada de las mismas al entorno epidemiológico local para la elaboración de los protocolos locales.
Programa de auditorías (audits) con objetivos prefijados en unidades prescripciones o situaciones priorizadas, o de manera rotatoria, con evaluación de la prescripción y realización de recomendaciones no impositivas en tiempo real, previo acuerdo con los prescriptores.
Programas activos de apoyo al manejo de determinados problemas, como las bacteriemias, microorganismos de difícil tratamiento, etc.
Sistemas de alerta ante disparidad entre sensibilidad y antibiótico prescrito, dosificaciones potencialmente inadecuadas.
Uso de técnicas rápidas para identificación de microorganismos resistentes que permitan la optimización precoz de tratamientos, cuando sean coste-efectivas.
Nivel excelenteEvaluación de las guías locales en cuanto a su grado de acierto en los tratamientos empíricos y sus resultados clínicos.
Auditorías de prescripción en tiempo generalizadas en todo el hospital.
Sistemas expertos de apoyo a la prescripción en función de los datos del paciente y epidemiológicos.
FinanciaciónEste documento ha sido financiado en su totalidad por la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y el Ministerio de Ciencia e Innovación, Instituto de Salud Carlos III, cofinanciada por el Fondo Europeo de Desarrollo Regional «Una manera de hacer Europa» FEDER, Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008).
Conflicto de interesesJ. Rodríguez-Baño ha sido ponente para MSD, Pfizer, Wyeth, Astra, Novartis y Janssen; ha realizado tareas de asesoría para MSD, Pfizer, Novartis y Janssen-Cilag; y ha recibido financiación para investigación de Wyeth y Novartis. J.R. Paño ha realizado tareas de asesoría para Gilead, Merck y Wyeth y ha recibido fondos de investigación de Gilead. S. Grau ha sido ponente para Novartis, Janssen-Cilag, MSD, Pfizer, Gilead, Schering-Plough y Astellas, y ha recibido financiación para investigación de Pfizer, Novartis y Janssen. J.P. Horcajada ha sido ponente para Astellas, Novartis, Janssen-Cilag y AstraZeneca, y ha recibido financiación para la investigación de AstraZeneca. A. Oliver ha recibido fondos para investigación de Janssen-Cilag, Cubist Pharmaceuticals y Calixa Therapeutics. J. Cobo ha sido consultor para AstraZeneca, Wyeth y Novartis, ha recibido fondos de investigación de Pfizer y ayudas para organización de actividades de formación de AstraZeneca. E. Cercenado ha sido ponente para Novartis. J. Pasquau ha recibido ayudas económicas por asesorías o conferencias, o para actividades de formación o investigación, de Janssen, Novartis, Wyeth, MSD, Pfizer, Astra Zeneca, Gilead, BMS, Roche, GSK, Boehringer Ingelheim y Abbott. El resto de los autores no tienen conflictos de interés.
Agradecemos a los miembros de las sociedades firmantes los comentarios y sugerencias realizadas.
GEIH-SEIMC: Grupo de Estudio de la Infección Hospitalaria-Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (Hospital Infection Working Group-Spanish Society of Infectious Diseases and Clinical Microbiology); SEMPSPH: Sociedad Española de Medicina Preventiva, Salud Pública e Higiene (Spanish Society of Preventive Medicine, Public Health and Hygiene).
Documento publicado simultáneamente en Farmacia Hospitalaria. Farm Hosp. 2012. doi: 10.1016/j.farma.2011.10.001.