Introducción
Proteus penneri, denominado con anterioridad Proteus vulgaris biogrupo 1 o P. vulgaris indol-negativo, fue reconocido como una especie nueva en 1982 1. P. penneri tiene una menor incidencia epidemiológica que otros miembros del género Proteus. Sin embargo, se asocia a procesos similares a los que producen P. mirabilis y P. vulgaris, y tiene factores de patogenicidad análogos a los de éstos. Desde el punto de vista de la resistencia a los antimicrobianos, presenta unas características particulares que, unidas a algunas peculiaridades en su perfil bioquímico, lo hacen fácilmente reconocible en el laboratorio 1-3.
Taxonomía del género Proteus
El género Proteus está incluido en la tribu Proteeae, junto con los géneros Providencia y Morganella, y sus miembros se describen como bacilos gramnegativos, móviles, con flagelos perítricos, aerobios y anaerobios facultativos 2. Todos ellos, y debido a la producción de fenilalanina desaminasa, se caracterizan por su capacidad para desaminar la fenilalanina y trasformarla en ácido fenilpirúvico; también hidrolizan la tirosina, desdoblan en casi todos los casos la urea y son resistentes a la colistina 2,4. En la tabla 1 se detallan las diferentes especies de este género y las pruebas bioquímicas que las caracterizan. En este género se incluyen tres "genomoespecies" (4, 5 y 6), que se han diferenciado por técnicas de biología molecular y que aún carecen de nombre científico 5. La separación de P. penneri de P. vulgaris se propuso en el año 1982, al establecerse diferencias en las respectivas secuencias de ADN mediante estudios de homología por técnicas de hibridación, así como por determinadas diferencias bioquímicas 1. Existen antisueros frente a antígenos somáticos O (lipopolisacárido), que permiten la clasificación epidemiológica de los aislados clínicos de P. penneri. Otros sistemas de tipificación incluyen la caracterización de las proteínas de membrana, la ribotipia y técnicas de reacción en cadena de la polimerasa (PCR) (rep-PCR y RAPD-PCR), cuyos resultados han demostrado que P. penneri posee una estructura poblacional con una elevada diversidad 6.
Microbiología e importancia epidemiológica de Proteus penneri
El reconocimiento inicial en las placas de cultivo de varias de las especies adscritas al género Proteus es relativamente sencillo, debido a su crecimiento en ondas en la superficie de los cultivos en agar no selectivo-diferencial. Este efecto, conocido como swarming, se debe a cambios en los procesos de elongación durante la división celular, que llevan a la formación de células alargadas no septadas y a la hiperexpresión de la síntesis de flagelina, que determina un recubrimiento profuso por flagelos de las células de estos microorganismos 2,7. Estos mecanismos biológicos mediados por el efecto de quorum sensing 8 permiten una mejor adaptación de los integrantes del género Proteus a los diferentes microambientes en los que se desarrollan. Esta propiedad se atenúa e incluso se pierde en medios deficientes en electrolitos, como el medio de CLED, así como en medios que contienen concentraciones subinhibitorias de diferentes alcoholes, como el medio PEA (phenyl-ethyl alcohol agar, habitualmente utilizado para el aislamiento de microorganismos anaerobios) o en medios que tienen una mayor cantidad de agar de lo habitual. La propiedad de producir swarming es común a la mayoría de las especies del género Proteus, aunque en algunas cepas de P. penneri esta capacidad está disminuida y es necesario reducir la concentración de agar del medio para que se manifieste. Muchos medios cromogénicos actuales utilizados para el cultivo de muestras de orina están diseñados para evitar este tipo de crecimiento 2,9.
A diferencia de P. vulgaris, P. penneri no produce indol a partir del triptófano (tabla 1). Asimismo, se caracteriza por su resultado negativo en las pruebas de fermentación de la salicina y de la hidrólisis de la esculina, así como por su resistencia al clorafenicol (halos de inhibición menores de 14 mm) 2,4. Al igual que las otras especies del género Proteus, P. penneri tiene un olor característico derivado de sus productos metabólicos 4.
En algunos sistemas automáticos de identificación que no utilizan inicialmente la prueba del indol o de la descarboxilación de la ornitina para diferenciar las distintas enterobacterias, puede producirse una falsa identificación de P. penneri como P. mirabilis 10. En estos casos se recomienda la realización de la prueba de indol para evitar este problema. No obstante, estas 2 especies difieren en el fenotipo de sensibilidad a los antibióticos β -lactámicos. Proteus penneri es naturalmente resistente a la amoxicilina y la cefuroxima, mientras que P. mirabilis puede ser sensible o resistente a la amoxicilina, pero habitualmente es sensible a la cefuroxima (con la excepción de las cepas que producen β -lactamasas de espectro extendido [BLEE]) 11.
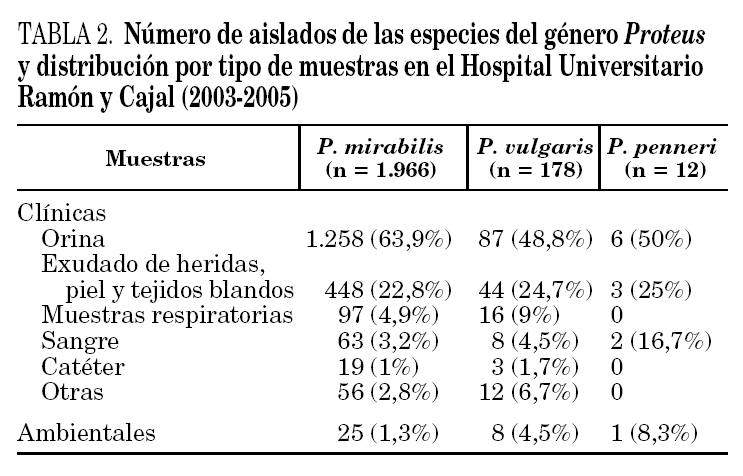
El género Proteus está ampliamente difundido en la naturaleza y forma parte de la microbiota intestinal. Se ha aislado en muestras ambientales, incluyendo tierras, abonos y aguas contaminadas, y en una gran variedad de muestras de animales. P. myxofaciens sólo se ha aislado en insectos. Entre todas las especies que pertenecen a este género, la más común es, sin duda, P. mirabilis, seguida de P. vulgaris 2-4. En la tabla 2 se indica el número de aislados obtenidos de las diferentes especies de este género en el Hospital Universitario Ramón y Cajal, durante los años 2003 a 2005, así como las muestras clínicas a partir de las cuales se han recuperado.
Proteus penneri se ha aislado mayoritariamente en muestras del tracto urinario y se ha asociado con infecciones urinarias no complicadas, pielonefritis aguda y cuadros de urolitiasis. Aunque Proteus, Providencia y Morganella se aíslan con mayor frecuencia en muestras de heces de pacientes con gastroenteritis que en individuos sin esta afección, su papel patogénico en estos casos es incierto. De entre todos los microorganismos relacionados, sólo se ha sugerido la implicación cierta de Providencia alcalifaciens en cuadros de diarrea. En ensayos de cultivos celulares, se ha demostrado que este microorganismo tiene capacidad de invadir las células eucariotas, así como de producir cuadros de diarrea en animales de experimentación 12. Con P. penneri no se han realizado estos estudios.
P. penneri también se ha relacionado con infecciones nosocomiales, sobre todo en pacientes ingresados en unidades de cuidados intensivos o con factores de riesgo como diabetes o inmunosupresión. En estos casos se ha aislado de orina, muestras respiratorias, incluyendo secreciones de aspiraciones bronquiales y lavado broncoalveolar, muestras del sistema nervioso central, piel y tejidos blandos, heridas quirúrgicas y pacientes quemados 4. En muchas ocasiones forma parte de cultivos mixtos, sobre todo en abscesos abdominales. También se ha aislado de muestras de sangre obtenidas por punción venosa y a través de catéteres 2,4.
Patogenicidad
La última edición del Manual de Microbiología Clínica de la Sociedad Americana de Microbiología 2 adjudica a P. penneri una significación patogénica en humanos de valor 1. La categoría 2 indica patogenicidad probada en contadas ocasiones y la 3 indica una significación incierta. En la categoría 1 también se incluyen otras especies del género Proteus, como P. mirabilis y P. vulgaris mientras que en la categoría 3 se incluye a Providencia heimbachae y Providencia rustigianii, generalmente aisladas de heces humanas y de animales. La patogenicidad de P. penneri es similar a la de P. mirabilis y P. vulgaris y se asocia a la presencia de fimbrias, flagelos, proteínas específicas de membrana externa, lipopolisacárido (LPS), enzimas proteolíticas, como gelatinasa y proteasas, hemolisinas y ureasa 7,12-14. En la tabla 3 se indican algunos factores de patogenicidad asociados a P. penneri y su contribución a la virulencia. La producción de fimbrias permite a P. penneri persistir en el tracto urinario sin ser eliminado eficazmente por los sistemas de depuración. Sus fimbrias son algo diferentes de las que se encuentran en P. mirabilis. En el primero se asocian con su capacidad de adherencia a las células de los glomérulos y a las membranas tubulares del riñón, así como a materiales plásticos propios de los catéteres. Esta última propiedad también la presenta P. stuartii. Las fimbrias de P. mirabilis se asocian con su adherencia al epitelio que recubre el tracto urinario superior y con la colonización de la vejiga 7,12.
La producción de ureasa por parte de las especies del género Proteus se considera de gran importancia para su patogenicidad y se relaciona con procesos de urolitiasis infectiva o cistitis alcalina incrustante en los que aparecen sedimentos urinarios asociados a la presencia de cálculos de estruvita. La ureasa es capaz de desdoblar eficazmente la urea presente en la orina y de producir la alcalinización de la misma por producción de hidróxido amónico. Como resultado de dicha alcalinización, el Mg 2+ y el Ca 2+, que habitualmente son solubles al pH fisiológico urinario, precipitan, y como consecuencia de este proceso se producen los mencionados cálculos de estruvita (MgNH4PO4.6H2O) 13. La presencia de exopolisacáridos bacterianos en la orina y la capacidad de los microorganismos de crecer en biopelículas (biofilms) facilita los procesos de nucleación de los cálculos. Aunque este efecto se ha asociado mayoritariamente a P. mirabilis, también se ha observado con P. vulgaris y P. penneri. La ureasa de P. penneri es similar desde el punto de vista funcional a la del resto de las especies que integran el género Proteus pero puede diferenciarse bioquímicamente de éstas así como de las de Morganella y Providencia. En modelos in vitro se ha confirmado que su expresión puede inducirse por la presencia de urea, a diferencia de la de P. mirabilis cuya síntesis es constitutiva. La actividad ureásica en P. penneri es inhibida por el ácido acetohidroxámico 13. Se ha destacado la capacidad de P. penneri de producir proteasas de IgA que actúan como coadyuvantes de su patogenicidad en el tracto urinario.
La alcalización de la orina por parte de la ureasa favorece la acción de estas proteasas. Proteus penneri produce al menos dos hemolisinas de codificación cromosómica que se relacionan parcialmente con las de Escherichia coli y P. mirabilis y facilitan la adherencia a los tejidos del tracto urinario. En ensayos in vitro se ha demostrado que la capacidad de invasión celular que demuestra P. penneri depende, en parte, de la producción de estas hemolisinas y de su efecto citotóxico asociado 14,15. Proteus penneri también produce sideróforos, proteínas o péptidos capaces de unir iones Fe+++, esenciales para el metabolismo de las bacterias 7.
Sensibilidad a los antimicrobianos y mecanismos de resistencia
Proteus penneri, al igual que P. vulgaris, es intrínsecamente resistente a la amoxicilina y a las cefalosporinas de espectro reducido, y su resistencia a la cefuroxima es característica. Este perfil se debe esencialmente a la producción de una β -lactamasa denominada HugA, similar a la β -lactamasa CumA de P. vulgaris. Por la resistencia que confieren a la cefuroxima, es frecuente referirse a ellas como cefuroximasas. HugA y CumA son penicilinasas cromosómicas de clase A (con serina en el centro activo), son inhibidas por el ácido clavulánico y están incluidas en el grupo 2e de la clasificación de β -lactamasas de Bush et al 16. Desde el punto de vista fenotípico e hidrolítico, este grupo se encuentra cercano al de la β -lactamasa de Klebsiella oxytoca (β -lactamasa K1) del grupo 2be, en el que también se incluyen las BLEE. Las β -lactamasas HugA, CumA, K1 y la de Citrobacter koseri (CKO) tienen un perfil hidrolítico amplio que incluye a las penicilinas, la cefuroxima, la ceftriaxona y la cefotaxima, pero no a la ceftazidima, las cefamicinas (cefotixitina) y los carbapénemes.
La β -lactamasa HugA (punto isoeléctrico, pI, de 8,3) de P. penneri tiene una homología elevada (86%) con la β -lactamasa CumA de P. vulgaris (pI 6,7). El gen hugA está sometido a una regulación postranscripcional en la que participa el gen hugR, de manera similar a la forma en que actúa ampD con ampC (este último responsable de la síntesis de la β -lactamasa cromosómica AmpC) en Enterobacter cloacae, o cumR con cumA en P. vulgaris 16-18. Este hecho diferencia, desde el punto de vista fenotípico, a P. penneri y P. vulgaris de P. mirabilis 19,20.
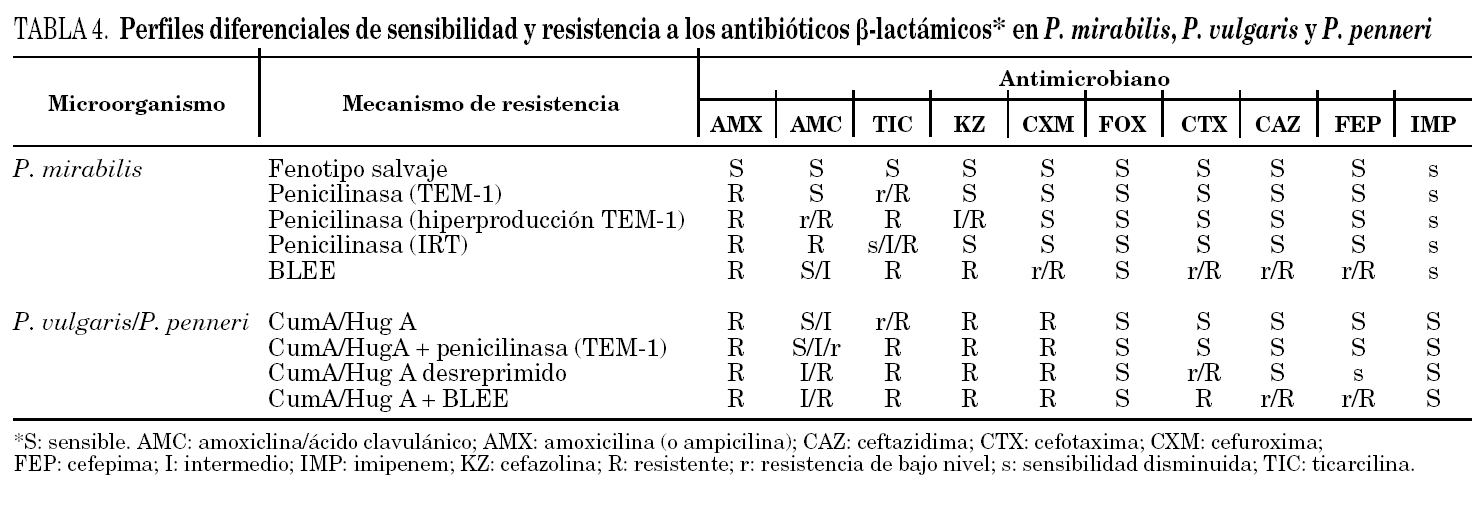
P. mirabilis no sintetiza de manera natural β -lactamasas cromosómicas (AmpC o similares) y su fenotipo salvaje habitual se corresponde con la sensibilidad a todos los antibióticos β -lactámicos. De manera característica, y debido a una baja permeabilidad asociada a su dotación particular de porinas, esta especie pierde sensibilidad a los carbapenemes, esencialmente al imipenem (tabla 4). Asimismo, la resistencia a la amoxicilina con sensibilidad a la asociación de amoxicilina-ácido clavulánico y a las cefalosporinas se debe a la presencia de penicilinasas plasmídicas, generalmente TEM-1. Por otra parte, en P. mirabilis la resistencia a las cefalosporinas de tercera generación (cefotaxima, ceftriaxona y ceftazidima), al aztreonam y a la cefepima se debe a la presencia de BLEE 11.
En P. penneri el fenotipo salvaje es idéntico al de P. vulgaris (tabla 4) y se caracteriza por la resistencia a la amoxicilina y a las cefalosporinas de primera y segunda generación, por la sensibilidad reducida a las acilureido y carboxipenicilinas (carbenicilina y ticarcilina), así como por la sensibilidad a la asociación de amoxicilina-ácido clavulánico, cefamicinas (cefoxitina), cefalosporinas de amplio espectro (incluyendo la cefepima) y aztreonam. En P. penneri y P. vulgaris es frecuente la adquisición de penicilinasas plasmídicas, esencialmente TEM-1, TEM-2 y SHV-1. En este caso, el fenotipo de sensibilidad es prácticamente indistinguible del fenotipo salvaje, aunque una mayor producción de β -lactamasa puede hacer disminuir la eficacia del ácido clavulánico y, por tanto, elevar los valores de la CMI de su asociación con amoxicilina. También se produce una elevación del nivel de resistencia a las acilureido y carboxipenicilinas.
En P. penneri y P. vulgaris, debido a mutaciones en los genes reguladores, se ha descrito la desrepresión de la síntesis de las β -lactamasas HugA y CumA, respectivamente. Esta desrepresión confiere resistencia a la cefotaxima y a la ceftriaxona, pero no a la ceftazidima, la cefepima y el aztreonam, si bien se produce una ligera pérdida de sensibilidad a estos compuestos. Este perfil es muy similar al que confieren las BLEE de tipo CTX-M (cefotaximasas) 11,21. Esta superposición fenotípica es clara en la prueba de doble difusión con discos para la detección de BLEE que hace indistinguibles a ambos fenotipos. La resistencia de P. penneri a la cefotaxima o a la ceftriaxona revierte con el ácido clavulánico, el sulbactam y el tazobactam 11. La frecuencia de cepas de P. penneri con desrepresión es baja, por lo que ante un aislamiento con sensibilidad disminuida a la cefotaxima se debe excluir la presencia de BLEE. La desrepresión in vitro de las β -lactamasas de P. penneri es fácil de obtener. No obstante, su observación in vivo es ocasional, aunque es de resaltar que se han descrito casos producidos durante el tratamiento con ceftriaxona 22. Por ello, debe desaconsejarse el tratamiento de las infecciones graves por P. penneri con cefotaxima o ceftriaxona, y la ceftazidima es una mejor opción terapéutica, al menos desde un punto de vista teórico. Por el momento, no se ha descrito la presencia de BLEE en P. penneri aunque su hipotético perfil de sensibilidad añadiría la corresistencia a la ceftazidima y a la cefepima, sobre todo en los casos de BLEE de tipo TEM y SHV.
El fenómeno de la inducción también se ha descrito en P. penneri. La ampicilina, la amoxicilina y las cefalosporinas de espectro reducido se comportan como inductores débiles frente a la β -lactamasa HugA y son compuestos inactivos, tanto sobre cepas con expresión inducible como con expresión desreprimida de estas enzimas. Las ureido y carboxipenicilinas, la cefotaxima y la ceftriaxona actúan como inductores fuertes y son activas sobre cepas inducidas pero no sobre los mutantes desreprimidos. Al contrario que en E. cloacae y Citrobacter freundii, los mutantes desreprimidos de P. penneri permanecen sensibles a la ceftazidima, el aztreonam (aunque se produce un ligero aumento de los valores de la CMI) y la cefoxitina 11,22.
P. penneri, como el resto de los integrantes del género Proteus, es resistente a la colistina y a las tetraciclinas. La resistencia a la colistina está relacionada con la estructura del LPS de las especies de Proteus, ya que poseen gran cantidad de grupos 4-amino-L-arabinosa, que reducen su afinidad por los antibióticos polipeptídicos. Con ello, se impide el desplazamiento de los iónes Ca 2+ y Mg 2+ del LPS, la desorganización de las membranas externa e interna de la bacteria y la muerte bacteriana. Otros géneros de enterobacterias con resistencia a la colistina son Providencia, Morganella, Serratia y Cedecea.
El género Proteus tiene resistencia natural a las tetraciclinas. Se han caracterizado diversos mecanismos causantes de la resistencia. Uno de ellos es la bomba TetJ, que participa en mecanismos de expulsión 23,24. El gen asociado es cromosómico y su expresión es inducida por la presencia de tetraciclinas, aunque también se han descrito mecanismos de expulsión de expresión constitutiva. Asimismo, se ha detectado resistencia transferible asociada a plásmidos. El sistema de transporte AcrAB también se asocia a la resistencia intrínseca de algunas especies del género Proteus a las tetraciclinas y a la pérdida de sensibilidad frente a las glicilciclinas (tigeciclina) 24.
P. penneri es resistente al cloranfenicol, aunque pueden existir discrepancias en los resultados de sensibilidad según el método utilizado para su estudio. Con un disco de 30 μg suele producir halos de inhibición menores de 14 mm. En algunos casos se ha demostrado que esta resistencia es plasmídica, al igual que la resistencia a las sulfonamidas 19,20.
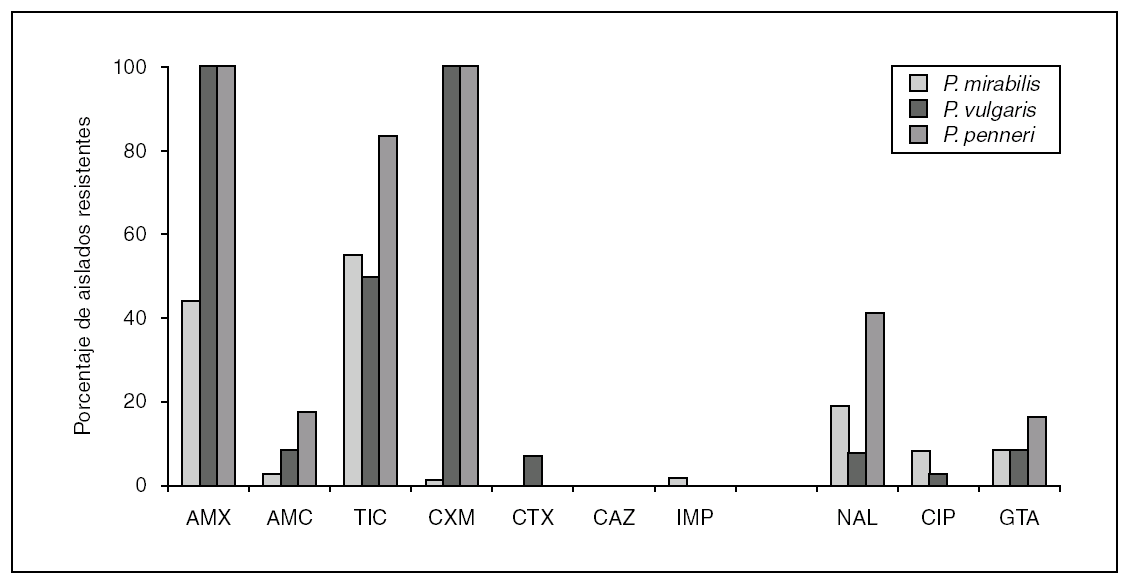
La resistencia a los aminoglucósidos en P. penneri no difiere de la encontrada en P. mirabilis y se debe, mayoritariamente, a la presencia de enzimas modificantes de estos compuestos. De modo similar a lo que ocurre con otros patógenos urinarios, la resistencia a las quinolonas en esta especie está incrementándose, aunque no alcanza cifras tan alarmantes como en E. coli. El mecanismo de resistencia es debido a mutaciones simples o dobles en los genes que codifican las subunidades GyrA y ParC de las topoisomerasas. Al contrario de lo que sucede habitualmente en E. coli, existen trabajos que demuestran un alto número de aislamientos con mutaciones simples y dobles en gyrB y que confieren resistencia a las quinolonas 25. En la figura 1 se indica el porcentaje comparativo de aislamientos de P. mirabilis, P. vulgaris y P. penneri resistentes a diversos antimicrobianos obtenidos en el Hospital Universitario Ramón y Cajal, durante los años 2003 a 2005.
Figura 1. Porcentaje de aislados del género Proteus (P. mirabilis, n = 1.343; P. vulgaris, n = 129; P. penneri, n = 7) resistentes a diferentes antimicrobianos (AMX: amoxicilina; AMC: amoxiclina-ácido clavulánico; TIC: ticarcilina; CXM: cefuroxima; CTX: cefotaxima; CAZ: ceftazidima; IMP: imipenem; NAL: ácido nalidíxico; CIP: ciprofloxacino; GTA: gentamicina), obtenidos en el Servicio de Microbiología del Hospital Universitario Ramón y Cajal, durante los años 2003 y 2005.
Por último, los organismos integrantes del género Proteus deben considerarse resistentes a la nitrofurantoína, con independencia del valor de la CMI obtenido en las pruebas de sensibilidad. La producción de ureasa por estos microorganismos provoca la alcalinización de la orina y a pH alcalino la nitrofurantoína pierde actividad antibacteriana.
Correspondencia: Dr. R. Cantón.
Servicio de Microbiología. Hospital Universitario Ramón y Cajal.
Ctra. Colmenar Viejo, Km 9.100. 28034 Madrid. España.
Correo electrónico: rcanton.hrc@salud.madrid.org