Taxonomía e identificación
Neisseria meningitidis, el agente causal de la enfermedad meningocócica, conocido como meningococo, es una de las especies que constituyen el género Neisseria, que se engloba, junto con los géneros Kingella, Eikenella, Simmonsiella y Alysiella, en la familia Neisseriaceae 1. El meningococo es una bacteria gramnegativa de pequeño tamaño (0,6-1,5 μm de diámetro), con una morfología característica, y se presenta en forma de diplococos con las caras laterales adyacentes aplanadas. En el género Neisseria sólo aparecen 2 especies patógenas (N. meningitidis y N. gonorrhoeae) y todas ellas tienen como característica común ser oxidasa y catalasa positivas. Las especies se diferencian por pruebas bioquímicas (tabla 1). Su temperatura óptima de cultivo es de 35-37 °C, aunque crece mejor en condiciones de humedad relativa del 50% y concentraciones de CO2 cercanas al 10%.
El hombre es el único reservorio conocido de esta especie, que se aísla de la nasofaringe de individuos sanos en porcentajes que oscilan entre el 4 y el 20%, variación asociada a factores como la edad, las condiciones de endemia o epidemia, etc. 2. En los casos de enfermedad invasiva, se aísla de líquido cefalorraquídeo (LCR), sangre, petequias, líquido sinovial, etc. En el caso del aislamiento en la nasofaringe, al no ser una muestra estéril, se hace necesario eliminar otra flora acompañante, incluyendo Neisseria saprofitas y otras especies comensales. En este caso, el medio selectivo generalmente utilizado es el descrito por Thayer y Martin, en 1966, consistente en agar chocolate suplementado con vancomicina, nistatina y colistina. El crecimiento en este medio constituye la base de la diferenciación inicial entre las 2 especies patógenas ya mencionadas y el resto de las especies, que son saprofitas 3. Como regla general, las especies patógenas crecen en el medio selectivo mientras que las saprofitas no, aunque hay que señalar que Neisseria lactamica y Neisseria polysaccharea sí crecen, al igual que puede hacerlo un limitado porcentaje del resto de las especies comensales. La identificación de N. meningitidis y su diferenciación de otras Neisseria se realiza fundamentalmente por diferencias en la degradación de azúcares (glucosa, maltosa, sacarosa, fructosa y lactosa) y los perfiles enzimáticos. El meningococo degrada la glucosa y la maltosa, pero no la sacarosa, la fructosa y la lactosa. No obstante, se han descrito cepas maltosa-negativas que pueden identificarse erróneamente como N. gonorrhoeae 3. En este sentido, hay 2 enzimas cuya detección es de especial relevancia en el género Neisseria. Así, la presencia de γ -glutamilaminopeptidasa es casi exclusiva de N. meningitidis mientras que la β -galactosidasa la produce únicamente N. lactamica.
El meningococo presenta una serie de antígenos característicos de especie, y algunos de ellos se han utilizado para su tipificación. Los más relevantes son el polisacárido capsular, que define el serogrupo de las cepas, las proteínas de clase 2/3 por las que se clasifican en diferentes serotipos y las proteínas de clase 1 que definirán los serosubtipos. Adicionalmente, se ha utilizado el lipopolisacárido para clasificar las cepas en inmunotipos o lipopolisacaridotipos, aunque sólo unos pocos laboratorios recurren a este antígeno como marcador. Algunos de estos antígenos son la base del desarrollo de vacunas, como se comentará posteriormente.
Serogrupo: situación en España
Las cepas de meningococo están rodeadas, en su parte externa, de una cápsula de naturaleza polisacárida que cumple un papel fundamental en el proceso de invasión de la bacteria. Por tanto, puede decirse que la cápsula es un factor de virulencia para la especie, de tal manera que es extremadamente raro aislar, en casos de enfermedad invasiva, cepas de meningococo no capsuladas, muy frecuentes, sin embargo, en la nasofaringe de portadores asintomáticos. El polisacárido capsular se ha utilizado, desde hace ya muchos años, como la principal herramienta para la clasificación serológica de las cepas de meningococo. Basándose en dicho polisacárido, se han definido 13 serogrupos, denominados A, B, C, D, X, Y, Z, 29E, W135, H, I, K y L.
Clásicamente, sólo los serogrupos A, B y C eran responsables de la casi totalidad de los casos de enfermedad invasiva. Sin embargo, en los últimos años, se ha asistido a un aumento creciente de los serogrupos Y y W135, que ha afectado a zonas geográficas concretas 4,5. Así, en ciudades de Estados Unidos, como Chicago, un tercio de los casos de enfermedad meningocócica están producidos por cepas de serogrupo Y. Igualmente, un cambio similar se ha descrito en países como Canadá y Colombia. La importancia creciente del serogrupo W135 viene constatada por la aparición de un brote en Arabia Saudí, en el año 2000, coincidiendo con la peregrinación a La Meca, circunstancia que se ha asociado con la aparición de brotes por las condiciones de elevada aglomeración y hacinamiento. Posteriormente, este tipo de aislamientos fue causante de pequeños brotes poco comunes en algunos países europeos y, especialmente, produjo una epidemia de gran intensidad en Burkina Fasso, con más de 12.000 casos en 2002. Así, la vigilancia de los cambios de incidencia de estos y otros serotipos nos dará respuesta al interrogante que surge sobre si otros serogrupos no habituales serán más o menos frecuentes en el futuro.
El serogrupo parece condicionar parte del comportamiento epidemiológico temporal de las cepas. Así, las del grupo B son generalmente la causa de ondas epidémicas con períodos interepidémicos de duración variable, las de grupo C estarían más implicadas en la producción de brotes y ondas de corta duración y las cepas de serogrupo A son fundamentalmente causantes de las grandes epidemias, que cíclicamente aparecen en países subsaharianos, en un área que se conoce como "cinturón africano de la meningitis".
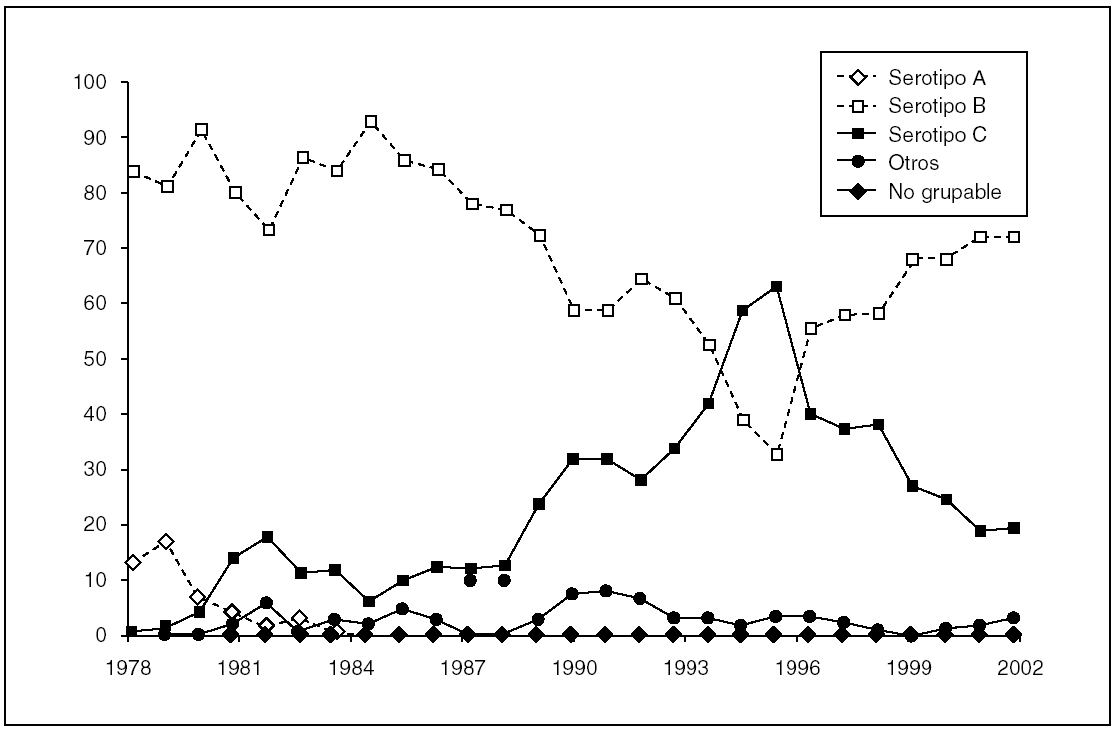
En España, el serogrupo B generalmente ha sido mayoritario, al menos desde finales de los años setenta (fig. 1), y ha representado, durante la década de los ochenta, entre un 80 y un 90% de los casos analizados en el Laboratorio Nacional de Referencia. Sin embargo, a finales de esa misma década se pudo observar un incremento gradual en el porcentaje de casos de enfermedad meningocócica producidos por cepas de serogrupo C. Este incremento fue más acusado a partir de 1994, de forma que, durante 1996 y 1997, este serogrupo pasó a ser el mayoritario 6. Ese aumento fue asociado con un incremento en la tasa de incidencia general de enfermedad meningocócica, que fue desigual en las diferentes comunidades autónomas. Esta situación condicionó que, en 14 de las 17 comunidades, desde diciembre de 1996 hasta finales de 1997, se decidiera realizar una campaña de vacunación entre los 2 y 19 años de edad, utilizando la vacuna entonces disponible A + C de polisacárido purificado 7. Dicha vacuna demostró una alta eficacia a corto plazo, aunque tras un año especialmente los grupos de edades inferiores mostraron una rápida pérdida de anticuerpos protectores y, por tanto, una rápida disminución de la eficacia, de tal forma que en años sucesivos se detectó un paulatino incremento en los valores de las tasas de ataque de la enfermedad. Esta observación resultó determinante para que, en otoño de 2000, poco después de obtener la licencia en España, se recomendara la inclusión en el calendario de una nueva vacuna frente a meningococo de serogrupo C 7,8. Esta vacuna se desarrolló según la misma estrategia de conjugación del polisacárido que se había seguido unos años antes con la de Haemophilus influenzae tipo b. Al ser una vacuna conjugada, el tipo de respuesta es radicalmente diferente (es inmunógena desde los 2 meses de edad y la respuesta que se obtiene es de larga duración) y, como pasa en el caso de H. influenzae, tiene la capacidad de reducir las tasas de portadores, por lo que este tipo de vacuna previene la aparición de nuevos casos de enfermedad y, adicionalmente, impide la transmisión del microorganismo. Este efecto, por el que aquellos colectivos que, bien por edad o bien por otras causas, no han recibido la vacuna se ven protegidos de forma indirecta, probablemente constituye hoy día la mejor estrategia para el control de la enfermedad. Tras 5 años de aplicación en España de las nuevas vacunas conjugadas, el descenso en el número de casos provocados por el serogrupo C ha sido dramático, situándose dicho descenso en torno al 90% en 2004. La caída en el número de casos de este serogrupo no ha venido acompañada de un aumento en las tasas del serogrupo B. Los serogrupos Y y W135 presentan un mayor número de casos en los últimos años, pero este aumento es aún poco significativo, por lo que podemos decir que no se ha observado, de momento, un fenómeno de reemplazamiento del serogrupo C por otros.
Figura 1. Epidemiología de la enfermedad meningocócica en España (1978-2002).
Serotipo y serosubtipo
La membrana externa del meningococo está compuesta por proteínas, lipopolisacáridos y fosfolípidos. Las principales proteínas de membrana externa de N. meningitidis han sido definidas como proteínas de las Clases 1 a 5, en función de su peso molecular. Todas estas proteínas de membrana externa se localizan en la superficie celular, y la variabilidad antigénica asociada a las proteínas de clase 2/3 (PorB) es la base del serotipado de las cepas de meningococo, mientras que la variabilidad de las proteínas de clase 1 (PorA) y, en menor medida, las de clase 5 (Opa), se asocia al serosubtipado de éstas 9.
Las proteínas de clase 2, o PorB2, y clase 3, o PorB3, están codificadas por 2 alelos mutuamente excluyentes del gen porB, de forma que cada cepa expresa en su membrana externa sólo una de las 2 clases. Estas proteínas, con una función de porinas, se expresan de forma constitutiva, son las proteínas predominantes de la membrana externa y son la base del tipado de las cepas de meningococo. En el modelo propuesto para las proteínas de clase 2/3 se predice la existencia de ocho bucles hidrofílicos expuestos en superficie, y se observan 4 regiones variables (VR1, VR2, VR3 y VR4) localizadas en los bucles I, V, VI y VII. La asociación de un número restringido de serotipos con infecciones graves y el hecho de que en situaciones endémicas las cepas virulentas muestren una heterogénea distribución de serotipos, mientras que en situaciones epidémicas aparezca un serotipo como predominante, hacen de dicha variabilidad un marcador epidemiológico de gran utilidad 9.
Las proteínas de clase 1, o PorA, actúan también como porinas y las expresa la mayoría de las cepas clínicas, aunque con variaciones en los valores de expresión. El gen que controla su expresión, el gen porA, muestra una estructura que es el resultado de progresivos sucesos de recombinación mediante transformación. La secuenciación de estas proteínas ha permitido conocer la existencia de tres regiones variables definidas como VR1, VR2 y VR3; las 2 primeras son las que presentan un mayor grado de polimorfismo y las que constituyen la base para el serosubtipado de las cepas de meningococo 9.
En la actualidad, el tipado y serosubtipado se realizan bien mediante un enzimoinmunoensayo, bien mediante Dot blot, con un panel de anticuerpos monoclonales que, por regla general, determina 7 serotipos (1, 2a, 2b, 4, 14, 15, 21) y 14 serosubtipos (P1.1, P1.2, P1.3, P1.4, P1.5, P1.6, P1.7, P1.9, P1.10, P1.12, P1.13, P1.14, P1.15, P1.16), aunque un porcentaje de las cepas, que puede oscilar entre un 30 y un 60%, puede resultar no tipable (NT) o no serosubtipable (NST), o ambas cosas a la vez. Con la nomenclatura actual, las cepas quedan definidas por su serogrupo:serotipo:serosubtipo, como por ejemplo, B:2b:P1.5,10 o C:NT:P1.13.
En España, por razones aún no bien comprendidas, se asiste a continuos cambios en los fenotipos/genotipos circulantes. Así, a principios de los años noventa, las cepas de grupo C eran mayoritariamente caracterizadas como C:2b:NST, del complejo clonal ET37, mientras que sólo unos años después, a partir de 1994, las cepas C eran mayoritariamente caracterizadas como C:2b:P1.5,2, de la línea clonal A4 6. Esta situación volvió a cambiar en el año 2000, de forma que la mayor parte de las cepas de serogrupo C aisladas en procesos invasivos resultaron ser C:2a:P1.5, nuevamente del complejo ET37. La elevada mortalidad observada en los últimos años en casos de enfermedad invasiva meningocócica por serogrupo C podría estar relacionada con la introducción reciente de esta cepa C:2a:P1.5 que, como se ha mencionado, pertenece a la línea clonal conocida como ET37, definida junto con otras como "línea hipervirulenta". La situación es claramente diferente entre las cepas de serogrupo B. En este serogrupo, durante los últimos 15 años, entre un 30 y un 40% de los aislados son caracterizados como B:4:P1.15, del complejo clonal conocido como ET5 10. Esta situación en cuanto al fenotipo/genotipo predominante se ha mantenido con ligeras oscilaciones. Sin embargo, otro tipo de cepas ha subido y bajado en frecuencia sin motivo aparente. Así, las cepas B:15:P1.7,16, también del complejo ET5 fueron relativamente frecuentes (7-10%), en la primera mitad de la década de los noventa. Sin embargo, durante los últimos años de esa década y los primeros años del presente siglo, las cepas B:1:P1.6, de la línea clonal 3 están sustituyendo a las anteriores.
Vacuna. Actualidad y perspectivas de futuro
Como ya se ha mencionado anteriormente, en la actualidad se encuentran disponibles vacunas conjugadas frente al serogrupo C 11. Este tipo de vacunas está introducido en el calendario infantil de vacunación desde otoño del año 2000, y han venido administrándose en un esquema de 2, 4 y 6 meses de edad, en el caso de 2 de las vacunas disponibles comercialmente, o de 2 y 4 meses en otra, cuya ficha técnica autorizaba la aplicación de sólo 2 dosis. Esta situación ha cambiado recientemente con la modificación de la ficha técnica de las 3 vacunas disponibles; se ha unificado para todas la utilización de 2 dosis en el primer año de vida y se recomienda la utilización de una tercera dosis en el segundo año de vida, esquema que será aplicado en todo el Estado español. Este cambio ha venido motivado por el hallazgo de que los niños que reciben sus dosis de vacuna durante los primeros 6 meses de vida pierden gran parte de la eficacia protectora tan sólo un año después de recibir la última dosis 12,13. En España, además, han recibido este tipo de vacuna todos los individuos menores de 20 años en diferentes campañas realizadas por las comunidades autónomas, si bien con coberturas muy desiguales.
Además de este tipo de vacunas, también están disponibles vacunas A + C de polisacárido purificado, sólo útil por encima de los dos años de vida, y con una rápida pérdida de eficacia protectora ligada con la edad, así como la vacuna A + C + Y + W135, de las mismas características que la anterior. Recientemente, en Estados Unidos se ha autorizado una nueva vacuna tetravalente conjugada A + C + Y + W135 que, probablemente, se autorizará en Europa en un futuro inmediato. Con la epidemiología actual de la enfermedad meningocócica en España, esta vacuna sería de utilidad sólo para su aplicación en viajeros a zonas de hiperendemia o epidemia por alguno de los serogrupos incluidos.
No obstante, aun está abierta la posibilidad de realizar cambios en los esquemas de vacunación futuros, y se contempla la posibilidad de añadir una dosis de recuerdo en torno a los 11 o 12 años de edad, con objeto de reforzar el estado inmunitario de los adolescentes e impedir, por tanto, la circulación del meningococo de serogrupo C. En este caso, bien podría utilizarse una dosis de vacuna tetravalente conjugada que aumente el rango de protección frente a otros serogrupos.
La vacuna frente al serogrupo B aún está lejos de ser una realidad. Esto se debe, por un lado, a la escasa inmunogenicidad del polisacárido B y, por otro, a su identidad con envueltas de células neuronales humanas, lo que podría conducir a fenómenos de autoinmunidad 11,14. Si bien hay diversas líneas de desarrollo, actualmente la más adelantada es la que se basa en la utilización de proteína de clase 1, de forma que se recurriría a una vacuna con formulación antigénica, cubriendo los 6 tipos más frecuentes. No obstante, este tipo de estrategia presenta algunas dificultades en cuanto a diferente respuesta frente a cada antígeno, así como con la distribución muy desigual de los tipos en diversas regiones y continentes. Una estrategia interesante es la realizada recientemente en Nueva Zelanda, en donde se ha utilizado una vacuna que podríamos definir como "a la carta", desarrollando una vacuna con proteína de clase 1, específica para la cepa epidémica que estaba produciendo altas tasas de ataque en los últimos años. Sin embargo, esta estrategia sólo sería de aplicación en situaciones de epidemia por un tipo de cepa, mientras que en situaciones de endemia con una alta heterogenicidad de las cepas productoras de casos, su utilidad sería escasa. Otras aproximaciones interesantes incluyen modificaciones en el polisacárido B y utilización de otros antígenos diferentes, tales como proteínas fijadoras de hierro y otros 15.
Regulación genética de la expresión capsular
Es muy interesante el fenómeno descrito en el meningococo según el cual habría cepas con analogía genética que expresarían diferentes polisacáridos capsulares. Esto sugiere que los aislados podrían intercambiar el serogrupo expresado mediante mecanismos de switch on-switch off de genes, lo que ya se ha descrito para otras especies también capsuladas como Streptococcus pneumoniae y H. influenzae. Este tipo de fenómenos tiene su origen en la capacidad de estas especies de adquirir e incorporar ADN exógeno mediante procesos de recombinación, y se consideran estrategias que desarrollan los microorganismos, como parte de un proceso evolutivo netamente "darwinista", para evadir la respuesta inmunitaria del hospedador, tanto natural como inducida. La colonización de la nasofaringe durante el estado de portador favorece este tipo de procesos de intercambio genético 16.
En España, tras la utilización de vacuna A + C, primero, y posteriormente la vacuna C conjugada, la presión inmunitaria producida podría dar como resultado una selección positiva de este tipo de cepas de grupo C que pasan a expresar cápsula de grupo B 17. En nuestro caso, y ya que las cepas mayoritarias son C:2a:P1.5, las resultantes de procesos de intercambio genético a nivel del operón capsular serían caracterizadas como B:2a:P1.5. La vigilancia instaurada por el Laboratorio de Referencia de Meningococos para el análisis de este tipo de aislados mostró su presencia ya en 2001, un año después de aplicar las nuevas vacunas conjugadas. Este tipo de cepas ha producido algunos brotes o agrupaciones de casos en España, y la progresión en el número de casos y su distribución geográfica indican, al menos de momento, una limitada capacidad epidémica, ya que no parecemos asistir a un crecimiento exponencial. Es probable que el coste biológico de este tipo de modificaciones sea demasiado alto para producir nuevas variantes con altas probabilidades de supervivencia y expansión. No obstante, debe mantenerse una estrecha vigilancia de estos fenómenos para poder analizar adecuadamente el alcance de las intervenciones en Salud Pública y poder tomar decisiones en cuanto a futuras intervenciones basadas en datos científicos.
Correspondencia: Dr. J.A. Vázquez.
Laboratorio de Referencia de Neisserias.
Centro Nacional de Microbiología. Instituto de Salud Carlos III.
Ctra. Majadahonda-Pozuelo, Km 2. 28220 Majadahonda. Madrid. España.
Correo electrónico: jvazquez@isciii.es