Las actuales medidas de prevención frente a la enfermedad neonatal causada por Streptococcus agalactiae, estreptococo del grupoB (EGB), son la realización de un cribado prenatal y la administración de profilaxis antibiótica intraparto con antimicrobianos adecuados. Una alternativa a esta estrategia sería la administración de una vacuna polisacarídica, por lo que es necesario conocer la distribución de serotipos capsulares de las cepas circulantes.
MétodosSe estudiaron 188 cepas procedentes de gestantes del área sanitaria norte de Granada portadoras vaginorrectales de EGB y 24 de recién nacidos con enfermedad neonatal enviadas al laboratorio desde distintos hospitales andaluces. Se realizó antibiograma frente a penicilina, eritromicina y clindamicina siguiendo las normas del Clinical and Laboratory Standards Institute (CLSI), y se determinó su serotipo capsular mediante 2 métodos: aglutinación con partículas de látex y métodos moleculares.
ResultadosDe las 188 cepas de S.agalactiae pertenecientes a mujeres embarazadas, se obtuvo una concordancia en los resultados del 80,8% entre ambas técnicas. Se detectó resistencia a eritromicina y clindamicina en el 16,5 y el 10,1% de cepas, respectivamente. En las cepas neonatales, en el 95,8% de los aislados los resultados obtenidos por ambas técnicas fueron coincidentes. Las tasas de resistencia frente a eritromicina y clindamicina fueron del 8,3 y del 4,1%, respectivamente. En ambos grupos de aislados el serotipo más frecuente fue el iii y el más relacionado con resistencia frente a antimicrobianos, el v.
ConclusiónSe deberían realizar más estudios epidemiológicos que permitan continuar con una vigilancia de los serotipos causantes de enfermedad invasiva así como sus patrones de sensibilidad antibiótica utilizando métodos sensibles y específicos.
Current preventive measures against neonatal disease caused by Streptococcus agalactiae (GBS) are prenatal screening and intrapartum antibiotic prophylaxis with appropriate antimicrobials. An alternative to this strategy would be the administration of a polysaccharide vaccine as the distribution of capsular serotypes of circulating strains needs to be known.
MethodsA study was made of 188 strains from pregnant women carrying GBS and 24 newborns with neonatal disease. Susceptibility testing was performed with penicillin, erythromycin and clindamycin following CLSI standards, and capsular serotype was determined by two methods: latex agglutination and PCR.
ResultsOf the 188 strains of S.agalactiae from the pregnant women, there was 80.8% agreement in the results between the two techniques. Resistant to erythromycin and clindamycin was found in 16.5% and 10.1%, respectively. For neonatal strains, 95.8% of the results obtained by the two techniques were identical. The rates of resistance to erythromycin and clindamycin were 8.3% and 4.1%, respectively. In both groups, most frequently isolated serotype was iii, and the most related to antimicrobial resistance serotype was v.
ConclusionEpidemiological studies are necessary to continue surveillance of serotypes causing invasive disease and its antibiotic sensitivity patterns using sensitive and specific methods.
La infección invasiva por Streptococcus agalactiae o estreptococo de grupoB (EGB) representa, en ausencia de medidas de prevención, la causa más frecuente de enfermedad bacteriana de transmisión vertical en el recién nacido1. Clínicamente puede manifestarse como sepsis, neumonía o meningitis, con una mortalidad estimada para la infección de inicio precoz del 4-6%2. Esto ha dado lugar a la recomendación de realizar un cribado antenatal para detectar la presencia de colonización por EGB en las gestantes entre las semanas 35-37 y, en el caso de estar colonizadas, utilizar la profilaxis antibiótica intraparto (PAI) para evitar la transmisión madre-hijo3,4, lo que ha revertido en una disminución drástica de los casos de infección neonatal precoz por EGB1,2,5,6. Los antibióticos recomendados para tal fin actualmente son penicilina/ampicilina, y en caso de pacientes alérgicas, clindamicina, cefazolina y vancomicina3,4. EGB sigue siendo universalmente sensible a la penicilina, aunque se han comunicado casos de cepas con sensibilidad disminuida7. En cuanto a la eritromicina y la clindamicina, se ha puesto de manifiesto en los últimos años un incremento en el porcentaje de resistencias, alcanzando actualmente el 10-20%2,8-11, lo que ha propiciado que en la última guía de los CDC y en el documento de consenso español se haya dejado de recomendar la eritromicina como antimicrobiano útil en PAI en gestantes alérgicas a la penicilina o la clindamicina en el caso de que no se conozca la sensibilidad frente a este antimicrobiano.
Una alternativa al uso de la PAI sería el desarrollo y posterior uso, en condiciones idóneas, de una vacuna que, administrada a la madre, induzca la producción de anticuerpos protectores (IgG) que sean transmitidos pasivamente al recién nacido12. El polisacárido capsular es uno de los principales factores de virulencia del microorganismo, el cual facilita la posibilidad de evadir los mecanismos de defensa innatos del hospedador y producir enfermedad invasiva13.
EGB se clasifica en 10 serotipos (ia, ib, ii al ix) de acuerdo con la estructura de su polisacárido capsular14. Cualquier vacuna diseñada para EGB debe tener en cuenta la diversidad geográfica en la distribución de estos serotipos. Se han utilizado diferentes técnicas para el serotipado de EGB, desde la reacciones basadas en aglutinación con partículas de látex, técnicas de coaglutinación, inmunoprecipitación, contrainmunoelectroforesis y precipitación capilar con una fiabilidad moderada y para las que se han encontrado porcentajes elevados de cepas no tipables o con errores de serotipos entre los aislados, hasta llegar a los métodos moleculares, bastante más reproducibles, específicos y fáciles de realizar dirigidos principalmente frente al operón cps de EGB15-17.
Presentamos los datos de distribución de serotipos y patrones de sensibilidad antibiótica de cepas de EGB procedentes de madres colonizadas de nuestra área sanitaria (Granada) y de los casos de enfermedad invasiva neonatal enviados desde diferentes hospitales de la comunidad autónoma de Andalucía a nuestro laboratorio durante el periodo de estudio.
Material y métodosDesde 2009 hasta finales del 2011 se identificaron en nuestro laboratorio 188 cepas de EGB procedentes de muestras vaginorrectales de mujeres embarazadas en la semana 35-37 de gestación pertenecientes al área sanitaria norte de Granada, así como 24 cepas procedentes de recién nacidos con enfermedad neonatal por EGB, remitidas por distintos hospitales de Andalucía. Las muestras se cultivaron en medio Granada a 37°C en condiciones de anaerobiosis y la identificación se realizó en base a la producción de colonias con pigmento rojo-naranja específico.
La sensibilidad frente a antimicrobianos se determinó mediante la técnica de disco-difusión en placas de Muller-Hinton sangre 5% (Becton Dickinson®) con discos de 10μg de penicilinaG, eritromicina de 15μg y clindamicina de 2μg (Biomérieux, Suecia). Para la lectura e interpretación de los antibiogramas se siguieron las indicaciones del Clinical and Laboratory Standards Institute (CLSI). A las cepas que resultaron intermedias o resistentes a cualquiera de los antibióticos se les calculó la CMI mediante E-test (AB Biomérieux, Suecia). La detección del fenotipo de resistencia inducible a clindamicina (MSLb inducible) se realizó observando la aparición del denominado «efecto D».
La determinación del serotipo de las cepas de EGB se realizó por 2 métodos: a)mediante una reacción de látex aglutinación con ayuda del kit comercial Strep-B-Latex slide agglutination test (Statenserum Institut, Dinamarca) realizando una suspensión densa de EGB crecido en agar sangre, en 250μl de buffer fosfato pH=7,2 y enfrentando 10μl de esta suspensión con 1μl de esta suspensión de látex de cada uno de los serotipos estudiados en tarjetas de plástico para observar la aglutinación, y b)mediante técnicas moleculares, a través de una multiplex-PCR (reacción en cadena de la polimerasa) descrita por Poyart et al.16 en 2007, para la detección de los serotipos ia, ib, ii, iii, iv, v, vi, vii y viii, y la utilización de primers específicos para el serotipo ix descritos por Imperi et al.17 en 2010. Cuando se observó alguna discrepancia entre ambas técnicas, estas fueron repetidas para comprobar el resultado.
En el caso de las cepas neonatales, 2 pertenecieron a aislados de EGB de nuestro hospital y las restantes 22 cepas fueron enviadas a nuestro laboratorio desde diferentes hospitales de nuestra comunidad. Sobre estas cepas se procedió del mismo modo que con las recuperadas de madres colonizadas.
Tanto para la toma de muestras de las gestantes como para las de neonatos se obtuvo la firma del consentimiento informado para participación en el estudio.
ResultadosSe obtuvo una muestra vaginorrectal en 1.180 gestantes, de las cuales en 188 se aisló EGB, por lo que el porcentaje de colonización fue del 15,9%.
Tanto en las cepas procedentes de mujeres gestantes como en las invasivas, el serotipo más frecuentemente detectado fue el iii (29,2%). Entre los resultados coincidentes en ambas técnicas los serotipos iii, ia, v y ii fueron los más frecuentes, consistiendo en conjunto el 88,1% del total de los aislados. La distribución fue similar en gestantes y neonatos, si bien el serotipo v se detectó con mayor frecuencia en las mujeres colonizadas que entre las cepas invasivas.
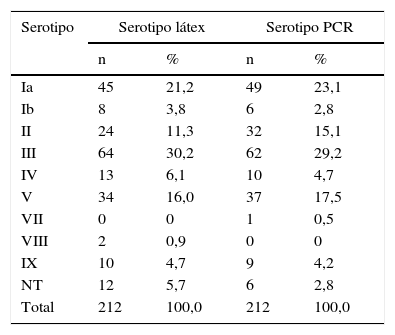
De las 188 cepas de S.agalactiae pertenecientes a mujeres embarazadas, fueron tipables el 93,6% (176/188) mediante el método de látex aglutinación y el 96,8% (182/188) mediante PCR, resultando 12 (6,38%) y 6 (3,19%) cepas, respectivamente, como no tipables por cada uno de los métodos empleados, y una de ellas no tipable por ninguno de los 2 métodos. Los resultados obtenidos por ambos métodos se muestran en la tabla 1.
Distribución de serotipos de EGB en mujeres embarazadas y recién nacidos determinados por látex aglutinación y por PCR
| Serotipo | Serotipo látex | Serotipo PCR | ||
|---|---|---|---|---|
| n | % | n | % | |
| Ia | 45 | 21,2 | 49 | 23,1 |
| Ib | 8 | 3,8 | 6 | 2,8 |
| II | 24 | 11,3 | 32 | 15,1 |
| III | 64 | 30,2 | 62 | 29,2 |
| IV | 13 | 6,1 | 10 | 4,7 |
| V | 34 | 16,0 | 37 | 17,5 |
| VII | 0 | 0 | 1 | 0,5 |
| VIII | 2 | 0,9 | 0 | 0 |
| IX | 10 | 4,7 | 9 | 4,2 |
| NT | 12 | 5,7 | 6 | 2,8 |
| Total | 212 | 100,0 | 212 | 100,0 |
NT: no tipable.
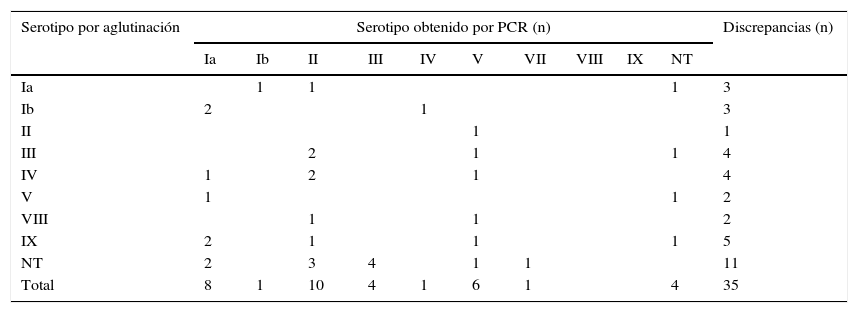
Se obtuvo el mismo resultado por ambas técnicas en 153/188 (81,4%) aislados, lo que supone una concordancia de 80,8% entre ambas técnicas. En 35 cepas (18,6%) los resultados obtenidos fueron discrepantes (tabla 2).
Discrepancias obtenidas entre las técnicas de aglutinación y PCR en las 188 cepas de gestantes
| Serotipo por aglutinación | Serotipo obtenido por PCR (n) | Discrepancias (n) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ia | Ib | II | III | IV | V | VII | VIII | IX | NT | ||
| Ia | 1 | 1 | 1 | 3 | |||||||
| Ib | 2 | 1 | 3 | ||||||||
| II | 1 | 1 | |||||||||
| III | 2 | 1 | 1 | 4 | |||||||
| IV | 1 | 2 | 1 | 4 | |||||||
| V | 1 | 1 | 2 | ||||||||
| VIII | 1 | 1 | 2 | ||||||||
| IX | 2 | 1 | 1 | 1 | 5 | ||||||
| NT | 2 | 3 | 4 | 1 | 1 | 11 | |||||
| Total | 8 | 1 | 10 | 4 | 1 | 6 | 1 | 4 | 35 | ||
NT: no tipable.
Entre los resultados coincidentes por ambas técnicas los serotipos iii, ia, v y ii fueron los más frecuentes, lo que constituye en conjunto el 88,13% del total de los aislados. El serotipoiii fue el predominante en nuestro estudio, incluyendo el 31,6% (48/152) de las cepas colonizantes obtenidas en las embarazadas. Encontramos 7 (4,6%) cepas pertenecientes al serotipoiv, 5 cepas asignadas al serotipoix (3,2%), 5 (3,2%) pertenecientes al serotipoib y una cepa (0,6%) no tipable por ambos métodos. No se detectaron cepas de los serotiposvi, vii y viii.
De las 12 cepas no tipables por látex aglutinación, se consiguió conocer el serotipo al que pertenecían en 11 casos mediante PCR perteneciendo 3 al serotipoii, 4 al serotipoiii, 2 al serotipoia, una cepa al serotipov y otra al serotipovii.
En el caso de las cepas neonatales, 23/24 (95,8%) se consiguieron tipar por ambas técnicas, resultando una única cepa 1/24 (4,2%) como no tipable por ambas técnicas. Del total, en 23/24 (95,8%) los resultados fueron coincidentes y en 1/24 (4,2%) hubo discrepancias entre los resultados de las técnicas empleadas, ya que no pudo ser tipado mediante PCR, mientras que la aglutinación frente al serotipoiii resultó positiva.
La distribución de serotipos para las 22 cepas invasivas neonatales con resultados coincidentes fue la siguiente: 10/23 (43,47%) serotipoiii, 7/23 (30,4%) serotipoia, 2/23 (8,7%) serotipoiv, 2/23 (8,7%) serotipov, 1/23(4,3%) serotipoii (tabla 1).
En cuanto a los estudios de sensibilidad, las 188 cepas de gestantes resultaron sensibles a la penicilina (tabla 3). Se detectó resistencia a la eritromicina en el 16,5% de las cepas estudiadas (31/188); de ellas, los serotipos más frecuentes fueron eliii (10/53, 18,96%), elv (9/35, 25,7%), elia (6/43, 19,9%), elii (4/31, 12,9%), eliv (1/8, 12,5%) y elix (1/5,20%).
Sensibilidad de las cepas EGB en gestantes y causantes de infección neonatal
| Antimicrobiano | Gestantes | Recién nacidos | ||||
|---|---|---|---|---|---|---|
| Sensible, n (%) | Intermedio, n (%) | Resistente, n (%) | Sensible, n (%) | Intermedio, n (%) | Resistente, n (%) | |
| Penicilina | 188 (100) | 0 | 0 | 24 (100) | 0 | 0 |
| Eritromicina | 156 (82,97) | 1 (0,53) | 31 (16,48%) | 22 (91,67) | 0 | 2 (8,34) |
| Clindamicina | 167 (88,82%) | 2 (1,06) | 19 (10,1%) | 22 (91,67) | 1 (4,16) | 1 (4,16) |
En cuanto a la resistencia a clindamicina, se encontró un 10,1% de cepas resistentes (19/188); los serotipos más frecuentes fueron elv (8/35, 22,8%), eliii (5/53, 9,4%), elii (3/31, 9,7%), elia (2/43, 4,6%) y una cepa no tipable (1/6, 16,7%).
De las 188 cepas ensayadas, se detectó «efecto D» positivo (fenotipo MLSb inducible) en 7 casos (3,7%); 2 de estas cepas pertenecían al serotipoiii, 2 al serotipoia y una a los serotiposiv, v y ix, respectivamente. En el 10,1% (19/188 cepas) se detectó resistencia conjunta a eritromicina y clindamicina (fenotipo MLSb constitutivo).
En el caso de las cepas neonatales, solo 2 de ellas presentaron resistencia a eritromicina (2/24, 8,3%), siendo ambas pertenecientes al serotipoiii y una cepa (1/24, 4,1%) con resistencia a clindamicina y eritromicina (fenotipo MLSb constitutivo) también de serotipoiii. Todas fueron sensibles a la penicilina. No se detectó ninguna cepa con fenotipo MSLb inducible entre las de origen neonatal.
DiscusiónA lo largo del tiempo se ha venido documentando el hecho de que la distribución de los serotipos capsulares de EGB varía geográficamente2,18-21. En nuestro estudio, a pesar del número de cepas obtenidas de madres colonizadas e invasivas, encontramos todos los serotipos, excepto elvi y elviii. Tanto en el caso de las cepas colonizantes como en cepas invasivas observamos que más del 80% de las cepas se distribuyen entre 3 serotipos predominantes: ia, iii y v, siendo el serotipoiii el más común tanto en un grupo como en el otro, como ocurre en otros estudios realizados en Europa22-25.
La proporción de cepas clasificadas como no tipables en nuestro estudio (12 [6,4%] mediante aglutinación y 5 [2,6%] mediante PCR para las cepas colonizantes) es bastante más baja que en estudios previos, donde cepas no tipables constituyen hasta el 15-20% del total22. Si descartamos las cepas que no pudieron ser tipadas por alguno de los 2 métodos utilizados, el grado de concordancia obtenido de forma global entre ambas técnicas fue del 92,30%, superior incluso al obtenido en estudios similares, como los de Yao et al.26 en 2013. Sin embargo, muchos de los aislados que resultaron no tipables mediante la técnica de aglutinación pudieron ser tipados utilizando el método molecular, por lo que este último método, cuando se utilizan los cebadores apropiados para la detección de los 10 serotipos conocidos, resulta más sensible y específico que el método de aglutinación. Este último en ocasiones puede dar lugar a resultados equívocos o fenómenos de autoaglutinación que son más dependientes de la experiencia del observador para la obtención del resultado. En ocasiones la falta de reactividad en el ensayo de aglutinación puede deberse a una expresión deficiente de la cápsula. Por otra parte, el uso de métodos moleculares frente al cps de EGB no revela si se expresa el polisacárido capsular, lo cual es una desventaja de estos métodos. Se han descrito diferentes mecanismos de pérdida o inserción de fragmentos de ADN para la región cps de EGB27. Ninguna de las técnicas moleculares diseñadas para el serotipado de EGB consigue un 100% de sensibilidad y especificidad, por lo que algunos autores sugieren la utilización de 2 técnicas distintas para aquellos casos en que los resultados no sean concluyentes. En nuestro estudio el mayor número de discrepancias entre ambas técnicas se da en las cepas de gestantes, probablemente influido por el mayor número de cepas ensayadas. El serotipo para el que se detectaron más discrepancias entre las técnicas de tipado utilizadas fueron elia y eliv; sin embargo, no existe una diferencia apreciable entre las discrepancias obtenidas con estos serotipos y el resto, por lo que no pueden atribuirse a una causa técnica relacionada con un determinado serotipo y puede estar más relacionado, en el caso del serotipoia, con la mayor proporción de cepas pertenecientes a este grupo encontradas.
Con las técnicas utilizadas en los laboratorios (aglutinación y/o métodos moleculares) existen algunos aislados que no se consiguen tipar, o presentan errores de tipado debido a las deficiencias de las técnicas empleadas. En estos casos, la ayuda de técnicas como la citometría de flujo se muestra bastante eficiente y puede convertirse en una alternativa26.
Debido a la uniforme sensibilidad de EGB a la penicilina y la ampicilina, estos son los antibióticos de elección en el tratamiento y en la prevención intraparto de la infección neonatal, mientras que la clindamicina, la cefazolina y la vancomicina son recomendadas en caso de alergia a la penicilina. En estudios recientes realizados en España y en otros países, la tasa de resistencia a la eritromicina está en un rango entre el 10 y el 20%8,25. Las tasas de resistencia obtenidas en nuestra población son inferiores a las comunicadas en otros estudios tanto de Estados Unidos como de Europa20,21,28,29, por lo que podrían seguir utilizándose estos antimicrobianos como primera elección, si bien sería recomendable la realización de antibiogramas en las gestantes colonizadas alérgicas a penicilina. A pesar de que tanto en gestantes como en recién nacidos el serotipo predominante es eliii, y que este es el más relacionado con la invasividad y la enfermedad en nuestro estudio, el serotipov constituye el 16,5% de todos los aislados, pero sin embargo el 25% de las cepas de este serotipo resultó resistente a la eritromicina y más del 20% resistente a la clindamicina, aunque ninguna de estas cepas fuera responsable de enfermedad neonatal. En varios estudios se ha encontrado una relación entre el serotipo y la tasa de resistencia frente a la eritromicina y la clindamicina tanto en adultos como en cepas invasivas causantes de enfermedad neonatal, encontrándose tasas de resistencia superiores en el serotipov11,20,28,30-33, e incluso una mayor tasa de mortalidad en neonatos con este serotipo22.
Nuestros datos y la literatura revisada indican que existe una gran variabilidad en la distribución geográfica de los serotipos de EGB, y que si bien el serotipo predominante tanto en la población adulta como en los neonatos es eliii, es necesario establecer una especial vigilancia en serotipos como elv, que están incrementando su presencia en nuestro medio y parecen estar relacionados con una mayor tasa de resistencias, lo que puede contribuir al cambio de patrones de sensibilidad actuales que permiten seguir utilizando los macrólidos como una alternativa adecuada al empleo de betalactámicos para la realización de la PAI.
Para la elaboración de una futura vacuna con una adecuada cobertura como método alternativo a la administración de la PAI, es esencial disponer de métodos sensibles y específicos que permitan desarrollar un trabajo de vigilancia de los principales serotipos circulantes y la emergencia de nuevos, lo que a su vez redundaría en una disminución del número de casos de enfermedad neonatal precoz y tardía, junto con una disminución en la utilización de antimicrobianos, conservando así la eficacia del arsenal terapéutico actual frente a EGB.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.