La hepatitis crónica por el virus de la hepatitis C afecta a casi 180 millones de personas en el mundo. La infección por el virus de la hepatitis C es curable. Hasta hace 1 año, el único tratamiento de la hepatitis por virus de la hepatitis C genotipo 1 consistía en la combinación de interferón pegilado y ribavirina con una modesta eficacia (40–50%). La llegada de los nuevos agentes antivirales directos, como el telaprevir, ha supuesto una auténtica revolución en la terapia de esta infección, un cambio de paradigma. Supone un incremento en las probabilidades de respuesta (80%) y la posibilidad de reducir la duración del tratamiento en más de la mitad de los pacientes. Se han desarrollado nuevas reglas de parada del tratamiento con el fin de evitar el desarrollo de resistencias. Finalmente, debemos prestar atención al desarrollo de efectos secundarios potencialmente graves, en especial la anemia y las alteraciones cutáneas.
Chronic hepatitis due to the hepatitis C virus (HCV) infection affects nearly 180 million people worldwide. This infection is curable. Until 1 year ago, the only treatment for genotype 1 HCV was the combination of pegylated interferon and ribavirin, which was only moderately effective (40–50%). The introduction of new antiviral agents, such as telaprevir, represents a change of paradigm and has revolutionized the treatment of this infection. This drug has increased the likelihood of viral response (to 80%) and has allowed treatment length to be shortened in more than 50% of patients. New stopping rules have been developed to avoid the development of resistances. Finally, special attention should be paid to potentially serious adverse effects, particularly anemia and cutaneous alterations.
Alrededor de un 3% de la población mundial está infectada por el virus de la hepatitis C (VHC), lo que representa unos 180 millones de personas infectadas, con 3 millones de nuevas personas infectadas anualmente1.
El 70% desarrollará una hepatitis crónica y, de estos, cerca del 25% desarrollará una cirrosis a largo plazo. Esta se asocia a una mortalidad del 3%, tanto por descompensaciones como por un hepatocarcinoma1.
El desarrollo de los nuevos agentes antivirales directos (AAD) ha supuesto el inicio de una nueva era en el tratamiento de la hepatitis C genotipo 1 y el desarrollo de nuevas guías de tratamiento2. En el momento actual, el tratamiento de los pacientes con infección crónica por VHC genotipo 1, el tratamiento estándar ha pasado de ser a base de doble terapia con interferón pegilado (Peg-IFN) y ribavirina (RBV) a ser triple terapia con un AAD, lo que supone un cambio de paradigma.
El telaprevir es uno de los AAD aprobados para el tratamiento de la hepatitis crónica C (HCC) genotipo 1 por la Food and Drug Administration (FDA) y la European Medicines Agency (EMA). Se trata de un inhibidor de la proteasa NS3/4A, esencial para la replicación del VHC. Se administra por vía oral en forma de comprimidos de 375 mg, con una dosificación total de 2 comprimidos (750mg) cada 7–9h y se toma con comida. Sin embargo, recientes estudios han demostrado que la administración de la misma dosis cada 12h es igual de eficaz3, como se describirá posteriormente. De hecho es más que probable que en el momento de la publicación de esta revisión, estemos prescribiendo a los pacientes 3 comprimidos cada 12h, con las indudables ventajas que esta posología aporta.
El telaprevir asociado al IFN y la RBV incrementa las posibilidades de respuesta viral sostenida (RVS) al 70–80% en pacientes no tratados previamente4,5. Además, según el concepto de terapia guiada por respuesta, más de la mitad de los pacientes podrá reducir la duración del tratamiento completo a 24 semanas. Esto dependerá de la negativización de la viremia en las semanas 4 y 12 del tratamiento.
La eficacia y la seguridad del telaprevir en pacientes con infección crónica por VHC genotipo 1 se ha evaluado mediante ensayos clínicos de fases II y III. De forma global, la elevada potencia antiviral se traduce en un 70% de respuesta viral rápida (RVR); dos tercios de los pacientes alcanzan una RVR extendida (eRVR) (ARN-VHC negativo en semanas 4 y 12), lo que permite reducir la duración del tratamiento. En los pacientes naïve con fibrosis leve, genotipo 1b, no diabéticos, genotipo CC, las tasas de RVS superan el 90%. Los pacientes naïve con genotipo favorable que alcanzan eRVR se curan casi todos (97%), y en aquellos sin cirrosis con genotipo favorable (CC), además de curarse el 100%, un tratamiento de 12 semanas de triple terapia es suficiente6.
El diseño y los resultados se comentan de forma más detallada a continuación.
- –
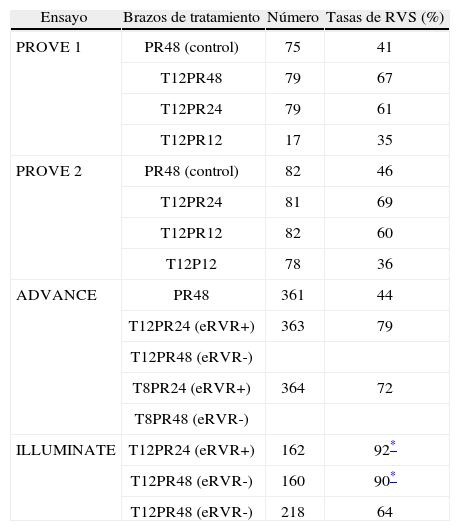
Estudio PROVE 17. Ensayo fase II, desarrollado en Estados Unidos, incluyó pacientes con HCC genotipo 1 sin tratamiento previo. Se distribuyeron de forma aleatoria como se representa en la tabla 1. Los pacientes de los brazos que recibieron telaprevir tuvieron una probabilidad significativamente mayor de alcanzar respuesta virológica rápida (RVR, ARN en semana 4 de tratamiento indetectable) respecto del grupo control (el 79 frente al 11%, respectivamente). En las primeras 12 semanas de tratamiento, el 91% de los pacientes que recibieron telaprevir alcanzó cargas virales negativas, frente al 41% del grupo control. Las tasas de RVS fueron significativamente mayores en los brazos que recibieron telaprevir y completaron el tratamiento hasta 24 y 48 semanas (tabla 1).
Tabla 1.Diseño y tasas de RVS de los ensayos clínicos con telaprevir.
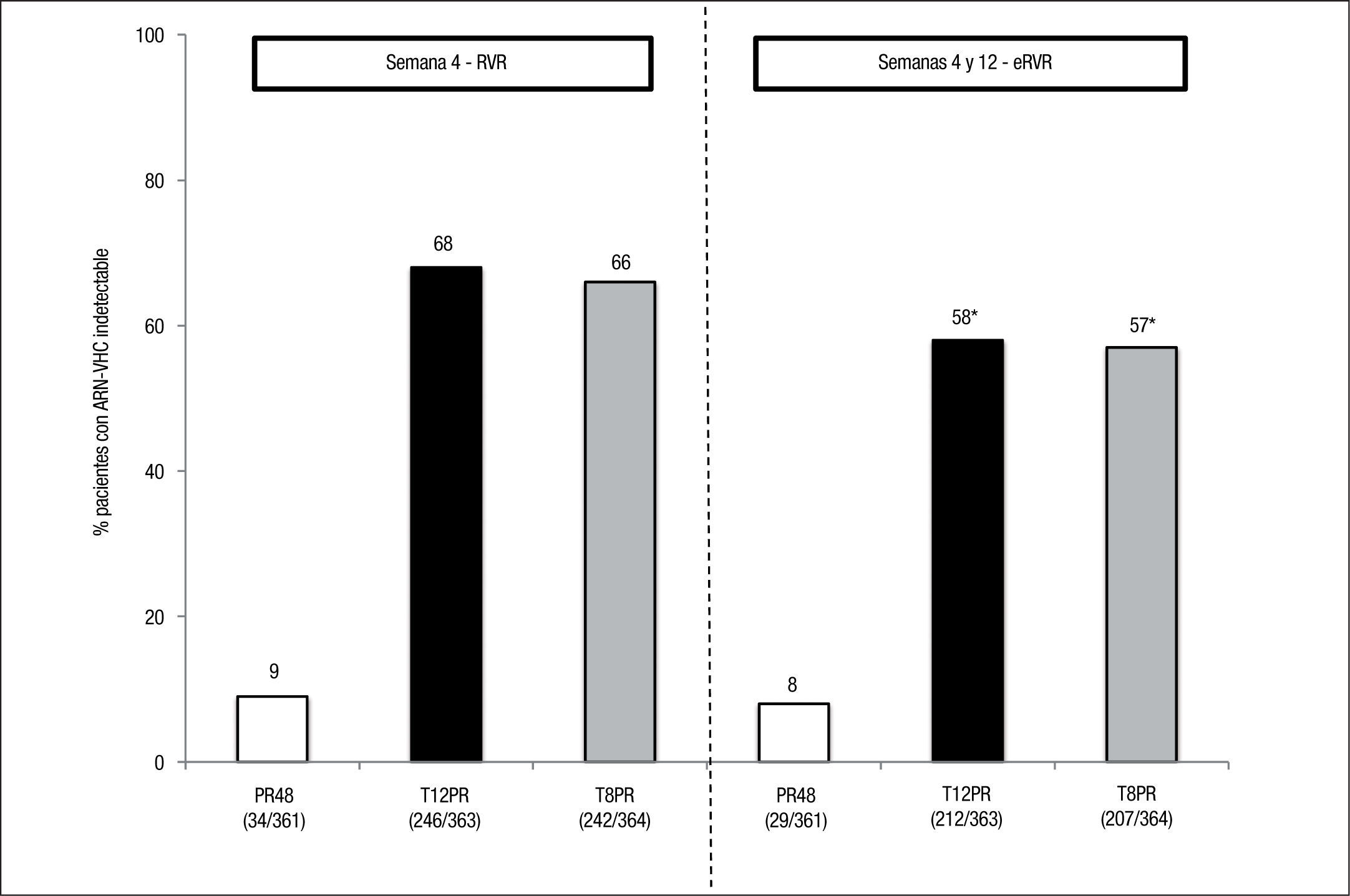
Ensayo Brazos de tratamiento Número Tasas de RVS (%) PROVE 1 PR48 (control) 75 41 T12PR48 79 67 T12PR24 79 61 T12PR12 17 35 PROVE 2 PR48 (control) 82 46 T12PR24 81 69 T12PR12 82 60 T12P12 78 36 ADVANCE PR48 361 44 T12PR24 (eRVR+) 363 79 T12PR48 (eRVR-) T8PR24 (eRVR+) 364 72 T8PR48 (eRVR-) ILLUMINATE T12PR24 (eRVR+) 162 92* T12PR48 (eRVR-) 160 90* T12PR48 (eRVR-) 218 64 eRVR: respuesta viral rápida extendida; PR: interferón pegilado + ribavirina; RVS: respuesta viral sostenida; T: telaprevir.
- –
Estudio PROVE 28. El estudio PROVE 2 se desarrolló en Europa, incluyó a 323 pacientes con HCC genotipo 1 naïve. Con un diseño similar al descrito previamente, en este caso se incluyó un grupo de tratamiento con IFN y telaprevir sin RBV. Los resultados fueron similares a los hallados en el PROVE 1, los brazos de telaprevir en combinación con Peg-IFN y RBV obtuvieron una mayor probabilidad de alcanzar RVS (fig. 1), con la salvedad del grupo sin RBV, en el que se observó una mayor probabilidad de recaída, de lo que se desprende que la RBV sigue teniendo un papel crucial en el tratamiento.
Con los resultados obtenidos en los estudios de fase II, telaprevir se presenta como una opción terapéutica con unas extraordinarias tasas de RVS y la posibilidad de reducir la duración del tratamiento cuando se asocia a IFN y a RBV. A continuación se resumen los ensayos de fase III.
- -
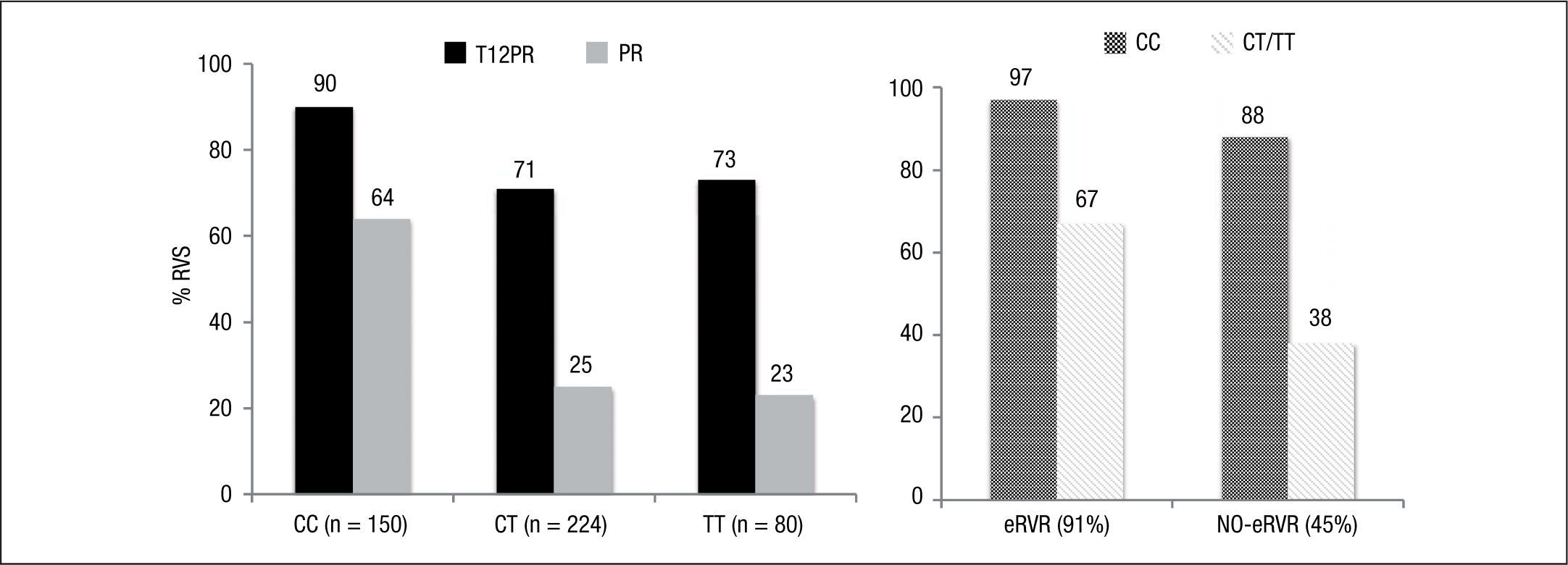
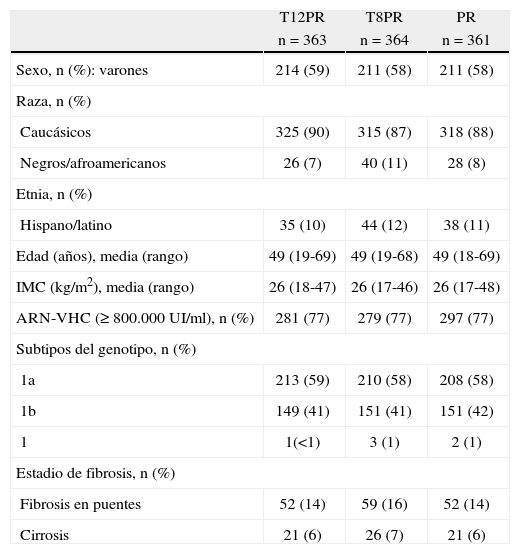
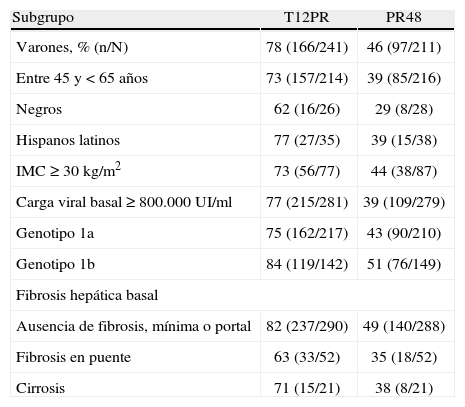
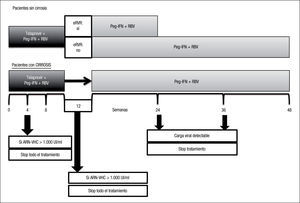
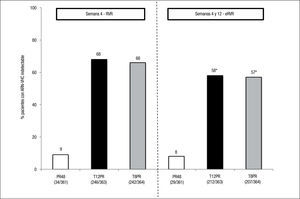
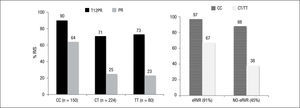
Estudio ADVANCE4. El estudio ADVANCE fue un ensayo clínico de fase III, doble ciego, aleatorizado, controlado con placebo, que se realizó en pacientes sin experiencia previa de tratamiento. El diseño del estudio comparó 2 regímenes: telaprevir durante las primeras 8 semanas (T8PR) o durante las 12 primeras semanas (T12PR) en combinación con Peg-IFN α-2a con RBV hasta completar 24 o 48 semanas frente al grupo control con tratamiento estándar. Los pacientes que alcanzaban ARN-VHC indetectable en las semanas 4 y 12 completaban tratamiento hasta un total de 24 semanas con el Peg-IFN y la RBV. Si no cumplían este requisito completaban tratamiento hasta un total de 48 semanas con la doble terapia. En este estudio se incluyeron 1.088 pacientes, cuyas características se describen en la tabla 2. La probabilidad de obtener RVS fue superior en los grupos expuestos al telaprevir frente al grupo control, así como en los distintos subgrupos, distribuidos por: sexo, edad, raza, etnia, índice de masa corporal (IMC), subtipo de genotipo, valor basal de carga viral y estadio de fibrosis (tabla 3). La cinética viral es un factor predictor de respuesta y además permite tomar decisiones terapéuticas, reduciendo la duración del tratamiento o interrumpiéndolo. En el estudio ADVANCE, casi el 70% de los pacientes consiguió RVR y más del 50% pudo reducir el tratamiento a 24 semanas (fig. 2). Asimismo, en los brazos de telaprevir el porcentaje de recaídas fue significativamente menor (T12PR: 4% frente a PR48:26%). Si bien en ambos grupos con telaprevir, las tasas de RVS, de recaída (4% ambos grupos) y el porcentaje de pacientes que se benefició de un tratamiento total más corto eran similares, el fracaso virológico durante el tratamiento fue menor en el brazo que recibía telaprevir durante las 12 primeras semanas frente a 8 (T12PR: 8% frente a T8PR: 13%). Es por ello que el tratamiento con telaprevir se debe mantener durante las 12 primeras semanas de tratamiento. En un análisis posterior se analizó la relación del polimorfismo de la IL28B con la RVS9. Se pudieron obtener resultados de este polimorfismo en un 42% (454/1.088) de los pacientes incluidos en el estudio ADVANCE, todos caucásicos. Como muestra la figura 3, el grupo con telaprevir obtiene elevadas tasas de RVS a pesar del genotipo de la IL28B. Y lo que es más importante, casi la totalidad de los pacientes con genotipo favorable (CC) podrá reducir la duración del tratamiento y curarse (el 91% de eRVR y el 97% de RVS).
Tabla 2.Características de los pacientes del estudio ADVANCE.
T12PR T8PR PR n = 363 n = 364 n = 361 Sexo, n (%): varones 214 (59) 211 (58) 211 (58) Raza, n (%) Caucásicos 325 (90) 315 (87) 318 (88) Negros/afroamericanos 26 (7) 40 (11) 28 (8) Etnia, n (%) Hispano/latino 35 (10) 44 (12) 38 (11) Edad (años), media (rango) 49 (19-69) 49 (19-68) 49 (18-69) IMC (kg/m2), media (rango) 26 (18-47) 26 (17-46) 26 (17-48) ARN-VHC (≥ 800.000 UI/ml), n (%) 281 (77) 279 (77) 297 (77) Subtipos del genotipo, n (%) 1a 213 (59) 210 (58) 208 (58) 1b 149 (41) 151 (41) 151 (42) 1 1(<1) 3 (1) 2 (1) Estadio de fibrosis, n (%) Fibrosis en puentes 52 (14) 59 (16) 52 (14) Cirrosis 21 (6) 26 (7) 21 (6) IMC: índice de masa corporal; PR: interferón pegilado + ribavirina; VHC: virus de la hepatitis C.
Tabla 3.Tasa de respuesta viral sostenida por subgrupos de pacientes del estudio ADVANCE.
Subgrupo T12PR PR48 Varones, % (n/N) 78 (166/241) 46 (97/211) Entre 45 y < 65 años 73 (157/214) 39 (85/216) Negros 62 (16/26) 29 (8/28) Hispanos latinos 77 (27/35) 39 (15/38) IMC ≥ 30kg/m2 73 (56/77) 44 (38/87) Carga viral basal ≥ 800.000 UI/ml 77 (215/281) 39 (109/279) Genotipo 1a 75 (162/217) 43 (90/210) Genotipo 1b 84 (119/142) 51 (76/149) Fibrosis hepática basal Ausencia de fibrosis, mínima o portal 82 (237/290) 49 (140/288) Fibrosis en puente 63 (33/52) 35 (18/52) Cirrosis 71 (15/21) 38 (8/21) IMC: índice de masa corporal.
- -
Estudio ILLUMINATE5. El estudio ILLUMINATE fue un ensayo clínico de fase III, aleatorizado y abierto, en pacientes no tratados previamente. El estudio se diseñó para explorar la terapia guiada por respuesta con un criterio de evaluación de no inferioridad, con un margen de –10,5%. Los pacientes eran tratados con telaprevir, Peg- IFN α-2a y RBV durante 12 semanas seguidos de doble terapia 24 o 48 semanas en total; aquellos eRVR en la semana 20 eran aleatorizados a completar un tratamiento total de 24 o 48 semanas. Se seleccionó un total de 540 pacientes con las siguientes características basales: edad de 51 años (rango: 19 a 70); el 60% varones; el 30% presentaba un IMC > 30kg/m2; el 14% de raza negra, el 10% de raza hispana/latina; el 80% tenía cargas virales basales > 800.000UI/ml; el 16% de pacientes con fibrosis en puente y el 11% con cirrosis; el 72% con genotipo 1a y el 27% genotipo 1b. En este estudio, de forma similar a sus predecesores, se mostraron unas elevadas tasas de RVS (74%) y se evidenció que en pacientes que alcanzan eRVR (65%) no se observó ningún beneficio en prolongar la doble terapia a 48 semanas (tabla 1). Los resultados de eficacia en función del grado de fibrosis basal son: el 77% (302/391) en el grupo con ausencia de fibrosis, mínima o portal (F0–F2); el 74% (65/88) en pacientes con fibrosis en puentes (F3), y el 51% (31/61) en el caso de los pacientes con cirrosis (F4). El grupo de cirróticos no contó con un elevado número de pacientes, 11% (61). En un análisis posterior de los pacientes cirróticos incluidos en el ILLUMINATE, de los 30 pacientes que alcanzaron eRVR (49%), los incluidos en el brazo que completaba el tratamiento a 24 semanas obtuvieron el 67% (12/18) de RVS frente a los que lo completaron hasta 48 semanas con un 92% (11/12)10. De esta evidencia, a pesar del escaso número de casos, se infiere que los pacientes con cirrosis deben seguir un régimen de tratamiento en el que tras 12 semanas de triple terapia, esta se consolide con 36 semanas más de doble terapia.
- -
Estudio OPTIMIZE3. La experiencia con telaprevir se completa con la reciente publicación de los resultados del estudio OPTIMIZE3. La administración de la dosis de telaprevir cada 12 h (3 comprimidos/ 12 h) se había explorado previamente en un ensayo de fase II (el C208)11. Se obtuvieron tasas de RVS > 80% en los grupos que administraron telaprevir. El OPTIMIZE es un ensayo clínico de fase III, aleatorizado, abierto, con el objetivo de mostrar la no inferioridad de la administración de telaprevir cada 12 frente a 8h. Las tasas de RVS12 fueron: el 72,8% para el grupo “cada 8 h” frente al 74,3% del “grupo cada 12h”, diferencia del 1,5% (intervalo de confianza del 95%, –4,9 a 12%), confirmando la no inferioridad. Estos datos muestran el potencial de una pauta simplificada con administración cada 12h. En este estudio, más del 66% de los pacientes pudo reducir el tratamiento a 24 semanas.
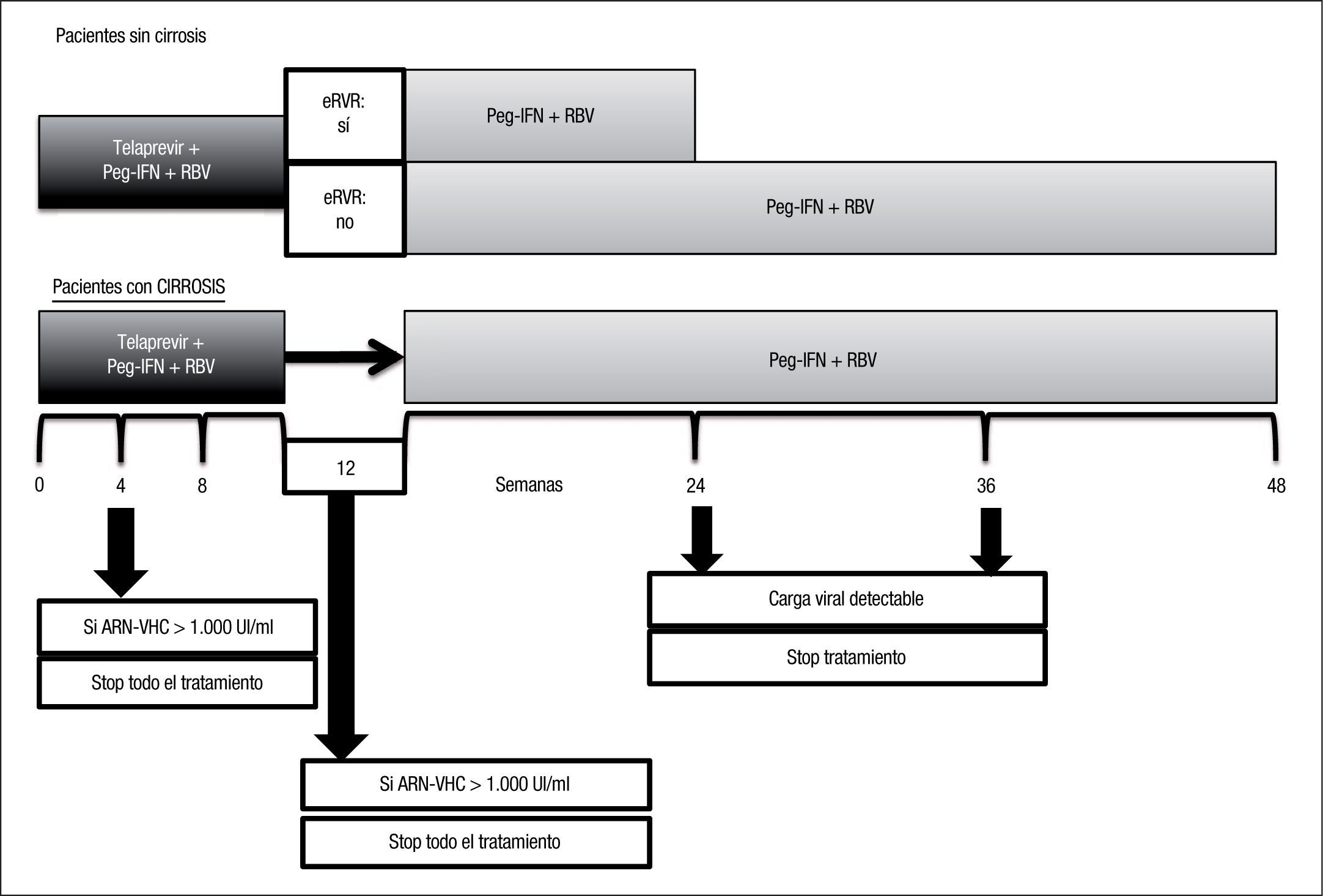
Una pobre respuesta viral reduce las posibilidades de alcanzar RVS. En el manejo del telaprevir se han establecido reglas de parada de obligado cumplimiento, con el fin de evitar el desarrollo de resistencias. Se recomienda que si el ARN-VHC es > 1.000UI/ml en las semanas 4 y 12 de tratamiento, este se suspenda. En los ensayos de fase III ningún paciente con carga viral > 1.000UI/ml en las semanas 4 y 12 alcanzó RVS. Los pacientes con ARN-VHC entre 100–1.000UI/ ml en las semanas 4 y 12 alcanzaron RVS en un 25% (4/16 para semana 4 y 2/8 para semana 12). Si el tratamiento se programa a 48 semanas, este debe suspenderse si el ARN-VHC es detectable en las semanas 24 y 36.
Las consecuencias del desarrollo de resistencias están por explorar. Es por ello que cobra vital importancia la suspensión del tratamiento cuando se cumplen las reglas de parada, ya que es posible la aparición de resistencias cruzadas12.
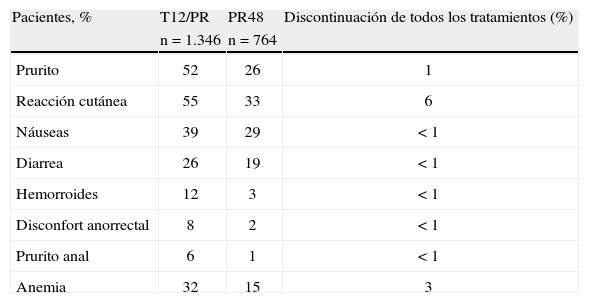
Seguridad. Efectos secundarios e interacciones farmacológicasLos acontecimientos adversos fueron más frecuentes en los pacientes que recibieron triple terapia basada en telaprevir en comparación con el tratamiento con Peg-IFN y RBV en los ensayos de fase III, incluyendo anemia, náuseas, diarrea, síndrome rectal, exantema y prurito. Los efectos adversos y la repercusión en el tratamiento de los ensayos de fases II y III13 se resumen en la tabla 4.
Resumen de seguridad del telaprevir en los ensayos de fase II/III.
| Pacientes, % | T12/PR | PR48 | Discontinuación de todos los tratamientos (%) |
| n = 1.346 | n = 764 | ||
| Prurito | 52 | 26 | 1 |
| Reacción cutánea | 55 | 33 | 6 |
| Náuseas | 39 | 29 | < 1 |
| Diarrea | 26 | 19 | < 1 |
| Hemorroides | 12 | 3 | < 1 |
| Disconfort anorrectal | 8 | 2 | < 1 |
| Prurito anal | 6 | 1 | < 1 |
| Anemia | 32 | 15 | 3 |
Un 41% de los pacientes incluidos en los ensayos de fase III desarrolló anemia, frente al 26% del tratamiento estándar. La media de descenso de la hemoglobina fue 1g/dl superior en los pacientes que recibieron telaprevir frente a los que recibieron tratamiento estándar. La anemia severa por debajo de 8,5g tuvo lugar en el 8%. En los ensayos no estuvo permitido el uso de estimulantes de la eritropoyesis.
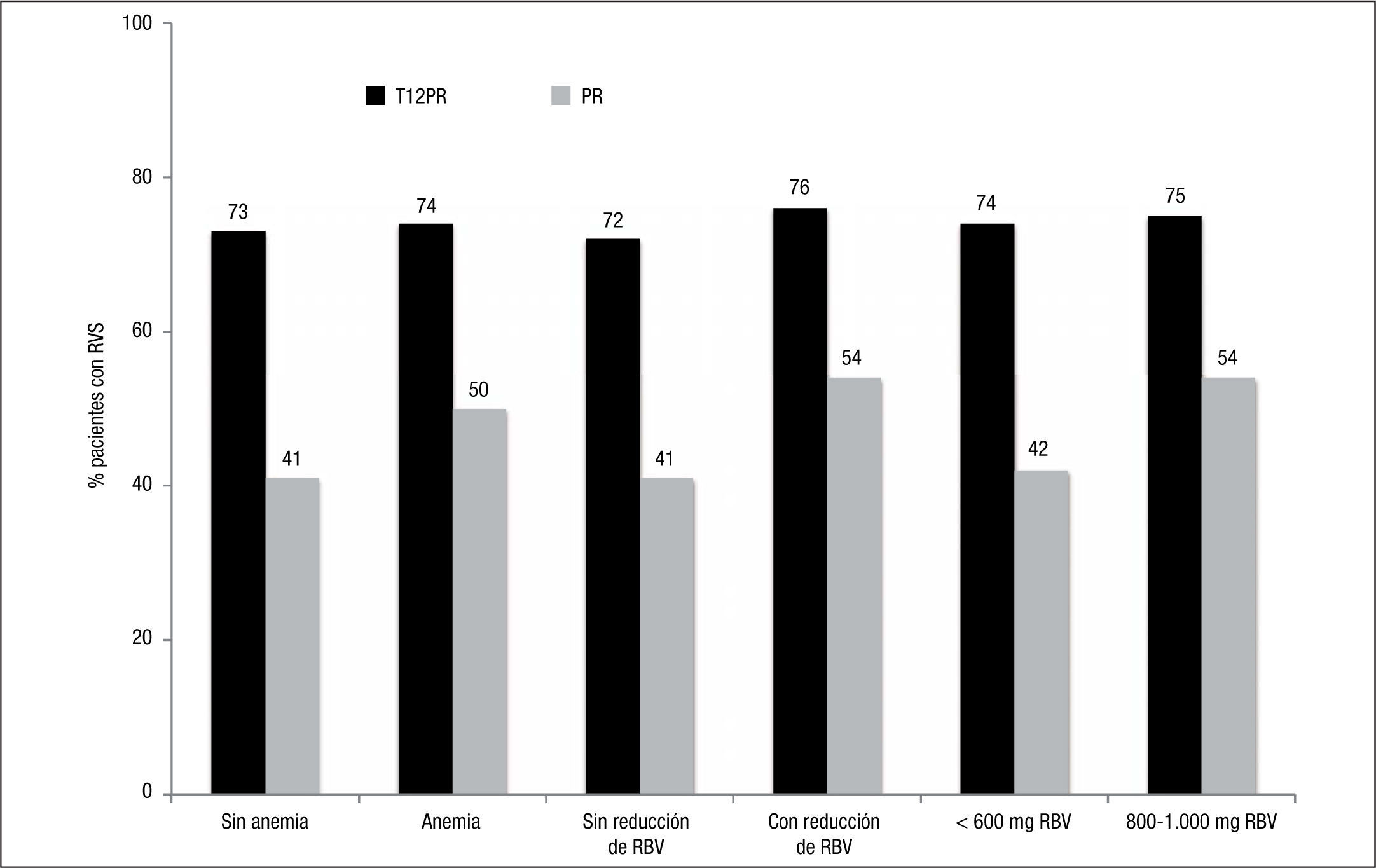
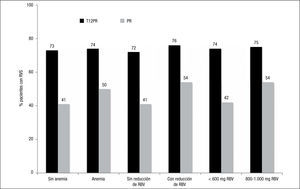
En análisis posteriores de los ensayos de fase III se ha observado que la anemia, la reducción de la RBV, así como la dosis mínima de esta, no tienen un impacto negativo en la RVS14–16 (fig. 4). En el manejo de la triple terapia basada en telaprevir, la primera medida en el manejo de la anemia debe ser la reducción paulatina de la dosis de RBV.
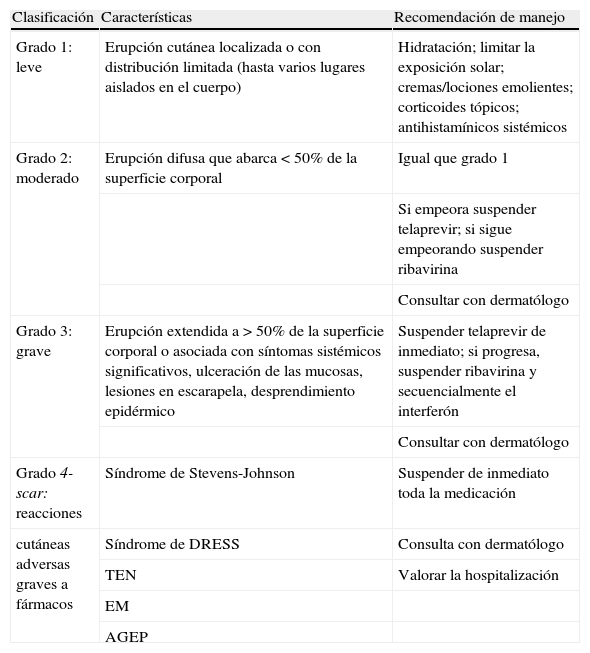
Más de la mitad de los pacientes expuestos al telaprevir desarrolló exantema, menos del 10% progresa. En los ensayos de fase II supuso la discontinuación del tratamiento en un 6%, motivo por el cual se desarrolló un manual de manejo de los efectos cutáneos4,17,18 (tabla 5), lo que permitió reducir la suspensión del tratamiento por este motivo al 1% en los ensayos de fase III.
Manual de manejo de los efectos cutáneos.
| Clasificación | Características | Recomendación de manejo |
| Grado 1: leve | Erupción cutánea localizada o con distribución limitada (hasta varios lugares aislados en el cuerpo) | Hidratación; limitar la exposición solar; cremas/lociones emolientes; corticoides tópicos; antihistamínicos sistémicos |
| Grado 2: moderado | Erupción difusa que abarca < 50% de la superficie corporal | Igual que grado 1 |
| Si empeora suspender telaprevir; si sigue empeorando suspender ribavirina | ||
| Consultar con dermatólogo | ||
| Grado 3: grave | Erupción extendida a > 50% de la superficie corporal o asociada con síntomas sistémicos significativos, ulceración de las mucosas, lesiones en escarapela, desprendimiento epidérmico | Suspender telaprevir de inmediato; si progresa, suspender ribavirina y secuencialmente el interferón |
| Consultar con dermatólogo | ||
| Grado 4-scar: reacciones | Síndrome de Stevens-Johnson | Suspender de inmediato toda la medicación |
| cutáneas adversas graves a fármacos | Síndrome de DRESS | Consulta con dermatólogo |
| TEN | Valorar la hospitalización | |
| EM | ||
| AGEP |
AGEP: pustulosis exantemosa generalizada; DRESS: drug reaction, eosinophilia and systemic symptoms; EM: eritema multiforme; TEN: necrólisis epidérmica tóxica.
En la mayoría de los pacientes que desarrollaron alteraciones cutáneas, estas fueron de intensidad leve-moderada, con más frecuencia en las primeras 4 semanas, y se resolvieron al cumplir el tratamiento a las 12 semanas. Estas alteraciones cutáneas suelen ser una dermatitis eccematosa, con pápulas eritematosas de localización preferente en tronco y extremidades, y tienen tendencia a descamarse. Este efecto secundario suele ser bien tolerado y responde adecuadamente al tratamiento con corticoides tópicos y emolientes.
Los síntomas anorrectales tuvieron una mayor incidencia en los pacientes expuestos al telaprevir. Este inhibidor de la proteasa se metaboliza en el hígado y su eliminación es fecal. Probablemente, la eliminación de los metabolitos derivados sea responsable de estos síntomas, como son: prurito anal (6%), hemorroides (12%) o proctalgia (8%). La mayoría de estos síntomas son leves y responden favorablemente con tratamiento tópico.
Dentro del International Telaprevir Early Access Program (programa internacional de acceso precoz al telaprevir) se incluyó un grupo de pacientes naïve. Se han presentado datos preliminares19, y los resultados de eficacia y toxicidad se están reproduciendo en la práctica clínica.
Las interacciones farmacológicas no son motivo de esta revisión, pero es importante saber que telaprevir es inhibidor y sustrato de la glucoproteína-p y, en su mayor parte, se metaboliza por el sistema del CYP3A4 y por ello puede presentar interacciones medicamentosas con los fármacos que empleen dichas vías metabólicas. Para más detalles consultar el artículo de Crespo y Lens18 o a través del enlace web de interacciones medicamentosas20, donde se pueden consultar las interacciones con actualizaciones permanentes.
Telaprevir en poblaciones especialesLa experiencia de la triple terapia con telaprevir en pacientes con enfermedad hepática avanzada, coinfectados con el virus de la inmunodeficiencia humana (VIH) y en recidiva postrasplante hepático está en desarrollo. En los pacientes con cirrosis compensada, pero con antecedentes de descompensación, la eficacia es alta (con un 85% de ARN-VHC negativo en semana 12)19, pero a expensas de un aumento del número y gravedad de los efectos adversos, suspensión del tratamiento, así como una mortalidad no desdeñable. Asimismo, según la experiencia propia y en lo recientemente publicado, se ha observado un incremento de las infecciones bacterianas, descompensaciones de la cirrosis y necesidad de ingreso hospitalario21.
Acerca de los pacientes coinfectados VIH-VHC (sin tratamiento previo para VHC) se están publicando resultados de ensayos clínicos con tasas de RVS del 74%22. En este grupo de pacientes será de gran importancia la valoración de potenciales interacciones medicamentosas.
El tratamiento con triple terapia en pacientes con trasplante hepático se limita a la publicación de la experiencia de los centros. El tratamiento del paciente trasplantado supone un importante reto en el manejo de esta terapia, empezando por las importantes interacciones medicamentosas de los inhibidores de la proteasa y los inmunosupresores. Debido a la interferencia metabólica que supone la administración de un AAD, las dosis de inmunosupresores pueden tener que disminuirse de forma muy importante (desde 2–3 veces para ciclosporina hasta 40 veces para tacrolimus)23.
Conclusiones prácticasTelaprevir se presenta como una terapia eficaz y segura para el tratamiento de la HCC genotipo 1, con una indicación de clase 1 y nivel A según la última actualización de la AASLD (American Association for the Study of Liver Diseases)2.
El esquema de manejo del telaprevir en pacientes naïve se resume en la figura 1.
Es de vital importancia un correcto seguimiento del esquema terapéutico y cumplimiento de las reglas de parada, con el fin de evitar el desarrollo de variantes resistentes, puesto que se han descrito resistencias cruzadas entre los inhibidores de la proteasa.
Desde el Ministerio de Sanidad y Consumo se ha elaborado y publicado un documento con las recomendaciones para el manejo de la triple terapia en el tratamiento de la hepatitis C24. Con esta guía se pretende recomendar el tratamiento con triple terapia en los pacientes con fibrosis avanzada y un perfil de respuesta desfavorable, determinado por el polimorfismo de la IL28B. De esta manera la triple terapia queda restringida a los pacientes con F2 e IL28B TT/CT y F3- F4 (tabla 6).
Grupos de pacientes con indicación para triple terapia según el documento del Ministerio de Sanidad24.
| Pacientes con F2 (7,6–9,5 kPa) + genotipo IL28B no-CC |
| Pacientes con F ≥ 3 (≥ 9,5 kPa) |
F: fibrosis.
La triple terapia es un arma terapéutica de extraordinaria eficacia, pero más compleja. Se precisa una correcta indicación y manejo para poder obtener lo mejores resultados. En cuanto al manejo de la triple terapia cobran especial importancia el reconocimiento y el tratamiento de los efectos adversos, más frecuentes e importantes en los pacientes cirróticos, y de esta forma poder minimizar la suspensión precoz del tratamiento y favorecer una correcta adherencia. La educación de nuestros pacientes es clave en el empleo de la triple terapia. Para que esto sea factible resulta de interés el desarrollo de unidades específicas para el tratamiento de la hepatitis. Unidades multidisciplinares que permitan optimizar la terapia desde varios puntos de vista, con enfermera especializada, dermatólogo, farmacéutico, etc., e incluso con las propias unidades de trasplante hepático con las que habría que desarrollar programas específicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.