La polineuropatía y la miopatía, agrupadas bajo el término «polineuromiopatía del paciente crítico» (PNMPC), son enfermedades neuromusculares que los pacientes de la unidad de cuidados intensivos (UCI) son susceptibles de presentar. Son enfermedades multifactoriales: la conexión prolongada al ventilador es uno de los factores más comunes. El objetivo de esta revisión ha sido identificar la eficacia de diferentes tratamientos rehabilitadores en pacientes con PNMPC y la relación entre esta y una serie de indicadores hospitalarios.
MetodologíaSe ha realizado una revisión sistemática de los estudios primarios seleccionados de las bases de datos Medline, Scielo, Web of Science, Cochrane, Cuiden y Science Direct, siguiendo las directrices de la declaración PRISMA, a través de la cual se estableció el protocolo de búsqueda.
Resultados y conclusionesDe 161 artículos, solo 10 fueron seleccionados para formar parte de esta revisión, en la cual se estudiaron un total de 717 pacientes ingresados en la UCI. Se ha observado una relación estadísticamente significativa entre la PNMPC y el fallo en la desconexión del ventilador, la mortalidad, el aumento de estancia en UCI y del tiempo que los pacientes necesitan ventilación mecánica. Además, todo ello mejora en este tipo de pacientes con la aplicación de alguna terapia rehabilitadora. El uso de corticoides, por el contrario, no ha demostrado tener relación con la alteración neuromuscular.
Polyneuropathy and myopathy, grouped under the term «intensive care unit-acquired weakness» (ICUAW), are neuromuscular pathologies to which patients in the intensive care unit (ICU) are susceptible. They are multifactorial pathologies, prolonged connection to a ventilator is one of the most common. The objective of this review was to identify the efficacy of different rehabilitative treatments in patients with ICUAW, and the relationship between ICUAW and a series of indicators.
MethodsA systematic review of the primary studies selected from the Medline, Scielo, Web of Science, Cochrane, Cuiden and Science Direct databases was carried out, following the guidelines of the PRISMA statement, by which the search protocol was established.
Results and conclusionsOf 161 articles, only 10 were selected to be part of this review, in which a total of 717 patients admitted to the ICU were studied. A statistically significant relationship was observed between ICUAW and failure in ventilator disconnection, mortality, increase in ICU stay and the time that the patients required mechanical ventilation. Moreover, all this improved in this type of patients with the application of a rehabilitation therapy. The use of corticosteroids, was not shown to be related to neuromuscular alteration.
Los diversos avances en los tratamientos aplicados a los pacientes ingresados en la Unidad de Cuidados Intensivos (UCI) han supuesto una mejora en el pronóstico y en la supervivencia de estos enfermos. Sin embargo, pueden producir enfermedades neuromusculares que los pacientes anteriormente no padecían. Estas tienen relación directa con largas estancias en las UCI, con la gravedad de las enfermedades por las que ingresaron y con el tratamiento empleado para combatirlas1.
Entre todas ellas, podemos encontrar una serie de problemas neurológicos que provocan una afectación del sistema nervioso periférico; de ellas, la polineuropatía del paciente crítico (PPC) es la más conocida y común, ya que pueden llegar a desarrollarla entre un 50 y un 80% de estos enfermos2. Aun así, existen dudas con respecto a su etiología, patología, pronóstico y tratamiento3. Esta alteración produce una degeneración de las vainas de mielina que puede hacer que se retarde la conducción de las señales nerviosas, mientras que, cuando ocurre en los axones o en la neurona completa, puede hacer que el nervio deje de funcionar. Todo ello produce una afectación de las fibras del músculo estriado debido a la denervación que sufren y que producen una serie de síntomas y signos en el paciente: disminución de la sensibilidad, debilidad muscular generalizada, dificultad para deglutir o respirar, espasmos musculares, disminución de los reflejos y neuralgias. Los músculos faciales suelen permanecer intactos, aunque también puede haber afectación de estos4.
En la actualidad, diversos autores utilizan el concepto «polineuromiopatía del paciente crítico», englobando en él los términos polineuropatía (PPC) y miopatía (MPC), otro tipo de afectación del sistema neuromuscular a nivel periférico en la que se produce una atrofia de las fibras musculares y una disminución del potencial de acción. Esto es debido a la dificultad de realizar exámenes neurológicos en los pacientes ingresados en UCI, a las similitudes entre las manifestaciones clínicas y a la frecuencia con la que se dan de manera simultánea3. En esta revisión sistemática, nosotros usamos el término «polineuromiopatía del paciente crítico» (PNMPC). Esta enfermedad tiene una etiología multifactorial: los factores más comunes que la provocan son la estancia prolongada en UCI, la sepsis, el fallo multiorgánico y la conexión al ventilador, que se traducen en fallos en la desconexión, un aumento del tiempo de tratamiento con ventilación mecánica (VM), alteraciones de la musculatura respiratoria y un aumento de la mortalidad a los 30 días. Otros factores como tratamientos con bloqueantes neuromusculares, corticoides, sedantes o relajantes aún están en controversia. Sin embargo, el control glucémico y la terapia de movilidad precoz han demostrado una reducción drástica de esta neuropatía4,5.
Durante la fase aguda de la enfermedad por la que estos pacientes ingresan en UCI, las manifestaciones de la PNMPC pueden encubrirse con el uso de relajantes musculares y sedantes. Generalmente, el personal sanitario que trabaja con pacientes críticos reconoce esta enfermedad por un importante cuadro de debilidad muscular que se manifiesta con la imposibilidad de desconectarlos del ventilador una vez resuelto el cuadro crítico por el que ingresaron. Hasta un 62% de estos pacientes muestran evidencia de disfunción neuromuscular lo suficientemente significativa como para explicar los fallos respiratorios persistentes de estos pacientes, que pueden iniciarse incluso a las 18 h del inicio de la VM4,6.
En estos casos, es de gran utilidad el uso de escalas de medición que nos ayuden a la hora de hacer un diagnóstico definitivo basado en la clínica del paciente. El método de valoración usado habitualmente en la práctica clínica es la escala de fuerza muscular modificada del Medical Research Council (MRC). Esta herramienta nos permite valorar la función de los músculos con una graduación del 0 al 5, donde el grado 0 se asignaría a una degeneración total, en la que no se detecta contracción activa a la palpación, mientras que los pacientes con grado 5 mantienen una fuerza normal y vencen la resistencia máxima aportada por el profesional sanitario. Además de esta, existen otros instrumentos de medición menos específicos, pero que también pueden ofrecernos información de la gravedad del paciente crítico, como la Escala APACHE II o el índice de Barthel6. La biopsia nerviosa no es esencial para el diagnóstico de esta afectación, pero se debe reconocer la necesidad de pruebas de imagen o electrofisiológicas (electromiogramas y estudios de conducción nerviosa sensitivo-motora) como complemento a la exploración neurológica cuando sea pertinente: nos es de utilidad para concretar si el problema es de origen central (intracraneal o medular) o periférico (neuromuscular)4,7.
Es necesario asegurarse de que no existía esta debilidad antes del ingreso y descartar traumatismos, síndrome de Guillain-Barré, distrofia muscular, miastenia grave, botulismo o síndrome de Eaton-Lambert, entre otros, para poder especificar los factores relacionados del problema y asignar un tratamiento acertado y preciso. Junto a ello, es imprescindible reconocer la gravedad del cuadro, ya que en los casos de afectación leve, la rehabilitación puede llevarse a cabo en semanas. A medida que el cuadro se agrava, el pronóstico funcional empeora y puede mantenerse una importante disminución de la movilidad y de la calidad de vida a los 2años8.
Varios ensayos clínicos proponen el aporte de suplementos nutricionales y antioxidantes, proteína C activada e inmunoglobulinas, pero ninguno ha resultado efectivo. El único tratamiento con el que se ha observado una disminución de complicaciones es la prevención, con énfasis en mantener un control estricto de los valores de glucemia a través del tratamiento insulínico, manejo precoz de la sepsis, reducción del tiempo de conexión paciente-ventilador, mediante la realización precoz de pruebas de respiración espontánea, prevención de complicaciones y rehabilitación temprana5,6.
El objetivo principal de esta revisión sistemática fue describir la eficacia de diferentes tratamientos rehabilitadores (terapia ocupacional y física, electroestimulación muscular, control euglucémico y movilización temprana) en pacientes con PNMPC. Además, como objetivo secundario nos planteamos describir la relación entre esta alteración neuromuscular y los días de estancia en UCI, el tiempo de conexión al ventilador y la tasa de fallos en la desconexión, el consumo de corticoides y la mortalidad.
Material y métodoSe ha llevado a cabo una revisión sistemática de estudios primarios en las bases de datos Medline, Scielo, Web of Science, Cochrane, Cuiden y Science Direct, siguiendo las directrices de la declaración PRISMA, a través de la cual se estableció el protocolo de búsqueda. La pregunta PICO a partir de la cual se definió el tema y se limitó la búsqueda fue: «En pacientes con PNMC ingresados en una Unidad de Cuidados Intensivos, ¿cuál es la eficacia de la aplicación de un tratamiento rehabilitador (terapia ocupacional y física, electroestimulación muscular, control euglucémico y movilización temprana) o no, en términos de estancia en UCI, tiempo de conexión y tasa de fallos en la desconexión al ventilador, consumo de corticoides y mortalidad?».
Se llevaron a cabo búsquedas adaptadas a las diferentes bases de datos utilizadas, usando los descriptores «polyneuropathies/polineuropatías», «myopathy/miopatía», «critical illness», mechanical ventilation», «early mobilization» e «intensive insuline treatment» combinándolos entre ellos con el operador booleano «and», todos ellos descritos en el tesauro DeCS, excluyendo del estudio la población pediátrica y neonatal («not child»). A continuación, se exponen las diferentes estrategias de búsqueda avanzada llevadas a cabo en cada una de las bases de datos (tabla 1).
Estrategias de búsqueda empleadas
| Base de datos | Estrategia de búsqueda |
|---|---|
| Medline | «(polyneuropathies OR myopathy) AND critical illness AND mechanical ventilation AND (early mobilization OR intensive insulin treatment) NOT child» |
| Scielo | «(polyneuropathies OR myopathy) and mechanical ventilation» |
| Web of Science | «(polyneuropathies OR myopathy) AND critical illness AND mechanical ventilation AND (early mobilization OR intensive insulin treatment)» |
| Cochrane | «(polineuropatía OR miopatía) AND ventilación mecánica» |
| Cuiden | «(polineuropathies OR myopathy) AND mechanical ventilation » |
| Science Direct | «(polyneuropathies OR myopathy) AND critical illness AND mechanical ventilation AND (early mobilization OR intensive insulin treatment)» |
Criterios de inclusión: Se incluyeron los estudios primarios publicados desde el 30/04/2009 hasta la fecha. Se limitó la búsqueda a estudios observacionales retrospectivos, prospectivos o ensayos clínicos a texto completo llevados a cabo en pacientes críticos ingresados en UCI, de edad >15 años, con VM y cuya variable resultado fuera el desarrollo de una polineuromiopatía.
Criterios de exclusión: Se excluyeron revisiones sistemáticas, artículos de opinión y metaanálisis y estudios que estuvieran publicados en idiomas distintos al inglés, español o portugués.
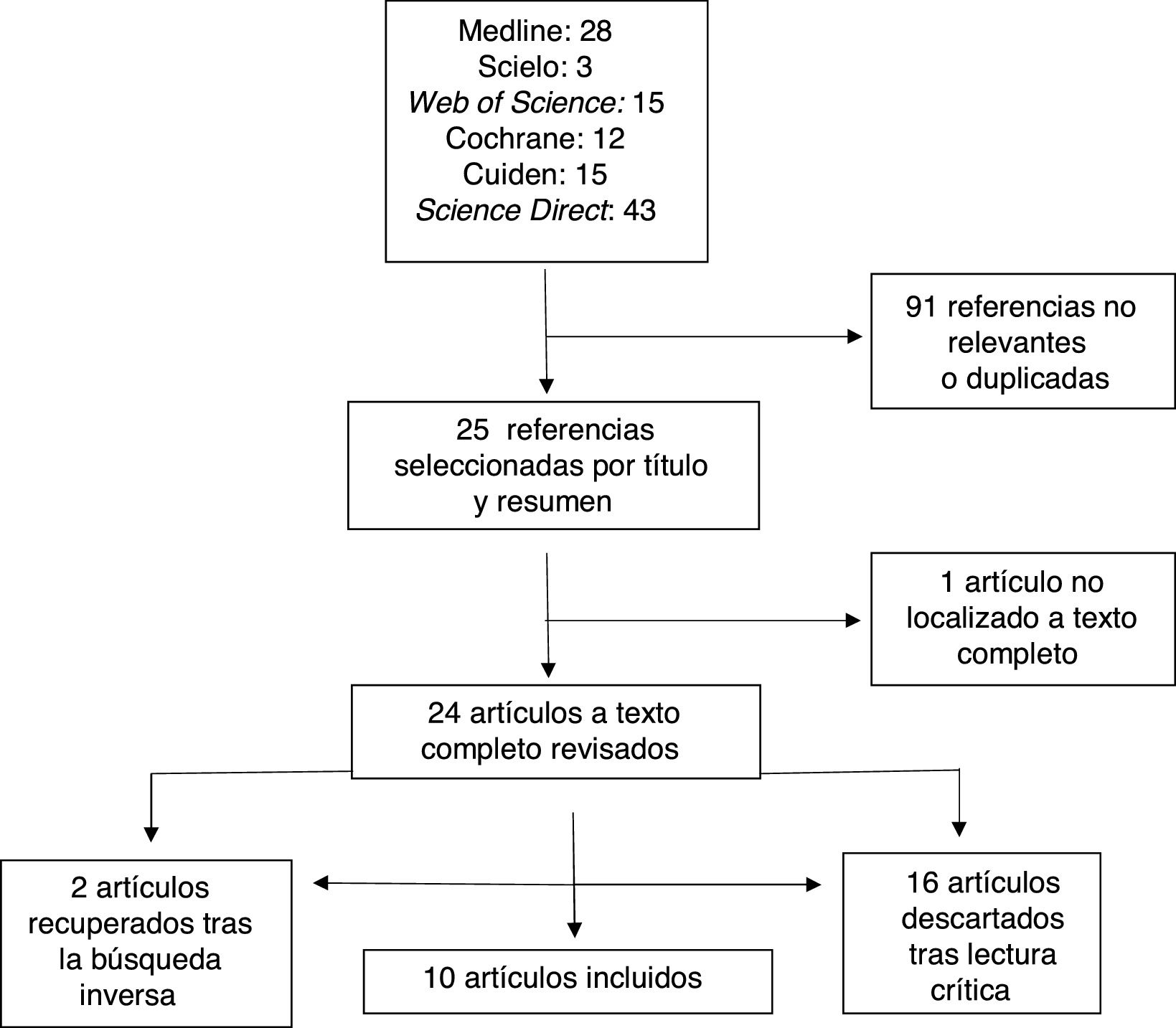
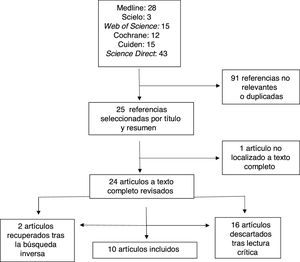
En total, se localizaron un total de 116 referencias bibliográficas en las diferentes bases electrónicas: 28 en Medline, 3 en Scielo, 15 en Web of Science, 12 en Cochrane, 15 en Cuiden y 43 en Science Direct. La primera selección de artículos se realizó por título y calidad del abstract, de los cuales se descartaron 91 referencias por no ser relevantes o estar duplicadas. En una segunda revisión se valoró metodológicamente siguiendo la plantilla CASPe9, con la finalidad de evaluar los posibles sesgos y descartar las referencias que no cumplieran los criterios de inclusión propuestos. Por ello, se excluyeron 16 artículos tras la lectura crítica (de los cuales, 13 eran revisiones sistemáticas) y uno que no estaba disponible a texto completo. Además, se recuperaron 2artículos mediante la búsqueda inversa, lo que nos ha permitido trabajar con un total de 10 artículos (fig. 1).
Todos los estudios tenían una validez interna buena o moderada. Se han clasificado según sus niveles de evidencia (NE) y grados de recomendación (GR) siguiendo la escala SIGN10. Se utilizó, además, el gestor bibliográfico Mendeley para referenciar la bibliografía, siguiendo las normas de Vancouver.
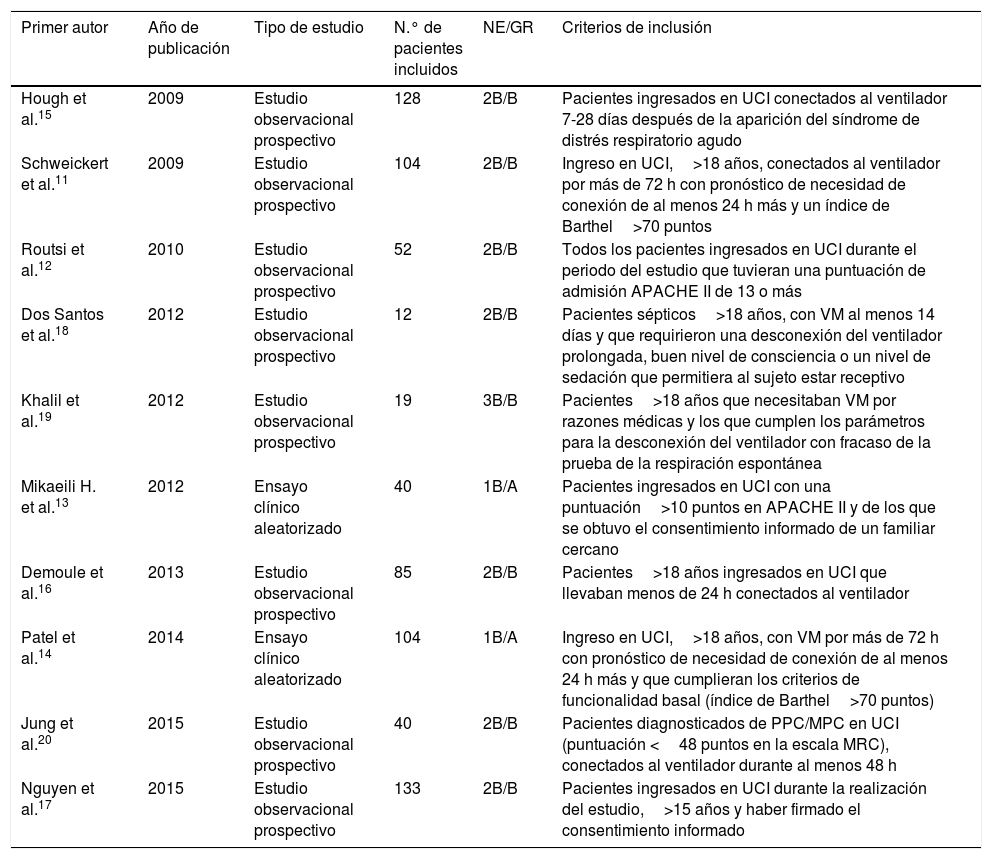
ResultadosFinalmente, el estudio se realizó con 10 artículos: 8 de ellos eran estudios observacionales prospectivos y 2 eran ensayos clínicos aleatorizados, con tamaños muestrales entre 12 y 133 participantes (tabla 2).
Estudios seleccionados y sus características
| Primer autor | Año de publicación | Tipo de estudio | N.° de pacientes incluidos | NE/GR | Criterios de inclusión |
|---|---|---|---|---|---|
| Hough et al.15 | 2009 | Estudio observacional prospectivo | 128 | 2B/B | Pacientes ingresados en UCI conectados al ventilador 7-28 días después de la aparición del síndrome de distrés respiratorio agudo |
| Schweickert et al.11 | 2009 | Estudio observacional prospectivo | 104 | 2B/B | Ingreso en UCI,>18 años, conectados al ventilador por más de 72 h con pronóstico de necesidad de conexión de al menos 24 h más y un índice de Barthel>70 puntos |
| Routsi et al.12 | 2010 | Estudio observacional prospectivo | 52 | 2B/B | Todos los pacientes ingresados en UCI durante el periodo del estudio que tuvieran una puntuación de admisión APACHE II de 13 o más |
| Dos Santos et al.18 | 2012 | Estudio observacional prospectivo | 12 | 2B/B | Pacientes sépticos>18 años, con VM al menos 14 días y que requirieron una desconexión del ventilador prolongada, buen nivel de consciencia o un nivel de sedación que permitiera al sujeto estar receptivo |
| Khalil et al.19 | 2012 | Estudio observacional prospectivo | 19 | 3B/B | Pacientes>18 años que necesitaban VM por razones médicas y los que cumplen los parámetros para la desconexión del ventilador con fracaso de la prueba de la respiración espontánea |
| Mikaeili H. et al.13 | 2012 | Ensayo clínico aleatorizado | 40 | 1B/A | Pacientes ingresados en UCI con una puntuación>10 puntos en APACHE II y de los que se obtuvo el consentimiento informado de un familiar cercano |
| Demoule et al.16 | 2013 | Estudio observacional prospectivo | 85 | 2B/B | Pacientes>18 años ingresados en UCI que llevaban menos de 24 h conectados al ventilador |
| Patel et al.14 | 2014 | Ensayo clínico aleatorizado | 104 | 1B/A | Ingreso en UCI,>18 años, con VM por más de 72 h con pronóstico de necesidad de conexión de al menos 24 h más y que cumplieran los criterios de funcionalidad basal (índice de Barthel>70 puntos) |
| Jung et al.20 | 2015 | Estudio observacional prospectivo | 40 | 2B/B | Pacientes diagnosticados de PPC/MPC en UCI (puntuación <48 puntos en la escala MRC), conectados al ventilador durante al menos 48 h |
| Nguyen et al.17 | 2015 | Estudio observacional prospectivo | 133 | 2B/B | Pacientes ingresados en UCI durante la realización del estudio,>15 años y haber firmado el consentimiento informado |
GR: grados de recomendación; MRC: Medical Research Council; NE: nivel de evidencia; UCI: Unidad de Cuidados Intensivos.
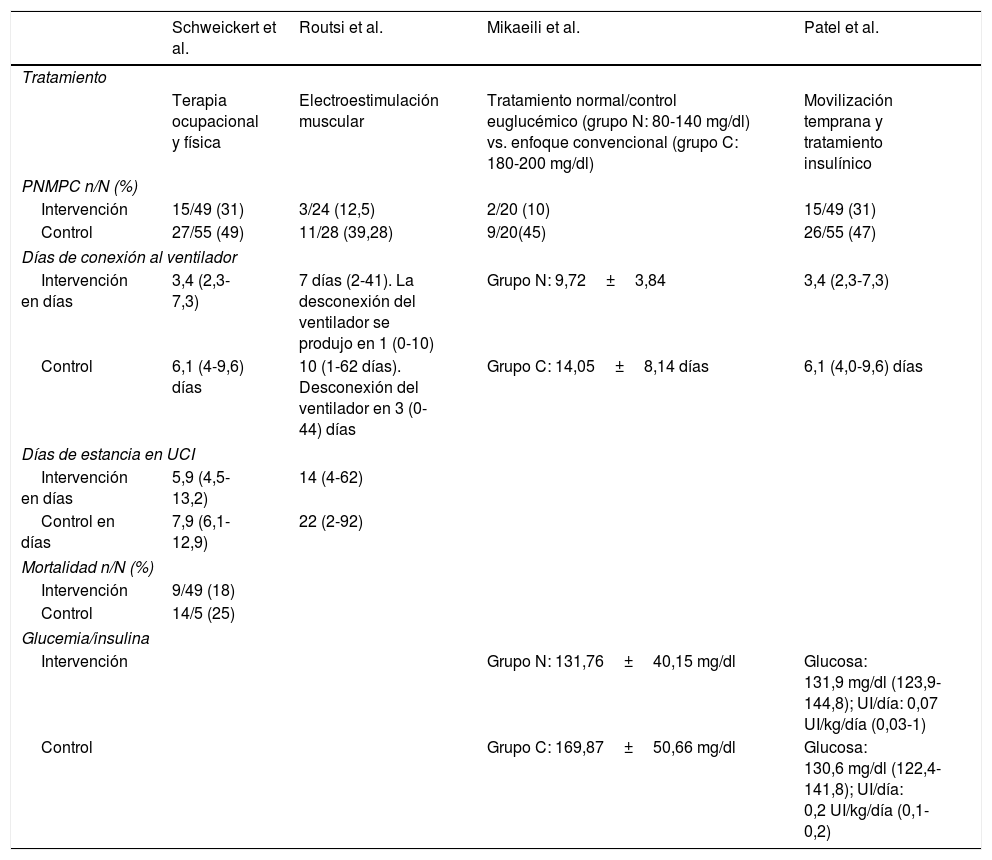
La metodología de los estudios elegidos se fundamentó en el análisis de la eficacia de diferentes tratamientos rehabilitadores en pacientes conectados al ventilador, comparando 2grupos: uno que recibía el tratamiento y otro que no, y observando la incidencia de la PNMPC en cada uno de ellos. Estos resultados se obtuvieron de 4artículos expuestos en la tabla 3.
Resultados de los diferentes tratamientos rehabilitadores y su relación con los diferentes indicadores
| Schweickert et al. | Routsi et al. | Mikaeili et al. | Patel et al. | |
|---|---|---|---|---|
| Tratamiento | ||||
| Terapia ocupacional y física | Electroestimulación muscular | Tratamiento normal/control euglucémico (grupo N: 80-140 mg/dl) vs. enfoque convencional (grupo C: 180-200 mg/dl) | Movilización temprana y tratamiento insulínico | |
| PNMPC n/N (%) | ||||
| Intervención | 15/49 (31) | 3/24 (12,5) | 2/20 (10) | 15/49 (31) |
| Control | 27/55 (49) | 11/28 (39,28) | 9/20(45) | 26/55 (47) |
| Días de conexión al ventilador | ||||
| Intervención en días | 3,4 (2,3-7,3) | 7 días (2-41). La desconexión del ventilador se produjo en 1 (0-10) | Grupo N: 9,72±3,84 | 3,4 (2,3-7,3) |
| Control | 6,1 (4-9,6) días | 10 (1-62 días). Desconexión del ventilador en 3 (0-44) días | Grupo C: 14,05±8,14 días | 6,1 (4,0-9,6) días |
| Días de estancia en UCI | ||||
| Intervención en días | 5,9 (4,5-13,2) | 14 (4-62) | ||
| Control en días | 7,9 (6,1-12,9) | 22 (2-92) | ||
| Mortalidad n/N (%) | ||||
| Intervención | 9/49 (18) | |||
| Control | 14/5 (25) | |||
| Glucemia/insulina | ||||
| Intervención | Grupo N: 131,76±40,15 mg/dl | Glucosa: 131,9 mg/dl (123,9-144,8); UI/día: 0,07 UI/kg/día (0,03-1) | ||
| Control | Grupo C: 169,87±50,66 mg/dl | Glucosa: 130,6 mg/dl (122,4-141,8); UI/día: 0,2 UI/kg/día (0,1-0,2) | ||
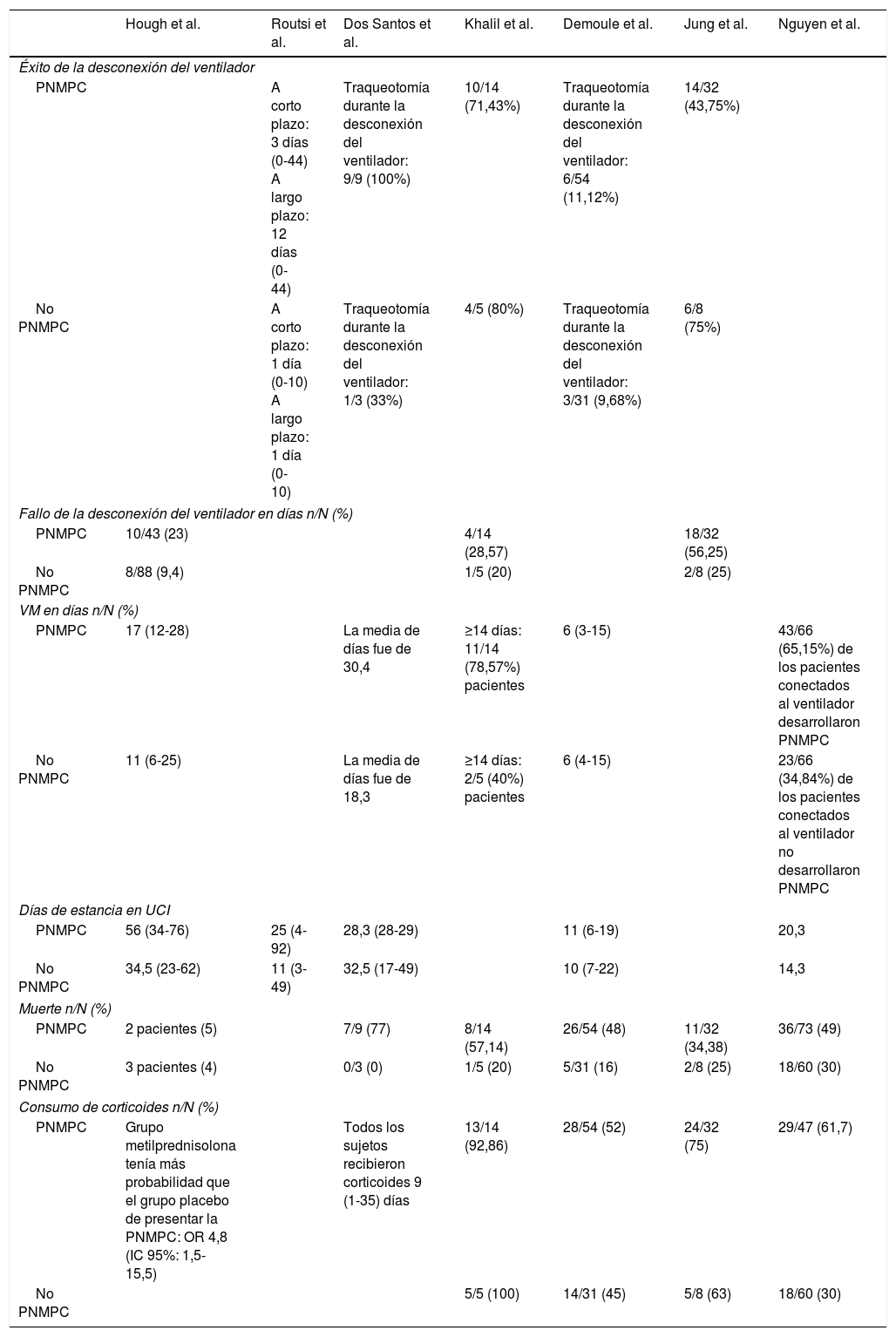
En 7 de los estudios se identificó la diferencia entre el éxito o el fracaso de la desconexión del paciente al ventilador, la necesidad o no de recibir VM y, en caso de ser necesario, su duración, además de los días de estancia en UCI, el consumo de corticoides y la mortalidad entre un grupo de pacientes que había desarrollado PNMPC y los que no, observando así la relación que pudiera existir entre estos (tabla 4).
Relación entre el desarrollo de PNMPC y los diferentes indicadores
| Hough et al. | Routsi et al. | Dos Santos et al. | Khalil et al. | Demoule et al. | Jung et al. | Nguyen et al. | |
|---|---|---|---|---|---|---|---|
| Éxito de la desconexión del ventilador | |||||||
| PNMPC | A corto plazo: 3 días (0-44) A largo plazo: 12 días (0-44) | Traqueotomía durante la desconexión del ventilador: 9/9 (100%) | 10/14 (71,43%) | Traqueotomía durante la desconexión del ventilador: 6/54 (11,12%) | 14/32 (43,75%) | ||
| No PNMPC | A corto plazo: 1 día (0-10) A largo plazo: 1 día (0-10) | Traqueotomía durante la desconexión del ventilador: 1/3 (33%) | 4/5 (80%) | Traqueotomía durante la desconexión del ventilador: 3/31 (9,68%) | 6/8 (75%) | ||
| Fallo de la desconexión del ventilador en días n/N (%) | |||||||
| PNMPC | 10/43 (23) | 4/14 (28,57) | 18/32 (56,25) | ||||
| No PNMPC | 8/88 (9,4) | 1/5 (20) | 2/8 (25) | ||||
| VM en días n/N (%) | |||||||
| PNMPC | 17 (12-28) | La media de días fue de 30,4 | ≥14 días: 11/14 (78,57%) pacientes | 6 (3-15) | 43/66 (65,15%) de los pacientes conectados al ventilador desarrollaron PNMPC | ||
| No PNMPC | 11 (6-25) | La media de días fue de 18,3 | ≥14 días: 2/5 (40%) pacientes | 6 (4-15) | 23/66 (34,84%) de los pacientes conectados al ventilador no desarrollaron PNMPC | ||
| Días de estancia en UCI | |||||||
| PNMPC | 56 (34-76) | 25 (4-92) | 28,3 (28-29) | 11 (6-19) | 20,3 | ||
| No PNMPC | 34,5 (23-62) | 11 (3-49) | 32,5 (17-49) | 10 (7-22) | 14,3 | ||
| Muerte n/N (%) | |||||||
| PNMPC | 2 pacientes (5) | 7/9 (77) | 8/14 (57,14) | 26/54 (48) | 11/32 (34,38) | 36/73 (49) | |
| No PNMPC | 3 pacientes (4) | 0/3 (0) | 1/5 (20) | 5/31 (16) | 2/8 (25) | 18/60 (30) | |
| Consumo de corticoides n/N (%) | |||||||
| PNMPC | Grupo metilprednisolona tenía más probabilidad que el grupo placebo de presentar la PNMPC: OR 4,8 (IC 95%: 1,5-15,5) | Todos los sujetos recibieron corticoides 9 (1-35) días | 13/14 (92,86) | 28/54 (52) | 24/32 (75) | 29/47 (61,7) | |
| No PNMPC | 5/5 (100) | 14/31 (45) | 5/8 (63) | 18/60 (30) | |||
Por ello, como se puede observar en las tablas 3 y 4, la totalidad de los resultados del estudio se derivan de 2puntos de vista diferentes pero complementarios: por un lado, la afectación que produce la PNMPC y su relación con los diferentes indicadores hospitalarios y, por otro, la efectividad de un tratamiento rehabilitador a la hora de desarrollarlas o no.
Descripción de los resultados de los estudiosCuatro artículos11-14 midieron la eficacia de tratamientos rehabilitadores en pacientes críticos con VM que estaban ingresados en UCI. Su objetivo era valorar cuáles eran las diferencias entre el grupo al que se le aplicó el tratamiento y el grupo al que no. Estos tratamientos fueron: terapia ocupacional y física, electroestimulación muscular, control euglucémico y movilización temprana. En general, todos los artículos aportaron resultados que respaldan su ejecución, ya que disminuyó de forma significativa la incidencia de pacientes con PNMPC, el tiempo de conexión al ventilador, la estancia en UCI y la mortalidad en aquellos que formaban parte del grupo intervención.
En el ensayo de Mikaeili et al.13 y Patel et al.14 utilizaron, además, la administración de insulina y la medición de la glucemia como indicadores. En el primero13, la terapia consistía en el mantenimiento de glucemias entre 80 y 140mg/dl a uno de los grupos y, en el segundo14, los autores estudiaron la eficacia de la movilización temprana y el control glucémico. En ambos se redujo significativamente la incidencia de PNMPC y el tiempo de conexión al ventilador.
Por otra parte, los pacientes que desarrollaron PNMPC mostraron una estancia media superior en la UCI, diferencias que fueron estadísticamente significativas12,15,16,17. Sin embargo, Santos et al.18 encontraron que los pacientes que no desarrollaron ninguna alteración neuromuscular habían tenido una estancia ligeramente superior a los afectados por la neuropatía, pero la relación entre estas no fue significativa.
Por otro lado, se ha encontrado en los sujetos con PNMPC una duración de la conexión al ventilador superior15,17-19, con diferencias estadísticamente significativas excepto en el estudio de Khalil et al.19. Sin embargo, en el estudio llevado a cabo por Demoule et al.16 se mostró que la media de días en ambos grupos fue la misma.
En cuanto al fallo en la desconexión al ventilador en los pacientes, los sujetos que desarrollaron PNMPC realizaron una desconexión exitosa más tardía, fallida en un mayor número de ocasiones, con un aumento de las complicaciones12,15,18,19,20. Estas diferencias fueron estadísticamente significativas en los estudios de Hough et al.15, Routsi et al.12 y Santos et al.18. Además, Santos et al.18 observaron que estos pacientes requerían con mayor frecuencia de una traqueotomía frente a los que no presentaban ningún tipo de alteración neuromuscular.
La relación existente entre la administración de corticoides y la incidencia de PNMPC en los pacientes críticos es un tema en el que aún existe controversia. La mayoría de los autores15,16,17,20 observaron una mayor incidencia de PNMPC en los pacientes que recibían tratamiento con corticoides, a excepción de Khalil et al.19, quienes encontraron una relación inversa. Esta asociación no fue estadísticamente significativa en ninguno de los estudios.
Por último, en todos los ensayos incluidos7,15,17-19,20 se puede observar una mayor mortalidad en los pacientes con PNMPC. Esta relación fue estadísticamente significativa en todos ellos, excepto en los ensayos de Hough et al.15 y Jung et al.20.
DiscusiónEn las últimas décadas ha aumentado notablemente el número de artículos que relacionan los pacientes ingresados en UCI con PNMPC, por ello, los resultados de este trabajo se han comparado con los obtenidos por otros autores en sus artículos y se ha obtenido concordancia entre ellos.
En sus artículos, Medica et al.21, McWilliams et al.22 y Needham et al.23 también demostraron efectividad en los diferentes tratamientos rehabilitadores en este tipo de pacientes.
De Jonghe et al.24 y Busico et al.25 calificaron la PNMPC como un factor de riesgo para el aumento de complicaciones a la hora de desconectar al paciente del ventilador y un aumento del tiempo que el paciente recibía VM (p<0,05). Otros como Garnacho-Montero et al.26 coinciden con los de nuestra revisión, ya que, en esta, el autor relaciona directamente presentar esta la alteración con una estancia más larga en la UCI y en el hospital. Con respecto a la administración de corticoides, Wilcox et al.27 y Zorowitz et al.28 obtuvieron unos resultados similares a los encontrados: los pacientes a los que se les administraron corticoides tenían una incidencia mayor de PNMPC, aunque la relación entre ambos indicadores no fue estadísticamente significativa. Por último, Hermans et al.29 encontraron relación entre un aumento de mortalidad y esta dolencia.
Estos resultados tienen diferentes implicaciones para el ejercicio profesional, al alertar al personal sanitario en el diagnóstico y en la necesidad del tratamiento precoz en este tipo de pacientes: además de disminuir la posibilidad de desarrollar la PNMPC, suponen una disminución de la necesidad de cuidados hospitalarios y del tiempo de hospitalización, lo que reduce, a su vez, el coste sanitario por paciente.
Como conclusión, se pone de manifiesto que la aplicación de un tratamiento rehabilitador (terapia ocupacional y física, electroestimulación muscular, control euglucémico y movilización temprana) mejora el estado general de ese tipo de pacientes, disminuye la incidencia de PNMPC, el tiempo de conexión al ventilador, los días de estancia en UCI y la mortalidad. Además, esta alteración neuromuscular es una complicación común de la enfermedad crítica asociada a debilidad muscular y a todos los indicadores estudiados excepto al uso de corticoides, que no ha demostrado tener relación con el desarrollo de esta alteración.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.