La contaminación de hemocultivos puede ocurrir desde la extracción al procesamiento, y su tasa no debería exceder del 3%.
ObjetivoEvaluar el impacto de una acción formativa sobre la tasa de hemocultivos contaminados tras la instauración de recomendaciones de extracción de muestras basadas en la mejor evidencia.
MétodoEstudio prospectivo antes-después en una unidad de cuidados intensivos polivalente de 18 camas. Se establecieron dos fases (enero-junio 2012, octubre 2012-octubre 2015) con un período formativo entre ellas. Principales recomendaciones: técnica estéril, mascarilla quirúrgica, doble desinfección de piel (alcohol 70° y clorhexidina alcohólica 2%), desinfección con alcohol 70° de tapones de frascos de cultivo e inyección de muestras sin cambiar aguja. Incluidos todos los hemocultivos de pacientes con solicitud facultativa de extracción. Variables: demográficas, gravedad, patología, motivo de ingreso, estancia y resultados de hemocultivos (negativo, positivo y contaminado). Estadística descriptiva básica: media (desviación estándar), mediana (rango intercuartílico) o porcentaje (intervalo de confianza del 95%). Calculadas tasas de contaminación por 100 hemocultivos extraídos. Análisis bivariado entre períodos.
ResultadosIncluidos 458 pacientes. Extraídos 841 hemocultivos, 33 de ellos contaminados. En las variables demográficas, gravedad, diagnóstico y estancia en pacientes con contaminación de la muestra, no se observaron diferencias con no contaminados. Tasas de contaminación pre-formación vs post-formación: 14 vs 5,6 por 100 hemocultivos extraídos (p=0,00003).
ConclusiónUna acción formativa basada en la evidencia ha reducido la contaminación de las muestras. Es necesario seguir trabajando en la planificación de actividades y cuidados para mejorar la detección de contaminantes y prevenir la contaminación de las mismas.
Blood culture contamination can occur from extraction to processing; its rate should not exceed 3%.
ObjectiveTo evaluate the impact of a training programme on the rate of contaminated blood cultures after the implementation of sample extraction recommendations based on the best evidence.
MethodProspective before-after study in a polyvalent intensive care unit with 18 beds. Two phases were established (January-June 2012, October 2012-October 2015) with a training period between them. Main recommendations: sterile technique, surgical mask, double skin disinfection (70° alcohol and 2% alcoholic chlorhexidine), 70° alcohol disinfection of culture flasks and injection of samples without changing needles. Including all blood cultures of patients with extraction request. Variables: demographic, severity, pathology, reason for admission, stay and results of blood cultures (negative, positive and contaminated). Basic descriptive statistics: mean (standard deviation), median (interquartile range) and percentage (95% confidence interval). Calculated contamination rates per 100 blood cultures extracted. Bivariate analysis between periods.
ResultsFour hundred and eight patients were included. Eight hundred and forty-one blood cultures were taken, 33 of which were contaminated. In the demographic variables, severity, diagnosis and stay of patients with contaminated samples, no differences were observed from those with uncontaminated samples. Pre-training vs post-training contamination rates: 14 vs 5.6 per 100 blood cultures extracted (P=.00003).
ConclusionAn evidence-based training programme reduced the contamination of samples. It is necessary to continue working on the planning of activities and care to improve the detection of pollutants and prevent contamination of samples.
La incidencia de hemocultivos falsos positivos debido a su contaminación en el momento de la extracción es un problema frecuente. Este se asocia a un aumento en los costes, constituye un factor de confusión para los clínicos, conlleva la administración inapropiada de antibióticos, pruebas adicionales y aumento de la estancia hospitalaria.
La contaminación de las muestras puede deberse a múltiples factores, que comprenden desde una técnica incorrecta de extracción, momento inapropiado de la misma e incluso el estado mental alterado del paciente, que se presenta poco colaborador y dificulta la obtención de la muestra.
Qué se aportaRecomendaciones basadas en la mejor evidencia disponible para la extracción de este tipo de muestras. Su difusión y la consiguiente formación del personal de enfermería han conseguido reducir la incidencia de hemocultivos falsos positivos en nuestra cohorte de pacientes.
Implicaciones del estudioEnriquece la investigación sobre el efecto de las acciones formativas en enfermeras y cómo influyen directa o indirectamente en la administración de cuidados de calidad.
Desde los años cuarenta del siglo xx, la extracción de hemocultivos en pacientes febriles es una práctica consolidada1. La presencia de bacterias u hongos en sangre se detecta por su aislamiento en los hemocultivos, que constituyen las muestras que con más frecuencia se procesan en los laboratorios de microbiología. En nuestro servicio, en 2015, supuso el mayor porcentaje de muestras extraídas (31%). Los objetivos de su extracción son, además de facilitar el diagnóstico de bacteriemia o fungemia, determinar una terapia específica y proporcionar valor pronóstico2. Una de las principales limitaciones para el diagnóstico es que no existe un gold standard apropiado para diferenciar los hemocultivos verdaderos positivos de los falsos positivos o hemocultivos contaminados3-9.
La contaminación puede ocurrir en cualquier fase del proceso, pero se señala una desinfección inadecuada y una técnica pobre como causa primaria de falso positivo10. Otras causas serían una solicitud poco restrictiva de la prueba, momento inapropiado de extracción, estado mental alterado del paciente o premura en la administración de dosis iniciales de antibióticos3-10. La contaminación se asocia a un aumento en los costes11-16, constituye un factor de confusión para los clínicos, conlleva administración inapropiada de antibióticos, pruebas adicionales y aumento de la estancia hospitalaria17,18. De acuerdo con la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica19, la American Society for Microbiology y el Clinical Laboratory Standards Institute20,21, la tasa de contaminación no debería exceder del 3%.
En nuestra unidad de cuidados intensivos se realizó en 200322 un estudio sobre utilización y rendimiento de hemocultivos, donde también se valoraba el grado de contaminación, que en ese momento era del 6%. En 2012, durante los meses de enero a junio, observamos una contaminación del 8% en 158 hemocultivos, dato que superaba nuestra tasa de 2003 y el estándar aceptado para este tipo de muestras.
Debido a la variabilidad observada en la técnica de extracción de hemocultivos, se elaboró una guía con las recomendaciones basadas en la mejor evidencia disponible para este procedimiento. Una vez elaborada la guía, nos planteamos realizar un estudio con el objetivo de evaluar el impacto de una acción formativa, basada en las recomendaciones, sobre la tasa de hemocultivos contaminados.
MetodologíaEstudio cuasi-experimental antes-después desarrollado en una unidad de cuidados intensivos (UCI) polivalente, de 18 camas, de un hospital universitario de tercer nivel.
El equipo investigador estaba constituido por 8 enfermeras de la unidad, un facultativo especialista en microbiología, dos médicos internos residentes de medicina intensiva y un facultativo especialista en medicina intensiva.
Se establecieron dos fases en el estudio, con un período de formación entre ellas. Fasei (pre-formación) de enero a junio de 2012. Formación: de julio a septiembre de 2012. Faseii (post-formación) de octubre de 2012 a octubre de 2015.
Se incluyeron todos los hemocultivos extraídos, por indicación médica, a los enfermos ingresados en la UCI en los periodos de estudio. No se incluyó a pacientes menores de edad ni embarazadas. Los médicos solicitantes fueron ajenos a la recogida de datos y la decisión de la extracción de los hemocultivos fue única y exclusivamente debida a la situación clínica del paciente. La extracción de hemocultivos siempre se realizó por punción directa.
La clasificación de los hemocultivos se realizó, de forma independiente, por los médicos de cuidados intensivos del equipo investigador, estableciendo las tasas de hemocultivos positivos y contaminados durante todo el estudio. En caso de discrepancia se decidió conjuntamente.
Fase i. Pre-formaciónSe recogieron las variables relacionadas con la extracción de hemocultivos (las referidas en el apartado «Variables recogidas en ambas fases»), los resultados de los mismos, y se calculó la tasa de incidencia de falsos positivos.
Simultáneamente se elaboró una guía (Anexo 1) de extracción de hemocultivos basado en el «Manual de Recogida de Muestras del Laboratorio de Microbiología» del hospital y en las aportaciones realizadas por el equipo investigador en base a la mejor evidencia hallada.
La búsqueda bibliográfica se realizó utilizando las plataformas Pubmed y Ovid, además de buscadores generales no específicos. La búsqueda se realizó con las siguientes palabras clave (en inglés y castellano): hemocultivo, cuidados intensivos, extracción de hemocultivos, contaminación de hemocultivos, bacteriemia, falsa bacteriemia, bacteriemia relacionada con catéter, coste, efectividad y rendimiento de hemocultivos. Entre los artículos seleccionados se encontraban revisiones con metaanálisis y artículos de «buenas prácticas».
Tras la fase i, una vez elaborada la guía, las enfermeras del equipo investigador realizaron las sesiones necesarias, en turnos de mañana, tarde y noche, explicando el procedimiento de extracción y procesamiento de los hemocultivos. Se llevó a cabo un registro de todas las enfermeras y auxiliares de enfermería que realizaban la formación, con el fin de asegurar que todas recibían la docencia. Además de las sesiones de enfermería, se realizaron pósteres, que fueron colocados en las unidades, con los puntos principales a tener en cuenta en la extracción de las muestras. La guía se incluyó también en los ordenadores del servicio para que fuera accesible a todos los trabajadores de las unidades.
Las principales modificaciones con respecto a la guía de extracción previa se correspondían con la realización del procedimiento con técnica y campo estéril, uso de mascarilla quirúrgica, doble desinfección de la piel con alcohol de 70° y clorhexidina alcohólica al 2%, desinfección con alcohol de 70° de los tapones de caucho de los frascos de cultivo e inyección de las muestras en los frascos de cultivo sin cambiar de aguja y por la misma persona que realiza la punción (extractor), mientras que el asistente retira el compresor si procede y presiona el punto de punción.
Fase ii. Post-formaciónTras la formación del personal e instauración de las recomendaciones, se inició la segunda fase de estudio.
Durante esta fase, y hasta la finalización del estudio, el equipo investigador fue informando mensualmente de las tasas de contaminación a todo el equipo de enfermería.
Variables recogidas en ambas fasesSe recogieron variables demográficas de los pacientes (edad y sexo), gravedad al ingreso en la UCI estimada por Simplified Acute Physiologic ScoreII (SAPSII), patología que ocasionó el ingreso, estancia y resultados de los hemocultivos (hemocultivo negativo, positivo, contaminado).
Definiciones de variables23- •
Hemocultivo positivo: aislamiento, en al menos un set, de alguno de los siguientes microorganismos: cocos grampositivos diferentes de Staphylococcus coagulasa-negativo, bacilos gramnegativos u hongos. También se considera positivo cuando en los dos sets se aísla Staphylococcus coagulasa-negativo y el paciente presenta clínica compatible con bacteriemia.
- •
Hemocultivo contaminado: cuando se aísla en un solo set Staphylococcus coagulasa-negativo, Bacillus spp. (excepto Bacillus anthracis), Propionebacterium spp, Streptococcus del grupo viridans, Aerococcus spp., Micrococcus spp. o Corynebacterium spp.
Cuando se indicó la extracción de hemocultivos, se recogieron dos sets por paciente (4 frascos). El volumen de muestra recomendado, según las características técnicas del producto, es de 8-10ml, aunque en las indicaciones del fabricante se contempla la posibilidad de utilizar volúmenes de muestra de solo 3ml24. Cada muestra de sangre se inoculó en dos frascos BACTEC aerobic y BACTEC anaerobic y se enviaron al Laboratorio de Microbiología para su incubación en el sistema BD BACTEC™ FX (Becton Dickinson Diagnostics, Sparks, MD) durante un periodo de 5días.
Los sets empleados contienen los siguientes ingredientes reactivos en composiciones específicas para aerobios y anaerobios: agua tratada, caldo digerido de soja-caseína, extracto de levadura, digerido de tejido animal, aminoácidos, azúcar, citrato sódico, polianetosulfonato de sodio, vitaminas, antioxidantes/reductores, resina absorbente no iónica (13,4% para aerobios y 16% para anaerobios) y resina de intercambio catiónico (0,9% para aerobios y 1% para anaerobios). Todos los medios BACTEC se suministran con CO2 añadido, los medios anaerobios se prerreducen y se dispensan con CO2 y N2.
A todas las botellas de hemocultivos detectadas como positivas se les realizó la tinción de Gram, se sembraron en los medios de cultivos de agar sangre, agar chocolate, agar McConckey y agar Brucella (bioMérieux) y se incubaron a 35°C. Los hemocultivos positivos con tinción gramnegativa se reintrodujeron en el equipo para completar sus 5 días de incubación.
La identificación de los microorganismos directamente del hemocultivo positivo se realizó por métodos convencionales: paneles de MicroScan (Micro-Scan Systems, Siemens, Renton, WA, EE.UU.), tiras de API (bioMérieux, Marcy l’Etoile, Francia) y pruebas bioquímicas. Desde septiembre de 2015 la identificación de los aislados se realizó con Maldi-Tof (Bruker Daltonics, Bremen, Alemania). También se realizaron pruebas de sensibilidad por el método de disco difusión con antibióticos seleccionados según el tipo de microorganismo, utilizando para todo ello, como inóculo, gotas de caldo extraídas del frasco de hemocultivo.
AnálisisSe realizó una estadística descriptiva básica, expresando los resultados como media (desviación estándar), mediana (rango intercuartílico) o porcentaje, según corresponda. Se calcularon las tasas de contaminación por 100 hemocultivos extraídos. Las comparaciones entre períodos se realizaron mediante la t de Student o la U de Mann Whitney según normalidad. Fue considerado un nivel de significación estadístico con p<0,05. Se utilizaron los programas estadísticos SPSS 17.0 y Stata 14.0.
Consideraciones éticasEl estudio fue aprobado por el Comité de Ética e Investigación Clínica del hospital, no considerando necesario solicitar el consentimiento informado, prevaleciendo el criterio de respeto hacia la dignidad del sujeto y a la protección de sus datos, derechos y bienestar.
El procedimiento seguido está conforme a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki25.
Se siguieron las recomendaciones recogidas en el Convenio de Oviedo de 1997, la Ley 15/1999 de regulación del tratamiento automatizado de los datos de carácter personal y la Ley 41/2002 de autonomía del paciente.
ResultadosSe formó a un total de 126 profesionales de enfermería, de los cuales 73 eran enfermeras y 53 auxiliares de enfermería. Estos 126 profesionales constituían la totalidad de la plantilla y eventuales.
Se incluyeron en el estudio 540 pacientes que generaron 584 ingresos: en la fase pre-formación 82 pacientes, y 458 en la fase post-formación.
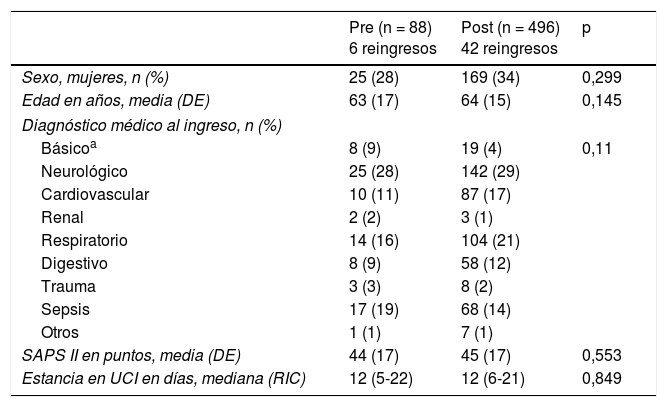
No se han observado diferencias significativas en cuanto a las variables demográficas, gravedad, patología que motivó el ingreso y días de estancia en la UCI entre los dos periodos (tabla 1).
Características de los ingresos en ambos períodos
| Pre (n = 88) 6 reingresos | Post (n = 496) 42 reingresos | p | |
|---|---|---|---|
| Sexo, mujeres, n (%) | 25 (28) | 169 (34) | 0,299 |
| Edad en años, media (DE) | 63 (17) | 64 (15) | 0,145 |
| Diagnóstico médico al ingreso, n (%) | |||
| Básicoa | 8 (9) | 19 (4) | 0,11 |
| Neurológico | 25 (28) | 142 (29) | |
| Cardiovascular | 10 (11) | 87 (17) | |
| Renal | 2 (2) | 3 (1) | |
| Respiratorio | 14 (16) | 104 (21) | |
| Digestivo | 8 (9) | 58 (12) | |
| Trauma | 3 (3) | 8 (2) | |
| Sepsis | 17 (19) | 68 (14) | |
| Otros | 1 (1) | 7 (1) | |
| SAPS II en puntos, media (DE) | 44 (17) | 45 (17) | 0,553 |
| Estancia en UCI en días, mediana (RIC) | 12 (5-22) | 12 (6-21) | 0,849 |
DE: desviación estándar; RIC: rango intercuartílico; SAPS II: Simplified Acute Physiologic Score II.
Respecto a las muestras extraídas, se obtuvieron un total de 999 hemocultivos, de los cuales 158 fueron extraídos en la fase de pre-formación y 841 en la fase post-formación. La tasa de contaminación (falsos positivos) de la fase pre-formación fue de 14 por cada 100 hemocultivos extraídos vs 5,6 por cada 100 hemocultivos extraídos en la fase post-formación (p=0,00003).
La gravedad de los pacientes con falsos positivos de ambos períodos no resultó significativa (SAPSII, media [DE]: 42 [14] vs 42 [15], p=0,96). Tampoco resultó significativa los días de estancia en la UCI (mediana [RIC]: 13 [5-37] vs 17 [9-31], p=0,44).
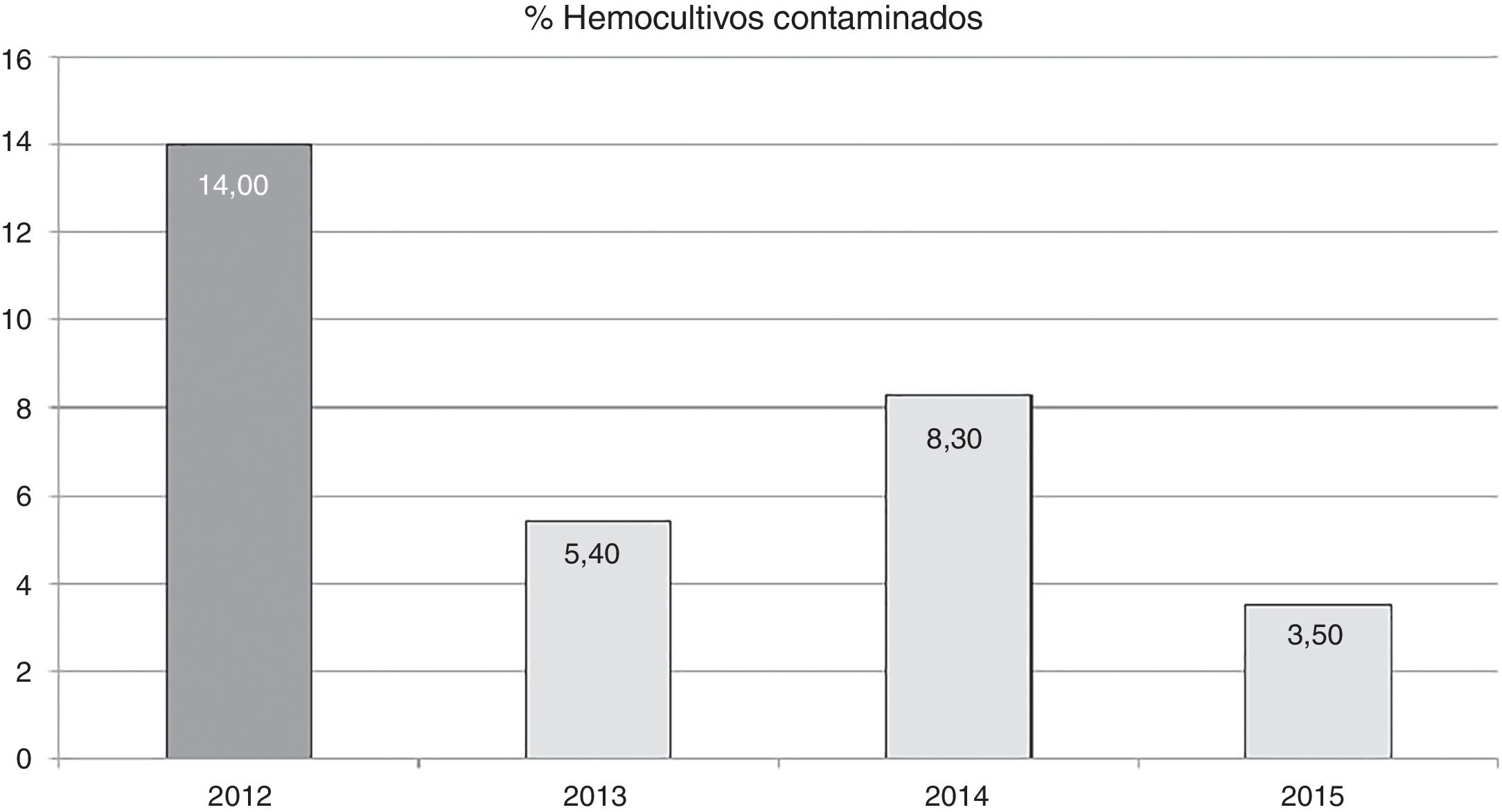
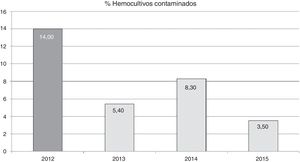
El efecto de la formación en las tasas de contaminación anuales se puede observar en la figura 1. Podemos observar como tras la actividad formativa, las tasas disminuyen de 14 por cada 100 hemocultivos extraídos a 5,4 por cada 100 hemocultivos extraídos en 2013. Esta tasa aumenta al año siguiente, pero disminuye en 2015 hasta 3,5 por cada 100 hemocultivos extraídos.
DiscusiónEn nuestro estudio el principal hallazgo es la reducción de la tasa de hemocultivos falsos positivos o contaminados tras una acción formativa en base a la mejor evidencia disponible.
La reducción en la tasa de contaminación de hemocultivos, tras la actividad formativa, fue del 62% en el primer año (año 2013). La tasa aumentó en el año 2014 con respecto al año anterior, aunque sin superar la tasa pre-formación (fig. 1). Es posible que este hecho fuera por relajación en la aplicación de las recomendaciones, ya que se corrigió (hasta 3,5 por 100 hemocultivos en 2015) tras informar al personal de enfermería sobre el aumento en la tasa e insistir en la importancia del cumplimiento de las recomendaciones. Esto podría demostrar que la vigilancia continuada de las tasas nos puede alertar sobre la correcta aplicación de las medidas recomendadas y corregir una trayectoria no deseada.
Es difícil comparar nuestros resultados con otros encontrados en la literatura, debido a la heterogeneidad en el procedimiento de extracción y en el origen de la muestra. Las muestras de este estudio siempre se obtuvieron por punción directa, mientras que en otros estudios26,27 no se especifica el origen de la muestra (punción o a través de catéter).
Presentamos valores superiores a los obtenidos por Mimoz et al.26 (1,4%), estudio donde se realizaba la comparación entre dos antisépticos, la povidona yodada y una solución alcohólica de gluconato de clorhexidina al 0,5%, obteniendo mejores valores con este último antiséptico. En este estudio no se especifica el procedimiento de extracción empleado. Septimus et al.27 introducen el baño de clorhexidina como variable más importante para reducir la contaminación de la muestra, obteniendo una tasa del 3,3% en uno de los grupos considerados y que más se asemeja a nuestra cohorte. No obstante, en este estudio no se especifica si la muestra era obtenida por punción o extraída a través de catéter, lo que consideramos una importante limitación del mismo.
En lo relativo a otros estudios14,15,28-31 realizados en pacientes críticos, los resultados son similares a los nuestros, mostrando tasas de contaminación entre el 3,5%31 y el 4%14,15. Alahmadi et al.15 contemplan específicamente el efecto de una acción formativa sobre la tasa de contaminación de hemocultivos, que aun permaneciendo por encima del estándar, supuso una reducción del 9 al 4%.
Si nos comparamos con el estudio22 realizado en nuestra unidad en 2003, que no valoraba el efecto de una acción formativa pero que estimó la tasa de falsos positivos, la reducción en la tasa de contaminación ha sido considerable en 2015 (6% vs 3,5%), aunque seguimos estando por encima del estándar establecido por las sociedades científicas.
Por otro lado, la contaminación de las muestras tiene un coste económico, que Alahmadi et al.14 en 2011 calcularon teniendo en cuenta gastos directos e indirectos, superiores a 5.000libras (unos 5.777euros) por hemocultivo contaminado. Si tomamos este valor como referencia, teniendo en cuenta que estamos hablando de dos sistemas sanitarios diferentes, reducir la contaminación del 8 al 3,5% en nuestro servicio, hipotéticamente, habría supuesto un ahorro de 218.630euros.
Además del coste económico, podríamos hablar de mejoras cualitativas, como la reducción del sufrimiento del paciente y el incremento en la excelencia de los cuidados, algo que no se ha valorado en este estudio y que podría constituir una limitación del mismo.
Entre las limitaciones relacionadas con la actividad formativa, no se evaluaron las competencias adquiridas con la formación, pero el descenso de las tasas podríamos considerarlo como un indicador indirecto de la capacitación de los profesionales, como así es confirmado por otros estudios32,33 que han mostrado el efecto positivo de una intervención educativa sobre el descenso de la contaminación de este tipo de muestras.
Garcia et al.34, en su revisión de «buenas prácticas», incluyen estudios que contemplan la implementación de procesos de retroalimentación, asociados o no a intervenciones de reentrenamiento del personal responsable de la extracción de muestras. En nuestro estudio la acción formativa no contemplaba esta retroalimentación y al personal responsable de la extracción no se le comunicó si la muestra extraída resultó contaminada o no, un aspecto a tener en cuenta en próximos estudios, pues como indica la evidencia publicada, puede tener cierta relevancia.
Finalmente, consideramos que la limitación más importante se encuentra en el volumen de extracción de muestra, que por no formar parte de la práctica habitual, no se registró. Estudios como los de Cockerill et al.35, Bouza et al.36, Lee et al.37 y Patel et al.38 determinaron que a mayor volumen de muestra, mayor sensibilidad de la prueba, hallazgo confirmado en la última revisión realizada por Lamy et al.39 en el 2016. Por otra parte, Bekeris et al.40 y el Clinical and Laboratory Standards Institute41 recomiendan que se sigan las indicaciones del fabricante en cuanto al volumen de muestra requerido. En cualquier caso, esta sería una variable a considerar en próximos estudios relacionados.
ConclusiónA partir de estos resultados, podemos concluir que una adecuada acción formativa de recomendaciones basadas en la evidencia ha reducido la contaminación de hemocultivos en nuestra cohorte de pacientes. Aun así, es necesario seguir trabajando en ello mediante la planificación de actividades y cuidados para reducir esa tasa. Las actividades estarían orientadas hacia la realización de una técnica basada en la evidencia, la formación continuada del personal y la adecuación de las solicitudes de muestras de cultivos de sangre en pacientes con una probabilidad muy baja de bacteriemia en base a criterios clínicos.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.