Examinar el perfil de pérdidas sanguíneas diagnósticas (extracciones analíticas) e iatrogénicas (técnicas de depuración extracorpórea [TDE]) en pacientes con trauma grave.
MétodoEstudio descriptivo observacional prospectivo durante un año. Incluimos aquellos pacientes mayores de 15 años ingresados por trauma grave con Injury Severity Score (ISS) superior o igual a 16 puntos. Excluimos a aquellos pacientes a los que se hubiera indicado limitación del esfuerzo terapéutico. De 225 pacientes, con 1.619 días de evolución, analizamos volumen perdido/día/paciente, tipo de extracción, evolución clínica y presencia o no de TDE. Las variables se expresan como media±SD comparadas con la prueba de la t de Student.
ResultadosEl promedio de pérdidas hemáticas/paciente/día ha sido de 55,5±32,2cm3. Encontramos diferencias estadísticamente significativas en el volumen sanguíneo extraído, comparando el primer día respecto al segundo (73,5±32,2 vs. 56,3±21,9cm3; p<0,001); evolución clínica (alta o éxitus) (54,8±33 vs. 60,7±24,9; p<0,05); gravedad (Injury Severity Score<31 o ≥31) (54,65±20 vs. 61,5±28,5; p<0,001) y sin TDE/TDE (50,9±18,9 vs. 97,2±72,6; p<0,001).
ConclusionesLa mayor pérdida de sangre diagnóstica se produce en la fase de resucitación, en los pacientes que fallecen, en aquellos con mayor gravedad y los sometidos a TDE.
To analyze diagnostic (blood drawings) and iatrogenic (Continuous Renal Replacement Therapy, CRRT) blood losses (BL) in severe trauma patients.
MethodA one-year descriptive, prospective and observational study. We included patients over 15 years of age, admitted with severe trauma and who had a score of ≥16 on the Injury Severity Index (ISS). Those patients in whom limitation of therapeutic effort had been indicated were excluded. A total of 225 patients with 1619 days of evolution were analyzed for volume of BL/day/patient, type of diagnostic test, clinical outcome and utilization of CRRT. The variables were described as mean ± standard deviation with the Student's T test.
ResultsAverage blood loss of patient per day was 55.5±32.2cc. Statistically significant differences were found between the blood volume drawn when the first day was compared to the second day, 73.5±32.2 vs. 56.3±21.9 (p<0.001); clinical outcome (alive vs death) 54.8±33 vs. 60.7±24.9 (p<0.05); severity (ISS<31 or ≥31) 54.65±20 vs. 61.5±28.5 (p<0.001), No RRT vs RRT: 50.9±18.9 vs. 97.2±72.6 (p<0.001).
ConclusionsThe greatest diagnostic BL occurs during the resuscitation phase, in the patients who die, in those with greater severity and those undergoing CRRT.
Uno de los problemas más comunes en el paciente crítico es la anemia, que contribuye a un aumento de la morbimortalidad y a la necesidad de transfusión de hemoderivados1–5.
Diferentes estudios destacan, entre las causas agudas más frecuentes, el sangrado gastrointestinal, las intervenciones quirúrgicas, las lesiones traumáticas y las alteraciones de la coagulación1,6,7. Además, los pacientes críticos sufren a diario otras pérdidas sanguíneas, adicionales a las del proceso patológico, que pueden derivar en lo que se ha venido a denominar anemia nosocomial2,8,9. Nos referimos a aquellas producidas por las continuas extracciones analíticas con fines diagnósticos. Su frecuencia depende de la práctica de cada institución, la gravedad del paciente y la facilidad para obtenerlas por la presencia de catéteres9,10. Se incluyen también las producidas de forma iatrogénica, ligadas al soporte terapéutico, por la coagulación o fugas de los circuitos extracorpóreos que se utilizan en los pacientes sometidos a terapias de reemplazo renal.
Sería interesante establecer una relación entre las pérdidas sanguíneas adicionales y la disminución de la hemoglobina y del hematocrito, con el fin de ahorrar en la administración de hemoderivados a los pacientes. Esta analogía ha sido demostrada en personas sanas11, pero en el caso de los pacientes críticos existen factores añadidos que hacen más complejo este análisis, como los balances hídricos positivos o el cambio de volumen de distribución del agua corporal secundario a la ventilación mecánica. Von Asher et al7, con muestras de pacientes con patología medicoquirúrgica, recogen hasta un 17% (rango: 10–28) de pérdidas hemáticas diagnósticas. En los pacientes con enfermedad traumática grave no hemos encontrado referencias al respecto, probablemente por sus peculiaridades (sangrados activos internos y externos, cirugías frecuentes o coagulopatías).
Asumiendo que las pérdidas sanguíneas derivadas del mecanismo lesional traumático son difíciles de evitar, el propósito de nuestro trabajo es examinar el perfil de las pérdidas sanguíneas adicionales potencialmente evitables. A partir de este análisis, los profesionales de enfermería podemos adoptar medidas para contribuir a la gestión de ahorro de sangre de los pacientes con trauma grave.
MétodoDiseño y muestraEstudio descriptivo, observacional y prospectivo, realizado en una unidad monográfica de pacientes con trauma grave, en el Hospital Terciario Universitario 12 de Octubre del Servicio Madrileño de Salud.
Se reclutaron 225 pacientes durante el período de octubre de 2006 a septiembre de 2007, que generaron un total de 1.619 días de evolución. Los criterios de inclusión fueron ser mayor de 15 años y presentar trauma grave definido por una puntuación en la escala Injury Severity Score (ISS) superior o igual a 16. Se excluyeron aquellos pacientes en los que se decidió adoptar limitación del esfuerzo terapéutico.
Instrumento y proceso de recogida de datosPara la recogida de datos se creó un registro que incluía las variables de interés: edad, sexo, antecedentes personales, día de evolución, mecanismo lesional, tipo de trauma, ISS, evolución clínica (hacia el alta o éxitus), volumen de sangre perdido por paciente y día, presencia de terapias de depuración extracorpórea y, en ese caso, número de filtros no retornados, asegurando su actualización diaria con la gráfica de evolución clínica.
También se analizó el número de extracciones y el tipo de test sanguíneo por paciente y día, especificando si era gasometría, bioquímica, hemograma, estudio de coagulación, hemocultivos u otras (perfil férrico, niveles de fármacos, serología, pruebas cruzadas, hormonas, etc.). Se incluyó además como extracción aquellas glucemias plasmáticas monitorizadas a pie de cama (con medidor Accu-Chek® Aviva) no coincidentes con las analíticas convencionales, extraídas según el protocolo de insulinoterapia establecido en la unidad.
Todos los pacientes incluidos en el estudio portaban catéter arterial (tipo Arrow®, número 20Ga, 4,45cm) con equipo de monitorización de presión (Edwards Lifesciences), purgado con suero salino y/o catéter venoso central (tipo Arrow®, 7Fr, 20cm), de donde se extrajeron las distintas muestras. El volumen de desecho en cada extracción fue de 4cm3 (3cm3 más espacio muerto). Las muestras sanguíneas se obtuvieron con el sistema a vacío tipo Vacuette®.
El volumen sanguíneo requerido para cada determinación analítica fue de 1cm3 para la gasometría, 3cm3 para el hemograma, 5cm3 en la bioquímica, 3,5cm3 en las coagulaciones, 10cm3 en los hemocultivos y 10cm3 para otras extracciones.
En los pacientes con terapias de depuración extracorpórea se estimó un promedio de pérdida sanguínea de 135cm3 por cada circuito coagulado, ya que suponía no poder retornar la sangre al paciente. Los equipos utilizados para estos tratamientos fueron máquina tipo Prisma® (filtro M100, AN 69) y Kimal® (línea arterial KH205, venosa KH 215, filtro HF1200).
Consideraciones éticasNo efectuamos ninguna modificación en el cuidado de los pacientes, ni realizamos procedimientos experimentales, por lo que no se requirió autorización por parte del paciente o sus familiares, acorde a las normas internacionales estipuladas en la declaración de Hensinki y en su última revisión.
Análisis de datosSe utilizó la estadística descriptiva: las variables cualitativas fueron expresadas como frecuencia absoluta y relativa, y las variables cuantitativas se expresaron como media±SD. Las comparaciones se realizaron con la prueba de la t de Student, considerándose el nivel de significación estadística para p<0,05.
Los cálculos fueron realizados con el programa estadístico Stadistical Package for Social Science en su versión 11.0.
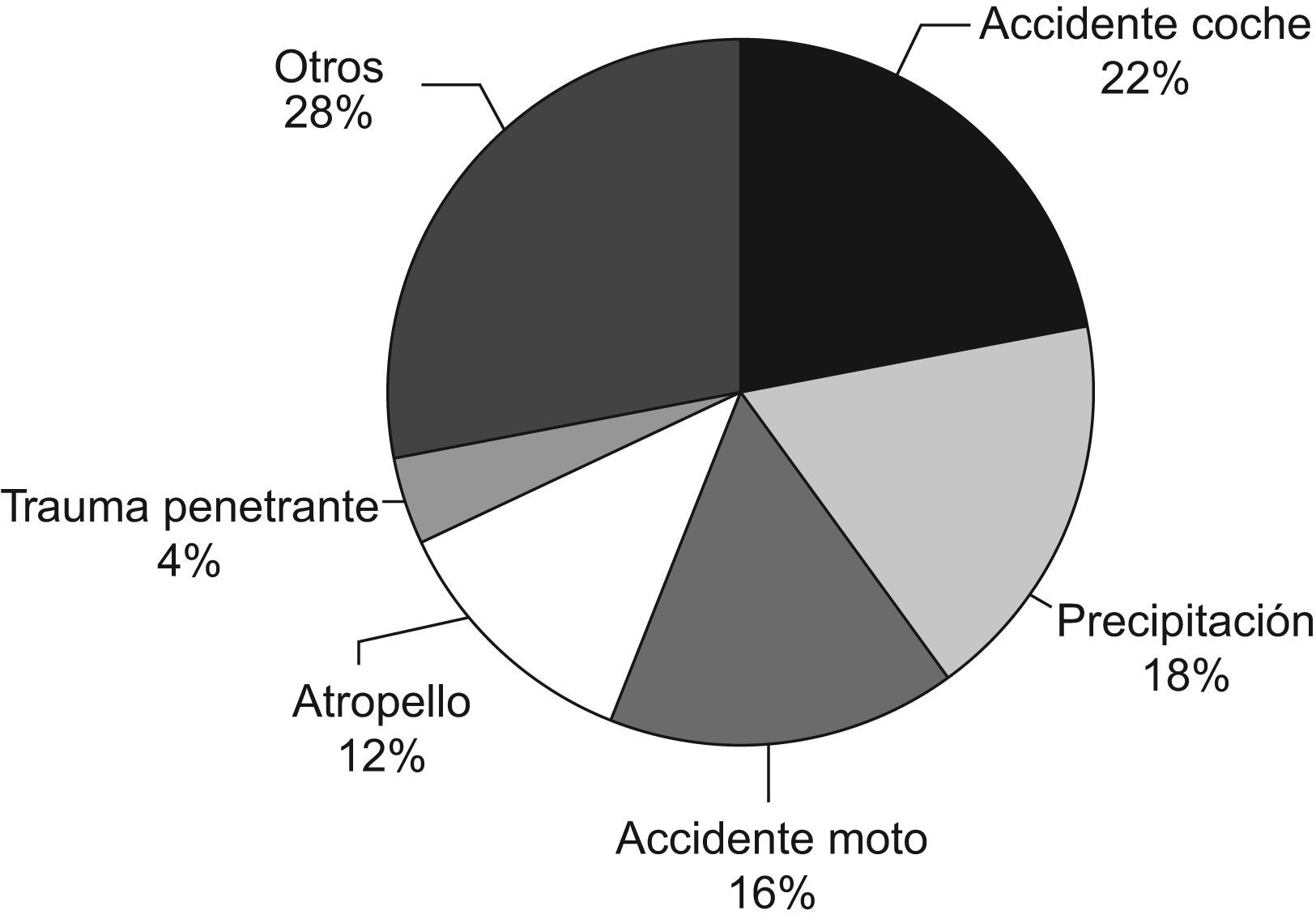
ResultadosLa edad media de los pacientes incluidos en el estudio fue de 41±19 años, de los cuales el 81% (182) eran hombres. Los mecanismos traumáticos que causaron el ingreso se recogen en la figura 1.
El 90% (203) presentaba trauma multisistémico. El traumatismo craneoencefálico grave (TCG) apareció en el 36% (81) de los pacientes. La estancia media en la UCI fue de 8±10 días. La gravedad media expresada a través del ISS fue de 31,2±13,7, con una mortalidad global del 26%.
El valor medio de pérdidas hemáticas diagnósticas e iatrogénicas por paciente y día fue de 55,5±32,2cm3 (mediana de 49cm3 y rango intercuartílico de 40,5–62,5cm3). La media de pérdida total por paciente durante toda la estancia fue de 396cm3.
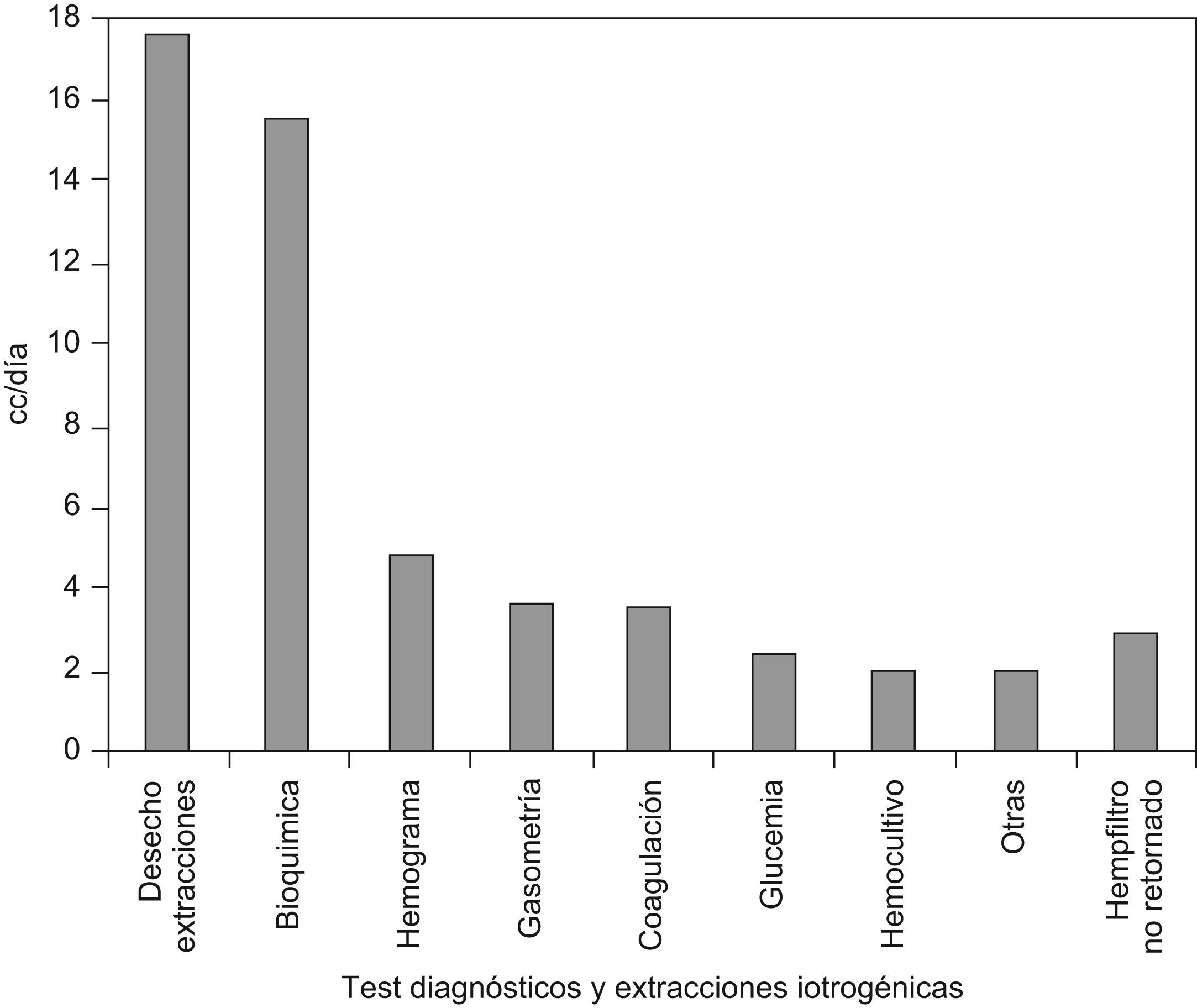
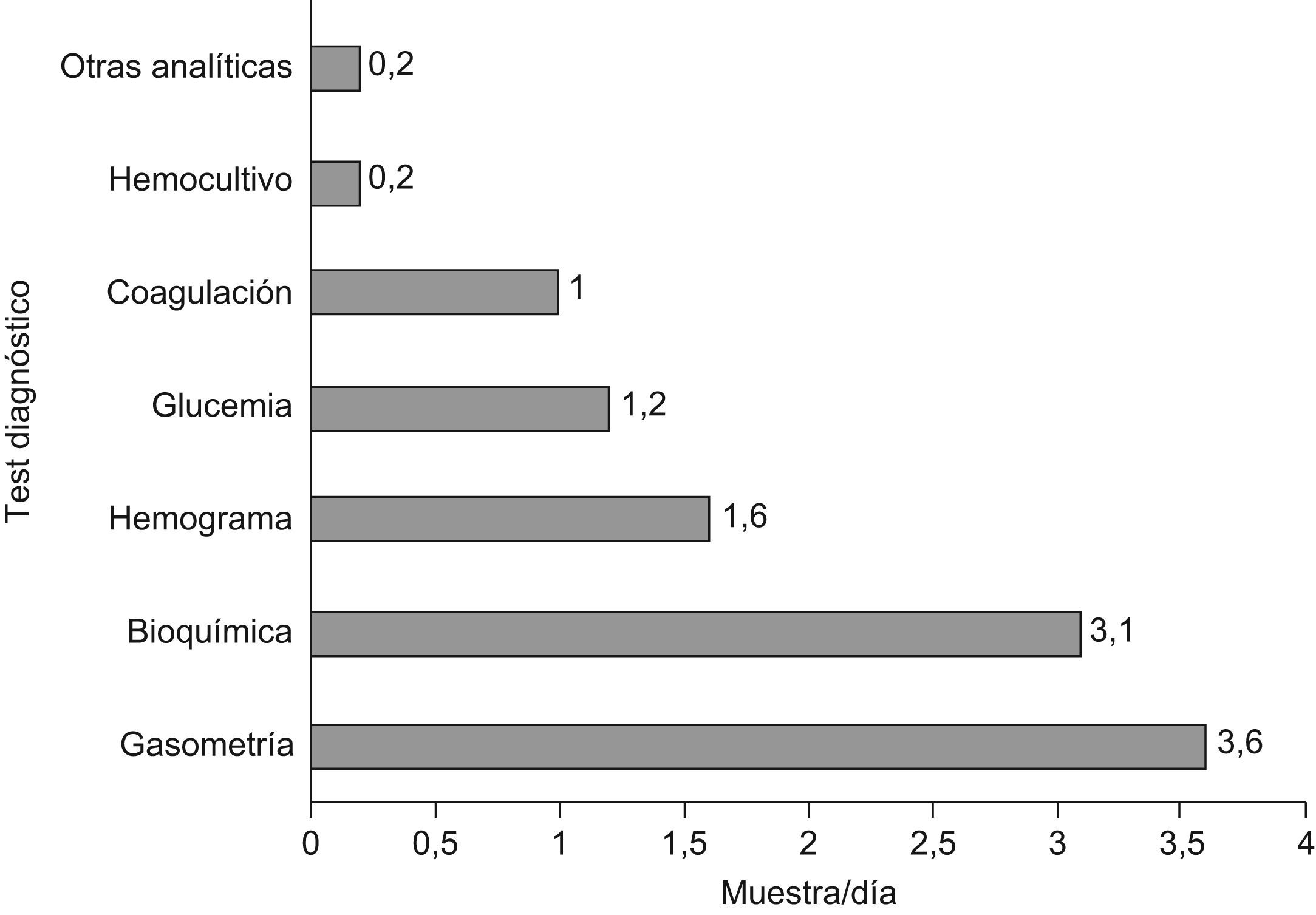
Las pérdidas sanguíneas de los distintos test diagnósticos se recogen en la figura 2. El volumen desechado por extracciones supuso una pérdida del 31%, seguido del volumen sanguíneo requerido para las determinaciones bioquímicas que representó el 27,9%. La media de extracciones diarias fue de 4,41±1,54. La frecuencia diaria de las distintas determinaciones diagnósticas se recoge en la figura 3.
Los pacientes que recibieron terapias de depuración extracorpórea fueron 18 y el número de filtros no retornados fue de 2,05 por paciente/tratamiento, produciendo una pérdida media de 2,7cm3/día con una frecuencia de 0,02 veces/día.
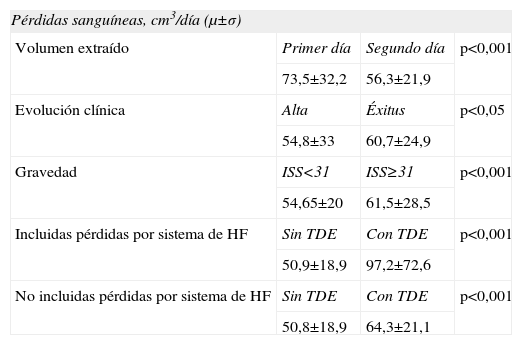
Encontramos diferencias estadísticamente significativas en las siguientes variables: el volumen sanguíneo extraído el primer día de estancia respecto al segundo día (73,5±32,2 vs. 56,3±21,9cm3; p<0,001); la frecuencia de extracciones del primer día respecto al segundo (5,13±2,09 vs. 4,83±1,43; p<0,001); el volumen sanguíneo extraído según la evolución clínica (alta o éxitus) (54,8±33 vs. 60,7±24,9cm3; p<0,05); en función de la gravedad (ISS <31 o ≥31) (54,65±20 vs. 61,5±28,5; p<0,001) durante los 7 primeros días; también observamos diferencias significativas entre los pacientes que recibieron terapias de depuración extracorpórea y los que no, tanto al tener en cuenta las pérdidas iatrogénicas por coagulación del filtro como sin considerar dichas pérdidas (tabla 1).
Variables con significación estadística
| Pérdidas sanguíneas, cm3/día (μ±σ) | |||
| Volumen extraído | Primer día | Segundo día | p<0,001 |
| 73,5±32,2 | 56,3±21,9 | ||
| Evolución clínica | Alta | Éxitus | p<0,05 |
| 54,8±33 | 60,7±24,9 | ||
| Gravedad | ISS<31 | ISS≥31 | p<0,001 |
| 54,65±20 | 61,5±28,5 | ||
| Incluidas pérdidas por sistema de HF | Sin TDE | Con TDE | p<0,001 |
| 50,9±18,9 | 97,2±72,6 | ||
| No incluidas pérdidas por sistema de HF | Sin TDE | Con TDE | p<0,001 |
| 50,8±18,9 | 64,3±21,1 | ||
HF: hemofiltración; ISS: Injury Severity Score; TDE: técnicas de depuración extracorpórea.
No encontramos diferencias estadísticamente significativas en los pacientes con TCG respecto a los que no lo presentaban (55,6±34,9 vs. 55,5±24,9).
DiscusiónLas pérdidas sanguíneas diagnósticas en el paciente crítico han sido bien estudiadas a lo largo de décadas12–27. Sin embargo, en el grupo específico de pacientes con enfermedad traumática grave no se han especificado. Tampoco hemos encontrado referencias bibliográficas que añadan, a estas pérdidas diagnósticas, las que hemos venido a denominar como iatrogénicas, derivadas de terapias extracorpóreas, acercándonos así a las pérdidas reales extras de nuestros pacientes.
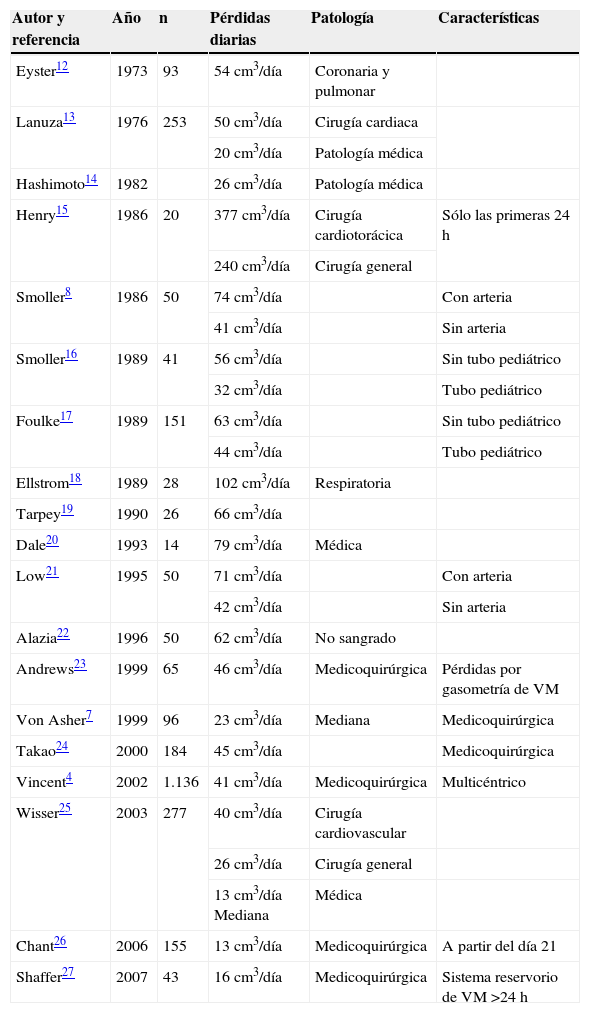
En la tabla 2 se describen los datos reflejados en distintos estudios publicados desde 1973 hasta la actualidad, donde se cuantifican las pérdidas sanguíneas diagnósticas. Los resultados obtenidos en nuestro estudio se asemejan a estos datos, aunque podríamos considerarlos en un rango superior. Creemos que puede ser debido a los elevados índices de gravedad de nuestros sujetos, a la inclusión de las pérdidas iatrogénicas e incluso a la no utilización de sistemas de ahorro.
Pérdidas sanguíneas diagnósticas en paciente crítico
| Autor y referencia | Año | n | Pérdidas diarias | Patología | Características |
| Eyster12 | 1973 | 93 | 54cm3/día | Coronaria y pulmonar | |
| Lanuza13 | 1976 | 253 | 50cm3/día | Cirugía cardiaca | |
| 20 cm3/día | Patología médica | ||||
| Hashimoto14 | 1982 | 26cm3/día | Patología médica | ||
| Henry15 | 1986 | 20 | 377cm3/día | Cirugía cardiotorácica | Sólo las primeras 24h |
| 240cm3/día | Cirugía general | ||||
| Smoller8 | 1986 | 50 | 74cm3/día | Con arteria | |
| 41cm3/día | Sin arteria | ||||
| Smoller16 | 1989 | 41 | 56cm3/día | Sin tubo pediátrico | |
| 32cm3/día | Tubo pediátrico | ||||
| Foulke17 | 1989 | 151 | 63cm3/día | Sin tubo pediátrico | |
| 44cm3/día | Tubo pediátrico | ||||
| Ellstrom18 | 1989 | 28 | 102cm3/día | Respiratoria | |
| Tarpey19 | 1990 | 26 | 66cm3/día | ||
| Dale20 | 1993 | 14 | 79cm3/día | Médica | |
| Low21 | 1995 | 50 | 71cm3/día | Con arteria | |
| 42cm3/día | Sin arteria | ||||
| Alazia22 | 1996 | 50 | 62cm3/día | No sangrado | |
| Andrews23 | 1999 | 65 | 46cm3/día | Medicoquirúrgica | Pérdidas por gasometría de VM |
| Von Asher7 | 1999 | 96 | 23cm3/día | Mediana | Medicoquirúrgica |
| Takao24 | 2000 | 184 | 45cm3/día | Medicoquirúrgica | |
| Vincent4 | 2002 | 1.136 | 41cm3/día | Medicoquirúrgica | Multicéntrico |
| Wisser25 | 2003 | 277 | 40cm3/día | Cirugía cardiovascular | |
| 26cm3/día | Cirugía general | ||||
| 13cm3/día Mediana | Médica | ||||
| Chant26 | 2006 | 155 | 13cm3/día | Medicoquirúrgica | A partir del día 21 |
| Shaffer27 | 2007 | 43 | 16cm3/día | Medicoquirúrgica | Sistema reservorio de VM >24h |
VM: ventilación mecánica.
Las determinaciones más frecuentes han sido las gasometrías y las bioquímicas. Suponemos que es por el control exhaustivo de equilibrio ácido-base, iones y CPK, entre otros, que requieren los pacientes traumáticos graves, en concreto los traumatismos craneales y ortopédicos, que son los más incidentes en nuestra muestra. Wisser et al25, Chant et al26 y Shaffer27 recogen datos similares en pacientes medicoquirúrgicos.
Nuestras pérdidas por volumen desechado son similares a lo reflejado en la literatura médica, variando entre el 2722 y el 30%15. Respecto a la cantidad descartada en cada extracción, consideramos que estamos en un rango superior a lo publicado, lo que nos ha hecho plantearnos el volumen mínimo ideal para obtener resultados fiables28,29.
La mayor pérdida de sangre diagnóstica se produce en la fase de resucitación (primeras horas tras el traumatismo, según el Advanced Trauma Life Support), tanto en volumen como en número de test diagnósticos. Estos valores son comparables a los de otras unidades de pacientes críticos medicoquirúrgicos10,19,22,30.
También hemos apreciado pérdidas mayores cuando el desenlace ha sido el fallecimiento del paciente. Asimismo, los pacientes más graves, en nuestro caso los de mayor ISS y en otros casos los de mayor APACHE o SOFA, son los que más pierden por extracciones4,10,19,26,30.
En nuestra muestra se realizan más extracciones en pacientes con terapias de depuración extracorpórea, posiblemente relacionado con que poseen índices de gravedad más elevados. Andrews et al23 encuentran un mayor número de determinaciones, pero lo asocian a los controles frecuentes de heparina. Nuestro protocolo de técnicas de hemofiltración no contempla el análisis de anticoagulación del circuito, sino la del paciente, por lo que no aumenta las determinaciones de este tipo respecto a otros pacientes.
La diferencia de pérdidas sanguíneas en los pacientes con TCG, a pesar del estrecho control gasométrico e iónico al que son sometidos, no resulta estadísticamente significativo frente a los que no lo presentan. Este hallazgo nos ha sorprendido y ha hecho que nos planteemos si existe exceso de prescripción en algunos pacientes.
Con el diseño de nuestro trabajo no hemos podido determinar si todos los test diagnósticos se correlacionan con un cambio en el manejo diario de tratamiento de los pacientes, lo que nos habría permitido, en un futuro, racionalizarlas en función de la situación clínica, evitando extracciones sanguíneas innecesarias.
Deberíamos haber considerado la necesidad de contabilizar otras pérdidas sanguíneas por iatrogenia, como las que se producen durante técnicas invasivas u otros procedimientos terapéuticos (cateterismos, inserción de tubos torácicos, entre otros), para acercarnos, aún más, a todo lo que el paciente pierde de forma extraordinaria. Además, no hemos podido determinar si ser portador de catéteres arteriales o venosos aumenta el número de extracciones, como sugieren algunos autores8–10,21.
A partir de los resultados hemos establecido un grupo de trabajo para valorar la eficacia de técnicas de ahorro, cambio en la política de prescripciones y concienciar a los profesionales implicados de la importancia de la economía del volumen desechado.
Conclusiones- •
En nuestros pacientes con trauma grave, el volumen sanguíneo diagnóstico e iatrogénico es similar al de otros pacientes, aunque se acerca al límite superior. Los test diagnósticos más frecuentes fueron las gasometrías y las bioquímicas y la mayor pérdida se produce con el volumen de desecho.
- •
Se producen más extracciones en la fase de resucitación, en los pacientes que fallecen, en aquellos con índice de gravedad más altos y en los sometidos a terapias de depuración extracorpórea.
- •
Las pérdidas sanguíneas de los pacientes con TCG fueron similares a los que no lo presentaban.
Los autores declaran no tener ningún conflicto de intereses.