Introducción: Los tumores cerebrales representan el tipo de tumor sólido más frecuente y la primera causa de mortalidad por cáncer en la edad pediátrica. La mortalidad es alta, dado que el 40% de los niños con tumor cerebral presenta recaída o no responden al tratamiento inicial La sobreexpresión del factor de crecimiento epidérmico (EGFR) sobre las células tumorales altera la regulación del ciclo celular, incrementando la proliferación, bloqueando la apoptosis y promoviendo la angiogénesis. El nimotuzumab en un anticuerpo monoclonal que actúa contra el EGFR.
Objetivo: Determinar la seguridad y eficacia del tratamiento con cisplatino, vincristina y nimotuzumab en pacientes pediátricos con tumor cerebral recurrente o refractario.
Métodos: Estudio fase II, etapa I de acuerdo a los criterios de Gehan. Se incluyeron pacientes menores de 17 años de edad, con diagnóstico de tumor de sistema nervioso central en primera recaída o refractario al tratamiento convencional con ifosfamida, carboplatino, etopósido, que expresaran positividad para EGFR en el estudio histopatológico inicial. Se realizaron curvas de sobrevida global a 6 y 12 meses por el método de Kaplan-Meier, y se determinó mediante Log Rank Test si existió significancia estadística.
Resultados: Se estudiaron 10 pacientes. El 20% de ellos con tumor de localización supratentorial y 80% infratentorial. La sobrevida global en general fue de 50% a los 6 meses y de 30% a los 12 meses. La disminución de tamaño tumoral fue estadísticamente significativa (p=0.025), a los 2 meses de iniciado el tratamiento.
Discusión: La quimioterapia con cisplatino, vincristina y nimotuzumab es una opción de tratamiento para aquellos pacientes con tumores cerebrales en recaída, o que no responden a tratamiento primera línea.
Introduction: Brain tumors represent the most common type of solid tumor and the leading cause of cancer death in children. In Mexico the incidence is 17 cases per million per year. Approximately 40% of these patients relapse taking this to death in 100% of the cases. Overexpression of epidermal growth factor (EGFR) on the tumor cells alters cell cycle regulation, increasing proliferation, blocking apoptosis, promoting angiogenesis and increasing motility, adhesion and invasiveness. Nimotuzumab is a monoclonal antibody against EGFR.
Objective: To determine the safety and efficacy of treatment with cisplatin, vincristine and nimotuzumab in pediatric patients with recurrent or refractory brain tumor.
Methods: A phase II, stage I according to the criteria of Gehan. Patients less than 17 years old diagnosed with central nervous system tumor in first relapse or refractory to conventional treatment with ifosfamide, carboplatin, etoposide, which express EGFR positivity in the initial histopathology were included. Curves were overall survival at 6 and 12 months for the Kaplan-Meier method, and it was determined by Log Rank Test whether there was statistical significance.
Results: Ten patients were studied. The 20% with supratentorial tumor location and 80% infra-tentorial. The general overall survival was 50% at 6 months and 30% at 12 months. The decrease in tumor size was statistically significant (p=0.025) at 2 months of starting treatment.
Discussion: Chemotherapy with cisplatin, vincristine and nimotuzumab is a treatment option for patients with relapsed or brain tumors that do not respond to first line treatment.
Introducción
Los tumores cerebrales representan el tipo de tumor sólido más frecuente y la primera causa de mortalidad en la edad pediátrica1,2. A nivel mundial la incidencia se encuentra entre 10 y 18 casos por millón por año, con una frecuencia de presentación del 12% y una expectativa de vida de acuerdo a la SEER (por sus siglas en inglés, Surveillance Epidemiology End Result) a los 5 años del 56%3,4.
En México, la incidencia es de 2.5 casos por 100,000 niños por año, encontrándose la máxima frecuencia en el primer decenio de vida5,6.
La mortalidad es alta, dado que el 40% de los niños con tumor cerebral presenta recaída o no responden al tratamiento inicial7,8. La recidiva de los tumores cerebrales infantiles tanto de bajo grado como malignos puede presentarse muchos años después del tratamiento inicial, como es el caso de los meduloblastomas y ependimomas.
En algunas ocasiones puede realizarse una segunda resección quirúrgica para mejorar la sobrevida. Sin embargo, debe individualizarse la necesidad de intervención quirúrgica con base en el tipo del tumor inicial, el tiempo transcurrido entre el tratamiento inicial y la reaparición de la lesión y el cuadro clínico9.
A pesar de que los tratamientos se han mejorado con el paso de los años, utilizando esquemas de quimioterapia alternos, con ifosfamida, carboplatino, etopósido, vincristina y procarbazina; aproximadamente el 40% de estos pacientes presentan recurrencias tempranas o tardías y con pocas posibilidades de sobrevida10-12.
Esto ha dado pie a la búsqueda de nuevas alternativas terapéuticas, dentro de éstas, la de Judah Folkman en la universidad de Harvard en 1971, quien propuso que la inhibición de la angiogénesis podría ser una estrategia terapéutica efectiva en el tratamiento del cáncer, iniciándose una búsqueda dirigida hacia la purificación de los factores angiogénicos tumorales13,14.
La angiogénesis tumoral es la proliferación de una red de vasos sanguíneos que penetra dentro de crecimientos tumorales, proporcionando nutrientes y oxígeno, y removiendo productos de desecho15,16. La angiogénesis tumoral empieza en realidad cuando las células neoplásicas del tumor liberan moléculas que envían señales al tejido huésped normal vecino. Este señalamiento activa a genes que, a su vez, producen proteínas para estimular el crecimiento de nuevos vasos sanguíneos; entre estas moléculas de señalización se encuentra el factor de crecimiento endotelial vascular17 (VEGF) y el factor de crecimiento epidérmico (EGFR), un receptor y miembro de la familia de receptores transmembrana ERbB. Su dominio intracelular está asociado a la actividad de la proteína tirosin cinasa y su sobreexpresión en las células tumorales altera la regulación del ciclo celular, incrementando la proliferación, bloqueando la apoptosis y promoviendo la angiogénesis, así como incrementando la motilidad, la adhesividad y la capacidad invasiva18-20.
Los medicamentos que tienen como blanco al EGFR, han demostrado que mejoran la respuesta cuando se usan junto con tratamientos convencionales, como radioterapia y quimioterapia.
El nimotuzumab es un anticuerpo monoclonal humanizado del tipo IgG1 dirigido al EGFR, al cual se une con afinidad intermedia21. En 2005, fue aprobado para el tratamiento del cáncer avanzado de la cabeza y cuello, y en 2007 se amplió su indicación para el tratamiento de glioma maligno en adultos y niños.
Este anticuerpo se ha evaluado en varios ensayos clínicos en países como Alemania, Canadá, China, Corea del Sur, Cuba, China, Estados Unidos, India y Japón. En estos estudios, el nimotuzumab ha demostrado ser seguro y eficaz en términos de control de la enfermedad y mejoría de la sobrevida global22-24,27.
A pesar de lo anterior, la experiencia en pacientes pediátricos es limitada; encontrando dentro de las pocas investigaciones estudios fase II y III realizados en Alemania por Bode25,26 y publicados por la Sociedad Americana de Oncología Clínica en 2006, donde se demostró la seguridad y eficacia del nimotuzumab en el tratamiento de pacientes pediátricos con tumor de tallo cerebral27.
El objetivo es determinar la seguridad y eficacia del tratamiento con cisplatino, vincristina y nimotuzumab en pacientes pediátricos con tumor cerebral recurrente o refractario.
Métodos
El presente estudio se realizó en el Hospital de Pediatría Centro Médico Nacional Siglo XXI en el Servicio de Oncología, en el periodo comprendido de octubre de 2010 al mes de octubre del 2012, en el cual se incluyeron a los pacientes con diagnóstico de tumor del sistema nervioso central en primera recaída tumoral o refractarios a tratamiento convencional, que expresaron positividad para el EGFR. A estos pacientes se les administró quimioterapia de segunda línea consistente en: cisplatino 75 mg/m2/dosis, diluido en manitol al 20% y solución salina al 0.9%, administrado intravenoso en 3 horas el día 1, vincristina 2 mg/m2 dosis intravenosa administrada en 10 minutos en solución salina 0.9% día 1, y el nimotuzumab a dosis de 150 mg/m2/dosis intravenoso en infusión de 60 minutos una vez a la semana durante 4 semanas. Este esquema se administró mensualmente por 4 cursos (es decir durante 4 meses). Se requirieron medicamentos complementarios como el omeprazol a 1 mg/kg dosis cada 12 horas, y ondansetrón a 0.5 mg/m2 dosis. En los casos en que el paciente presentó progresión tumoral, salió del estudio, no así del análisis y se consideró como paciente fuera de tratamiento oncológico.
Se realizaron estudios de biometría hemática, química sanguínea, pruebas de funcionamiento hepático y renal previo a cada curso, así como estudios de imagen de resonancia magnética de cráneo y neuroeje al momento de entrar al estudio, posteriormente al segundo y cuarto curso de quimioterapia.
Se realizó así también determinación de EGFR en el espécimen histopatológico obtenido de la cirugía inicial, disponible en el Servicio de Patología del Hospital de Pediatría Siglo XXI.
Resultados
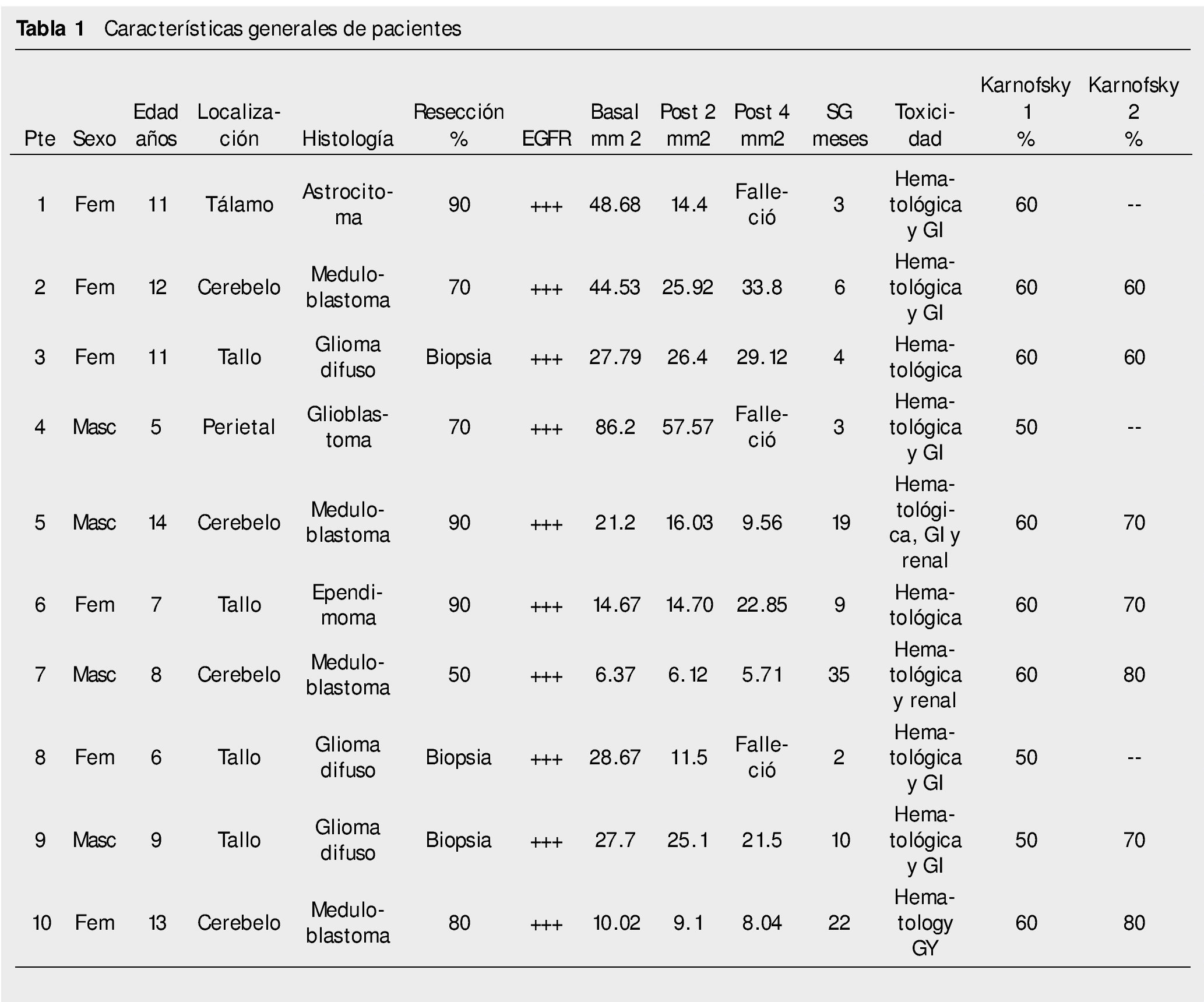
Se incluyeron en el estudio 11 pacientes, de los cuales uno fue eliminado dado que no completó 2 cursos de quimioterapia por fallecimiento. El deceso de este paciente de 2 años fue debido a progresión tumoral, presentaba tumor germinal, específicamente teratoma inmaduro en la glándula pineal. De 10 pacientes que se incluyeron en el estudio, 60% (n=6) fueron del sexo femenino y 40% (n=4) del sexo masculino. La mediana de edad fue de 10 años, con un valor mínimo de 5 años 6 meses y un máximo de 14 años 3 meses (tabla 1).
En lo concerniente a la localización de la tumoración, el 20% (n=2) fue supratentorial y 80% (n=8) infratentorial (40% en cerebelo y el otro 40% localizado en tallo). Respecto a la histología se identificaron: tumores astrocíticos en 50% (n=5), 40% tumores embrionarios y 10% tumor ependimario, todos ellos tumores derivados del tejido neuroepitelial de acuerdo a la clasificación de la Organización Mundial de la Salud (OMS).
Respecto al tratamiento utilizado previo a la administración de quimioterapia de rescate se empleó esquema ICE (ifosfamida-carboplatino-etopósido),y tratamiento con radioterapia a cráneo en el 100% de los casos, y a neuroeje en meduloblastoma y ependimoma
La resección tumoral se llevó a cabo de forma parcial en el 70% de los casos (n=7), siendo ésta del 50%, 70%, 80% y 90% en el caso de los meduloblastomas, 70% en el caso del glioblastoma parietal y de 90% de la lesión en el caso de un astrocitoma fibrilar y un ependimoma anaplásico. En 3 casos correspondientes a glioma difuso de tallo, únicamente se realizó biopsia.
En lo concerniente al estado actual, 8 pacientes han fallecido (80%) y 2 pacientes se encuentran en seguimiento por consulta externa (20%); respecto a la histología de estos 2 últimos casos corresponden a meduloblastoma ambos.
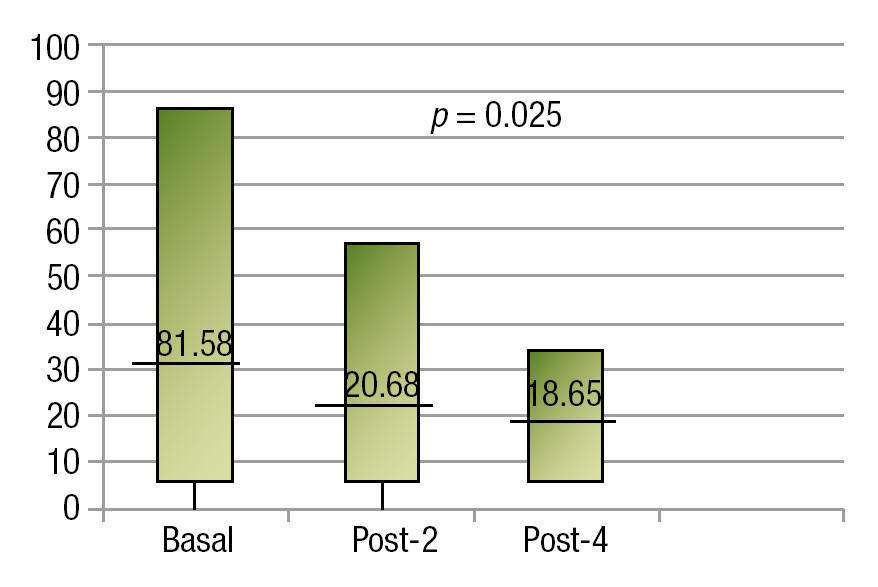
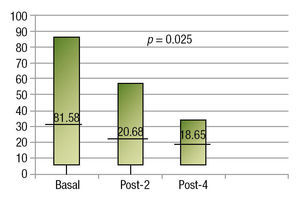
En cuanto a la reducción del tamaño tumoral, en la imagen basal se tuvo una media de 31.58 cm2 con una desviación de 23.51. En el control radiológico a los 2 meses, la media fue de 20.68 y desviación estándar de 14.78, siendo esta disminución estadísticamente significativa (p=0.025). El control al finalizar el cuarto curso, se realizó en 7 pacientes, ya que 3 fallecieron antes, mostrando una media de 18.65 cm2 (fig. 1).
Figura 1. Reducción tumoral.
La toxicidad reportada fue de tipo hematológica en el 100% de los casos, específicamente por depleción en el conteo de plaquetas, variando desde grado 1 a 4 (10% grado 1, 40% grado 2, 20% grado 3, 30% grado 4); gastrointestinal en 70% de los casos (40% grado 1, 20% grado 2, 10% grado 3) y renal en 20% de los pacientes (grado 1 en ambos casos).
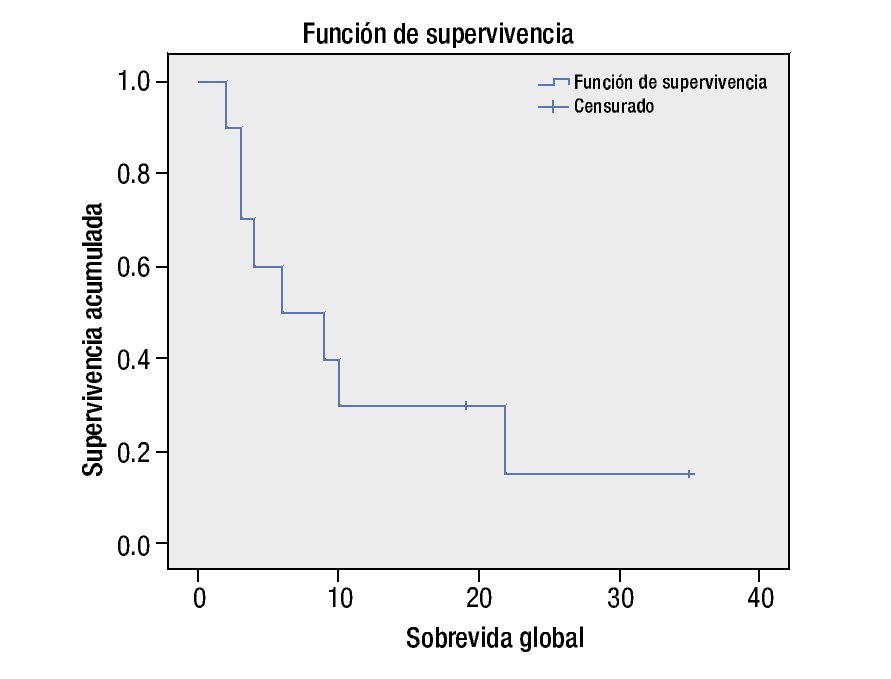
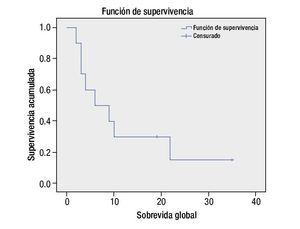
La sobrevida global para todos los pacientes con tumor del sistema nervioso central refractario a quimioterapia de primera línea o recurrente fue de 50% a los 6 meses, y de 30% a los 12 meses (fig. 2).
Figura 2. Sobrevida global.
No se encontró significancia estadística respecto a la edad, el sexo, la histología, la localización, el porcentaje de resección y la supervivencia global.
Discusión
Los tumores cerebrales representan el tipo de tumor sólido más frecuente y la primera causa de mortalidad por cáncer en la edad pediátrica. Aproximadamente el 40% presenta recurrencias; culminando en el 100% de estos casos en el fallecimiento del paciente, por lo cual es imprescindible tener un esquema eficaz de segunda línea para tratar de recuperar más de estos pacientes. Con este propósito se han desarrollado diversos fármacos cuyo principal mecanismo de acción está encaminado al cese de la proliferación celular y capacidad invasiva de las células cancerígenas, la apoptosis y la disminución de la adhesividad de las mismas, así como promoción de la antiangiogénesis.
Ya en 1971, Folkman postula el potencial rol de una terapia antiangiogénica en el tratamiento del cáncer. Varias décadas después, y gracias a investigación básica en angiogénesis, contamos con una serie de moléculas que antagonizan dicho mecanismo a varios niveles. Dentro de estas se encuentran el imatinib, bevacizumab, trastuzumab, sorafenib y nimotuzumab, entre otras. Una serie de estudios fase II con estas moléculas en monoterapia en glioblastoma recurrente han mostrado resultados modestos con grados de respuesta entre 0%-15% en controles imagenológicos y sin prolongación de sobrevida libre de progresión a 6 meses, ni en la sobrevida global en comparación con estudios históricos. Sin embargo, al comparar con estudios que combinan el uso de moléculas antiangiogénicas con citotóxicas, como es el caso de la asociación bevacizumab e irinotecán en pacientes adultos con recidiva de glioblastoma (Vredenburh), se observan grados de respuesta radiológica entre 57%-63%, sin aumento significativo de complicaciones hemorrágicas, así como sobrevida libre de enfermedad a 6 meses de 46%-50%, comparado con 21% del control histórico28,29, porcentaje que es mayor comparado tanto con la respuesta de reducción tumoral observada en nuestro estudio, que fue de 10%-54%, así como con la sobrevida libre de progresión que fue de 20% a los 6 y 35 meses de seguimiento, siendo representado este porcentaje por los 2 pacientes vivos que continúan en vigilancia y libres de progresión tumoral, una vez que se inició la quimioterapia de rescate.
Uno de los estudios realizado en Hong Kong por Pu JK, Chan RT en relación al uso del bevacizumab más irinotecán en pacientes adultos con glioma recurrente, encontró resolución radiológica tumoral en 86% de los pacientes, siendo ésta completa en 29% de ellos (mayor a la observada en nuestro estudio)30. En cuanto a la sobrevida libre de progresión esta fue de 71% a los 6 meses; también más alta a la observada en nuestro caso. Sin embargo, las características de los pacientes de ambos estudios son bastante heterogéneas en cuanto a la edad, número de resecciones tumorales realizadas y respecto a la histología.
Un tercer estudio realizado en este hospital en el año 2008, en el que se utilizó quimioterapia metronómica para tratamiento de tumores del tallo cerebral, administrando talidomida como antiangiogénico, mostró una reducción significativa del tamaño tumoral, así como una sobrevida global de 71.6% a 24 meses14 en niños con tumor de tallo cerebral (mayor a lo observado en nuestro estudio que fue de 50% a los 6 meses y de 30% a los 12 meses), alcanzando sin embargo el porcentaje establecido como mínimo en una de las hipótesis de este trabajo de investigación.
A pesar de no haber encontrado significancia estadística, dado que la muestra de pacientes fue pequeña, se observó que la sobrevida fue mayor en los pacientes con tumor de localización cerebelar, sin embargo desconocemos en qué proporción esto fue debido a la mayor facilidad de resección tumoral o a la localización per se.
La toxicidad documentada fue hematológica en el 100% de los casos, gastrointestinal en el 70% y renal en 20% de los pacientes, no mayor a la reportada con la quimioterapia de primera línea en cuanto a las 2 últimas, pero si con un incremento evidente respecto a la toxicidad hematológica, específicamente por afección en el conteo plaquetario. Por otro lado, no se documentaron efectos adversos durante la infusión de nimotuzumab.
Respecto al porcentaje de reducción tumoral, no fue posible realizar el último control imagenológico en todos los pacientes dado que 3 de ellos fallecieron antes; sin embargo, del 70% que sobrevivieron y a quienes se les realizó la resonancia de control, 57% (n=4) presentaron reducción tumoral menor del 30% y en un solo caso ésta fue mayor al 30% (con una disminución estadísticamente significativa entre el tamaño tumoral basal y a los 2 meses de tratamiento).
Consideramos conveniente completar el tamaño de muestra, que incluyan un grupo mayor y más homogéneo de pacientes para poder generalizar los resultados y generalizar nuevos esquemas de tratamiento.
Sin embargo y a pesar de que la progresión tumoral se documentó en el 80% de los pacientes (n=8), es de destacar que 2 pacientes continúan en seguimiento por consulta externa y que respondieron a la quimioterapia de segunda línea; considerando que de no haber recibido este tratamiento, su evolución hubiese sido invariablemente al fallecimiento.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Departamento de Oncología Pediátrica, UMAE Hospital de Pediatría Centro Médico Nacional Siglo XXI.
Av. Cuauhtémoc N° 330, Colonia Doctores, Delegación Cuauhtémoc, C.P. 01620, México, D.F., México.
Teléfono: 5627 6900, ext. 22500.
Correo electrónico: elopezaguilar@hotmail.com (Enrique López-Aguilar).