Las enfermedades autoinmunes, o mediadas por la inmunidad, se caracterizan por una pérdida de tolerancia a autoantígenos y por una activación del sistema inmunológico que ocasiona daño a uno o a múltiples órganos. Los mecanismos por los cuales se inicia y se mantiene esta respuesta inmunológica anómala no están del todo establecidos. La aproximación terapéutica de estas enfermedades se basa, en general, en corticoides, inmunomoduladores y anticuerpos monoclonales. Dada la capacidad excepcional de las células dendríticas de inducir inmunogenicidad, se han obtenido ya los primeros resultados en seres humanos para el tratamiento de tumores (melanoma) o infecciones (VIH) con células dentríticas inmunogénicas. La identificación de células dendríticas con capacidad tolerogénica y los resultados obtenidos de su uso en modelos experimentales de enfermedades autoinmunes (encefalomielitis autoinmune, diabetes mellitus, colitis) indica que el tratamiento con células dendríticas tolerogénicas podría ser una alternativa terapéutica beneficiosa en el tratamiento de enfermedades autoinmunes o mediadas por la inmunidad, como la enfermedad de Crohn.
Autoimmune diseases, or immune-mediated diseases, are characterized by loss of tolerance to autoantigens and immune system activation causing damage to one or multiple organs. The mechanisms through which this abnormal immune response is started and maintained are not fully established. The therapeutic approach to these diseases is generally based on corticosteroids, immunomodulators, and monoclonal antibodies. Given the exceptional capacity of dendritic cells to induce immunogenicity, early results in humans for the treatment of tumors (melanoma) or infections (HIV) with immunogenic dendritic cells have recently been obtained. Identification of dendritic cells with tolerogenic capacity and the results in experimental models of autoimmune diseases (autoimmune encephalomyelitis, diabetes mellitus, colitis) suggests that treatment with tolerogenic dendritic cells could be a beneficial therapeutic alternative in the treatment of autoimmune diseases or immune-mediated diseases such as Crohn's disease.
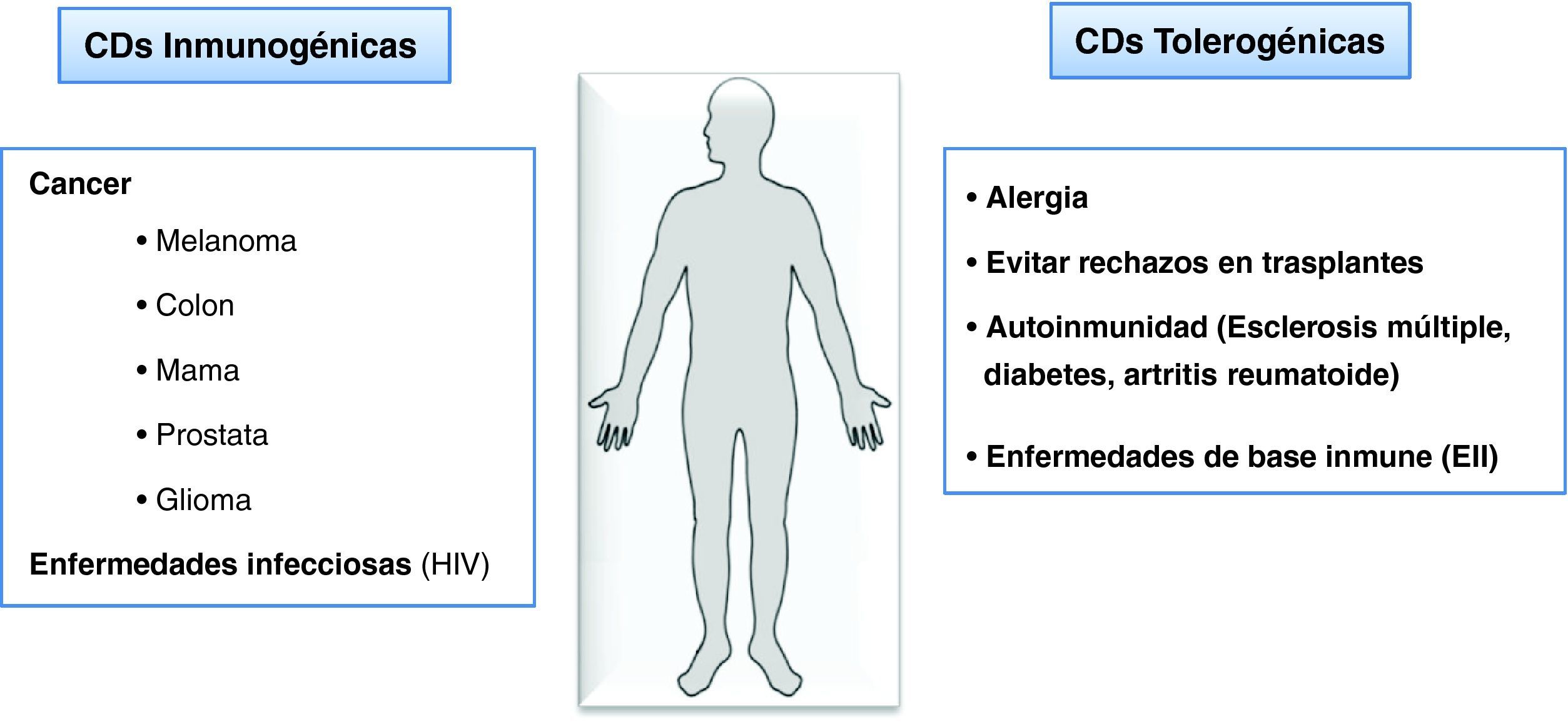
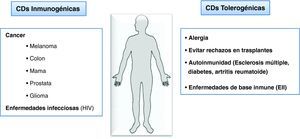
Las células dendríticas (CD) representan un grupo heterogéneo de células presentadoras de antígeno, que actúan como nexo entre la respuesta innata y la adaptativa y están involucradas en la inducción de fenómenos de inmunidad y de tolerancia. La respuesta inmunológica adaptativa puede ser tanto inmunogénica, confiriendo resistencia a infecciones y cáncer, o tolerogénica, en la que se silencian respuestas inmunitarias exacerbadas contra agentes no patógenos. La falta de regulación de esta última resulta en situaciones patológicas como el rechazo de órganos trasplantados, la aparición de enfermedades autoimmunes o mediadas por la inmunidad y alergias. Una vez las CD han reconocido y fagocitado patógenos sufren una serie de transformaciones funcionales en un proceso complejo, conocido como maduración. La maduración provoca la migración de las CD hacia los ganglios linfáticos y la presentación de antígenos procesados a linfocitos T específicos. Las CD tienen, por tanto, un papel crucial en el inicio de la respuesta inmunitaria y en el tipo de respuesta generada. Debido a las propiedades fisiológicas de las CD, que las hace únicas, y a la posibilidad de su generación in vitro mediante el uso de reactivos manufacturados en grado clínico, las CD han sido utilizadas en ensayos clínicos en humanos (fig. 1) con el objetivo de generar respuestas inmunogénicas contra tumores o infecciones1. A pesar de las posibilidades que ofrecen las terapias celulares con CD en pacientes con cáncer, hasta la actualidad no se ha explorado la capacidad tolerogénica de las CD. Dichas propiedades reguladoras indican una terapia innovadora para el tratamiento de enfermedades autoinmunes o mediadas por la inmunidad en las cuales el objetivo final es silenciar respuestas inmunitarias exacerbadas.
Los diferentes tipos de CD presentes en situaciones no patológicas son conocidos como subpoblaciones. En humanos, se han propuesto la unificación y organización de las diferentes subpoblaciones de CD en 5 tipos, independientemente de su localización en órganos linfoides o en tejidos periféricos; 2 tipos de CD clásicas mieloides (CD11c+ y BDCA1+ o BDCA3+), CD plasmacitoides (CD11c− y BDCA2+), células de Langerhans (CD207+, CD14−) y CD derivadas de monocitos2.
Cada una de las diferentes subpoblaciones de CD presentan diferencias fenotípicas que permiten su caracterización3, y que se traducen en diferencias funcionales importantes debido a la expresión de receptores de membrana, así como moléculas asociadas al reconocimiento de estructuras patógenas (PRR) y receptores específicos (receptores de tipo Toll, lectinas, receptores intracelulares, scavenger receptors, etc.)4. Así, las CD plasmacitoides expresan niveles altos de TLR7/9, lo que permite el reconocimiento de secuencias CpGs o ssRNA procedentes de bacterias o virus, y la secreción de valores muy elevados de interferones de tipo I (α y β)5. Por otro lado, las CD mieloides expresan otros tipos de receptores diferenciados. Así, las CD BDCA1+ expresan RIG-I, MDA-5, NOD y NALP, mientras que las BDCA3+ expresan TLR36, lo que permite el reconocimiento de un amplio abanico de estructuras patogénicas y la inducción de diferentes tipos de respuestas, caracterizadas por la secreción de IL-12 e IL-23.
En la mayor parte de los ensayos clínicos con CD se han utilizado los monocitos (CD14+) como precursores de las CD y su posterior diferenciación in vitro, debido a la relativa facilidad que supone su obtención a partir de sangre periférica respecto a otro tipo de CD7,8. Algunos estudios han utilizado CD circulantes para el tratamiento de tumores lo que supone una mayor complejidad de manipulación. La utilización de diferentes subtipos de CD en terapias celulares será de gran relevancia en el futuro dependiendo del tipo de respuesta inmunitaria que se desee obtener y que se basa en las diferencias funcionales existentes entre las subpoblaciones. Así, las CD plasmacitoides están implicadas en el mantenimiento de la tolerancia, mientras que las poblaciones mieloides participarían de manera importante en la activación de linfocitos CD4+ y CD8+ y de la respuesta humoral mediada por anticuerpos.
Generación de la respuesta inmunológicaEn la patogenia de la enfermedad de Crohn (EC) están claramente implicadas diversas poblaciones de linfocitos T activados. En pacientes con EC, la expansión y activación incontrolada de linfocitos T con un perfil de citocinas de tipo Th1 (secretoras de IFN-γ) se relaciona con una producción más elevada, en respuesta a agonistas de los receptores de tipo toll (TLR), de IL-12 por CD activadas. La IL-12, a su vez, provoca una expansión de células T de tipo Th1, generándose un bucle de retroalimentación positiva que cronifica la EC. Recientemente, el interés científico se ha focalizado también en la IL-23, citocina heterodimérica que comparte una subunidad con la IL-12 (p40), también producida por CD activadas en respuesta a gérmenes patógenos. La IL-23 se ha implicado en la expansión de una subpoblación de linfocitos T recientemente descrita como Th17, y que se caracterizan por la secreción de IL-17. Parece que tanto Th1 como Th17 están estrechamente relacionados con la EC, aunque aún está por clarificar el papel que desempeña cada una de estas subpoblaciones en la fisiopatología de la enfermedad9. Además, otra población de linfocitos T con una capacidad reguladora, las células T reguladoras (Treg) caracterizadas por la expresión del factor de transcripción Foxp3, son cruciales para el mantenimiento de la integridad del tracto digestivo, debido a que son capaces de modular e inhibir respuestas inmunitarias no específicas. La EC se caracteriza, por tanto, por un desarrollo anómalo de linfocitos T CD4 efectores en respuesta a antígenos no patogénicos que se mantiene por retroalimentación positiva con las citocinas secretadas por las CD activadas. El objetivo de futuras terapias para la EC se debería centrar en interrumpir esa alimentación positiva célula T-CD que mantiene la inflamación crónica de la mucosa, sea por el incremento del número de Treg, disminuyendo el número de CD4 efectoras o ambas.
Una estrategia planteada para el tratamiento de enfermedades autoinmunes o mediadas por la inmunidad se basa en la capacidad de las CD para generar y expandir Treg, con capacidad supresora de respuestas inmunitarias exacerbadas, así como atenuar respuestas del tipo Th1/Th17 ya existentes. Las Treg pueden también suprimir a otras CD, afectar a la funcionalidad de macrófagos o bien inhibir respuestas efectoras de linfocitos T. Numerosos estudios en modelos murinos demuestran que es posible inducir in vivo una respuesta reguladora específica mediada por Treg, cuando los antígenos son presentados por CD inmaduras, estableciendo la prueba de concepto para su utilización clínica. En circunstancias especiales, también las CD maduras son capaces de expandir Treg (CD4+CD25+) capaces de inhibir el desarrollo de diabetes en ratones NOD. Estos estudios sugieren que las CD maduras serían críticas para la reestimulación y/o expansión de Treg funcionales.
Concepto de células dendríticas tolerogénicasLas propiedades tolerogénicas de las CD inmaduras han sido documentadas en humanos, utilizando voluntarios sanos, proporcionando la prueba de concepto de que es factible inducir una tolerancia antigénica sistémica en los linfocitos T específicos10. Sin embargo, un punto crítico en el diseño de terapias basadas en CD inmaduras es que estas células puedan recibir, en un ambiente proinflamatorio como es la enfermedad inflamatoria intestinal (EII), señales madurativas in vivo, mediante citocinas proinflamatorias y/o por moléculas derivadas de patógenos y, como resultado, estimular una respuesta de linfocitos T de manera incontrolada. Por consiguiente, las CD inmaduras no son suficientemente seguras para su uso terapéutico en las enfermedades que cursan con inflamación crónica. Uno de los objetivos básicos es la obtención de CD tolerogénicas fenotípicamente estables, en un proceso que sea reproducible y con la obtención de células de alta pureza y viabilidad, aspectos indispensables para su aplicación terapéutica en humanos. Una alternativa para la generación de CD tolerogénicas es el proceso que se conoce como «CD activadas de manera alternativa» y que consiste en que las CD reciban tratamiento con agentes tolerogénicos y posteriormente la incubación con estímulos madurativos. Estas células han demostrado su capacidad tolerogénica en un modelo murino, que se tradujo en un aumento en la supervivencia del trasplante, en comparación con CD que sólo habían recibido tratamiento inmunosupresor11. In vivo, se ha descrito que es de gran importancia el microambiente en el cual se localizan las CD para la inducción o no de tolerancia. Así, la presencia de citocinas antiinflamatorias del tipo TGF-β, TSLP, PGE2, IL-10 o la interacción con células epiteliales en ausencia de factores derivados de patógenos, condicionarían a las CD hacía una función tolerogénica12.
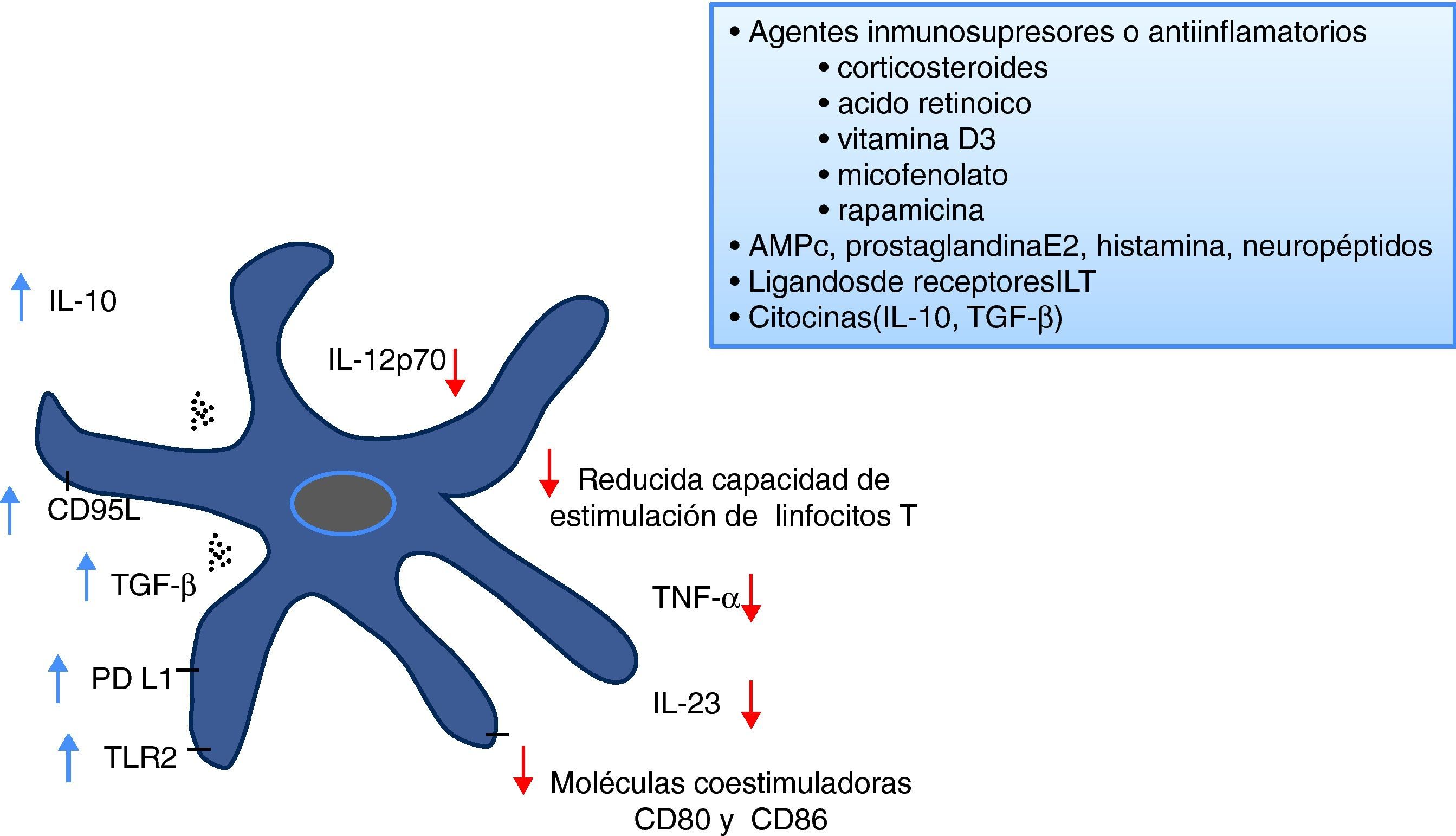
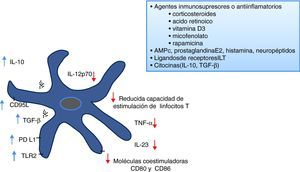
Para la obtención in vitro de CD tolerogénicas, diversos agentes inmunosupresores que incluyen corticoides (principalmente dexametasona)13, vitamina D314, rapamicina, micofenolato15, ácido retinoico, péptido vasoactivo intestinal (VIP)16 o IL-1017, han sido descritos en la generación de CD resistentes a la maduración, requisito que es absolutamente indispensable para su utilización en condiciones inflamatorias (fig. 2). Los protocolos de obtención de CD tolerogénicas se basan, en general, en la purificación de monocitos de sangre periférica y su posterior cultivo en presencia de citocinas de diferenciación y crecimiento, IL-4 y GM-CSF18 con la presencia de uno o de la combinación de varios agentes inmunosupresores.
A pesar de que se ha sugerido que las CD tolerogénicas se identificarían por la expresión preferencial del TLR219, este receptor no constituye un marcador exclusivo de tolerogenicidad. No existe, por tanto, ningún marcador específico de CD tolerogénicas en la actualidad que permita su rápida identificación. La falta de un marcador específico hace que la caracterización del perfil tolerogénico se base en las propiedades funcionales de las células. Principalmente se utiliza la respuesta alogénica como indicador de su baja inmunogenicidad. Otro aspecto característico de las CD tolerogénicas es la capacidad incrementada de producir IL-10 respecto a la IL-12 en respuesta a estímulos madurativos. La identificación del fenotipo de las células con una expresión moderada de moléculas asociadas a la maduración, también da una indicación sobre el perfil tolerogénico de las CD. El estudio exhaustivo de las propiedades tolerogénicas de las CD obtenidas es básico y constituye una garantía de calidad para la utilización de estas células en pacientes.
Células dendríticas tolerogénicas como opción terapéutica en enfermedades autoinmunesLa respuesta inmunológica inapropiada a autoantígenos, en pacientes genéticamente predispuestos, puede derivar en enfermedades autoinmunes o mediadas por la inmunidad. Se acepta que uno de los eslabones fundamentales que dan lugar a fenómenos de autoinmunidad es la sobreproducción de una o varias citocinas específicas en cuyo proceso intervienen las CD20. Así, por ejemplo, el TNF- es una citocina clave en la artritis reumatoide, la EC o la psoriasis cuyo bloqueo con anticuerpos específicos obtiene resultados terapéuticos significativos. En la psoriasis, las CD aisladas de piel afectada son la mayor fuente de producción de TNF-21. Además, en el lupus eritematoso sistémico, una enfermedad sistémica con formación de autoanticuerpos, especialmente contra nucleoproteínas, se observa una producción significativa de IFN tipo I procedente de CD plasmacitoides que infiltran la piel afectada22. Las CD plasmacitoides y el IFN tipo I se han propuesto también como patogénicos en otras enfermedades como la psoriasis, la dermatomiositis o el síndrome de Sjögren. Por otro lado, la IL-23 es una citocina implicada en psoriasis y en la EII23, siendo las CD productoras importantes de IL-23.
Además de inducir autoinmunidad, las CD están implicadas también en la respuesta terapéutica a distintos fármacos: a) los corticoides inhiben la función y el número de CD inmunogénicas; b) la azatioprina/mercaptopurina modula la respuesta inmunológica derivándola hacia un respuesta tolerogénica24, y c) las terapias que activan la formación de células Treg pueden suprimir también la activación de CD inmunogénicas25.
Existen múltiples evidencias procedentes de modelos animales que indican que las CD activadas con autoantígenos per se pueden inducir la aparición de enfermedades autoinmunes. Por ejemplo, la transferencia de CD maduras de ratón derivadas de la médula ósea, estimuladas con autoantígenos y transferidas a ratones sanos son capaces de inducir una potente respuesta Th1/Th17 y provocar enfermedades autoinmunes como encefalitis26, uveítis27, hepatitis autoinmunes28 o diabetes mellitus tipo I29. Se sabe, no obstante, que en sujetos no susceptibles, la transferencia de estas células es capaz de inducir autoanticuerpos pero no una enfermedad autoinmune por lo que deben existir otros factores ambientales o del huésped que favorezcan la aparición de estas enfermedades30–32.
No existen, hasta la fecha, estudios en humanos que hayan evaluado el tratamiento con CD tolerogénicas en enfermedades autoinmunes o de base inmune pero se han llevado a cabo estudios en modelos animales de artritis reumatoide y colitis. En un modelo animal con artritis reumatoide establecida se inyectaron por vía intravenosa 3 dosis de CD tolerogénicas (obtenidas de CD de médula ósea y generadas con dexametasona y vitamina D3), CD maduras o suero fisiológico. La CD tolerogénicas obtenidas mostraron un fenotipo semimaduro, produjeron bajos niveles de citocinas proinflamatorias y mostraron una baja capacidad estimuladora de células T. Tras la inyección, los ratones tratados con CD tolerogénicas mostraron una mejoría en la gravedad y la progresión de la artritis a diferencia de los ratones tratados con CD maduras o suero fisiológico. La mejoría coincidió con un descenso significativo de células Th17 y una elevación de células CD4+ productoras de IL-1033.
Asimismo, la inyección única de CD inmaduras en 2 voluntarios sanos indujo una respuesta de células Treg CD8+ con producción IL-10 e inhibición de IFN-γ y de células T efectoras CD8+ con efecto citolítico10.
Aplicación terapéutica de células dendríticas tolerogénicas en la enfermedad de CrohnLa EC es una enfermedad inflamatoria crónica incurable que puede afectar a cualquier parte del tracto digestivo y que se caracteriza por dolor abdominal, diarrea, rectorragias, pérdida de peso, náuseas y vómitos y retraso de crecimiento cuando afecta a niños. El curso de la enfermedad es intermitente, con fases de actividad y fases de remisión. Aunque la etiología es desconocida, existen evidencias de que se produce una pérdida o alteración de la inmunotolerancia a antígenos presentes en la luz intestinal. En el mecanismo de inmunotolerancia intervienen múltiples factores entre los que destacan las células Treg y las CD. Un desequilibrio de citocinas pro/antiinflamatorias, de células Th1 y de células T efectoras/reguladoras ocasiona un desequilibrio en la homeostasis inmunológica y da lugar al desarrollo de respuestas inflamatorias exageradas y a fenómenos de autoinmunidad.
El tratamiento actual de la EC está dirigido a reducir la inflamación y a tratar los signos y síntomas de la enfermedad y se basa en el uso de corticoides, inmunomoduladores (azatioprina, metotrexato) y agentes anti-TNF-α (infliximab, adalimumab). Los objetivos de dichos tratamientos son inducir y mantener la remisión clínica y conseguir la curación de la mucosa para restablecer la función intestinal normal. Aunque los fármacos empleados son eficaces, no están exentos de efectos adversos frecuentes y a veces graves. A pesar de un uso de los fármacos cada vez más generalizado, no se ha conseguido reducir la necesidad de tratamiento quirúrgico, de forma que, a los 5 años del diagnóstico, un 40-50% de los pacientes requieren cirugía. Por otro lado, un 10-15% de pacientes presentan actividad crónica de su enfermedad a pesar de un tratamiento médico intensivo, y la localización o la extensión de su enfermedad hacen que la cirugía esté contraindicada. Este hecho obliga a la búsqueda de nuevas opciones terapéuticas para este grupo seleccionado de pacientes. Entre estas opciones se ha incluido el trasplante de progenitores hematopoyéticos que se ha llevado a cabo en más de 700 pacientes con enfermedades autoinmunes o de base inmune (esclerodermia, esclerosis múltiple, artritis reumatoide, lupus eritematoso sistémico) y en pacientes con EC34. Aunque los resultados preliminares sugieren que el trasplante alogénico o autólogo de progenitores hematopoyéticos podría ser eficaz en inducir y mantener la remisión en pacientes con EC resistente, se ha descrito una mortalidad asociada a la técnica del 1,5-8%35–38.
La inducción de tolerancia es un proceso básico para la prevención de autoinmunidad y en el mantenimiento de la inmunotolerancia, las células Treg tienen un papel fundamental. Se ha demostrado que las células Treg pueden prevenir e incluso curar varios modelos experimentales de colitis. Sin embargo, la aplicabilidad del tratamiento depende en gran medida del número de células Treg que se puedan aislar y transferir. En este sentido, las CD, además de ser las más potentes células presentadoras de antígeno, son capaces de inducir y activar células Treg que tienen un papel esencial en suprimir la respuesta inmunológica ante los antígenos propios39. Resultados experimentales generados en modelos murinos demuestran que la utilización de CD tolerogénicas incubadas en la presencia de VIP son capaces de prevenir o incluso revertir la inducción de colitis en ratones tratados con TNBS. El efecto terapéutico claramente se asociaba a una inhibición de la respuesta inmunitaria de tipo Th1, principalmente debido a la generación de Treg secretoras de IL-10. Un aspecto importante del mismo estudio es la ruta de inoculación de las células. Los mismos autores demuestran que la administración intraperitoneal de las CD-VIP es capaz de acceder a los ganglios mesentéricos, lugar clave para el control de la respuesta inflamatoria intestinal16.
Además de las propiedades fenotípicas de las CD que vienen conferidas por diferentes estímulos madurativos o a la presencia de agentes tolerogénicos, las CD tienen una gran capacidad de migrar desde los tejidos periféricos hacia los ganglios linfáticos, lugar donde interaccionan con linfocitos T y B generando una respuesta inmunogénica o tolerogénica. El seguimiento de la migración de las CD inyectadas en pacientes proporciona una información precisa sobre el número de células que llegan al ganglio desde el lugar de inyección y su comportamiento una vez inoculadas. Está demostrado que para que la inmunoterapia con CD sea efectiva, éstas deben migrar a través de los vasos linfáticos hacia los ganglios linfáticos y acceder al área T40. En condiciones fisiológicas, la migración de las CD es un proceso muy regulado y asociado a la maduración de las CD, que se basa en la expresión de receptores específicos de quimiocinas, como por ejemplo el CCR7. Este receptor dirige las CD hacia los ganglios linfáticos en respuesta a un grupo de quimiocinas (CCL19 y CCL21) secretadas específicamente por las células estromales del ganglio. La migración de las CD derivadas in vitro en inmunoterapia es un proceso bastante ineficiente. Las razones para esta baja eficiencia de migración no han sido exhaustivamente estudiadas, y por lo tanto mejorar este proceso representa un campo de investigación de gran interés.
ConclusionesLa calidad de vida de una gran parte de los pacientes con EC está gravemente afectada como resultado de la actividad recurrente de la enfermedad, la necesidad de cirugías repetitivas, reacciones adversas a diferentes medicamentos y a complicaciones extraintestinales. Las herramientas terapéuticas, incluyendo los agentes biológicos más recientes, o han sido ineficaces, o son incapaces de mejorar el pronóstico a largo plazo, en una proporción de pacientes. Estrategias terapéuticas prometedoras como el bloqueo de los linfocitos T (con anticuerpos anti-CD3, anti-CD4 o anti-CD25), modulación de las células T reguladoras (rhIL-10), bloqueo de la diferenciación/activación de las células T (anti-IL-6, anti-IFN-γ, anti-IL-12, anti-IL-23, anti-CD80/86), bloqueo del reclutamiento celular (anti-ICAM1, anti-α4-integrinas) o estimulación del sistema inmunológico innato (GM-CSF), se han demostrado ineficaces hasta la fecha. Esta falta de nuevas terapias para el tratamiento de la EC obliga a evaluar nuevas aproximaciones terapéuticas. Aunque hasta la actualidad no se han llevado estudios clínicos de inmunoterapia encaminados a evaluar la seguridad y eficacia de las CD tolerogénicas para el tratamiento de EC u otras enfermedades autoinmunes o de base inmune, los resultados obtenidos in vitro y en modelos animales obligan a explorar esta vía terapéutica alternativa y novedosa.