El antígeno de superficie del virus de la hepatitisB (HBsAg), descubierto en 1965 por Blumberg, es el marcador fundamental para el diagnóstico de la infección por el virus de la hepatitisB (VHB). La síntesis del HBsAg es muy compleja, se realiza en el hepatocito por más de una vía y su producción excede lo que es necesario para el ensamblaje de los viriones1. El HBsAg puede encontrarse en el plasma formando parte de estructuras filamentosas o esféricas sin capacidad infecciosa que pueden formar inmunocomplejos circulantes con antiHBs. La cuantificación del HBsAg incluye las 3formas (viriones, esferas y filamentos)2, y el interés en su determinación surgió hace unos años, cuando algunos estudios lo asociaron a los niveles intrahepáticos de cccDNA. Aunque los primeros intentos de cuantificación se realizaron en los años ochenta, no ha sido hasta la última década cuando se ha dispuesto de técnicas reproducibles y estandarizadas para la cuantificación del HBsAg. En la actualidad hay 2pruebas comerciales, denominadas Architect QT assay® (Abbott Diagnostic) y Elecsys HBsAgII Quant assay® (Roche Diagnostic), con muy buena correlación con los niveles del HBsAg, independientemente del genotipo del VHB3.
En los últimos años numerosos estudios han analizado el papel de la cuantificación del HBsAg en la historia natural de la hepatitis crónicaB y su utilidad como marcador durante el tratamiento con interferón o antivirales orales.
Utilidad de la cuantificación del HBsAg en la historia natural de la hepatitis BExisten 4fases en el curso natural de la historia de la hepatitisB:
- 1.
Inmunotolerancia, caracterizada por positividad del HBeAg, transaminasas normales, ADN VHB muy elevado y lesión hepática mínima o ausente.
- 2.
Inmunoactividad/inmunoaclaramiento (HBeAg positivo, transaminasas elevadas, ADN VHB más bajo que en la fase anterior y lesión hepática de intensidad variable).
- 3.
Portador inactivo (HBeAg negativo, ADN VHB<2.000UI/ml y transaminasas persistentemente normales.
- 4.
Hepatitis crónica HBeAg-negativo (ADN VHB>2.000UI/ml, transaminasas elevadas y lesión hepática activa).
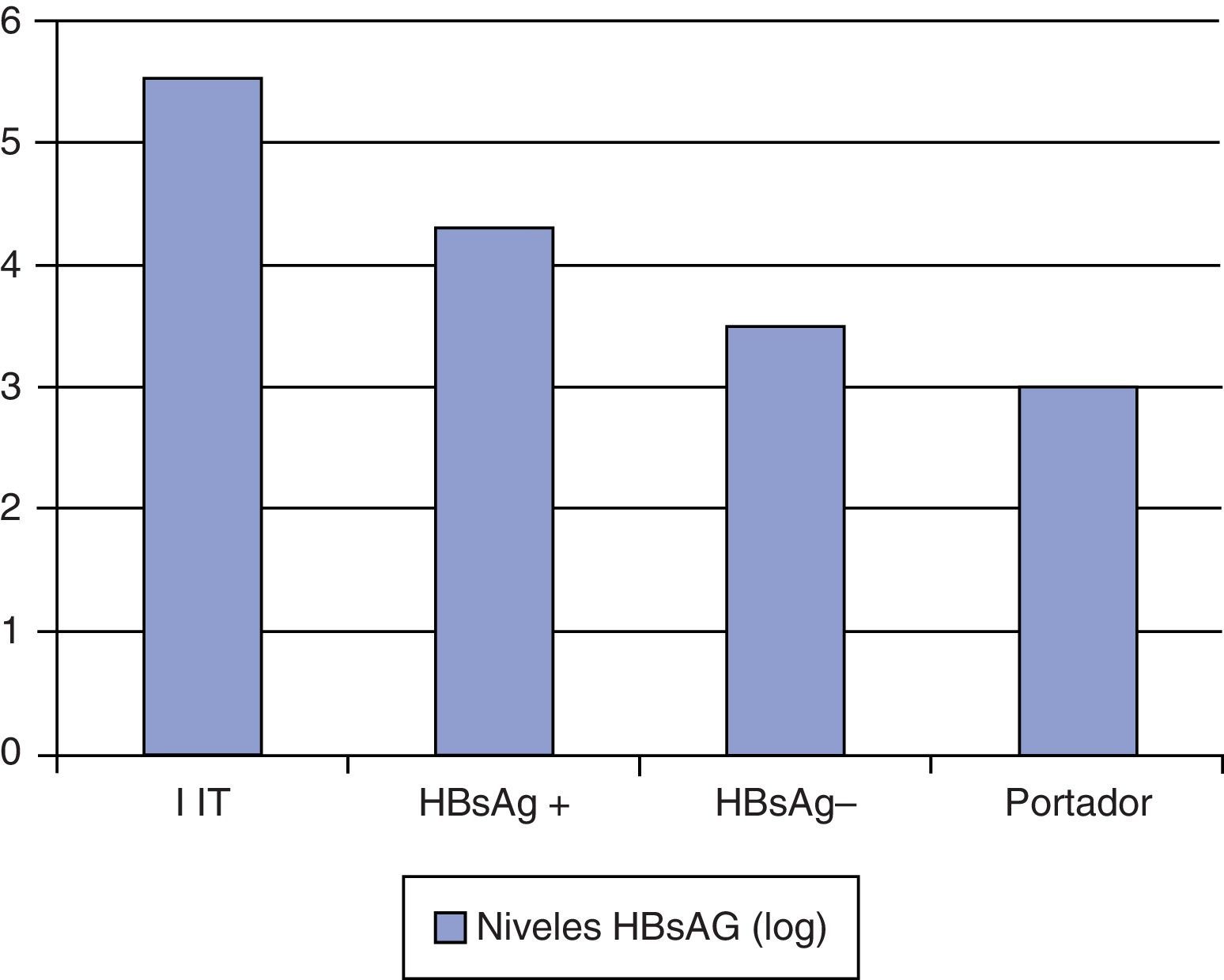
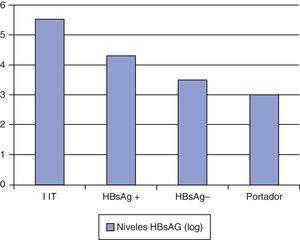
Durante la fase de inmunotolerancia los niveles de HBsAg y ADN VHB son elevados. En un estudio realizado en una cohorte de pacientes asiáticos con genotiposB y C los niveles medios de HBsAg fueron de 4,53log10UI/ml, y significativamente mayores en los pacientes HBeAg positivo que en los HBeAg negativo4. En otro estudio realizado en Asia, Chan et al.5 analizaron 177pacientes con hepatitis crónicaB no tratados durante un periodo de 99±16meses. Los pacientes inmunotolerantes presentaron los niveles de ADN VHB y HBsAg más elevados (8log10UI/ml y 5log10UI/ml, respectivamente). Durante el seguimiento, la reducción media del HBsAg por año fue de –0,006log10.
Los niveles de HBsAg se han correlacionado también con las transaminasas y la actividad histológica. En un estudio con 140pacientes HBeAg positivo con biopsia hepática que iban a iniciar tratamiento, 17 fueron clasificados como inmunotolerantes basándose en los parámetros bioquímicos y serológicos, y los 123 restantes dentro de la fase de inmunoaclaramiento. La media de los valores de HBsAg fue de 105.020UI/ml (ALT normal), 40.490UI/ml (ALT 1-2 veces por encima del valor normal) y 9.362UI/ml (ALT>2 veces el valor normal) (p<0,001). Los pacientes inmunotolerantes con transaminasas normales no tenían fibrosis; cuando la cifra de ALT era inferior a 2veces el valor normal el porcentaje de pacientes sin lesión hepática era del 78%; y cuando era mayor de 2 este porcentaje cayó al 33%. Los niveles de HBsAg de los pacientes sin fibrosis fueron significativamente mayores que los de aquellos con fibrosis significativa. Por el contrario, los niveles de ADN VHB no se correlacionaron con la lesión histológica. En el análisis multivariante los factores asociados con ausencia de fibrosis en pacientes con ALT inferior a 2veces el valor normal fueron un título de HBsAg>25.000UI/ml y la edad joven6. Otros estudios han alcanzado conclusiones similares y sugieren que la cuantificación del HBsAg puede ser útil en el manejo de los pacientes HBeAg positivo y evitar la realización de la biopsia hepática en algunos casos7.
Las guías de la EASL y AEEH establecen la diferencia entre portador inactivo y hepatitis crónica HBeAg negativo en un valor de ADN VHB inferior a 2.000UI/ml y una cifra de transaminasas persistentemente normal. Pero en la práctica clínica hay pacientes con valores de viremia discretamente elevados o aumentos puntuales de transaminasas en los que es difícil determinar fehacientemente el estado de portador inactivo o de hepatitis crónica HBeAg negativo. Numerosos estudios han intentado evaluar la utilidad de la cuantificación del HBsAg en esta situación. En uno de ellos, Brunetto et al.8 efectuaron el seguimiento de 209pacientes durante una media de 34,5meses. Los niveles de HBsAg fueron significativamente inferiores en los clasificados como portadores inactivos, mientras que aquellos con viremia inferior a 20.000UI/ml presentaban niveles más bajos que los que presentaban fluctuaciones (883 vs 4.233UI/ml). De acuerdo con los autores, la combinación de un título de HBsAg<1.000 y ADN VHB<2.000UI/ml es capaz de identificar a los «verdaderos» portadores inactivos con un valor positivo de predicción (VPP) del 88% y negativo (VPN) del 96,7%. Adicionalmente, los niveles de HBsAg inferiores a 100UI/ml pueden predecir la negatividad del antígeno en el seguimiento de los pacientes infectados por genotipoB o C9.
Otros estudios han correlacionado la cuantificación del antígeno y la predicción de la seroconversión del HBsAg10. Datos recientes de la cinética del HBsAg de 203pacientes en los 3años previos a su seroconversión comparados con otros tantos controles que no seroconvirtieron han demostrado la presencia de niveles significativamente inferiores de HBsAg en los seroconvertores en comparación con los controles en cualquier momento del estudio. En el 75% de los pacientes que alcanzaron la seroconversión, los niveles de HBsAg fueron inferiores a 100UI/ml en los 3años anteriores. Los mejores predictores del aclaramiento del HBsAg fueron los valores de HBsAg inferiores a 200UI/ml y su reducción anual de al menos 0,5log10. En otro estudio que incluyó 103pacientes HBeAg negativo, un valor de HBsAg inferior a 100UI/ml fue capaz de predecir la pérdida del antígeno con una sensibilidad del 71% y una especificidad del 91%11.
¿Se correlacionan los niveles de ADN VHB con los del HBsAg? Aunque los resultados son controvertidos, varios estudios coinciden en que esta correlación existe en los pacientes HBeAg positivo y no tanto en los pacientes HBeAg negativo5,12,13. Por otra parte, los niveles de HBsAg son significativamente mayores en los pacientes coinfectados con el VIH en comparación con los pacientes monoinfectados14, y son superiores en los que no reciben tratamiento antirretroviral en comparación con los tratados, especialmente si el recuento de linfocitos CD4 es inferior a 200células/mm3.
Utilidad de la cuantificación del HBsAg en los pacientes en tratamiento antiviralEn la actualidad muchos de los pacientes con hepatitis crónicaB reciben tratamiento con antivirales orales de segunda generación (entecavir o tenofovir). Como es bien conocido, los pacientes HBe positivo deben recibir tratamiento hasta la seroconversión a anti-HBe, y los HBe negativo, indefinidamente. Por su parte, el tratamiento con interferón pegilado (PEG-IFN) alcanza mayores porcentajes de seroconversión del HBeAg que los antivirales orales después de un año de tratamiento, pero la tolerancia es mala y la respuesta es pobre en pacientes HBeAg negativo. Por este motivo, varios estudios han tratado de determinar la capacidad de predicción de la cuantificación del HBsAg en la respuesta al tratamiento con PEG-IFN. En uno de estos estudios, Sonneveld et al.15 analizaron los niveles de HBsAg en pacientes HBeAg incluidos en 3ensayos clínicos de PEG-IFN (monoterapia y combinación con lamivudina). De los 803pacientes incluidos, el 23% aclaró el HBeAg y el 5% el HBsAg 6meses después de haber finalizado el tratamiento. En los pacientes respondedores se observó una mayor disminución de los niveles de HBsAg incluso cuando se ajustó por el genotipo o por el tipo de tratamiento (monoterapia o terapia combinada). Cuando se analizó la cinética del HBsAg durante el tratamiento, los pacientes con HBsAg<1.500UI/ml alcanzaron respuesta en el 45%. En la semana24 el título de HBsAg superior a 20.000UI/ml identificó de forma muy precisa a los pacientes con muy baja probabilidad de respuesta, independientemente del genotipo. Con todo, los autores del estudio sí incluyen el genotipo en el algoritmo de respuesta en la semana12, de manera que si los pacientes tienen genotipoA o D se debe interrumpir el tratamiento si no hay disminución en los niveles de HBsAg, mientras que si el genotipo es C o D la interrupción se debe efectuar si el HBsAg supera las 20.000UI/ml.
En otro estudio realizado en Asia16, los pacientes con una disminución del HBsAg mayor de 1log10 y niveles inferiores a 300UI/ml en el mes6 de tratamiento tuvieron una probabilidad de respuesta (definida como seroconversión del HBeAg y ADN<2.000UI/ml) del 75%, comparada con el 15% en los pacientes en que no alcanzaron este objetivo combinado.
Como ya se ha mencionado, los pacientes HBeAg negativo tienen tasas bajas de respuesta al tratamiento con PEG-IFN y son difíciles de monitorizar, por lo que en este caso cobra aún más importancia establecer reglas de parada. En 2010 Rijckborst et al.17, al evaluar un total de 102pacientes HBeAg negativo tratados con PEG-IFN observaron que la no disminución de los niveles del HBsAg en la semana12 de tratamiento, combinado con la disminución de menos de 2log10 del ADN VHB, tenía un VPN del 100%. Estos datos han sido validados recientemente por el mismo grupo utilizando otra cohorte de 160pacientes18. También se ha investigado la importancia del genotipo del VHB en la cinética del HBsAg durante el tratamiento y su relación con la respuesta19. Datos muy recientes sugieren que los patrones de descenso son similares para los pacientes con genotiposA, B y D, pero en el caso de los pacientes con genotipoC no se observan diferencias entre respondedores y no respondedores.
Otro aspecto de especial interés es el análisis comparativo de la cinética del HBsAg entre los pacientes tratados con PEG-IFN y los que reciben análogos de nucleós(t)ido (AN). Los datos disponibles sugieren que la disminución del HBsAg es más lenta y menos pronunciada en los pacientes con AN. En los 2estudios de registro de tenofovir se observó que en los pacientes HBeAg positivo los niveles de HBsAg disminuyen de forma más marcada que en los pacientes HBeAg negativo. En estos estudios solo se observó la pérdida del HBsAg en los pacientes HBeAg positivo con mayores títulos basales y una caída superior a 2log10 a las 24semanas de tratamiento. En un grupo de pacientes tratados con telbivudina se observaron resultados similares: el descenso mayor de 1log10 en los niveles de antígeno al año de tratamiento fue predictor de la pérdida del HBsAg20.
Los pacientes HBeAg negativo, por el contrario, tienen una disminución menos pronunciada del HBsAg. Algunos autores han sugerido que un descenso rápido del HBsAg durante el tratamiento podría identificar a los pacientes que con el tiempo perderían el HBsAg9. La mayoría de estos estudios están realizados con un número relativamente pequeño de pacientes, y se precisan estudios controlados para evaluar si la determinación periódica del HBsAg durante el tratamiento con AN es útil para identificar a los pacientes en los que se puede suspender el tratamiento.
ConclusionesLos niveles de HBsAg varían en función de la fase evolutiva de la hepatitis B y son más elevados en los pacientes inmunotolerantes y más bajos en los portadores inactivos (fig. 1).
La determinación del HBsAg puede ser útil en la práctica clínica en determinadas situaciones (tabla 1), especialmente en pacientes tratados con PEG-IFN, y puede ayudar a la toma de decisiones sobre el seguimiento y la interrupción del tratamiento.
Utilidades de la cuantificación del HBsAg en la práctica clínica
| Durante la historia natural de la enfermedad | Durante el tratamiento |
| • Facilitar el diagnóstico de los pacientes en fase de inmunotolerancia• Diagnóstico de los «verdaderos» portadores inactivos | • Establecer reglas de parada en los pacientes que reciben interferón pegilado• En un futuro valorar la suspensión del tratamiento con antivirales orales |
Se precisan estudios en pacientes HBeAg negativo tratados con AN que permitan identificar a aquellos en los que es posible la suspensión del tratamiento.