INTRODUCCIÓN
La frecuencia de varices esofágicas (VE) en los enfermos con cirrosis hepática (CH) varía del 30 al 80%, con un riesgo de hemorragia del 25 al 35% en un período de 2 años y una mortalidad asociada al primer episodio de hemorragia que puede ser tan alta como del 40%1-3.
La vigilancia endoscópica es importante para la identificación de las VE y la prevención de la hemorragia varicosa4. Entre los enfermos con CH, el tamaño de las VE5-8, la presencia de puntos rubí sobre las varices y la gravedad de la enfermedad hepática se han identificado como factores que aumentan el riesgo de hemorragia varicosa5-7.
Actualmente, se recomienda la realización de una endoscopia en todos los pacientes con diagnóstico reciente de CH, para determinar si son candidatos a recibir manejo profiláctico para hemorragia varicosa5,8,9. Sin embargo, esta conducta es controvertida debido a que no existen estudios prospectivos que hayan demostrado una relación coste-efectividad de realizar estudios endoscópicos en estos enfermos10,11.
La colangitis esclerosante primaria (CEP) es una enfermedad colestásica crónica y progresiva que se asocia con el desarrollo eventual de CH, hipertensión portal y defunción si no se realiza trasplante hepático12-14. Los pacientes con CEP usualmente desarrollan VE, pero la frecuencia exacta no se conoce. En este estudio decidimos analizar a un grupo de enfermos con CEP para determinar la frecuencia de VE y los factores asociados para predecir su presencia y riesgo de hemorragia varicosa.
MATERIAL Y MÉTODOS
Pacientes
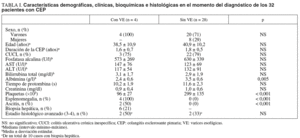
Se evaluaron las características demográficas, bioquímicas, endoscópicas y la evolución clínica de 32 enfermos con CEP vistos durante el período comprendido entre el 1 de febrero de 1992 y el 30 de septiembre de 2004 en el Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. Veinticuatro pacientes eran varones (75%). El promedio de edad fue de 40,2 años con un intervalo mínimo-máximo de 19 a 66. Veinticinco pacientes (78%) tuvieron colitis ulcerativa crónica inespecífica. En el momento del diagnóstico, 22 (69%) se encontraban en estadio funcional Child-Pugh A y 10 (31%) en Child-Pugh B. Las características demográficas, clínicas, bioquímicas e histológicas de los 32 pacientes de acuerdo con la presencia de VE en el momento de su ingreso se observan en la tabla I.
El deterioro de la función hepática se definió como la progresión hacia Child-Pugh B o C en los pacientes evaluados; las evaluaciones se realizaron durante los episodios libres de colangitis agudas. La duración de la CEP se definió como el tiempo desde la aparición de la primera evidencia clínica, bioquímica, histológica o colangiográfica que llevó al diagnóstico de CEP hasta la última valoración en el hospital.
Colangiografía retrógrada endoscópica
El diagnóstico de CEP se realizó mediante los hallazgos característicos por colangiografía, como obstrucción biliar intrahepática o extrahepática con dilataciones o estenosis de los conductos biliares15.
Hallazgos de la endoscopia
Se registraron la presencia de VE, el tamaño y la historia de los episodios de hemorragia para cada paciente. El tamaño de las varices se determinó de acuerdo con las recomendaciones de la Sociedad de Investigación Japonesa de hipertensión portal16. En el momento del diagnóstico ningún paciente tenía historia de hemorragia varicosa y en todos se realizó un estudio endoscópico inicial para determinar la presencia de VE y se les realizó seguimiento posterior endoscópico en promedio cada año.
Hallazgos de enfermedad
El estadio de las biopsias se determinó sobre la base de los criterios de Ludwig17: estadio 1: daño hepático (inflamación, fibrosis, esclerosis) confinado a las áreas portales; estadio 2: daño portal y periportal; estadio 3: fibrosis septal, y estadio 4: cirrosis biliar. Sólo 10 pacientes tuvieron una biopsia hepática. De éstos, 2 (6%) se encontraban en estadio 1; 4 (12%) en estadio 2; 2 (6%) en estadio 3, y 2 (6%) en estadio 4.
Análisis estadístico
Las variables categóricas se compararon con la prueba exacta de Fisher y las dimensionales, con la prueba U de Mann-Whitney. Se realizó un análisis de regresión logística para determinar los factores que se asociaron de manera independiente a la presencia de VE y de hemorragia varicosa.
RESULTADOS
En la primera endoscopia, 4 pacientes (13%) presentaron VE (1, grandes y 3, pequeñas), uno con datos de mal pronóstico y otro con gastropatía congestiva. De ellos, 2 tenían biopsia hepática con estadio histológico avanzado (3-4).
Los factores que se asociaron a la presencia de VE al momento del ingreso en el análisis bivariado fueron: esplenomegalia (4/6 frente a 0/26; p < 0,001), ascitis (2/4 frente a 0/24; p < 0,001), trombocitopenia (96 ± 27 frente a 299 ± 135/103; p < 0,001) e hipoalbuminenia (2,4 ± 0,6 frente a 3,5 ± 0,6 g/dl; p = 0,005).
Durante un seguimiento promedio de 7 años (intervalo mínimo-máximo, 2-15 años), 6 pacientes con endoscopia normal en el momento del diagnóstico desarrollaron VE y 7 presentaron hemorragia varicosa.
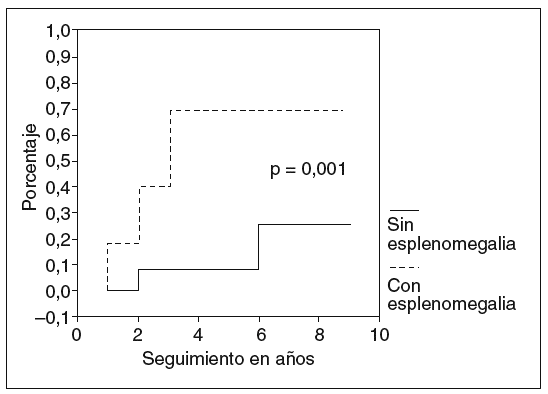
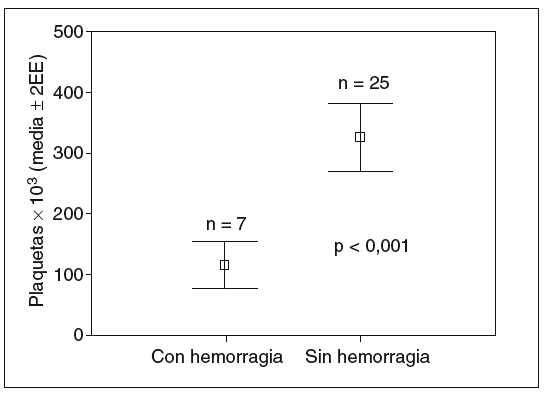
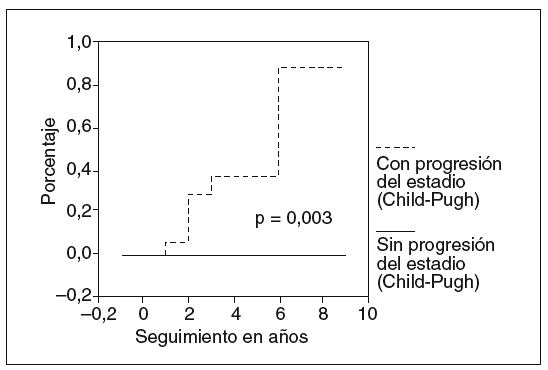
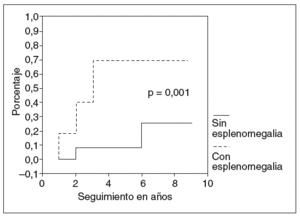
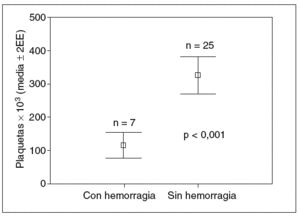
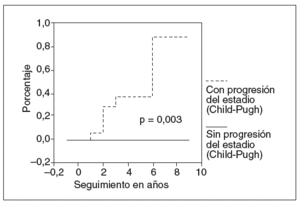
Los factores asociados a la hemorragia varicosa en el análisis bivariado fueron: esplenomegalia (5/8 frente a 2/24; p = 0,001; fig. 1), trombocitopenia (113 ± 52 frente a 329 ± 134; p < 0,001; fig. 2) y deterioro de la función hepática (7/16 frente a 0/16; p = 0,003; fig. 3).
Fig. 1. Riesgo de hemorragia varicosa y presencia de esplenomegalia.
Fig. 2. Valores promedio de plaquetas (¥103) en pacientes con y sin hemorragia varicosa.
Fig. 3. Riesgo de hemorragia varicosa de acuerdo con la progresión del estadio Child-Pugh.
Otros factores asociados a la hemorragia varicosa fueron la presencia de varices grandes y estigmas de mal pronóstico en las varices (7/7 frente a 0/25; p = 0,001; 6/7 frente a 1/25; p = 0,001, respectivamente).
No encontramos una asociación entre el tiempo de evolución de la enfermedad y el desarrollo de varices esofágicas (presencia: 3,5 ± 3,3 frente a 3,2 ± 2,9 años) ni con hemorragia varicosa (2,9 ± 2,7 frente a 3,2 ± 2,9 años).
En el análisis de regresión logística los factores que se asociaron de manera independiente a la presencia de VE fueron la trombocitopenia y la esplenomegalia (tabla II). Los factores relacionados con la hemorragia varicosa fueron el deterioro de la función hepática y la esplenomegalia (tabla III).
DISCUSIÓN
La historia natural de los pacientes con CEP no ha sido bien definida y parece encontrarse una gran variabilidad entre cada individuo en relación con el grado de progresión de la enfermedad y el desarrollo de VE. Los episodios de hemorragia varicosa son frecuentes en estos pacientes, con un gran impacto en cuanto a la morbilidad y mortalidad.
Además, en las recomendaciones actuales para los pacientes con CH, no existe una estrategia de vigilancia endoscópica para búsqueda de VE en sujetos con CEP. Una limitación de las guías actuales, que recomiendan la realización de endoscopia basados en la presencia de cirrosis, es que la precisión del diagnóstico histológico en los enfermos con CEP se ve afectada por la gran variabilidad de la toma de muestra por biopsia hepática, lo que parece subestimar la cirrosis en por lo menos un cuarto de los pacientes con CEP18; por lo que el uso de variables no invasivas es de particular importancia debido a que la biopsia hepática no es indispensable para establecer la existencia de CEP19. Además, debido al daño portal tan particular que presentan, podrían cursar con VE y hemorragia aun sin la presencia de cirrosis20. Nuestros resultados concuerdan con lo reportado en la literatura médica en relación con que los marcadores de laboratorio y la enfermedad hepática avanzada pueden predecir VE, incluso en pacientes con CEP20. Un recuento de plaquetas bajo es un factor predictivo independiente y constante de la presencia de VE en los casos con enfermedad hepática avanzada. Sin embargo, la mayoría de los estudios se basa en pacientes con CH en estadios avanzados e incluso referidos para valoración de trasplante hepático21-24.
Nuestra cohorte incluye a pacientes sin diagnóstico de CH y que presentan VE, así como otros en estadios tempranos de cirrosis que puede inferirse a partir de las pruebas de función hepática (tabla I). Esto es importante ya que confirma que la predicción de VE utilizando marcadores no invasivos no debe limitarse a los enfermos con CH. Esto último sugiere que las recomendaciones para vigilancia endoscópica basadas en cohortes previas sobrestiman a los pacientes con enfermedad hepática avanzada y subestiman a aquellos en estadios tempranos. Esto no puede ser aplicable para la población general de sujetos con cirrosis, al menos no para los que presentan cirrosis secundaria a CEP.
En conclusión, las VE son frecuentes en los pacientes con CEP y en nuestra cohorte una proporción importante de los pacientes con CEP y VE no tienen datos de hepatopatía avanzada por datos clínicos, bioquímicos o histológicos.
Este estudio muestra que la detección de trombocitopenia, esplenomegalia y deterioro de la función hepática puede ser útil para predecir la presencia de VE y mayor riesgo de hemorragia varicosa en pacientes con CEP, por lo tanto, también podría ayudar a determinar cuáles son los enfermos que se beneficiarán de la vigilancia endoscópica.